脊柱结核骨质破坏、脓腔MSCT、MRI特点与临床病程的关系研究
2024-01-08王姿丽杨长成
王姿丽,梁 昆,杨长成
(巴彦淖尔市医院:1.影像科;2.科教科;3.神经康复科,内蒙古巴彦淖尔 015000)
脊柱结核是一种发病率较高的肺外结核,在骨关节结核中约占50%[1],近年脊柱结核发病率有所上升[2]。脊柱结核的临床表现缺乏特异性,结核中毒症状多不明显,多表现为腰背痛或神经根痛[3],极易误诊[4],延误诊断和治疗,导致患者预后差。脊柱结核骨质改变在多层螺旋CT(multislice spiral computed tomography,MSCT)、MRI表现多样,本文回顾性分析脊柱结核骨质病变MSCT、MRI的特点,分析二者影像改变与结核病程的相关性,进而帮助临床诊断和治疗,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年9月至2022年6月本院收治的33例脊柱结核患者病例资料。纳入标准:(1)经手术病理或临床证实为脊柱结核;(2)均进行MSCT检查、MRI平扫+增强检查,且二者检查时间间隔<1周。排除标准:(1)曾行有创检查或手术治疗史;(2)合并其他感染,如同时合并布氏杆菌感染者;(3)影像学资料不完整。33例患者中男15例,女18例,年龄32~80岁,平均(61.8±10.4)岁;主要表现为病变相应部分的疼痛、压痛及叩击痛,发热、盗汗或盗汗者7例,感觉异常16例;实验室检查表现为血沉ESR升高,C反应蛋白及超敏C反应蛋白升高。
1.2 方法
1.2.1检查方法
MSCT采用美国GE公司128层CT(GE LightSpeed)进行轴面平扫,管电压120 KV,管电流300 mA,层厚和层间距均为0.625 mm,所获得图像由其自带的后处理工作站进行矢状面及冠状面重建,重建层厚3 mm。MRI采用Philips Ingenia 3.0T超导型MRI扫描仪。颈椎采用头颈联合线圈,胸、腰段采用脊柱专用线圈。先进行常规MRI平扫检查,扫描序列包括横轴位T2WI、矢状位T2WI、矢状位T1WI和脂肪抑制T2WI,层厚4.0~5.5 mm,层间距0.3~0.4 mm。常规平扫后进行增强扫描,对比剂采用钆喷酸葡胺注射液,注射剂量15 mL,流率2 mL/s。经肘静脉注射后行轴位、矢状位、冠状位T1WI扫描。
1.2.2图像分析
所有患者的影像资料均由1位高年资住院医师及2位副主任医师进行分别阅片分析,再共同阅片,达成一致观点,获得准确数据。对病变部位、个数、各种骨质破坏类型MSCT特点、MRI平扫和增强特点进行分析和评价。
1.3 统计学处理
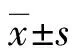
2 结 果
2.1 临床特点
33例患者发现症状至初次就诊时间为20 d至36个月,平均(8.0±6.3)个月。33例患者共74个病变椎体,其中颈椎4个(5.4%)、胸椎25个(33.8%)、腰椎41个(55.4%)、骶椎4个(5.4%),腰椎是最常受累的部位。33例患者中仅1例跳跃多椎体病变,无单椎体病变。
2.2 不同骨质破坏类型与脓腔形成关系
根据MSCT骨质破坏情况分为骨质正常型、溶骨型、骨碎片型、局灶破坏硬化型4种类型。33例患者74个病变椎体MRI信号均有异常,MSCT显示骨质破坏67个。不同骨质破坏类型脓腔构成比比较,差异有统计学意义(χ2=22.795,P<0.001),骨碎片型最易形成脓腔,见表1。

表1 不同类型骨质破坏脓腔比较[n(%)]
2.3 骨质破坏区周围骨质CT密度和T1WI信号变化的分层现象
通过观察骨质破坏区周围骨质密度和信号发现:(1)“4层密度(信号)”,即低密度破坏区边缘高密度带,外周稍高密度影及最外周正常密度,对应MRI上T1WI破坏区稍低信号,边缘明显低信号,外周低信号及最外周正常信号,主要见于有较小脓腔形成的骨质破坏类型;(2)“3层密度(信号)”,低密度破坏区边缘高密度带,外周稍高密度,对应MRI上T1WI破坏区稍低信号,边缘明显低信号,外周低信号,主要见于较大脓腔形成的骨质破坏类型;(3)“2层密度(信号)”,低密度破坏区周围高密度,对应MRI上T1WI破坏区稍低信号,边缘低信号,主要见于尚未形成脓腔的溶骨性骨质破坏或大的脓腔形成类型,但大的脓腔周围骨质密度往往会更高。
2.4 结核脓腔形成及变化在MRI增强扫描特点
根据脓腔形成及脓腔周围骨质强化特点分为未见脓腔(图1)、脓腔形成早期(图2)、脓腔进展期(图3)和脓腔愈合期(图4)。未形成脓腔的破坏区明显强化,多见于骨质正常型;脓腔形成早期表现为明显强化区内见裂隙状脓腔,随病程进展脓腔范围扩大,这种骨质破坏类型多见于溶骨性骨质破坏;脓腔进展期,脓腔较大且不规则,边缘见明显强化带,邻近骨质呈低强化,脓腔往往与椎旁及椎间隙脓腔相连,呈现流注状态,多见于碎片型骨质破坏;脓腔愈合期,脓腔逐渐缩小,脓腔边缘明显强化带变窄,与周围低强化骨质及硬化带形成典型的4层信号,常见于碎片型或局灶硬化型骨质破坏。
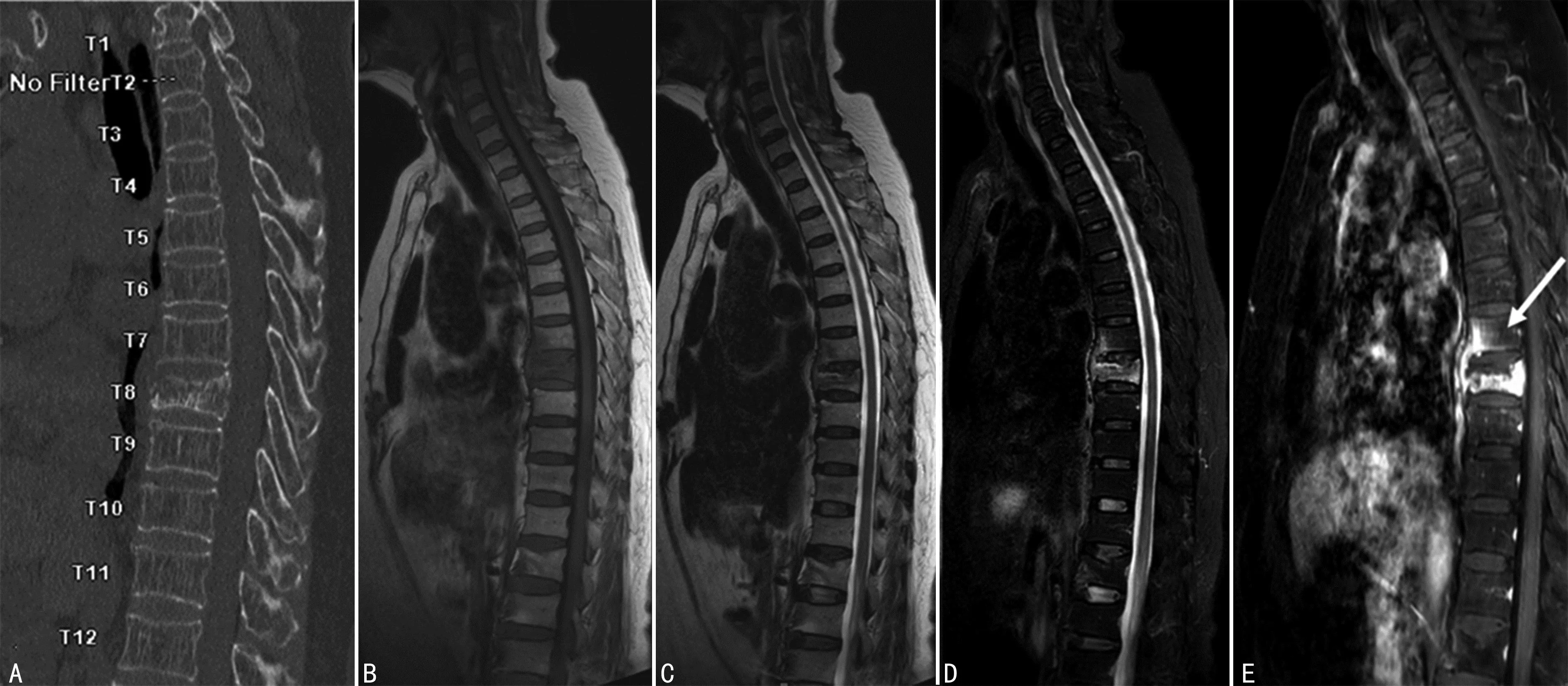
A:CT矢状位,第7胸椎骨质未见明显破坏;B~D:分别为T1WI、T2WI、T2WI压脂序列矢状位,第7胸椎椎体前缘骨质片状T1WI、T2WI低信号,T2WI压脂序列高信号;E:MRI增强扫描矢状位,箭头所示第7胸椎椎体前缘及终板下明显强化,未见脓腔形成,邻近第8胸椎椎体破坏区有脓腔形成,周围软组织肿胀。
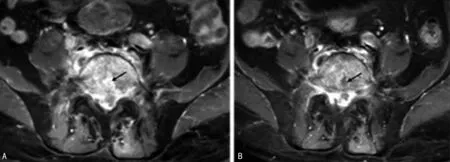
A:骨破坏区强化,并见裂隙状低信号脓腔(黑箭头);B:1个月复查脓腔范围扩大(黑箭头)。
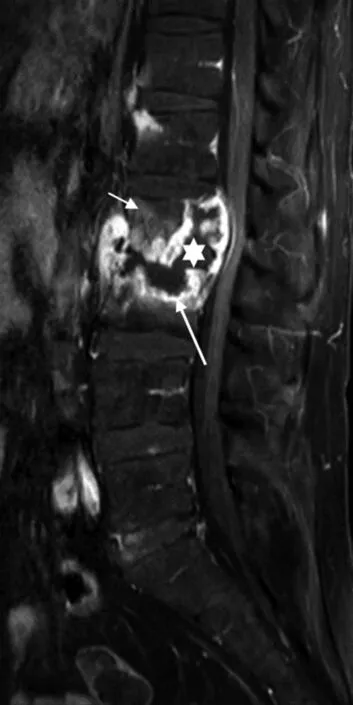
第2~3腰椎见较大脓腔形成,与椎间隙、椎旁脓腔相连,典型的流注型脓腔,脓腔未强化(白星)脓腔边缘明显强化(白长箭头),外围骨质低强化(白短箭头),形成3层信号。
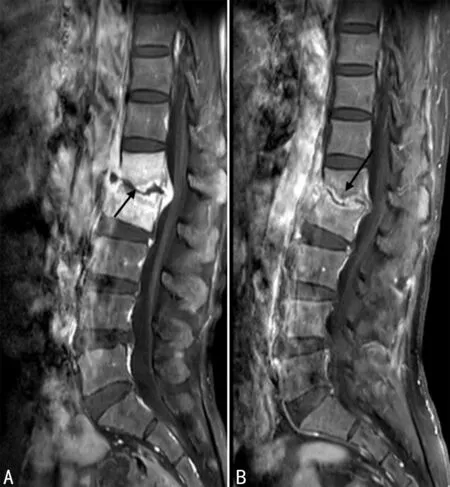
A:第1~2腰椎椎体终板下破坏区脓腔形成,脓腔边缘明显强化,周围骨质低强化(黑箭头);B:患者3个月后复查脓腔缩小,脓腔周围明显强化带范围变窄,可见硬化带(黑箭头),周围骨质强化较前减低,可见四层信号。
2.5 脊柱结核破坏区邻近脊髓、神经根的MRI特点
33例患者中均表现有不同程度的神经症状,主要表现为疼痛和感觉异常,CT观察脊髓和神经根有一定限度,MRI可较好显示脊髓和神经根。33例患者中脊髓或马尾主要表现为受压改变,由硬膜外脓肿或增厚的硬膜外软组织造成;炎症蔓延至神经孔引起单侧或双侧神经根周围炎症及神经根炎症,表现为椎间孔脂肪间隙模糊,增强扫描不均匀强化。
3 讨 论
脊柱是骨肌系统结核最常见的发病部位。脊柱结核的病理学变化主要有炎性渗出、增生、坏死3个基本类型,常常以某1种或2种病变为主,但多种病变又以不同的比例同时混合存在,构成了脊柱病理的形态多样性[5]。镜下往往既能看见骨质破坏、死骨形成的区域,也能够看见少量新生骨的再生;既能看见广泛骨质破坏、死骨形成、干酪坏死,也能看见肉芽肿及典型结核结节特征病变,以及不典型急性炎症反应区及慢性炎症反应区及钙化[6]。脊柱结核起病隐匿,临床主要表现为病变相应部位疼痛及相应的神经功能障碍,这与本研究患者表现是一致的。随着结核耐药菌株增加、人口老龄化、患者免疫功能受到抑制或破坏[7-8],脊柱结核的发病率也升高。本研究老年患者居多,其合并症多,机体代偿能力差,影响治疗和预后[9]。
脊柱结核最常累及胸椎和腰椎[10-11],颈椎和骶椎较少见,与本研究结果一致。术前评估主要依赖影像学检查,MRI增强扫描可清晰显示脊柱结核病变范围[12],应用CT、MRI联合检查能有效提高诊断准确率[13]。
3.1 骨质破坏类型及破坏区周围MSCT及MRI表现特点
MSCT图像上观察到的骨破坏和死骨形成对结核和化脓性脊柱炎的鉴别诊断有帮助[14]。有国外学者将脊柱结核骨质破坏类型分为骨碎片型、溶骨型、局灶破坏硬化型、骨膜下型及混合型5种类型[15],徐滢莹等[16]对这几种类型的MSCT特点进行分析,得出溶骨型最多,局灶破坏硬化型次之。但分析本研究患者MSCT发现,骨碎片型和混合型MSCT表现很难区分,溶骨型和骨膜下型的MSCT表现类似,故本研究根据MSCT表现分为骨质正常型、骨碎片型、溶骨型、局灶硬化型4种类型。
本研究有7个椎体MSCT表现为骨质正常,而MRI各序列均有信号异常,病变多位于终板下或韧带下,多由邻近椎体、椎旁软组织感染蔓延所致,考虑为骨髓炎早期渗出还未引起骨质结构的破坏,病变无干酪样坏死、钙化、死骨等改变时增强扫描多均匀强化[12],这与单纯水肿进行鉴别。溶骨型骨质破坏MSCT周围骨质略高于正常骨质密度但低于骨硬化密度,MRI显示异常信号、强化范围往往大于MSCT密度范围,可能与MRI对骨髓的炎症、水肿反应更敏感所致。
本研究患者骨质破坏类型最多的是骨碎片型,MSCT观察骨破坏区内死骨和钙化有优势[17],但不能判断是否有脓腔。MRI虽然对死骨和钙化显示不敏感,但MRI增强扫描可显示早期脓腔及脓腔的大小范围,与椎间隙、椎旁脓肿的关系。局灶骨硬化型虽然也可见脓腔,但脓腔较小,周围见硬化带,在显示骨硬化上,MRI表现有其特征性,表现为各序列低信号,增强扫描不强化,在T1WI上硬化区要明显低于骨破坏区。
3.2 结核脓腔影像学特点与脊柱结核病程的相关性及临床意义
本研究发现,分析不同骨质破坏类型MSCT和MRI强化特点可以判断病变所处不同临床病程。MRI在早期脊柱结核的诊断中更具优势[18-19]。结核早期诊断较困难,本研究7个骨质正常型均继发于邻近椎体蔓延,这一时期积极治疗可以避免椎体的进一步破坏。随病程进展MSCT破坏区可有或无死骨,MRI增强扫描可显示早期裂隙状脓腔,若此时感染得到控制,脓腔不再进展,则骨质结构破坏局限不会出现椎体的塌陷,如果感染未能有效控制或患者抵抗力下降,脓腔进一步扩大,椎体骨质结构进一步破坏导致椎体塌陷,脊柱畸形。这也说明早期诊断和治疗脊柱结核可以确保更好的结果,减少神经系统并发症和脊柱畸形[20],分析脊柱结核MSCT及MRI影像学特点,可为临床确诊及制定治疗方案提供参考依据[21]。
本研究中74个椎体中42个椎体有脓腔形成,其中骨碎片型形成脓腔最多,观察发现脓腔越大骨质破坏越严重,判断脓腔时期的意义在于:在脓腔形成早期经过积极治疗或患者免疫力提高,可能会阻止脓腔进一步发展,减轻骨质破坏程度;脓腔形成后,可根据脓腔愈合程度来判断治疗效果,若不能有效阻止脓腔的发展,提示临床要尽早手术治疗清除脓腔。
3.3 骨质破坏区周围骨质MSCT密度和T1WI信号分层现象的临床意义
既往研究认为,破坏区周围高密度影为骨质增生硬化,但本研究发现破坏区周围密度和信号也是分层的,不同密度代表不同的病理改变,破坏区边缘的高密带为硬化带,在MRI增强扫描不强化,周围稍高密度区为骨髓炎,在MRI增强扫描明显强化,经过治疗后骨髓炎区强化范围可缩小;而在溶骨性骨质破坏未形成脓腔时,周围的高密带区往往代表骨髓炎,增强扫描明显强化。高密度硬化带与骨修复有关,高于正常椎体但低于硬化带的高密度部分可能与骨质缺血有关,也可能与结核肉芽组织及干酪化物质充满髓腔有关,这也是近年学者认为病灶清除不彻底导致结核复发的原因之一[22-23]。有研究认为,通过对MSCT、MRI两种检查所得图像进行分析,对患者内镜手术治疗有较高指导价值[24]。因此,在临床工作中要提示破坏区周围骨质情况,帮助临床确定手术范围,避免结核的复发。
3.4 脊柱结核的神经、脊髓改变的临床意义
脊柱结核临床病程较长,结核中毒症状不明显,临床就诊病例多为神经症状,本研究发现病变椎体周围软组织增厚或形成硬膜外脓肿压迫脊髓或马尾,由于硬脊膜阻挡,炎症未累及脊髓;由于结核脓腔流注特点,感染可蔓延到单侧或双侧椎间孔,引起神经根炎症及周围炎症,MRI可以评估累及椎间孔的范围,对治疗后疗效进行评估。
综上所述,脊柱结核骨质改变4种类型MSCT、MRI有其相应的特征性,在发现病变的敏感性显然MRI要优于MSCT,但对骨质破坏区内死骨和钙化的显示上MSCT明显具备优势。这4种骨质改变往往不是孤立存在的,它代表脊柱结核感染的不同进程,同一患者往往同时存在几种破坏类型,脓腔变化也提示病变进展或愈合,观察其变化可为临床下一步治疗方案选择提供依据。
