内生真菌对宿主布顿大麦耐碱性的渗透调节和膜系统影响
2024-03-28任改香陈水红王凯特木尔布和
任改香 陈水红 王凯 特木尔布和
摘 要 为了研究带内生真菌(E+)和不带内生真菌(E-)布顿大麦(Hordeum bogdanii)的耐碱性,选择来源于新疆阿克苏温宿县的带内生真菌(E+)和不带内生真菌(E-)布顿大麦种子,先在培养皿中进行发芽,然后进行室内蛭石无土栽培,对其进行21 d的不同浓度混合碱胁迫处理,测定其渗透调节和膜系统变化。结果表明,在相同混合碱处理下, E-植株的相对电导率均显著高于E+植株(P<0.05),E+植株的细胞通透性弱于E-植株。在碱胁迫下E+植株的脯氨酸、可溶性糖和可溶性蛋白含量均显著高于E-植株(P<0.05)。内生真菌具有提高宿主渗透调节物质和降低膜损伤来提高布顿大麦抗碱的能力。
关键词 内生真菌;布顿大麦;混合碱胁迫;渗透调剂;膜系统
布顿大麦(Hordeum bogdanii)是一种分布于甘肃、青海、内蒙古、新疆等高寒地区的荒漠和盐渍土壤等逆境条件下生长的野生禾本科牧草[1]。布顿大麦在新疆分布比较广,沿天山两侧的平原、绿洲、草地、盐碱化草甸以及路边都有其野生种的生长。该草的产量较高,草质柔软、细嫩,适口性好,具有较强的抗寒、耐湿及盐碱的性能[2],在作为饲用牧草与改良荒漠土地及盐碱地等生态环境方面具有很广阔的前景[3]。
禾本科植物中的内生真菌类的研究工作首先是在欧洲进行的,1798年首先在瑞士燕麦族鸭茅属植物(Dactylis glomerata)上找到子座,将该内生真菌类确定为E.typhina[4]。20世纪40年代开始,在新西兰就针对导致牲畜食物中毒的黑麦草内生真菌展开研究[5]。接着世界各地展开禾草内生真菌的研究工作。近期研究发现,新疆地区野生布顿大麦保持较高的内生真菌侵染率[6]。
内生真菌(Endophytic fungi)是指生活史的全部或某一段时期生活在植物组织内部,且不引起植物组织发生明显病害症状的一类真菌[7]。内生真菌在大自然中是普遍存在的,目前许多种禾本科植物中已经发现内生真菌。内生真菌类在禾本科植物体中会长久存活,和宿主一同发展的,而在植物进化过程中内生真菌类也与其宿主之间会产生礼尚往来共利的关系[8]。
中国拥有非常宝贵的禾本科牧草资源,但关于禾本科植物的内生真菌研究起步晚,研究报道少,从醉马草(Achnatherum inebrians)、布顿大麦和阿拉套羊茅草(Festuca alatavica)中检测到了内生真菌Neotyphodium[9-10]。国外有大量研究成果显示内生菌对禾本科植物的侵染能够提高植物的耐旱能力[11]、耐盐性[12],增加了植株自身的竞争力,抵抗杂草[13],从而去影响植物的进化过程以及群落的演替,可以提高植物群落里物种的丰富度,有利于植物生态系统的可持续发展和环境的治理以及环境保护。
植株的耐盐碱机理十分复杂,而其耐盐碱机理的一个非常关键方面,就是在盐分胁迫下植株内会形成并积累某些细胞有机渗透压的调控产物,并借此来减少盐碱胁迫对植株所造成的破坏和减少细胞内渗透压位势以保持在盐分胁迫条件下水分的正常供给。这种化合物中主要含有可溶性葡萄糖、可溶性蛋白、脯氨酸及等[14]。膜系统也是植株盐害的主要靶点,在植株遭受盐害威胁时,作为主要靶点膜系统的对细菌细胞壁的破坏程度的高低可表现盐害对植株的影响,因此盐含量胁迫也会损害植株的膜防护体系[15],而盐含量胁迫也会使丙二醛(MDA)浓度进一步增加,叶片的电导率增加,因此膜破坏度进一步增加[16]。
为了研究内生真菌对布顿大麦的耐盐碱机理,探讨内生真菌在碱胁迫下对宿主渗透调节和膜系统的影响。本试验采用带内生真菌和不带内生真菌的布顿大麦种子,对其无土培养,盐碱处理一定时间后,取样测定渗透调节和膜系统相关的理化指标,综合分析并搞清楚内生真菌对其宿主的影响,结果可为后期的内生真菌研究和提高宿主渗透调节物质和膜系统的相关科学研究提供 参考。
1 材料与方法
1.1 试验材料
试验材料采集于新疆阿克苏地区温宿县境内的布顿大麦种子,种植后用苯胺蓝染色法检测内生真菌,并收集带菌布顿大麦的种子,同时,将采集E+布顿大麦种子用10%甲基托布津浸泡 6 h,剔除种子内种皮及糊粉层中的内生真菌获得不带内生真菌(E-)的布顿大麦种子[17]。
1.2 试验方法
1.2.1 种子培养 将布顿大麦E+和E-的种子在培养皿中发芽。于室內用蛭石无土法培养,小苗长出后移植于新疆阿拉尔市塔里木大学智能温室(白天平均温度28 ℃±2 ℃;夜间平均温度12 ℃±2 ℃)。幼苗生长至3~4个分蘖时取分蘖叶鞘内表皮的薄层再次采用苯胺蓝染色法依靠真菌形态学确认带菌E+和不带菌E-植株,同时移栽至花盆中(上:13 cm;下底:10 cm;高:12 cm),每周浇一次hoagland 营养液,每盆浇200 mL。
1.2.2 试验处理 布顿大麦植株生长2个多月后检菌确定E+与E-,分别用浓度为0 mmol/L(CK)、25 mmol/L、50 mmol/L、150 mmol/L和200 mmol/L的混合碱(Na2CO3∶NaHCO3= 1∶1)进行胁迫处理,每个处理6次重复,处理期间定期补充盆里减少的水分,处理21 d。
1.2.3 相关指标测定 MDA含量测定:参照李树伟等[18]的硫代巴比妥酸(TBA)法;可溶性蛋白含量:采用考马斯亮蓝法[19];可溶性糖测定:采用李合生[19]的蒽酮比色法;脯氨酸测定:采用张殿忠等[20]的磺基水杨酸法;细胞质膜透性测定:采用电导仪法[21]。
1.3 数据处理
采用Excel 2007软件进行绘图、用SPSS 23.0软件进行数据分析,数据采用“平均值±标准误”表示。采用双因素方差分析方法检测混合碱处理和布顿大麦内生真菌对不同生理指标的影响,其中不同混合碱处理浓度对布顿大麦生理指标的影响用单因素方差分析。
2 结果与分析
2.1 内生真菌和碱对膜透性的影响
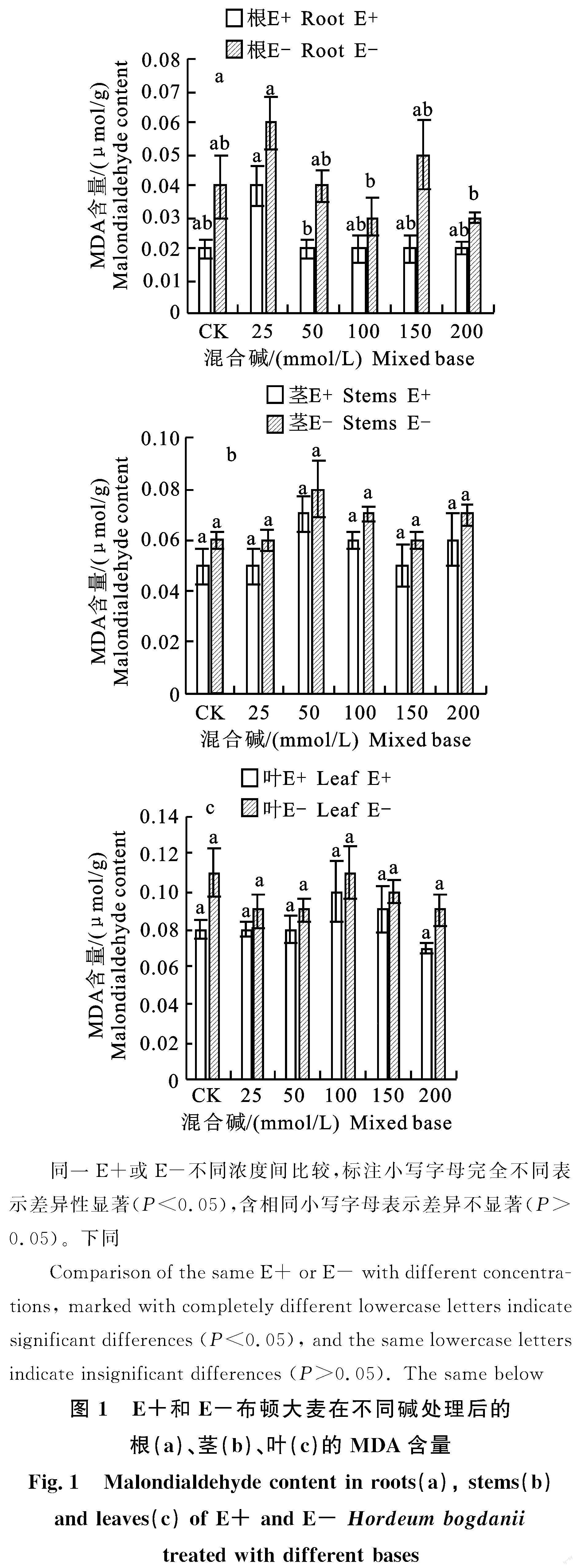
2.1.1 对MDA含量影响
在布顿大麦E-植株根内的MDA含量均高于E+植株(P<0.05)(图1-a)。茎中的MDA含量呈现出,E+植株小于E-植株,但差异不显著(图1-b)。叶片中的MDA含量也是E+植株小于E-植株(P< 0.05)(图1-c)。
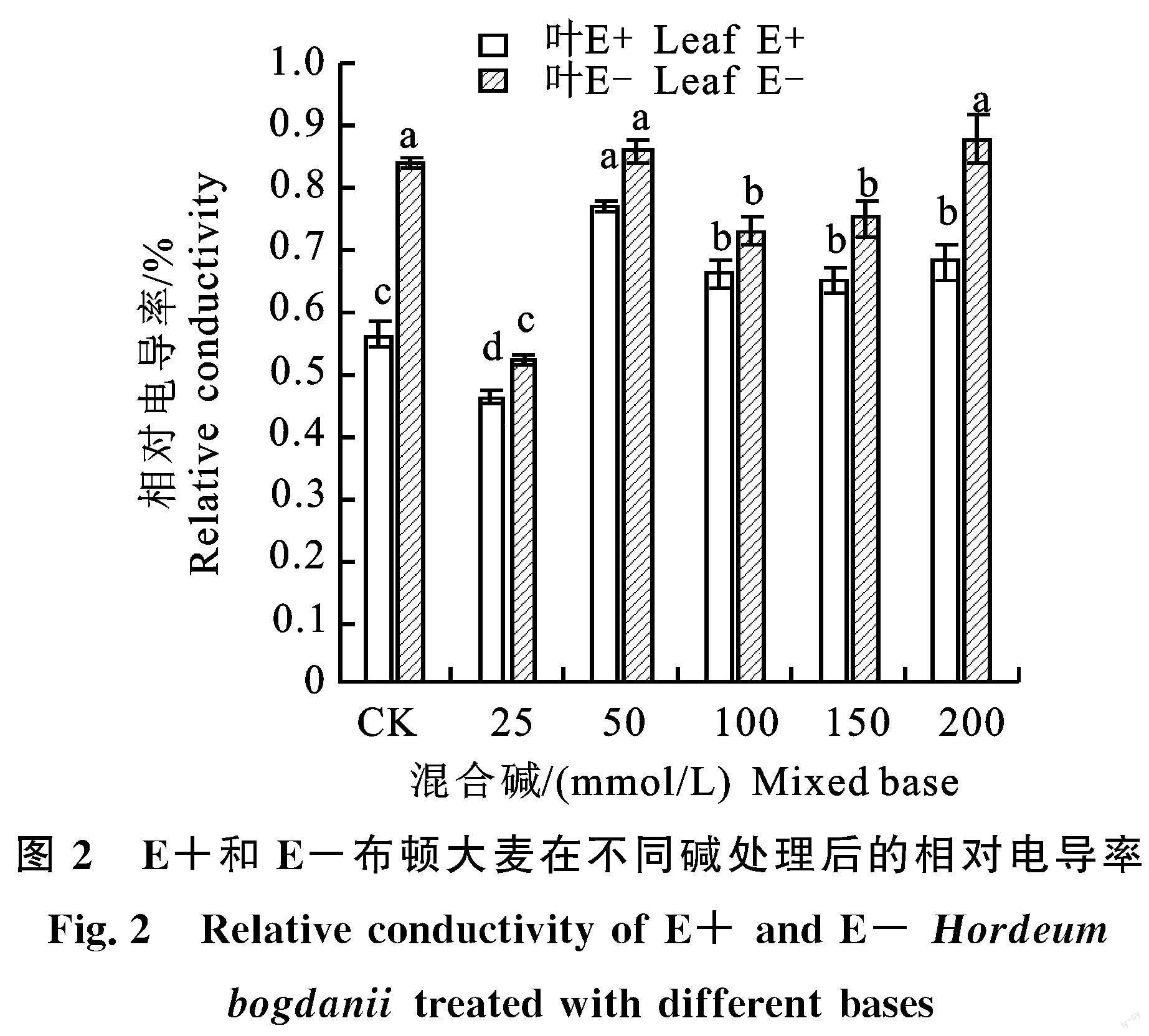
2.1.2 对叶片相对电导率影响 在相同处理下,布顿大麦E-植株的相对电导率均显著高于E+植株(P<0.05),E+和E-植株的相对电导率在高于50 mmol/L以上的处理中,均高于对照CK和25 mmol/L处理(图2)。
2.2 内生真菌和碱对渗透调节物质影响
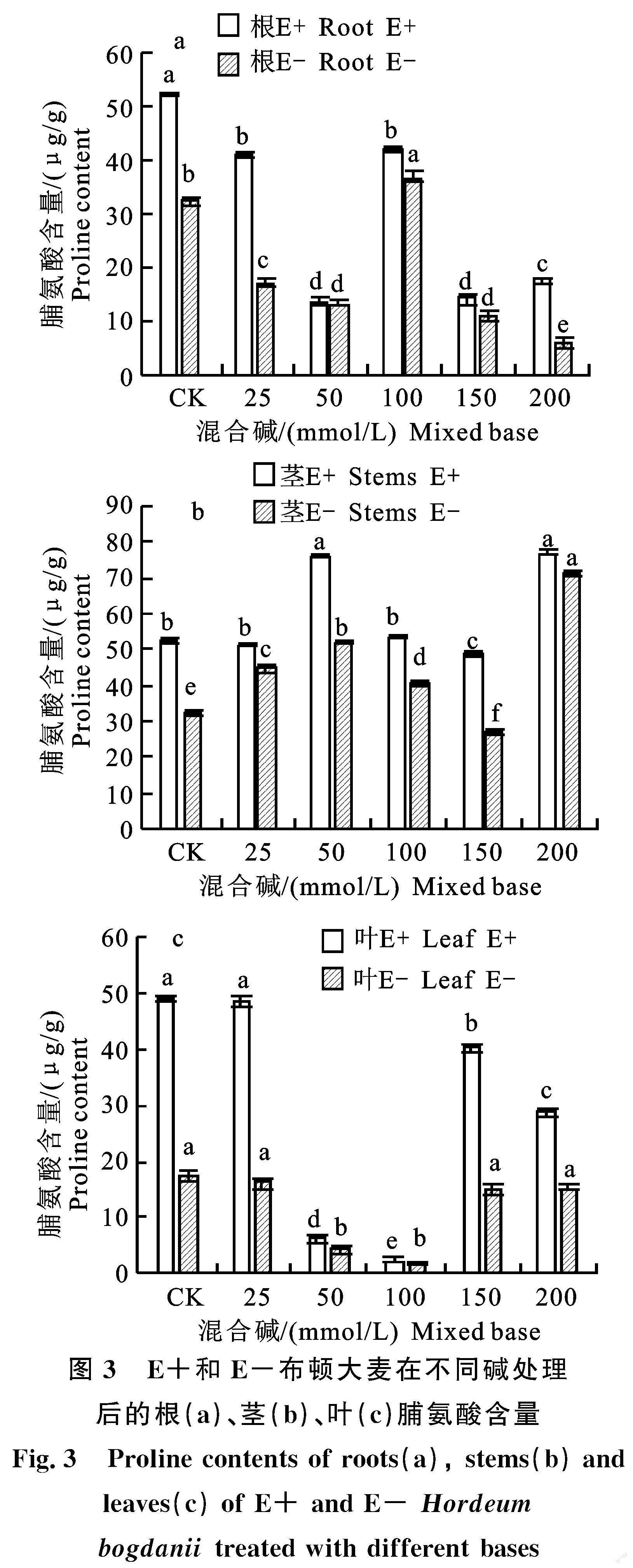
2.2.1 对脯氨酸含量的影响 布顿大麦根的脯氨酸含量在相同处理下,E-植株的均小于E+植株,在CK、25 mmol/L、100 mmol/L、200 mmol/L处理下,E-植株的脯氨酸含量显著小于E+植株(P<0.05)(图3-a)。在相同处理下, E+植株茎的脯氨酸含量均高于E-植株,除了200 mmol/L处理外,其余处理下,E-植株的脯氨酸含量均显著低于E+植株(P<0.05)(图 3-b)。E-植株叶片的脯氨酸含量均小于E+植株,在150 mmol/L、200 mmol/L处理下,E+植株叶片的脯氨酸含量显著高于E-植株 (P<0.05)(图3-c)。
2.2.2 对可溶性糖含量的影响 可溶性糖含量在CK、150 mmol/L处理下,布顿大麦E-植株根的可溶性糖含量显著低于E+植株(P< 0.05),其余处理中,E+植株的可溶性糖含量均高于E-植株(图4-a)。E-植株茎的可溶性糖含量均低于E+植株(P<0.05)(图4-b)。叶片的可溶性糖含量,在相同处理下,E-植株叶片的可溶性糖含量均低于E+植株,且在150 mmol/L处理下,E-植株叶片的可溶性糖含量显著低于E+植株(P< 0.05)(图4-c)。
2.2.3 对可溶性蛋白含量的影响 在相同条件处理下,布顿大麦E-植株根的可溶性蛋白含量均低于E+植株(P<0.05)(图5-a)。在相同处理下,E-植株茎的可溶性蛋白含量均小于E+植株,而在25 mmol/L处理中,E+植株茎的可溶性蛋白显著大于E-植株(P<0.05)(图5-b)。在相同处理下,E-植株叶的可溶性蛋白含量均小于E+植株,但其中25 mmol/L和50 mmol/L处理中,E+植株可溶性蛋白含量显著大于E-植株(P<0.05)(图5-c)。
3 讨 论
植物处于逆境当中,会对植物的各种反应机制形成胁迫,包括直接或者间接的碱胁迫,植株能够通过集聚渗透调节物质的方式提高植物的抗碱能力,从而适应碱胁迫植物积累的物质涵盖了脯氨酸、可溶性蛋白等,这些渗透调节物质为禾本科植物应对逆境胁迫提供了重要作用。本研究得出内生真菌对不同碱浓度胁迫的布顿大麦的渗透调节物质有显著影响。
布顿大麦内生真菌对MDA含量具有显著影响。在本试验研究中,E-植株叶片细胞内MDA含量均高于E+植株,MDA含量强弱也是细胞膜脂过氧化功能好坏的关键指标之一,MDA含量越高则表明细胞质中存在着越强的渗透性物质。在强碱性胁迫下内生真菌对布顿大麦细胞膜渗透性是有重要影响的。本试验研究结论表明,E+植株的细胞质渗透性弱于E-植株的,这一结论与王正凤等[22]的关于内生真菌可减少野大麦植株细胞MDA含量的试验研究结果完全 相符。
布顿大麦内生真菌对相对电导率有显著影响。在相同处理条件下,E-植株的相对电导率显著高于E+植株,盐胁迫浓度越高细胞膜被损伤的程度越大,本试验研究结果显示,E+植株的叶片相对电导率维持在较低的水平,说明内生真菌通过降低相对电导率来保护布顿大麦细胞膜免受碱胁迫的伤害,维持了细胞膜的完整性,此试验结果与宋梅玲[23]的内生真菌能降低盐处理野大麦植株电解质渗透率的研究结果一致。
大量试验研究结果表明,脯氨酸累积可以增加对渗透胁迫的耐性[24]。E-植株茎的脯氨酸含量显著低于E+植株。当布顿大麦植株处于盐胁迫的不良环境中时,会產生更多的脯氨酸来提高其抗盐性,本试验结果与施宠等人的内生真菌能提高盐处理披碱草植株脯氨酸含量的研究结果一致[25]。
在盐胁迫下的植株生长发育会遭到严重抑制,糖利用降低,同时植株叶片内的可溶性糖含量也提高了[26-27]。本试验研究结果表明,E-植株叶片的可溶性糖含量均小于E+植株,这说明内生真菌能够使植物的可溶性糖含量增加,这一结果与任安芝等[28]的内生真菌在高浓度盐处理能降低黑麦草植株可溶性糖的研究结果相反,推断此相反结果的理由是由于处理的盐碱、植物种类和内生真菌不同而导致。
试验结果中发现布顿大麦E-植株叶片的可溶性蛋白质含量均小于E+植株,这一结果与鲍根生等[29]的研究结果一致。可溶性蛋白也是重要的调节物质用来维持细胞渗透势,当布顿大麦抵御外来酸碱胁迫的恶劣条件时,就会产生更多的可溶性蛋白来增强其耐碱性。
4 结 论
混合碱的胁迫下,布顿大麦内真生菌通过减少其根、茎、叶中的MDA含量、叶片相对电导率,从而降低了混合碱对宿主膜质体系的破坏。通过增加宿主根、茎、叶片脯氨酸、可溶性糖和可溶性蛋白质含量,来调整植物细胞的渗透压。内生真菌具有提高宿主渗透调节物质和降低膜损伤来提高布顿大麦抗碱的能力。
参考文献 Reference:
[1] 余 玲,王彦荣,孙建华.环境胁迫对布顿大麦种子萌发及种苗生长发育的影响[J].草业学报,2002,11(2):79-84.
YU L,WANG Y R,SUN J H.Effects of environmental stress on seed germination and seedling growth of Hordeum bogdanii[J].Journal of Grass Industry,2002, 11(2):79-84.
[2] 马瑞昌,张鸿书,木拉提,等.布顿大麦草区域试验[J].新疆农业大学学报,1998,21(4):35-38.
MA R CH,ZHANG H SH,MULATI,et al.Area test of Hordeum bogdanii grass[J].Journal of Xinjiang Agricultural University,1998,21(4):35-38.
[3] 賈慎修.中国饲用植物志:第一卷[M].北京:农业出版社,1987:124-127.
JIA SH X.Forage Flora of China:the First Volume[M].Beijing:Agriculture Press,1987:124-127.
[4] 刑转青.我国北方Epichloae内生真菌资源及其生物碱合成基因的分布检测[D].南京:南京农业大学,2014.
XING ZH Q.Distribution of Epichloae endophytic fungi and their alkaloid synthesis genes in northern China[D].Nanjing:Nanjing Agricultural University,2014.
[5] 张红侠.中国产部分禾本科植物内生真菌资源的探索[D].南京农业大学,2013.
ZHANG H X.Exploration on endophytic fungi resources of some gramineae plants in China[D].Nanjing:Nanjing Agricultural University,2013.
[6] ZHANG Y P,ZHOU Y F,ZHANG X,et al.Effects of Epichloёendophyte on antioxidant enzymes activities,photosynthesis and growth of three ecotypes of Elymus dahuricus[J].Frontiers of Agricultural Science and Engineering,2018,5(1):148-158
[7] 罗 鑫,于 存.贵州马尾松内生真菌多样性[J].菌物学报,2021,40(3):531-546.
LUO X,YU C.Diversity of endophytic fungi in Pinus masson in Guizhou[J].Journal of Fungus,2021,40(3):531-546.
[8] 陈水红,曹 莹,陈泰祥,等.内生真菌提高禾草抗盐碱性研究进展[J].生物技术通报,2018,34(4):35-42.
CHEN SH H,CAO Y,CHEN T X,et al.Research progress of endophytic fungi improving salinE-alkali resistance of grass[J].Biotechnology Bulletin,2018,34(4):35-42.
[9] 李宝军,孙长穗.中国西北地区禾本科植物调查[J].中国草地,1996(2):29-32.
LI B J,SUN CH H.Investigation of gramineae in northwest China[J].China Grass,1996(2):29-32.
[10] 李宝军,孙长穗.中国西北地区禾本科植物调查[J].中国草地,1997(3):69-71.
LI B J,SUN CH S.Investigation of gramineae in northwest China[J].China Grass,1997(3):69-71.
[11] 宋梅玲,李春杰,彭清青,等.温度和水分胁迫下内生真菌对野大麦种子发芽的影响[J].草地学报,2010,18(6):833-837.
SONG M L,LI CH J,PENG Q Q,et al.Effects of endophytic fungi on germination of wild barley seeds under temperature and water stress[J].Grassland Journal,2010,18(6):833-837.
[12] 王正凤,李春杰,金文进,等.内生真菌对野大麦耐盐性的影响[J].草地学报,2009,17(1):88-92.
WANG ZH F,LI CH J,JIN W J,et al.Effects of endophytic fungi on salt tolerance of wild barley[J].Grassland Journal,2009,17(1):88-92.
[13] 尹立佳.内生真菌感染对宿主禾草盐碱耐受性的生理生态影响[D].天津:南开大学,2012.
YIN L J.Physiological and ecological effects of endophytic fungal infection on saline tolerance of host grasses[D].Tianjin:Nankai University,2012.
[14] 杨 涓,许 兴.盐胁迫下植物有机渗透调节物质积累的研究进展[J].宁夏农学院学报,2003(4):86-91.
YANG J,XU X.Advances in the accumulation of organic osmotic substances in plants under salt stress[J].Journal of Ningxia Agricultural College,2003(4):86-91.
[15] 崔 强.四种引进树种对大庆地区土壤盐碱胁迫的生理响应[D].哈尔滨:东北林业大学,2010.
CUI Q.Physiological responses of four introduced tree species to soil salt-alkali stress in Daqing Area[D].Harbin:Northeast Forestry University,2010.
[16] 王学征.设施环境盐分胁迫对番茄生长发育及膜系统影响的研究[D].哈尔滨:东北农业大学,2004.
WANG X ZH.Effects of salt stress on growth and membrane system of tomato[D].Harbin:Northeast Agricultural University,2004.
[17] 黎 勇,戚 芳,卢建军.校园绿化草坪植物高羊茅内生真菌的检测[J].黑龙江农业科学,2012(2):97-100.
LI Y,QI F,LU J J.Detection of endophytic fungi of tall fescue in campus green lawn[J].Heilongjiang Agricultural Sciences,2012(2):97-100.
[18] 李树伟,张剑云,陈水红,等.生物化学实验[M].北京:北京科学技术出版社,2015:94-136.
LI SH W,ZHANG J Y,CHEN SH H,et al.Biochemistry Experiment[M].Beijing:Beijing Science and Technology Press,2015:94-136.
[19] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:119-261.
LI H SH.Principles and Techniques of Plant Physiological and Biochemical Experiments[M].Beijing:Higher Education Press,2000:119-261.
[20] 張殿忠,汪沛洪,赵会贤.测定小麦游离脯氨酸含量的方法[J].植物生理学通讯,1990(4):62-65.
ZHANG D ZH,WANG P H,ZHAO H X.Method for determination of free proline content in wheat[J].Plant Physiology Communication,1990(4):62-65.
[21] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2015:123-187.
WANG X K.Principles and Techniques of Plant Physiological and Biochemical Experiments[M].Beijing:Higher Education Press,2015:123-187.
[22] 王正凤,李春杰,金文进,等.内生真菌对野大麦耐盐性的影响[J].草地学报,2009,17(1):88-92.
WANG ZH F,LI CH J,JIN W J,et al.Effects of endophytic fungi on salt tolerance of wild barley[J].Grassland Journal,2009,17(1):88-92.
[23] 宋梅玲.野大麦内生真菌共生体耐盐性的生理机制研究[D].兰州:兰州大学,2009.
SONG M L.Physiological mechanism of salt tolerance of endophytic fungi in wild barley[D].Lanzhou:Lanzhou University,2009.
[24] PAJOYCE,ASPINALL D,PALEY L G.Photosynthesis and the accumulation of proline in response to water deficit[J].Functional Plant Biology,1992,19(3):249-261.
[25] 施 宠,黄 炜,王纯利.内生真菌对披碱草耐盐性的影响[J].新疆农业大学学报,2016,39(4):277-280.
SHI CH,HUANG W,WANG CH L.Effects of endophytic fungi on salt tolerance of Elymus[J].Journal of Xinjiang Agricultural University,2016,39(4):277-280.
[26] MUNNS R.Physiological processes limiting plant growth in saline soils:some dogmas and hypotheses[J].Plant Cell Environment,1993,16:15-24.
[27] OTT J C,BIRKS K,JOHNSON G.Regulation of the photosynthetic electron transport chain[J].Planta,1999, 209:250-258.
[28] 任安芝,高玉葆,章 瑾,等.內生真菌感染对黑麦草抗盐性的影响[J].生态学报,2006,26(6):1750-1757.
REN A ZH,GAO Y B,ZHANG J,et al.Effects of endophytic fungal infection on salt resistance of ryegrass[J].Acta Ecologica Sinica,2006,26(6):1750-1757.
[29] 鲍根生,王 凯,陈水红.内生真菌对锈病感染布顿大麦生长和生理特性影响的研究[J].青海畜牧兽医杂志,2020,50(5):38-43,15.
BAO G SH,WANG K,CHEN SH H.Effects of endophytic fungi on growth and physiological characteristics of Rust-infected Hordeum bogdanii[J].Qinghai Journal of Animal Husbandry and Veterinary Medicine,2020,50(5):38-43,15.
Effects of Endophytic Fungi on Osmotic Regulation and Membrane System
of Alkaline Tolerance in Host Hordeum bogdanii Barley
Abstract This study aimed to investigate alkaline tolerance of Hordeum bogdanii barley, comparing plants with endophytic fungi (E+) and those without endophytic fungi (E-). Seeds of alkaline-tolerant barley from Aksu Wensu County in Xinjiang were used as experimental materials. Initially,the seeds were germinated in petri dishes and then cultivated in vermiculite soilless conditions in a laboratory setting. Over a 21-day period, the changes in osmotic regulation and membrane system under treatments of different mixed alkali concentration were observed. The results showed that E- plants exhibited significantly higher relative electrical conductivity compared to E+ plants when subjected to the same mixed alkali treatment (P<0.05), indicating greater cell membrane damage in E- plants.Conversely,the E+ plants exhibited stronger cell permeability and higher levels of proline, soluble sugar, and soluble protein under alkali stress compared to E- plants (P<0.05).In conclusion,Endophytic fungi play a role in enhancing the hosts osmotic regulation substances and reducing membrane damage,thereby improving alkali resistance of Hordeum bogdanii barley.
Key words Endophytic fungi; Hordeum bogdanii; Mixed alkali stress; Osmotic adjustment; Membrane system
