披针叶黄华中2株蠕形分生孢子内生真菌的鉴定
2015-10-13孙大林等
孙大林等


摘要:对披针叶黄华(Thermopsis lanceolata)中分离的编号为SP01、RM02的2株蠕形分生孢子内生真菌进行种属分类鉴定。观察真菌的形态,提取真菌DNA,扩增并测定其ITS、GAPDH序列,构建系统发育树,结合形态特征和遗传进化分析结果,并对其进行种属分类。结果表明,SP01菌株的形态特征与凸脐孢属(Exserohilum)中的E. rostratum最为相似,与E. rostratum的遗传进化关系最为密切;RM02菌株的形态特征与弯孢属(Curvularia)中C. spicifera、C. australiensis最为相似,与C. spicifera的遗传进化关系最为密切。确定披针叶黄华中分离的SP01、RM02分别为E. rostratum和C. spicifera。
关键词:披针叶黄华(Thermopsis lanceolata);内生真菌;蠕形分生孢子真菌;鉴定
中图分类号:S432 文献标识码:A 文章编号:0439-8114(2015)18-4473-06
DOI:10.14088/j.cnki.issn0439-8114.2015.18.021
近年研究表明,诸多药用植物内生真菌能够合成具有生物活性作用的次生代谢产物[1-4],通过人工选育和体外培养,该类真菌可以大量合成各种生物活性物质[5],是新型药物开发的重要资源。此外,内生真菌与宿主植物间存在着复杂的共生关系,具有提高植物抗病抗逆性、促进植物生长发育、维持微生态环境平衡等重要作用[6]。
披针叶黄华(Thermopsis lanceolata)为豆科黄华属多年生草本植物,广泛分布于我国东北、华北及西北等省区的半干旱和干旱地区,该植物根系发达、耐寒抗旱、抗风沙、繁殖力强,具有重要的生态利用价值。此外,披针叶黄华也是一种药用植物资源,该植物富含黄华碱、臭豆碱、野决明碱、金雀花碱等多种喹喏里西啶类生物碱,具有抗癌、抗心率失调、抑菌消炎等多种生物活性作用,民间用于多种疾病的治疗[7]。目前尚未见到关于披针叶黄华内生真菌的相关报道。在前期研究中,本实验室对采自宁夏的披针叶黄华内生真菌的多样性进行了研究,从中分离到2株具有蠕形分生孢子真菌形态特征的内生真菌。真菌学界将分生孢子形似蠕虫的半知菌称为蠕形分生孢子真菌(Helminthosoiroid fungi),属半知菌丝饱纲(Hyphomyeetes)暗色菌科,主要包括平脐蠕孢属(离蠕孢属)、弯孢属、内脐孢属、凸脐蠕孢属、长蠕孢属和卵蠕孢属6个属。该类真菌寄主范围宽、分布广泛,是一类具有重要经济意义的真菌类群[8]。本研究拟对分离自披针叶黄华植物组织中的2株蠕形分生孢子真菌进行形态和遗传发育分析,根据真菌的形态特征及内部转录间隔区序列(Internal transcribed space,ITS)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)序列等信息,对其进行了种属分类,为进一步研究披针叶黄华内生真菌的多样性、次生代谢产物及与宿主植物的相互作用关系奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 2013年8月于宁夏银川市采集无病害披针叶黄华的根和种子,分离出SP01和RM02菌株,保存于北方民族大学国家民委发酵和酿造工程重点实验室。
1.1.2 培养基 马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,去离子水1 000 mL,pH 6.5。水琼脂+麦秆培养基(TWA+W):琼脂13 g,去离子水1 000 mL,pH 6.5,制成平板后,放入灭菌麦秆。
1.1.3 仪器与试剂 C1000型PCR仪(美国Bio-Rad公司);凝胶成像系统(美国Bio-Rad公司);5418型高速离心机(德国Eppendorf公司);DNA提取试剂盒、琼脂糖凝胶回收试剂盒(美国OMEGA公司);DNA聚合酶、DNA Marker(大连宝生物工程有限公司);引物(上海生工生物工程股份有限公司合成);其他有机试剂为国产分析纯。
1.2 真菌的形态观察
将SP01、RM02菌株接种于PDA、TWA+W培养基上培养,挑取菌丝至载玻片上,经乳酸酚棉兰染液染色后在显微镜下观察。用目镜测微尺测量分生孢子的大小和菌丝的直径,根据真菌的菌丝、分生孢子、分生孢子梗的形态特点及产孢方式等对其进行初步的种属分类。
1.3 真菌ITS、GAPDH序列的扩增及遗传进化分析
分别取PDA培养基上培养15 d的真菌菌丝约200 mg,置于冰中放置的1.5 mL离心管中,用带有玻璃研磨钻头的电钻间歇研磨菌丝约20 s,然后用DNA提取试剂盒提取真菌基因组DNA。应用White等[9]报道的引物ITS1和ITS4扩增ITS序列,应用Berbee等[10]报道的引物gpd1和gpd2扩增GAPDH序列。PCR反应体系均为50 μL,其中DNA聚合酶2.5 U,PCR缓冲液5 μL,dNTP 4 μL,20 μM引物各2 μL,模板DNA 0.5 μL。具体反应条件为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;最后72 ℃ 10 min使其反应充分。对PCR产物进行琼脂糖凝胶电泳分析,确定成功扩增的产物进行凝胶纯化回收,将纯化的PCR产物送上海生工生物工程股份有限公司,分别以ITS1、ITS4引物和gpd1、gpd2引物进行双向测序,将正反测序结果拼接,获得ITS和GAPDH序列信息。
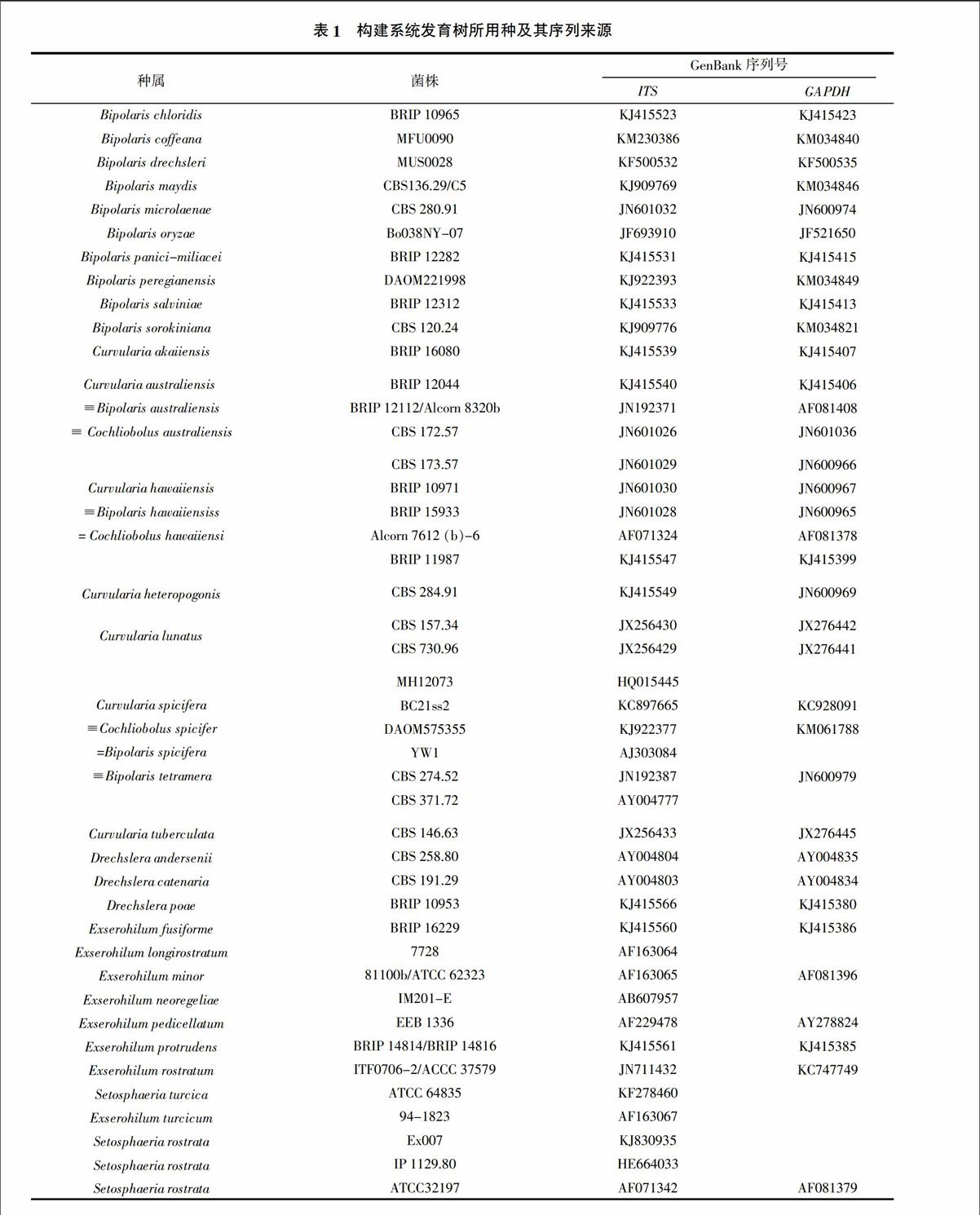
登录http//:www.ncbi.nlm.nih.gov,将已获得的各菌株ITS序列和GAPDH序列提交到GenBank,申请GenBank序列号。应用BLAST在线比对程序分别将测定的ITS序列和GAPDH序列与数据库中已提交的真菌序列进行同源性比较,获得各菌株的种属初步分类信息;选择数据库中相关属或临近属权威菌株的ITS序列和GAPDH序列(表1),应用MEGA 4.0软件中的Clustal W程序对各序列进行联配(Aligment),然后根据联配结果采用邻接法(Neighbor-joining,NJ)构建系统发育树,自展数据集为1 000。
1.4 真菌的种属分类
根据各菌株菌丝、分生孢子及分生孢子梗的形态特点,产孢方式、生长特性,并结合ITS、GAPDH序列同源性比较和遗传进化分析结果,对该类真菌进行种属分类。
2 结果与分析
2.1 SP01和RM02菌株的形态特征
SP01菌株在PDA培养基上菌落呈灰黑色,在TWA+W培养基上呈灰褐色。菌丝无色,分生孢子梗呈深褐色,上部屈膝状弯曲,未见分支。分生孢子呈浅褐色或深褐色,单生于分生孢子梗顶端或侧部,呈圆柱状,略弯曲,两端钝圆,孢子大小约为(60~90) μm×(13~16) μm,一端具脐点,突出于孢子表面。孢子具有6~9个假膈膜,两端膈膜较厚,颜色较深(图1a)。
RM02菌株在PDA培养基上菌落呈灰绿色,在TWA+W培养基上呈灰褐色。菌丝无色,在以上2种培养基上,该菌株均只能产生少量的分生孢子梗和分生孢子。分生孢子梗呈淡褐色,上部屈膝状弯曲,偶见分支。分生孢子呈浅褐色,单生或簇生,呈椭圆形,孢子平直,两端钝圆,孢子大小约为(10~24) μm×(7~10) μm,一端具脐点,与孢子壁表面平齐。孢子具有3个假膈膜(图1b)。
2.2 SP01、RM02菌株ITS、GAPDH的遗传进化分析结果
SP01、RM02菌株的ITS、GAPDH片段的核苷酸序列测定结果显示,SP01、RM02的ITS片段长度分别为601 bp、570 bp,GAPDH片段长度分别为524 bp、530 bp,其ITS序列的GenBank登录号分别为KP245767、KP245754,GAPDH序列的GenBank登录号分别为KP311327、KP311328。
BLAST比对结果显示,SP01菌株的ITS、GAPDH序列与凸脐孢属(Exserohilum)的E. rostratum及其有性型Setosphaeria rostrata的序列一致性最高,均达99%。RM02菌株的ITS序列与弯孢属(Curvularia)的C. spicifera、C. australiensis、C. hawaiiensis等菌株的序列一致性最高,为98%~100%。
基于ITS序列构建的NJ系统发育树(图2)表明,SP01菌株与Exserohilum属的各菌株在系统发育树中同处于一个分支,自检支持率高达99%,其中与E.rostratum ITF0706-2及E.rostratum的有性型S.rostrata IP 1129.80、S.rostrata Ex007、S.rostrata ATCC 32197等菌株遗传进化关系最为密切。RM02菌株与Curvularia属的各菌株在系统发育树中同处于一个分支,其中与C.spicifera的DAOM 575355、YW1、BC21ss2、CBS 274.52等菌株及C.spicifera的同物异名菌株C.tetramera CBS 371.72处于同一个分支,说明RM02菌株与C.spicifera的遗传进化关系最为密切。
基于GAPDH序列构建的NJ系统发育树(图3)表明,SP01菌株与Exserohilum属的各菌株在系统发育树中同处于一个分支,自检支持率也较高,其中与E.rostratum ITF0706-2及E.rostratum的有性型S.rostrata ATCC 32197、S.rostrata ACCC 37579等菌株遗传进化关系最为密切。RM02菌株与Curvularia属的各菌株在系统发育树中同处于一个分支,其中与C.spicifera的DAOM 575355、BC21ss2、CBS 274.52等菌株处于同一个分支,说明RM02菌株与C.spicifera的遗传进化关系最为密切。
3 小结与讨论
在本研究中,SP01菌株的分生孢子呈长圆柱形,具有多个假膈膜,孢子两端膈膜较厚且颜色较深,孢子一端具脐点,脐点明显突出于孢子外壁表面,孢子顶生或侧生,这些形态特点与Exserohilum中的E.rostratum较为相似[8]。此外,基于ITS、GAPDH序列构建的系统发育树也表明,SP01与Exserohilum各种同属于一个类群,且与E.rostratum的遗传进化关系最为密切。因此,本研究将SP01鉴定为E.rostratum(嘴突凸脐蠕孢)。
RM02菌株的分生孢子呈椭圆形,具3个假膈膜,孢子平直,两端钝圆,孢子一端具脐点,脐点与孢子壁表面平齐,该菌具有平脐孢属(Bipolaris)和弯孢属(Curvularia)真菌的典型特征,其中与平脐孢属真菌B.spicifera、B.australiensis最为相似[8]。基于ITS、GAPDH序列构建的系统发育树表明,RM02菌株与弯孢属(Curvularia)菌株处于同一类群,与C.spicifera、C.australiensis、C.hawaiiensis遗传进化关系较近,其中与C.spicifera遗传进化关系最近。而C.spicifera、C.australiensis、C.hawaiiensis分别是B.spicifera、B.australiensis、B.hawaiiensis的同物异名,故本研究将RM02鉴定为C.spicifera≡Bipolaris spicifera(长穗离蠕孢)[11,12]。
在蠕形分生孢子真菌中,突出的脐点是凸脐孢属区别于平脐孢属、内脐孢属等其他蠕形菌的最典型特征。但在实际观察中,真菌的形态变异较大,受培养条件的影响较大,仅据此来区分它们容易造成混淆。弯孢属和平脐孢属的相似程度很高,而且具有相同的有性型-旋孢腔菌属(Cochliobolus)。有学者认为分生孢子是否弯曲或分生孢子的膈膜类型可作为区分弯孢属和平脐孢属的重要依据[11]。但本研究表明,平脐孢属中的某些种的孢子也会出现弯曲,而弯孢属中的某些种的孢子是直的。Alcorn认为Bipolaris的分生孢子的膈膜为假膈膜,而Curvularia的膈膜为真膈膜,Bipolaris、Curvularia应为两个独立的属[12]。但Sivanesan认为,Curvularia中的未成熟或成熟的孢子中其膈膜并未与外壁相连,也是假膈膜[13]。因此,仅根据真菌的形态很难将2个属中的各个种严格区分开来[8]。
近年来,在传统形态分类学的基础上发展而来的核苷酸序列遗传进化分析技术为真菌的种属分类提供了必要的技术手段,如ITS、GAPDH、LSU、EF-1α、Brn1等序列已广泛用于蠕形分生孢子真菌的系统发育研究[8]。Li等[11]、Manamgoda等[12]对Bipolaris、Curvularia真菌的ITS、GAPDH序列进行了遗传进化分析,结果表明,Bipolaris和Curvularia的各个种均被分别划分到Cochliobolus的2个类群中。Manamgoda等[13]、Tan等[14]根据ITS、GAPDH、EF-1α等序列的遗传进化分析结果,对Bipolaris、Curvularia中的各种进行了重新划分,其中将B. spicifera、B.australiensis、B. hawaiiensis等明确划分到Curvularia中。在本研究中,基于ITS、GAPDH序列构建的系统发育树均将B.spicifera、B.australiensis、B.hawaiiensis划分到Curvularia类群中,与Bipolaris类群明显处于不同的进化树分支,这与Brebee等[10]、Manamgoda等[13]的报道相一致。据Shimizu等[15]、Sun等[16]、孙广宇等[17]报道,Brn1序列适用于对Exserohilum、Bipolaris、Curvularia中不同菌株的遗传变异分析,而且能够区分E.rostratum中的种间变异。本研究的结果表明,ITS、GAPDH序列也适用于对Exserohilum各种的区分。
参考文献:
[1] ZHAO J,ZHOU L,WANG J,et al. Endophytic fungi for producing bioactive compounds originally from their host plants[J].A. Méndez-Vilas (Ed.) Current Research,Technology and Education Topics in Applied Microbiology and Microbial Biotechnology,2010,1:567-576.
[2] STIERLE A,STROBEL G,STIERLE D B. Taxonl and taxane production by Taxomyces andreana, an endophytic fungus of pacific yew[J]. Science,1993,260(5105):214-216.
[3] 苏经迁,黄 彬,邱 慧,等.产生物碱和石杉碱甲蛇足石杉内生真菌的初步研究[J].中国药学杂志,2011,46(19):1477-1481.
[4] 孙建秋,郭良栋,臧 威,等.药用植物内生真菌多样性及生态分布[J].中国科学C辑:生命科学,2008, 38(5):475-484.
[5] BANDARA W M M S,SENEVIRATNE G,KULASOORIYA S A. Interactions among endophytic bacteria and fungi: Effects and potentials[J].Journal of Biosciences,2006,31(5):645-650.
[6] 袁志林,章初龙,林福呈.植物与内生真菌互作的生理与分子机制研究进展[J].生态学报,2008,28(9):4430-4439.
[7] 李 勇,赵晓瑞,张学礼.披针叶黄华的化学成分研究[J].农业科学研究,2008,29(4):68-69.
[8] 张天宇,孙广宇.中国真菌志(第三十卷)[M].北京:科学出版社,2010.
[9] INNIS M A,GELFAND D H,SNINSKY J J,et al. PCR Protocols: A Guide to Methods and Applications[M].New York:Academic Press,1990.315-322.
[10] BERBEE M L,PIRSEYEDI M,HUBBARD S. Cochliobolus phy-logenetics and the origin of known, highly virulent pathogens, inferred from ITS and glyceraldehyde-3-phosphate dehydrogenase gene sequences[J].Mycologia,1999,91(6):964-977.
[11] LI K N,ROUSE D I,GERMAN T L. PCR primers that allow intergeneric differentiation of ascomycetes and their application to Verticillium spp.[J]. Appl Environ Microbiol,1995,60 (12):4324-4331.
[12] MANAMGODA D S,CAI L,BAHKALI A H,et al. Cochliobolus:An overview and current status of species[J].Fungal Divers,2011,51(1):3-42.
[13] MANAMGODA D S,CAI L,CROUS P W,et al. A phylogenetic and taxonomic re-evaluation of the Bipolaris-Cochliobolus-Curvularia Complex[J]. Fungal Diversity,2012,56(1):131-144.
[14] TAN Y P, MADRID H, CROUS P W, et al. Johnalcornia gen. et. comb. nov., and nine new combinations in Curvularia based on molecular phylogenetic analysis[J]. Australasian Plant Pathol, 2014, 43(6):589-603.
[15] SHIMIZU K, TANAKA C, PENG Y L, et al. Phylogeny of Bipolaris inferred from nucleotide sequence of Brn1, a reductase gene involve in melanin biosynthesis[J]. J Gen Appl Microbiol, 1998, 44(4):251-258.
[16] SUN G Y,OIDE S,TANAKA E,et al. Species separation in Curvularia "geniculata" group inferred from Brn1 gene sequences[J].Mycoscience,2003,44(3):239-244.
[17] 孙广宇,张雅梅,张 荣.突脐孢属Brn1基因核苷酸序列比较及系统发育研究[J].菌物学报,2004,23(4):480-486.
