长期继代培养过程中楸树愈伤组织的分化能力
2024-03-28董静段秋笛徐艳红周美琪梁宏伟
董静 段秋笛 徐艳红 周美琪 梁宏伟
摘 要 以长期继代培养的楸树愈伤组织和新诱导的楸树愈伤组织为试验材料,利用石蜡切片比较分析它们的组织形态特征,并测定过氧化物酶(POD)、超氧化物歧化酶(SOD)和淀粉酶的活性,以及可溶性蛋白与可溶性糖的含量,以探究楸树愈伤组织长期继代培养后分化再生困难的形成原因。组织形态学观察分析发现,继代培养7 a的白色颗粒状愈伤组织细胞中淀粉粒含量丰富,分布均匀,仍为胚性愈伤组织;新诱导的浅绿色愈伤组织存在明显的细胞分化中心,有均匀分布的淀粉粒,为早期胚性愈伤组织;新诱导的黄白色致密愈伤组织为非胚性向胚性转化的愈伤组织,新诱导黄白色疏松愈伤组织为非胚性愈伤组织。生理生化指标测定分析发现,继代培养7 a的楸树胚性愈伤组织中可溶性糖和可溶性蛋白的含量均显著高于新诱导出的3种愈伤组织,但其同工酶活性却较低,表明在长期继代培养的过程中,楸树愈伤组织的生理生化代谢活性降低。由此推测生理生化代谢活性的下降可能是造成楸树胚性愈伤组织长期继代培养后分化再生困难的重要因素。
关键词 楸树;愈伤组织;长期继代;组织形态学;生理生化指标
楸树(Catalpa bungei C. A. Mey)是紫葳科(Bignoniaceae)梓树属(Catalpa)落叶乔木,中国特有珍贵树种,为优质的用材树种和名贵的园林观赏树种,自古素有“百木之王”的美称[1]。由于楸树天然分布分散,数量较少,且存在自花不孕,结实量少,种子发芽率低等原因,因此规模化发展人工林资源,已经成为楸树开发利用的重点,而开发适宜的优良种质规模化繁殖技术是人工林资源发展的首要问题[2]。楸树繁殖的方式主要有埋根、嫁接、扦插、组织培养等,由于埋根、嫁接与扦插的繁殖系数比较低,特别是楸树优良无性系的繁殖材料少,难以形成规模化生产,限制了其生产应用[3]。植物组织培养是在人为控制、无菌的环境下培养离体的植物细胞、组织或器官,经脱分化、再分化等过程,获得再生的完整植株或其他产品,可以快速实现植株的大量繁殖,是目前广泛应用的植物无性繁殖方式[4],且通过体胚发生途径获得再生植株为植物育种提供新的途径,还可以为遗传转化提供理想材料,为研究植物发育提供理想模型等[5]。然而在离体培养中发现,长期继代培养的楸树胚性愈伤组织离体再生能力大大下降,难以分化再生。
王长兰等[6]对楸树体胚发生过程中的4 种同工酶进行电泳分析,结果表明酯酶(EST)、过氧化物酶(POD)在体细胞胚胎发育过程中代谢活跃,提供分化过程中大量物质能量及维持活性氧平衡。孙政等[7]对楸树胚状体形成过程中不同類型的胚性愈伤组织以及非胚性愈伤组织之间的生理生化分析表明,可溶性蛋白和游离脯氨酸在胚性愈伤组织中的含量都远远高于其非胚性愈伤组织,代谢越旺盛,胚状体发生的潜能越大。本研究通过比较分析新诱导的愈伤组织和经多次继代培养的胚性愈伤组织的生理生化指标和组织形态学特征,以探究长期继代培养的楸树愈伤组织再分化困难的生理机制。该研究对于建立稳定的楸树组织培养再生体系具有重要意义;此外,长期稳定的体胚发生体系建立对于楸树种质资源的保存以及可持续开发利用同样具有重要意义。
1 材料与方法
1.1 植物材料
使用继代培养7 a的楸树胚性愈伤组织和新诱导的3类愈伤组织为供试材料。
1.2 培养基础和培养条件
以楸树未成熟合子胚为最佳外植体,采用 1/2 MS+2,4-D 1.0 mg·L-1+6-BA 0.1 mg·L-1为诱导培养基诱导愈伤组织,增殖培养基为1/2 MS+6-BA 1.0 mg·L-1+NAA 0.01 mg·L-1,体胚发生诱导最合适的培养基采用 1/2 MS+30 g·L-1 蔗糖+0.2 mg·L-1 6-BA+0.05 mg·L-1 NAA;继代培养基采用1/2 MS+30 g·L-1 蔗糖+0.5 g·L-1活性炭。所有培养基均在121 ℃、15 min灭菌;所有材料均在培养温度25 ℃±2 ℃,光照度2 500 lx,光照时间 12 h·d-1的条件下培养。
1.3 细胞学观察
选择上述试验材料,采用常规石蜡切片法[8]。加入FAA溶液抽气后固定24 h以上;再将材料进行脱水、包埋、切片以及高碘酸钾-锡夫试剂-萘酚黄染色剂染色封片,最后使用Nikon80i显微镜观察。
1.4 生理指标测定
测定方法:可溶性糖含量测定采用蒽酮比色法[9],可溶性蛋白含量采用考马斯亮兰G-250法测定[9]。过氧化物酶活性测定采用愈创木酚法[10],超氧化物歧化酶活性测定采用氮蓝四唑法[10]。淀粉酶活性通过利用淀粉酶对麦芽糖的分解作用来进行间接测定[11]。
数据分析:每个样品重复测定3次,使用Excel 2021、IBM SPSS Statistics 24进行数据处理及LSD多重比较分析。
2 结果与分析
2.1 楸树愈伤组织的细胞学形态特征
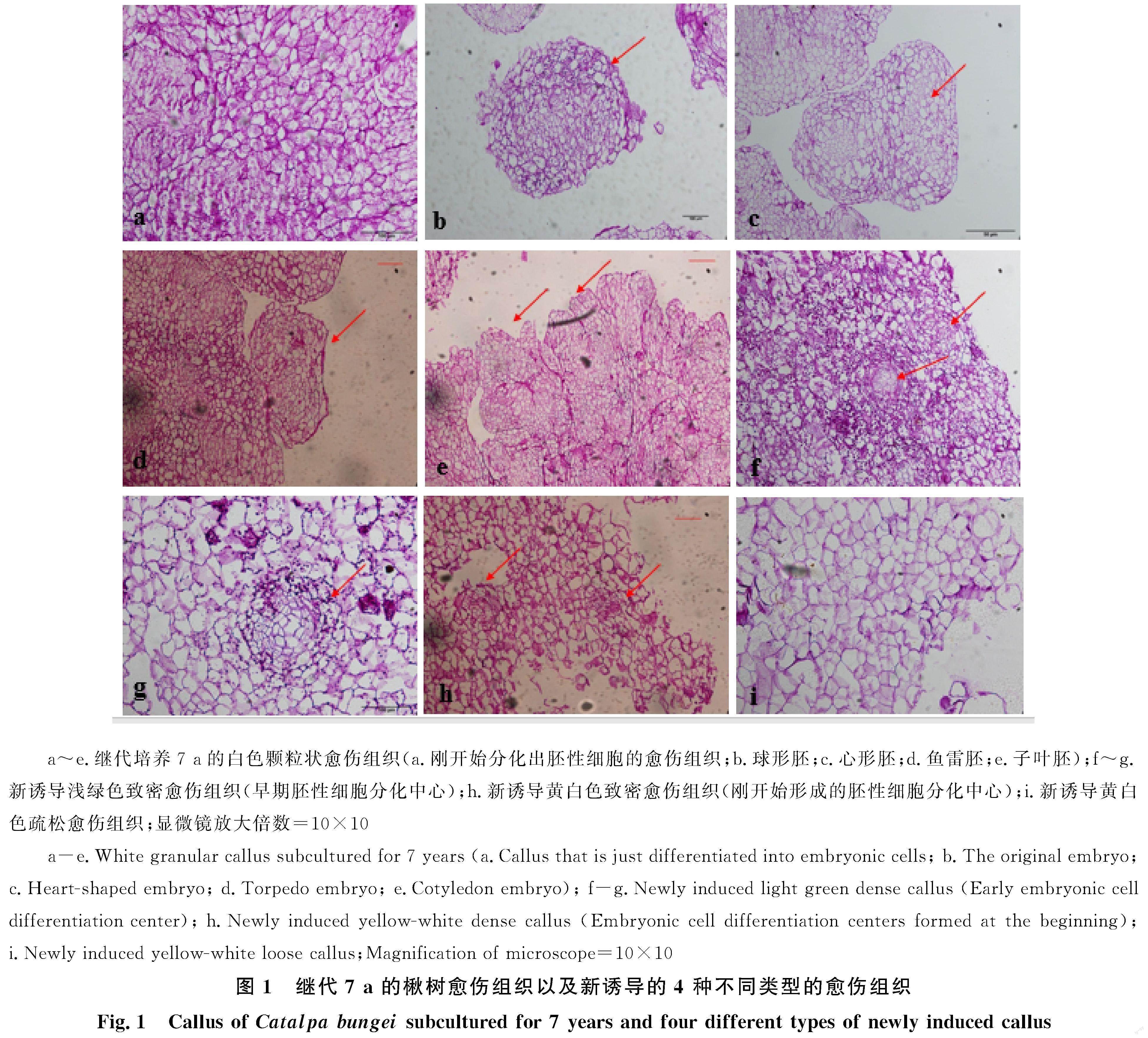
组织形态学观察分析发现,继代培养 7 a的楸树白色颗粒状愈伤组织的细胞较小,排列紧密,细胞内淀粉粒较小,含量丰富,分布均匀,能明显观察到处于分裂状态的胚性细胞中心,可见心形胚、鱼雷胚、子叶胚(图1-a~1-e),表明继代培养
7 a的白色颗粒状愈伤组织仍为胚性愈伤组织;新诱导的浅绿色致密愈伤组织细胞排列紧密,淀粉粒含量丰富,可见明显的正处于活跃分裂状态的细胞分化中心(图1-f~1-g),表明新诱导的浅绿色致密愈伤组织已形成早期胚性愈伤组织;新诱导的黄白色致密愈伤组织细胞分布状况不一,大部分组织中的细胞排列疏松,细胞体积较大,淀粉粒分布较少,但是部分细胞排列紧密,细胞体积较小,可见处于分裂状态的细胞分化中心(图1-h),表明新诱导的黄白色致密愈伤组织细胞是处于非胚性向胚性转化的细胞;新诱导黄白色疏松愈伤组织细胞间隙大,排列疏松,未见明显的淀粉粒分布(图1-i)。
2.2 楸树愈伤组织的生理生化特征
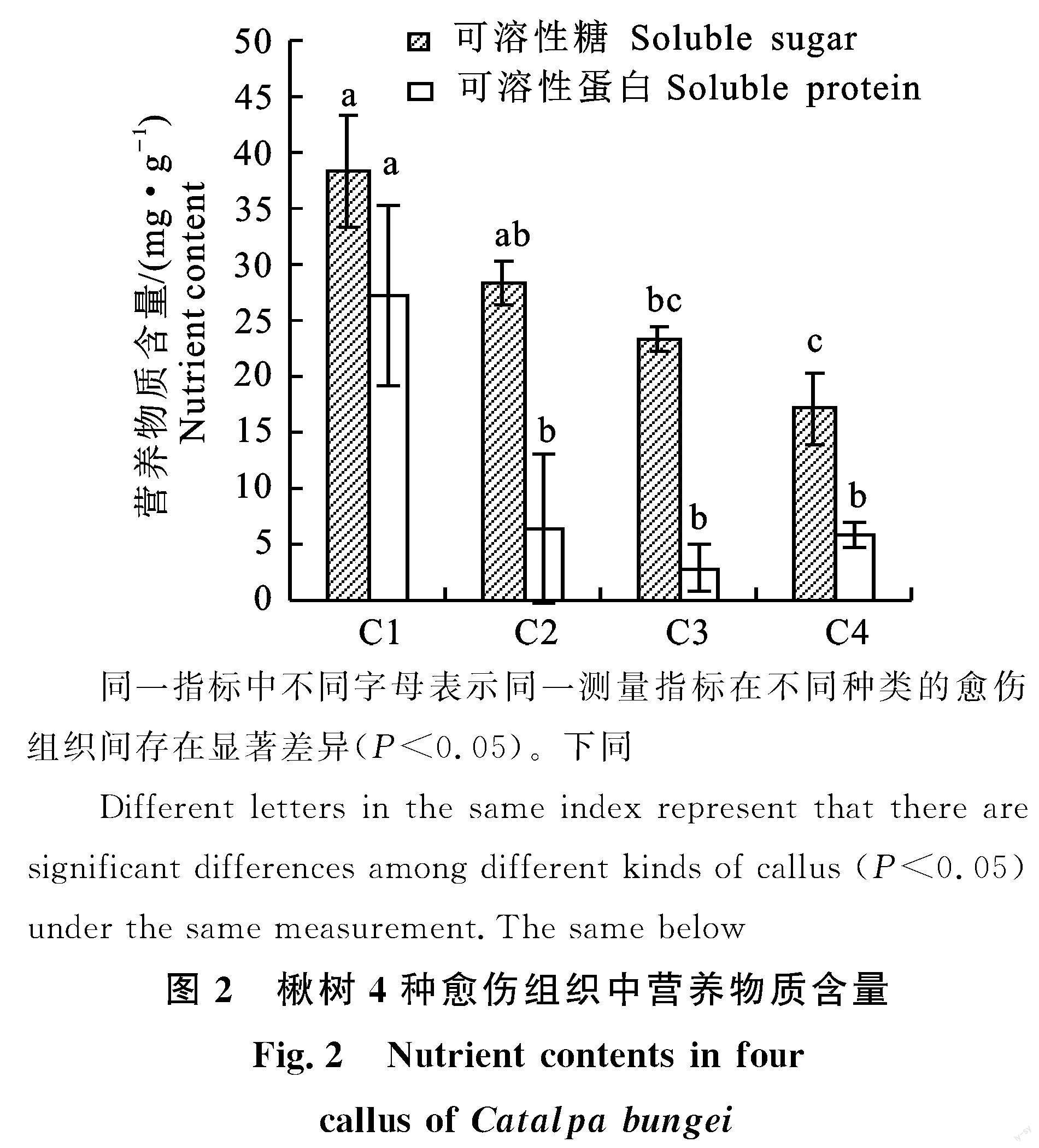
2.2.1 可溶性糖含量 各类愈伤组织中可溶性糖含量由高到依次为继代培养7 a的白色颗粒状胚性愈伤组织(C1)、新诱导浅绿色致密胚性愈伤组织(C2)、新诱导黄白色致密愈伤组织(C3)和新诱导黄白色疏松非胚性愈伤组织(C4)。胚性愈伤组织与非胚性愈伤组织中可溶性糖含量均存在显著性差异(图2)。
2.2.2 可溶性蛋白含量 各类愈伤组织中可溶性蛋白含量由高到低依次为C1、C2、C4、C3,可溶性蛋白含量在C1胚性愈伤组织与其他3种愈伤组织中存在显著性差异,而剩余的3 种愈伤组织中不存在显著性差异;C1胚性愈伤组织中可溶性蛋白含量远高于其他3 种愈伤组织(图2)。
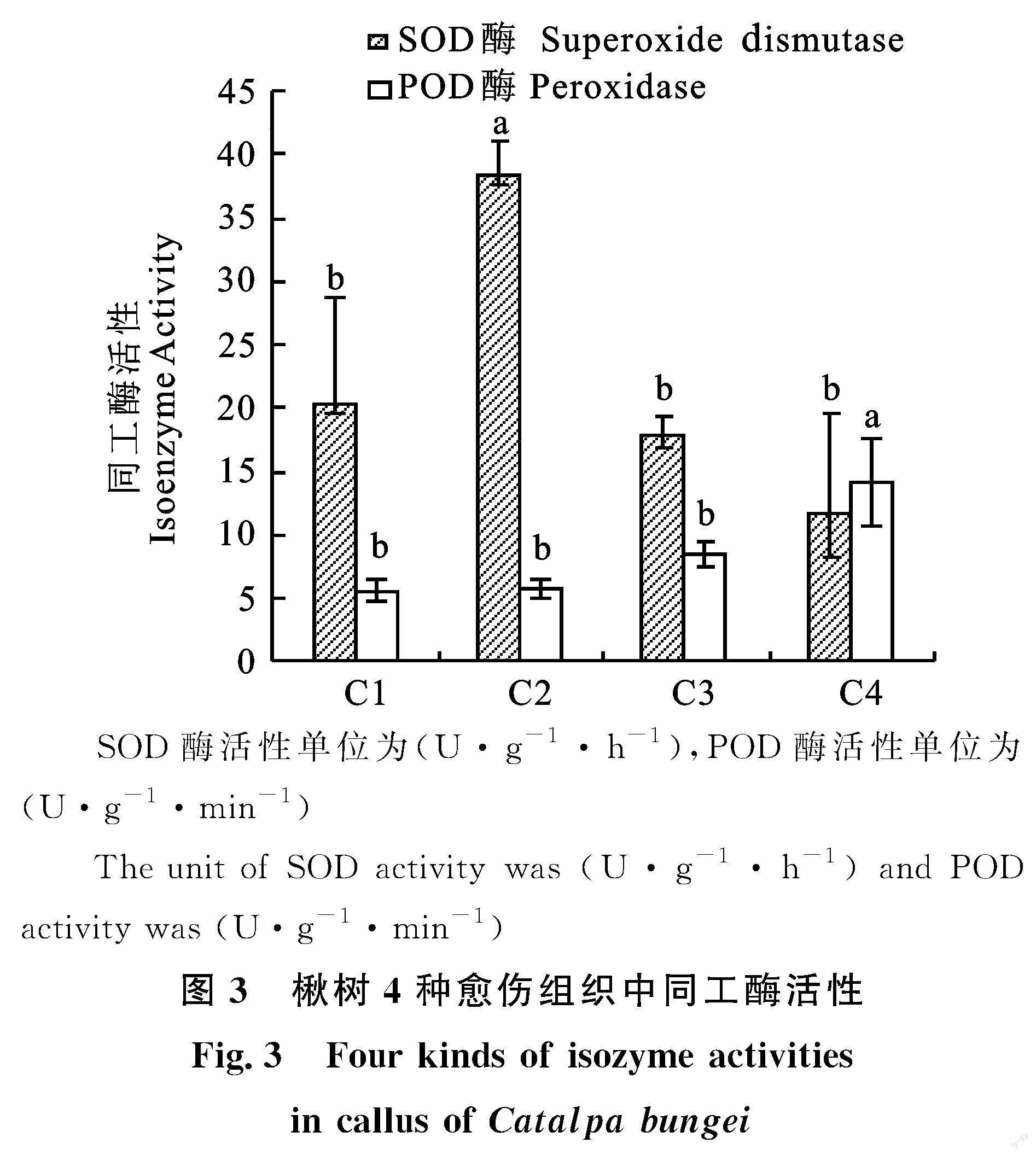
2.2.3 SOD酶活性 各类愈伤组织中SOD酶活性由高到低依次为C2、C1、C3、C4。胚性愈伤组织中SOD酶活性均高于非胚性愈伤组织,在新诱导胚性愈伤组织形成过程中,SOD酶活性是不断增加的。C2中SOD酶活性与其他3种愈伤组织存在显著性差异,而SOD酶活性在其他3种组织中均不存在显著性差异(图3)。
2.2.4 POD酶活性 各类愈伤组织中POD酶活性由高到低依次为C4、C3、C1、C2。非胚性愈伤组织中POD酶活性高于胚性愈伤组织,在新诱导胚性愈伤组织形成的过程中,POD酶活性不断下降。C4中POD酶活性与其他3种愈伤组织存在显著性差异,而POD酶活性在其他3种组织中均不存在显著性差异(图3)。
2.2.5 淀粉酶活性 各类愈伤组织中总淀粉酶活性由高到低依次为C4、C2、C1、C3。C1中α-淀粉酶活性最高,C4中β-淀粉酶活性最高。C4中總淀粉酶活性与C1、C3存在显著性差异;4种愈伤组织中α-淀粉酶活性均无显著性差异;β-淀粉酶活性在C4与C3中存在显著性差异(图4)。
3 讨 论
细胞形态学观察是判定细胞类型及生长状态的重要手段。胚性愈伤组织形成后,表面或内部产生分裂旺盛、排列相对紧密的小细胞组成的胚性细胞团[12],而非胚性愈伤组织的细胞大小不一致,细胞质稀,液泡较大,细胞分化能力差[13]。新诱导的3种愈伤组织中,C4中细胞体积大,间隙大,为非胚性愈伤组织;C3中存在分裂分化状态的细胞,可能处于非胚性向胚性愈伤转化的阶段;C2中存在明显的细胞分化中心,有均匀分布的淀粉粒,但未见形成任何发育阶段的体胚,可能处于体胚形成的初始分化阶段。这与香樟[14]、柑橘[15]和三叶木通[16]等木本植物相似。楸树的各类胚性愈伤组织中,体胚的形成以细胞内起源和外起源两种方式发生,与江荣翠[17]对滇楸的研究结果相似。进一步观察发现,C1中体细胞胚在发育过程中未见到明显的胚柄结构,只通过胚性细胞附着,子叶胚形成后,子叶形态较小,无明显的胚维管组织。与花楸树[18]和香榧[19]的体细胞发育有明显的差异。由于某些营养物质和生长调节剂只在胚柄中产生,缺乏足够的胚柄可能会剥夺体细胞胚胎正常茎顶端分生组织发育所需的生长因子[20]。体细胞胚胎分生区发育不良可能是导致植株再生效率低下的一个因素。
细胞内营养物质含量可作为判断细胞生长状况的依据,可溶性糖作为细胞的直接供能物质,促进胚性愈伤组织分化成体胚,为进一步发育提供了物质和能量基础[17]。楸树愈伤组织在发育过程中,可溶性糖含量是逐渐增加的,且与体胚的形成密切相关。新诱导的胚性愈伤组织脱分化形成不定芽较为普遍,但C1中细胞生长状态良好却几乎不存在根和芽的分化,可溶性糖含量显著高于C2,说明较高的可溶性糖含量抑制愈伤组织的脱分化作用;郭维明等[21]对花烛的研究也验证了这一点。
可溶性蛋白是细胞内重要渗透调节物质,其含量的高低可作为间接判断细胞内代谢活动强弱的指标之一,以及植物抗逆性强弱的参考指标[22]。新诱导愈伤组织形成体胚的过程中,可溶性蛋白含量先减少后增加,前期细胞中的蛋白质转化为细胞的结构物质,后随胚性细胞的形成,可溶性蛋白合成功能增强,含量逐渐积累。张慧君等[23]在橡胶树体胚形成的研究中也发现可溶性蛋白含量在体胚形成过程中先下降,后上升。C1中可溶性蛋白的含量显著高于新诱导各类的愈伤组织,说明长期继代的愈伤组织生长状况良好,抗逆性较强;同时其可溶性蛋白的含量变化较大,表明在植物愈伤组织长期继代培养中细胞变异性 较大。
细胞生长发育的不同阶段,同工酶的活性均会存在一定差异,可作为细胞生长状态、发育阶段的判断依据[24]。楸树诱导的愈伤组织在形成体胚的过程中,SOD酶活性在细胞快速生长过程中不断增强,迅速清除细胞中产生、积累的氧自由基,同时细胞中POD酶活性下降,产生的氧自由基不断减少,保护愈伤组织免受培养基中过多的氧自由基的损害。C1中SOD酶活性显著低于C2,POD酶活性也低于C2,表明长期继代的愈伤组织代谢较低下,细胞分化不活跃,产生的活性氧较少,与李新凤等[25]在牡丹的组织培养过程中POD活性与褐化率存在着显著的负相关性相一致;同时,长期继代培养,细胞的快速生长受到抑制,对环境的抗逆性不断增强,提高了活性氧的耐受性,保持细胞处于胚性状态。宋彦超[26]使用不同Cu2+浓度对水稻愈伤组织处理时发现,在分化较活跃的处理组以及生长阶段中,SOD酶的活性均较高。金玉佩等[27]的分析表明,楸树胚性愈伤组织在形成体胚的过程中POD酶活性是下降的。李双成等[28]的研究表明,当水稻的愈伤组织处于高渗的逆境下时,细胞生长受到抑制,胚性愈伤细胞更倾向于保持胚性而不是进一步分化。
淀粉酶催化淀粉水解为麦芽糖,进一步水解为葡萄糖,为细胞的生长代谢提供能量来源,与细胞正常发挥生理功能有着紧密的联系[29]。楸树愈伤组织形成胚性细胞的过程中,α-淀粉酶、β-淀粉酶、总淀粉酶活性均表现为先下降后上升,表明胚性细胞在形成前期,细胞中淀粉酶催化淀粉分解以提供足够的能量,支持细胞活跃的代谢活动,形成胚性细胞后淀粉酶活性重新恢复。C1中的淀粉酶活性稍低于C2,表明长期继代的胚性愈伤组织对淀粉的分解利用低于新诱导的胚性愈伤组织,可能与其细胞倾向于保持胚性而不是进一步分化有关;这与龚子端[30]甘薯愈伤组织的淀粉酶活性结论一致。徐春明等[31]通过对新疆雪莲芽分化过程中的淀粉酶分析也验证了β-淀粉酶与细胞的分化过程密切相关。
基于以上研究结果,笔者推测楸树愈伤组织在长期继代培养的过程中,胚性细胞长期保持使其更倾向于胚性的变异,在连续继代中逐步积累,且不断提高对环境的耐受性,从而使细胞中的代谢活动较新诱导的、再分化活跃的愈伤组织总体上更稳定。后期研究可从选择诱导率较高的部位进行组织诱导培养、改善培养条件、改善培养基营养结构和激素水平等角度来提高长期继代培养的楸树愈伤组织再分化诱导率,从而建立更稳定的楸树组织培养体系,为楸树的种质资源保护、工业化大量生产利用提供理论基础。
参考文献 Reference:
[1] 南 垚,郑莲香,周立东.楸树的研究现状与开发前景[J].西北药学杂志,2007,22(2):90-93.
NAN Y,ZHENG L X,ZHOU L D. Research status and development prospect of Catalpa bungei[J].Northwest Pharmaceutical Journal,2007,22(2):90-93.
[2] 姜 何,董玉峰,马玉珍,等.楸树组织培养研究进展[J]. 山东林业科技,2019,49(2):106-109.
JIANG H,DONG Y F,MA Y ZH,et al. Advances in research on tissue culture of eucalyptus[J].Journal of Shandong Forestry Science and Technology,2019,49(2):106-109.
[3] 梁有旺,杜旭華,王顺财,等.楸树嫩枝扦插生根的主要影响因子分析[J].植物资源与环境学报,2008,17(4):46-50.
LIANG Y W,DU X H,WANG SH C,et al. Analysis of main influence factors on rooting of twig cutting of Catalpa bungei[J].Journal of Plant Resources and Environment,2008,17(4):46-50.
[4] OLGV V Z,ALEXANDER A G,DMITRY S M,et al. Titanium trisulfide nanoribbons affect the downy birch and poplar×aspen hybrid in plant tissue culture via the emission of hydrogen sulfide[J].Forests,2021,12(6):713.
[5] LELU-WALTER M A,TEYSSIER C,GUERIN V,et al. Vegetative propagation of larch species:somatic embryogenesis improvement towards its integration in breeding programs[M]∥PARK Y S,BONGA J M,MOON H K. Vegetative Propagation of Forest Trees. Seoul,Korea:National Institute of Forest Science,2016:551-571.
[6] 王长兰,张 青,魏文桃,等.楸树体细胞胚胎发生过程中4种同工酶分析[J].基因组学与应用生物学,2016,35(11):3122-3127.
WANG CH L,ZHANG Q,WEI W T,et al. Analysis on four kinds of isoenzymes during somatic embryogenesis in Catalpa bungei C.A.Mey.[J].Genomics and Applied Biology,2016,35(11):3122-3127.
[7] 孙 政,陈发菊,高 晗,等.楸树胚性愈伤组织与非胚性愈伤组织的生理生化差异[J].分子植物育种,2017,15(11):4642-4646.
SUN ZH,CHEN F J,GAO H,et al. Physiological and biochemical differences between embryogenic callus and non embryonic callus of Catalpa bungei[J].Molecular Plant Breeding,2017,15(11):4642-4646.
[8] 梁忠泉,袁昌隆,张宝贺.微小组织石蜡切片制作体会[J].中国组织化学与细胞化学杂志,2018,27(4):368-373.
LIANG ZH Q,YUAN CH L,ZHANG B H. Experience in making microtissue paraffin section[J].Chinese Journal of Histochemistry and Cytochemistry,2018,27(4):368-373.
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
LI H SH. Principles and Techniques of Plant Physiological and Biochemical Experiments[M]. Beijing:Higher Education Press,2000.
[10] 孙 群,胡景江.植物生理学研究技术[M].陕西杨凌: 西北农林科技大学出版社,2006.
SUN Q,HU J J. Research Technology of Plant Physiology[M]. Yangling Shaanxi:Northwest Agriculture and Forestry University Press,2006.
[11] 李 雯,邵远志,陈维信.淀粉酶活性测定方法的改进[J].植物生理学通讯,2005,41(5):655-656.
LI W,SHAO Y ZH,CHEN W X. Improved method for determining amylase activity[J].Plant Physiology Communications,2005,41(5):655-656.
[12] RAGHAVAN V. Role of 2,4-dichlorophenoxyacetic acid (2,4-D) in somatic embryogenesis on cultured zygotic embryos of Arabidopsis:cell expansion,cell cycling,and morphogenesis during continuous exposure of embryos to 2,4-D[J].American Journal of Botany,2004,91(11):1743-1756.
[13] 陈敏敏,杨柳燕,杨 贞,等.‘凤丹白成熟胚愈伤诱导、增殖及组织学观察[J].经济林研究,2021,39(1):9-16.
CHEN M M,YANG L Y,YANG ZH,et al. Callus induction,proliferation and histological observation of Paeonia ostii cv. ‘Phoenix White mature embryo[J].Non-wood Forest Research,2021,39(1):9-16.
[14] 荆茹月,霍 坤,李志辉.香樟胚性与非胚性愈伤组织间的差异研究[J].中南林业科技大学学报,2020,40(10):70-78.
JING R Y,HUO K,LI ZH H. Difference between embryogenic and non-embryogenic callus of Cinnamomum camphora L.[J].Journal of Central South University of Forestry & Technology,2020,40(10):70-78.
[15] 刘华英.柑橘体细胞胚发生的细胞学及生理生化特性研究[D].长沙:湖南农业大学,2003.
LIU H Y. Cytological,physiological and biochemical characteristics of somatic embryogenesis in Citrus[D]. Changsha:Hunan Agricultural University,2003.
[16] 姜治国,马 鑫,胡 胜,等.三叶木通体细胞胚胎发生及植株再生研究[J].西南林业大学学报(自然科学),2022,42(3):34-41.
JINAG ZH G,MA X,HU SH,et al. Somatic embryogenesis and plant regeneration of Akebia trifoliata[J].Journal of Southwest Forestry University(Natural Science),2022,42(3):34-41.
[17] 江榮翠.滇楸体细胞胚胎发生及其机理研究[D].南京:南京林业大学,2010.
JIANG R C. Somatic embryogenesis and its mechanism in Sorbus yunnanensis[D]. Nanjing:Nanjing Forestry University,2010.
[18] 杨 玲,沈海龙.花楸树体细胞胚与合子胚的发生发育[J].林业科学,2011,47(10):63-69.
YANG L,SHEN H L. Cytological and histological investigations on somatic and zygotic embryogenesis of Sorbus pohuashanensis[J].Scientia Silvae Sinicae,2011,47(10):63-69.
[19] 项伟波,赵金凯,吴家胜,等.香榧体细胞胚发生、发育的形态与细胞学观察[J].园艺学报,2015,42(8):1477-1486.
XIANG W B,ZHAO J K,WU J SH,et al. Morphological and cytological observation of somatic embryogenesis and development in Torreya grandis ‘Merrilli[J].Acta Horticulturae Sinica,2015,42(8):1477-1486.
[20] JAYASANKAR S,BONDADA B R,LI Z,et al. Comparative anatomy and morphology of Vitis vinifera (Vitaceae) somatic embryos from solid and liquid-culture-derived proembryo genic masses[J].American Journal of Botany,2003,90(7):973-979.
[21] 郭維明,赵云鹏,文方德.花烛愈伤组织不同继代培养的再分化差异[J].园艺学报,2004,31(1):69-72.
GUO W M,ZHAO Y P,WEN F D. Relative physiological and biochemical features of redifferentiation difference in three types of calli subculture in Anthurium andraeanum[J].Acta Horticulturae Sinica,2004,31(1):69-72.
[22] ZHANG H,HUA Y,HUANG T,et al. Physiologic and biochemical characteristics in the development of embryogenesis of rubber tree[J].Chinese Journal of Tropical Agriculture,2014,4(10):12-18.
[23] 张慧君,华玉伟,黄天带,等.橡胶树体胚发生过程中的生理生化特性[J].热带农业科学,2014,34(10):12-14,18.
ZHANG H J,HUA Y W,HUANG T D,et al. Physiologic and biochemical characteristics in the development of embryogenesis of rubber tree[J].Chinese Journal of Tropical Agriculture,2014,34(10):12-14,18.
[24] 阎丽娜.不同类型水稻成熟胚再生体系的建立及其生理生化特性的研究[D].南京:南京农业大学,2009.
YAN L N. Establishment of regeneration system from mature embryos of different types of rice and its physiological and biochemical characteristics[D].Nanjing:Nanjing Forestry University,2009.
[25] 李新凤,巩振辉,孙冬青,等.不同品种牡丹几个生理参数的比较及其与组培中褐化的关系[J].西北农业学报,2008,17(1):142-145.
LI X F,GONG ZH H,SUN D Q,et al. The comparison of physiological indexes and the relation with browning in tissue culture about different peony species[J].Acta Agriculturae Boreali-occidentalis Sinica,2008,17(1):142-145.
[26] 宋彦超.寒地粳稻遗传体系优化以及分化过程中生理生化特性研究[D].哈尔滨:东北农业大学,2012.
SONG Y CH. Study on fenetic system optimization and physiological and biochemical characteristics of Japonica rice in cold region[D]. Harbin:Northeast Agricultural University,2012.
[27] 金玉佩,刘 佳,纪若璇,等.楸树体胚发生过程中5种酶的活性变化研究[J].热带作物学报,2017,38(2):252-257.
JIN Y P,LIU J,JI R X,et al. Analysis on activity change of enzyme during somatic embryogenesis in Catalpa bungei C.A.Mey.[J].Chinese Journal of Tropical Crops,2017,38(2):252-257.
[28] 李双成,王世全,尹福强,等.籼稻成熟胚愈伤组织培养影响因素研究[J].四川农业大学学报,2004,22(4):296-300,331.
LI SH CH,WANG SH Q,YIN F Q,et al. Some factors affecting mature embryos callus culture in indica rice[J].Journal of Sichuan Agricultural University,2004, 22(4):296-300,331.
[29] XUE W,LIU N,ZHANG T,et al. Substance metabolism,IAA and CTK signaling pathways regulating the origin of embryogenic callus during dedifferentiation and redifferentiation of cucumber cotyledon nodes[J].Scientia Horticulturae,2022,293(1):110680.
[30] 龚子端.PEG对甘薯愈伤组织淀粉酶的调节作用[D]. 成都:四川大学,2004.
GONG Z D. Regulation of PEG on amylase in sweet potato callus[D]. Chengdu:Sichuan University,2004.
[31] 徐春明,趙 兵.新疆雪莲芽分化过程蛋白质·可溶性糖含量及淀粉酶活性变化[J].安徽农业科学,2009,37(3):969-970.
XU CH M,ZHAO B. Study on the change of protein and soluble sugar contents and amylase activity of Xinjiang Saussurea involucrata during bud differentiation[J].Journal of Anhui Agricultural Sciences,2009,37(3):969-970.
Differentiation Ability of Catalpa bungei Callus in Long Term Subculture
Abstract In this study,the calli of Catalpa bungei subcultured for a long time and the newly induced calli of Catalpa bungei were used as experimental materials,the differences in their histological characteristics were compared and analyzed by paraffin sections,and the differences in the activities of peroxidase (POD),superoxide dismutase (SOD) and amylase,the changes in the content of soluble protein and soluble sugar were determined,so as to explore the reasons for the formation of difficulty in differentiation of regeneration of Catalpa bungei callus after long-term subculture. The observation and analysis of histomorphology showed that the white granular callus cells subcultured for 7 years were still embryogenic callus with abundant starch grains and uniform distribution; the newly induced light green calli had obvious cell differentiation centers and uniformly distributed starch grains. They were early embryogenic calli. The newly induced yellow white compact calli were non embryogenic to embryogenic calli. The newly induced yellow white loose calli were non embryogenic calli. The determination and analysis of physiological and biochemical indexes showed that the contents of soluble sugar and soluble protein in the embryonic callus of Catalpa bungei subcultured for 7 years were significantly higher than those in the three kinds of newly induced callus,but their isozyme activities were low,indicating that the physiological and biochemical metabolic activities of Catalpa bungei callus decreased in the long-term subculture process. It is speculated that the decline of physiological and biochemical metabolic activity may be an important factor that causes the difficulty in differentiation and regeneration of embryonic callus of Catalpa bungei after long-term subculture.
Key words Catalpa bungei; Callus; Long term subculture; Histomorphology; Physiological and biochemical indexes
