桃胶和竹醋涂膜对猕猴桃果实采后软化机理研究
2024-03-28代春蓉石浩吴健笔王琰王仁才
代春蓉 石浩 吴健笔 王琰 王仁才
摘 要 为探究桃胶和竹醋涂膜处理对猕猴桃采后果实软化的作用机理。以‘翠玉猕猴桃为试材,采用2%桃胶、0.5%竹醋及桃胶+竹醋复合涂膜处理浸泡3 min,置于(5±1)℃、湿度为90%~95%的冷库中贮藏,研究果实硬度、细胞壁组分、软化相关酶活性及其基因表达量的变化规律。结果表明,复合涂膜处理显著抑制多聚半乳糖醛酸酶(PG)、β-半乳糖苷酶(β-Gal)、纤维素酶(Cx)和果胶酯酶(PE)的活性,降低PG、β-Gal、Cx和PE基因的表达,有效抑制细胞壁骨架物质、原果胶和纤维素的降解,延缓可溶性总糖和可溶性蛋白含量的上升,从而维持果实的硬度,延迟果实后熟软化。综上,桃胶和竹醋复合涂膜保鲜效果优于单一处理,是延缓猕猴桃果实细胞壁代谢和保持果实品质的有效措施。
关键词 猕猴桃;桃胶;竹醋;软化;基因表达
猕猴桃隶属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia),富含膳食纤维和维生素C,具有很高的商品价值,颇受广大消费者赞誉[1]。但猕猴桃属于典型的呼吸跃变型浆果,采摘后易变软腐烂。果实软化是一个复杂且有序的生理生化过程,它涉及一系列酶活性的动态变化和基因差异表达的调控。细胞壁组分和结构变化是影响果实软化的关键因素,细胞壁主要成分的多糖可通过与细胞壁分解相关酶的催化而降解,进而影响细胞完整性和细胞粘附性[2]。细胞壁的结构变化涉及细胞壁修饰酶的协同作用,这些酶主要包括多聚半乳糖醛酸酶(polygalacturonase,PG)、β-半乳糖苷酶(β-D-galaetosidase,β-Gal)、纤维素酶(cellulase,Cx)和果胶酯酶(Pectinesterase,PE)。研究表明,这些酶活性的增强和细胞壁多糖含量的下降可能会导致西葫芦[3]、梨[4]、番茄[5]等采后新鲜水果软化并缩短贮藏时期,酶诱导的细胞壁修饰被认为是许多水果成熟过程中果肉软化的主要原因[6]。近年来,为了减缓果实采后软化速率,天然保鲜剂已成为果蔬采后保鲜的研究热点。
桃胶是桃或山桃等蔷薇科植物的树皮受损分泌的一种天然植物胶,多糖含量高达80%,很多性能优于与其化学成分相似的阿拉伯胶[7]。桃胶作为一种新型的可食用膜[8],在番茄[9]、蓝莓[10]和桃[11]上均有较好的保鲜效果,是一种药食兼备的中药材保鲜劑。竹醋是竹子热分解过程中的副产品,主要成分为水,含有机酸、酚类、酮类等,因其含有许多活性化学成分而具有抗氧化和抑菌的作用。与有机酸相比,竹醋具有更高的抗菌作用[12-13],被视为一种新型的食物添加剂。研究表明,竹醋涂膜处理能有效抑制微生物的生长而延长肉制品[14]、椪柑[15]的保质期。桃胶和竹醋因生态友好、技术成本低、普适性强等优点而被广泛研究并应用于食品行业。
湖南农业大学园艺学院猕猴桃课题组前期研究发现,桃胶和竹醋复合涂膜处理应用于猕猴桃采后保鲜,能显著提高果实硬度,延缓果实软化,进而延长猕猴桃的贮藏期,这一结果是否与猕猴桃果实细胞壁组分和结构变化有关系,值得深入研究。目前对猕猴桃果实软化的相关研究较少,因此本试验以‘翠玉猕猴桃为试材,探究桃胶和竹醋涂膜处理对猕猴桃果实采后成熟软化过程中硬度、淀粉、可溶性总糖、可溶性蛋白质、细胞壁组分、相关酶活性及基因表达的影响,探明桃胶和竹醋涂膜处理对猕猴桃的软化机理,以期开发新的采后处理方法,从而延长猕猴桃及其他园艺水果的贮藏期。
1 材料与方法
1.1 试验材料
试验材料为‘翠玉猕猴桃,于2021年10月3日采摘于湖南溆浦县,当天运回实验室,预冷12 h后挑选大小均一、无病虫害和机械损伤的猕猴桃果实用于后续试验。桃胶购于陕西盛恒生物科技有限公司,竹醋购于江阴中炬生物科技有限公司。湖南农业大学园艺学院猕猴桃课题组前期的试验筛选出最适宜的桃胶涂膜液的质量分数为2%,竹醋涂膜液的体积分数为0.5%。
试验设置2%桃胶涂膜液(T1)、0.5%竹醋涂膜液(T2)、2%桃胶+0.5%竹醋复合涂膜液(T3)和不做任何处理(对照,CK)4个处理。采用浸泡法涂膜3 min,要求果实浸泡均匀一致,室温通风下干燥,每组约为150个果实。处理后用PE袋包装后置于(5±1)℃、湿度为90%~95%的冷库中贮藏,每隔20 d测定果实硬度和细胞壁组分等指标,采用液氮速冻,置于-80 ℃冰箱中用于酶活性及基因相对表达量分析。所有试验均重复3次。
1.2 测定指标及方法
1.2.1 理化指标 采用GY-3硬度计测定果实硬度。原果胶和可溶性果胶含量采用咔唑比色法[16]测定。纤维素含量参考文献[17],淀粉含量参考文献[16],可溶性总糖[13]采用蒽酮硫酸法测定。可溶性蛋白含量采用G-250染色法[17]。
1.2.2 酶活性 多聚半乳糖醛酸酶(PG)活性采用DNS比色法[16]测定,在40 ℃水浴30 min,pH 6.0条件下,每克样本每小时分解果胶酸产生1 mg半乳糖醛酸为1个酶活力单位,单位为 mg·h-1·g-1。β-半乳糖苷酶(β-Gal)活性参考Zhang等[18]方法,以对-硝基苯-β-D-吡喃半乳糖苷为底物,37 ℃[JP2]保温30 min,400 nm处测定吸光值,以每克组织每分钟产生1 nmol对-硝基苯酚定义为1个酶活性单位,单位为μg·g-1·min-1。纤维素酶(Cx)活性采用蒽酮硫酸比色法[19]测定,以每克组织每分钟催化产生1 μg葡萄糖定义为1个酶活力单位,单位为mg·min-1·g-1。果胶甲酯酶(PE)采用NaOH滴定法[20]测定,以果胶为底物,37 ℃烘箱60 min,pH维持在7.8,以每克组织每分钟消耗1 μmol NaOH的酶用量为1个酶活力单位,单位为U·g-1。
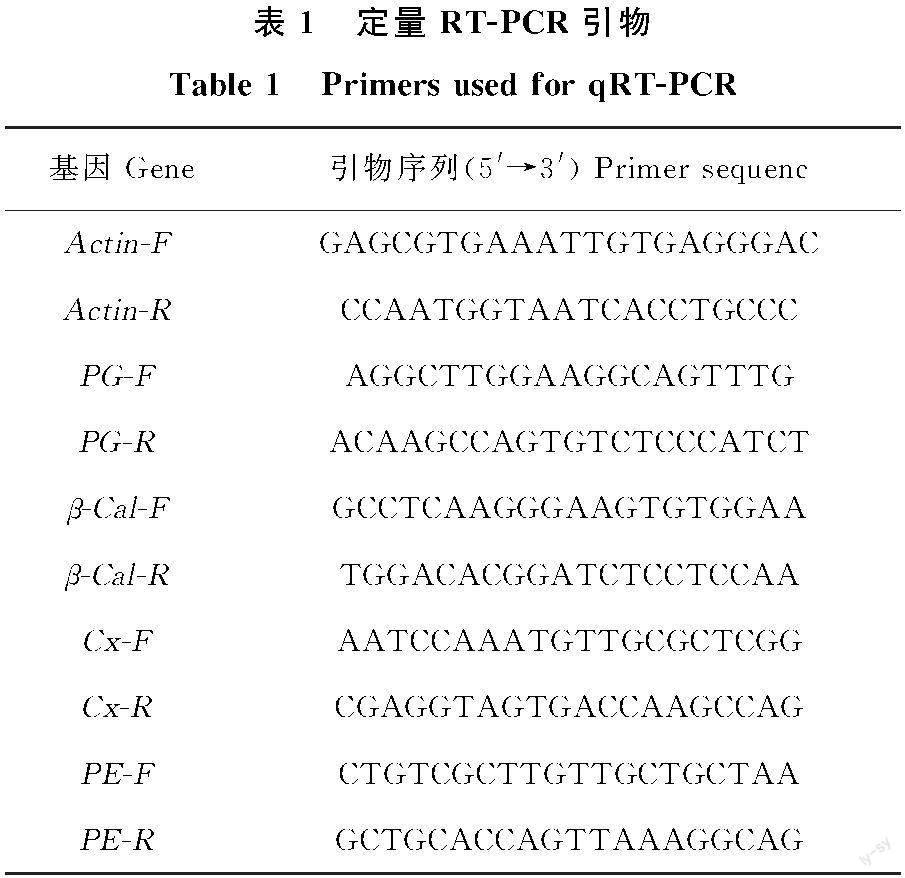
1.2.3实时定量PCR 根据前人报道[21-22]选择编码细胞壁降解酶关键基因,以猕猴桃基因组数据库中(http://bioinfo.bti.cornell.edu/cgi-bin/kiwi/home.cgi)各基因全长序列为模板,采用NCBI的Primer-BLAST在线设计引物。其他处理基因表达量使用多糖多酚植物总RNA提取试剂盒(擎科生物)提取果实的总RNA,反转录合成cDNA。以猕猴桃Actin为参照进行qPCR分析,qPCR仪型号为杭州博日FQD-96A;反应体系中qPCR Mix为10 μL,cDNA 1 μL,正反向引物均为1 μL,ddH2O为7 μL;反应阶段为95 ℃预变性2 min,进行40个循环的95 ℃变性15 s、60 ℃退火1 min。所用引物见表1,根据Ct值采用2-△△Ct法进行结果分析。
1.3 数据统计
利用Excel 2016软件对数据进行统计。采用SPSS 25.0软件进行标准差及方差分析,利用邓肯比较法检验数据差异显著性,采用Origin 2021软件绘图,图中数据为“平均值±标准差”。
2 结果与分析
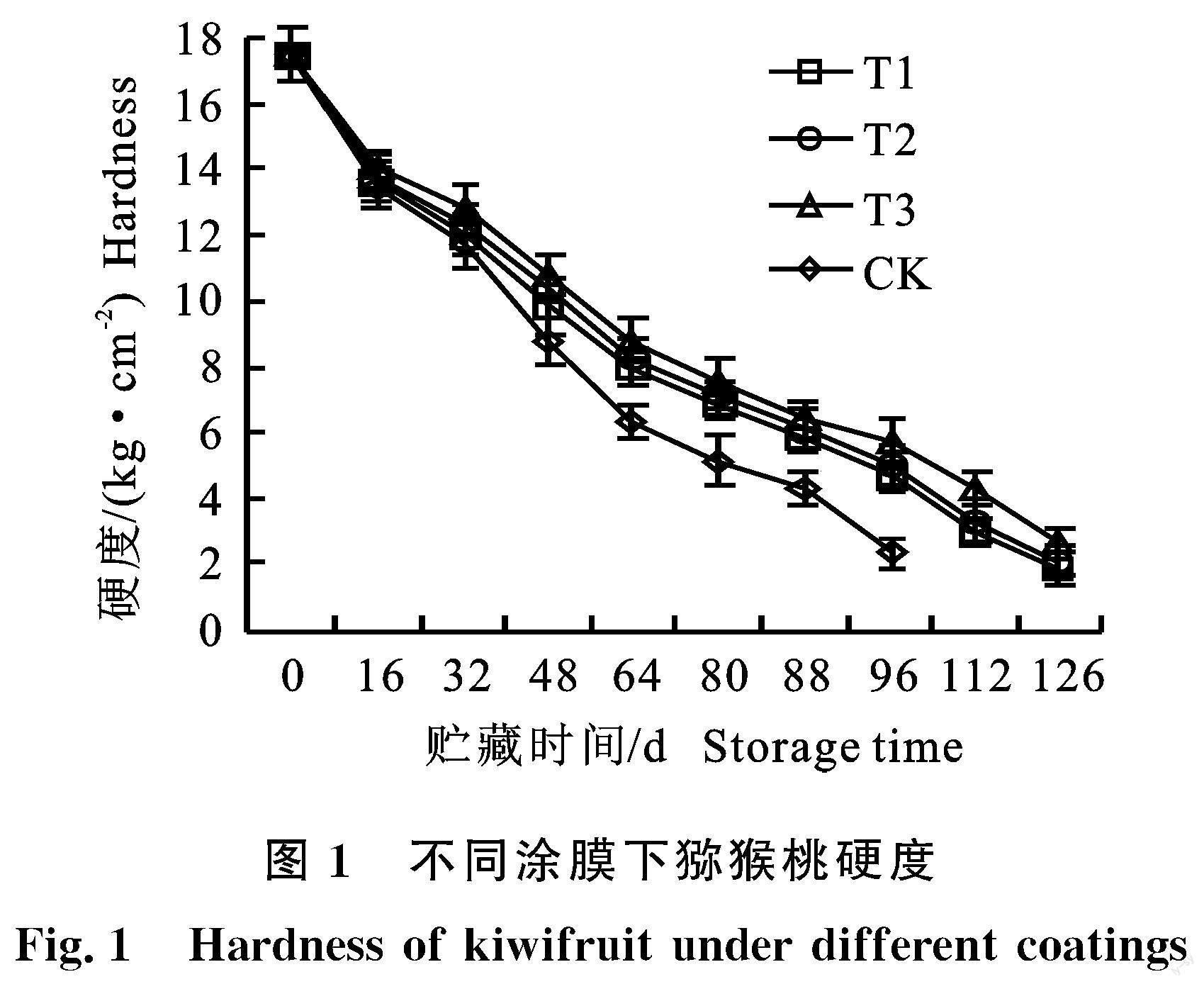
2.1 涂膜对猕猴桃贮藏期间硬度的影响
果实硬度是一个关键属性,对消费者的接受度产生重大影响,硬度直接影响果实的质地,并直接影响果实的商业价值。如图1所示,猕猴桃果实硬度随着贮藏时间的延长而逐渐下降,3个涂膜处理组的果实硬度均高于对照组。在贮藏期第96天时,T3的硬度为5.70 kg·cm-2,是CK处理组硬度的1.45倍,且差异显著(P<0.05),复合涂膜处理相较于单一涂膜处理保鲜效果更好,说明桃胶和竹醋涂膜处理有助于延缓果实硬度的下降,从而延长果实的贮藏时间。
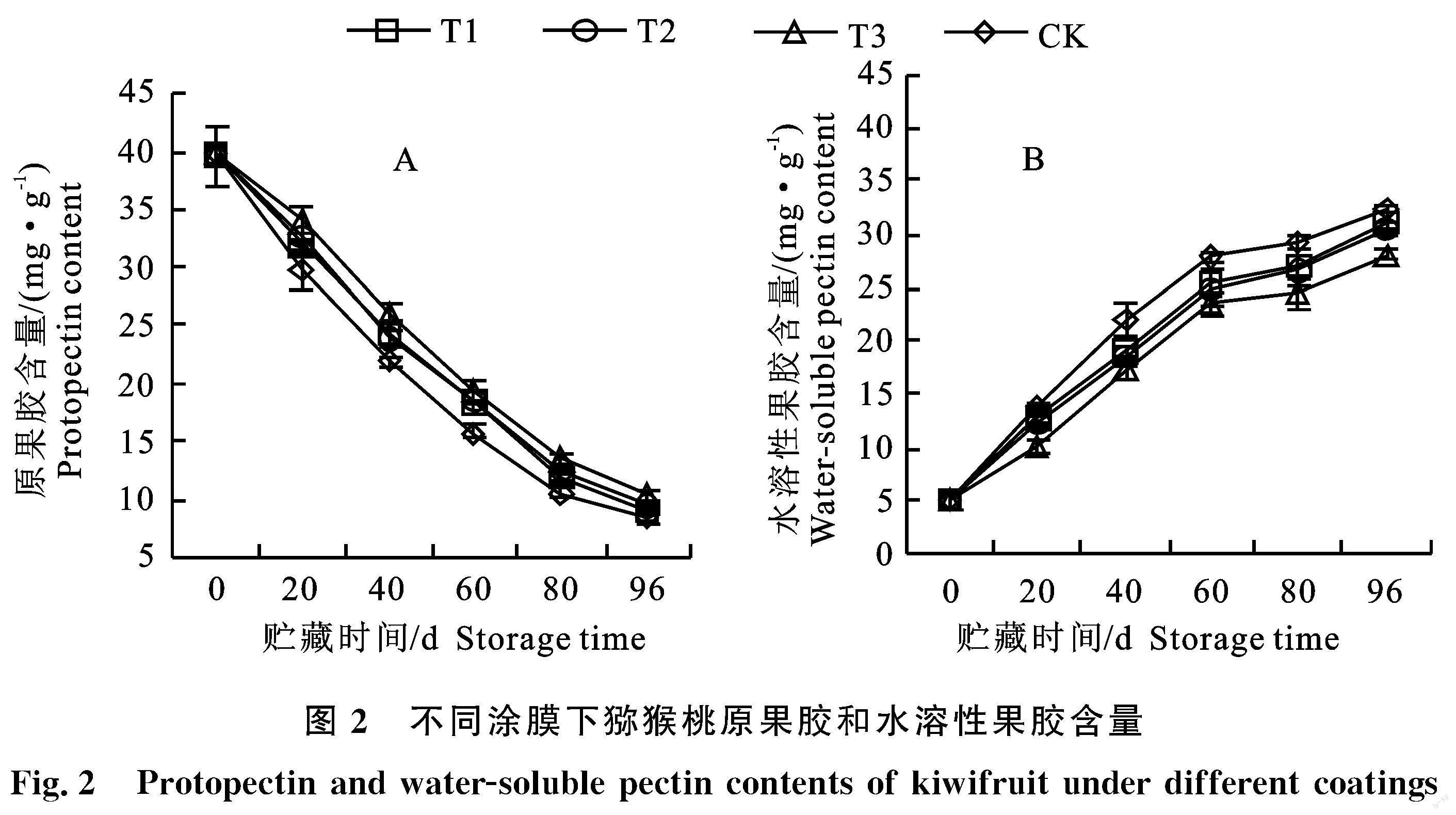
2.2 涂膜对猕猴桃贮藏期间原果胶和水溶性果胶的影响
细胞壁的降解与果实软化有直接的关系,细胞壁主要由多糖组成,包括果胶、半纤维素和纤维素。果胶是一种非常复杂的聚合物结构,存在于细胞初生壁和中间层中,有助于增强细胞之间的粘附和细胞的机械强度[23]。如图2-A所示,随着贮藏时期的延长,猕猴桃果实的原果胶呈下降趋势。3个涂膜处理的原果胶含量均高于CK组,在贮藏期第96天时,T1、T2、T3的原果胶含量分别为CK处理的1.10倍、1.17倍、1.25倍,说明桃胶和竹醋涂膜处理能有效地维持果实原果胶的含量,相较于单一涂膜处理,复合涂膜处理能更有效地抑制猕猴桃果实原果胶下降。
细胞壁多糖的结构变化被认为是在与成熟相关的硬度丧失过程中细胞壁结构改变的原因[24]。细胞壁是一种动态结构,其在果实成熟过程中的溶解和解聚对维持结构完整性和果实硬度具有关键作用[25],果实原果胶含量的下降和水溶性果胶含量的上升是猕猴桃后熟的普遍现象。如图2-B所示,水溶性果胶含量随着果实贮藏时间延长呈上升趋势,在贮藏期第96天时,T3的水溶性果胶含量为CK处理的86.5%。表明桃膠和竹醋涂膜处理在一定程度上能较好的保持果实细胞壁结构的完整性。
2.3 涂膜对猕猴桃贮藏期间纤维素和淀粉的 影响
果实软化会使细胞液流出,容易造成病害的感染,缩短货架期从而失去食用价值。纤维素对果实具有支撑和保护细胞结构的功能[26]。纤维素含量的下降会加速果实的软化。在整个贮藏期,涂膜处理组果实的纤维素含量一直高于对照组,均在贮藏期第96天时达到最低值。如图3-A所示,在贮藏期第96天时,T1、T2、T3的纤维素含量分别为CK处理的1.16倍、1.21倍、1.26倍。表明桃胶和竹醋涂膜处理能够较好地维持果实纤维素的含量,保持果实细胞壁结构的完整性。
猕猴桃采收时果实内的碳水化合物主要成分是淀粉,在成熟过程中不断水解成糖,可能导致可溶性固形物含量的上升。如图3-B所示,在贮藏期第96天时,T3比CK处理的淀粉含量高3.68 mg·g-1,两处理之间差异显著(P<0.05)。说明桃胶和竹醋复合涂膜处理能显著抑制果实淀粉含量的下降,保持果实良好的质地。
2.4 涂膜对猕猴桃贮藏期间可溶性总糖和可溶性蛋白质的影响
可溶性总糖随着贮藏时间的延长呈现上升的趋势。如图4-A所示,在贮藏期第60天时,T1、T2、T3的可溶性总糖含量分别为CK处理的 91.4%、90.1%、88.7%,3个涂膜处理组的可溶性总糖含量在整个贮藏期间均小于CK处理组,说明桃胶和竹醋涂膜处理延缓果实可溶性总糖含量的上升,其中复合涂膜延缓效果优于单一涂膜处理。如图4-B所示,可溶性蛋白质含量在整个贮藏期整体上呈现上升的趋势,T3处理组的可溶性蛋白质含量一直处理较低的水平,表明桃胶和竹醋复合涂膜能有效地抑制可溶性蛋白质含量上升,从而提高果实的商品价值。
2.5 涂膜对猕猴桃贮藏期间细胞壁降解酶活性的影响
如图5-A所示,PG活性总体上呈现上升的趋势,3个涂膜处理组的果实PG活性一直处于较低水平。CK处理组在贮藏第40天时达到峰值,为贮藏初值的1.60倍。T1、T2、T3涂膜处理组均显著抑制PG活性的上升(P<0.05),贮藏第40天时分别为CK处理组的79.1%、82.7%、77.8%,且均在第60天达到峰值。如图5-B所示,CK处理组的PE活性在贮藏0~20 d时迅速上升,贮藏第20天时为贮藏初期的2.18倍,之后开始迅速下降。这与高萌等[27]研究‘徐香与‘海沃德猕猴桃冷藏期间的PE活性基本一致。涂膜处理的果实在贮藏0~20 d时上升较CK处理组缓慢,在贮藏期第96天时,T1、T2、T3的PE活性分别为CK处理的83.3%、87.0%、80.0%,3个涂膜处理组与CK处理组均有差异显著(P< 0.05),说明涂膜处理在一定程度上能够抑制PE活性,保持果实细胞壁组分不被解聚。如图5-C所示,β-Gal活性在果实贮藏期间不断上升。在贮藏期第80天时,T3处理组的β-Gal活性为CK组的80.3%,差异显著(P<0.05),说明桃胶和竹醋涂膜处理能钝化β-Gal活性,减缓猕猴桃果实的软化速率。如图5-D所示,Cx活性在猕猴桃果实软化进程中呈上升的趋势。在贮藏期第96天时,T1、T2、T3的Cx活性分别比CK低 0.3、0.58、0.55 mg·min-1·g-1,说明桃胶和竹醋涂膜处理能保持Cx活性处于较低水平,避免纤维素含量被快速降解,从而保持了果实细胞壁结构的完整性。Sinha等[28]以壳聚糖和水杨酸复合涂膜可有效延迟梨PE、PG、Cx等细胞壁降解酶活性,从而保持膜结构的完整性。Lin等[29]以壳聚糖处理抑制了龙眼PE、PG、β-Gal和Cx的活性,稳定了龙眼果肉的细胞壁结构,减少了龙眼果肉破裂的发生,这与本试验的研究结果基本一致。
综上,桃胶和竹醋涂膜处理能够抑制PG、PE、β-Gal、Cx的活性,其中复合涂膜处理抑制效果优于单一涂膜处理,可更好地减缓纤维素和果胶的降解速率,从而延长果实的贮藏期。
2.6 涂膜对猕猴桃贮藏期间细胞壁降解酶基因表达的影响
如图6-A所示,在贮藏过程中,4个处理的PG表达量均有所增加,3个涂膜处理组的PG表达量始终低于对照组。在第96天时,T1、T2、T3的PG表达量分别为CK处理组的81.1%、 76.0%、70.0%,与CK处理组均差异显著 (P<0.05),表明桃胶和竹醋涂膜处理能有效地抑制PG表达量的上升。如图6-B所示,PE表达量在果实贮藏期出现“升-降-升”的趋势。贮藏期第40天时,3个处理组和对照组在PE表达量均达到最高值,在贮藏期96天时,T1、T2、T3的PE相对表达量分别比CK低0.97、1.53、 2.07,差异显著(P<0.05)。如图6-C所示,β-Gal相对表达量在整个贮藏期间呈上升的趋势。处理组的β-Gal相对表达量一直低于对照组,说明桃胶和竹醋涂膜处理能有效地抑制β-Gal基因的表達。如图6-D所示,Cx相对表达量整体上呈现上升的趋势,处理组的Cx相对表达量在整个贮藏期间均低于CK处理,其中在贮藏期第 40~80天时,3个涂膜处理和CK处理组之间差异显著。综上,桃胶和竹醋涂膜处理能抑制PG、PE、 β-Gal和Cx基因表达的能力,使其在果实整个贮藏时期维持较低的表达水平,维持细胞壁的完整性,保持果实较好的硬度,从而延长果实的贮藏期。
3 讨论与结论
猕猴桃果实采后会经历快速的软化和品质变化,其成熟软化是一个极为复杂的过程。果实软化影响果实品质、贮藏寿命和植物病原菌的入侵。细胞壁多糖的改变被认为是软化的关键原因,细胞壁多糖代谢与果胶多糖、纤维素等一系列生化变化有关,导致细胞壁结构的松动和弱化[30]。本研究中,2%桃胶协同0.5%竹醋涂膜处理能较好地保持果实细胞壁结构的完整性,复合涂膜效果优于单一涂膜,能有效抑制原果胶、纤维素等细胞壁物质的分解转化,从而维持果实硬度,延长其贮藏期。
果实软化由不同细胞壁降解酶的活性增加引发,细胞壁降解酶的作用促进了细胞壁多糖的分解,细胞壁果胶物质的代谢可通过PE、PG的结合激活,从而导致细胞壁结构的凝聚力降低,中间层被破坏,从而溶解细胞膜并导致水果软化[27]。果实软化是限制保质期、运输和储存的主要因素,硬度下降是它们最直接的特征变化之一。高硬度的同时出现高含量的纤维素以及低含量的水溶性果胶[31]。Nguyen等[32]发现电子束辐射延迟了芒果中细胞壁多糖的分解,通过降低细胞壁降解酶的活性来延缓果实软化。Ren等[33]发现PG、PE和Cx参与了番荔枝果实贮藏过程中软化,Cao等[34]利用褪黑素处理抑制了猕猴桃果实果胶、纤维素和半纤维素含量的降低,延缓了水溶性果胶含量的增加,保持PE、PG、Cx和β-Gal较低的活性,从而延缓了猕猴桃的软化。该研究中,2%桃胶和0.5%竹醋的协同作用延缓了猕猴桃果实的软化,赋予有效的氧气吸收屏障,从而减缓细胞壁水解酶的代谢和酶活性,从而进一步延缓多糖的溶解,降低PG、PE、Cx和β-Gal的活性及其基因的表达,有效调节细胞壁代谢并保持果实的结构完整性。这与何庆等[35]在葡萄上的研究结果基本一致。在众多的细胞壁修饰酶中,不同的酶可能在不同类型水果软化过程中,细胞壁分解的过程发挥着核心作用。鉴定猕猴桃果实中与细胞壁相关的关键基因有助于培育具有高硬度作为理想性状的育种计划。为此,需要全面分析猕猴桃果实中不同候选细胞壁相关基因的表达模式,以及软化过程中相关的多糖苷修饰。
2%桃胶协同0.5%竹醋涂膜处理下调了PG、PE、β-Gal和Cx的基因表达水平,降低与细胞壁多糖降解相关酶的活性,减缓了果实原果胶、纤维素的降解,保持了细胞壁结构的完整性,达到有效延缓猕猴桃果实硬度下降的效果,从而提高果实耐贮性。桃胶和竹醋作为一种新型的可食用保鲜膜在食品上应用可能是一种有效且方便的采后技术,可延缓猕猴桃在采后贮藏过程中的软化,提高猕猴桃果实可食用价值。
参考文献 Reference:
[1] 钟彩虹,黄文俊,李大卫,等.世界猕猴桃产业发展及鲜果贸易动态分析[J].中国果树,2021(7):101-108.
ZHONG C H,HUANG W J,LI D W,et al.Dynamic analysis of global kiwifruit industry development and fresh fruit trade[J].China Fruits,2021(7):101-108.
[2] 黄文俊,钟彩虹.猕猴桃果实采后生理研究进展[J].植物科学学报,2017,35(4):622-630.
HUANG W J,ZHONG C H.Research advances in the postharvest physiology of kiwifruit[J].Plant Sciences Journal,2017,35(4):622-630.
[3] CARVAJAL F,PALMA F,JAMILENA M,et al.Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J].Postharvest Biology and Technology,2015,108(10):68-77.
[4] DONG Y,ZHANG S,WANG Y.Compositional changes in cell wall polyuronides and enzyme activities associated with melting/mealy textural property during ripening following long-term storage of ‘Comiceand ‘dAnjoupears[J].Postharvest Biology and Technology,2018,135(1):131-140.
[5] BU J,YU Y,AISIKAER G,et al.Postharvest UV-C irradiation inhibits the production of ethylene and the activity of cell wall-degrading enzymes during softening of tomato(Lycopersicon esculentum L.) fruit[J].Postharvest Biology and Technology,2013,86(12):337-345.
[6] BRUMMELL D A.Cell wall disassembly in ripening fruit[J].Functional Plant Biology,2006,33(2):103-119.
[7] WEI C,ZHANG Y,ZHANG H,et al.Physicochemical properties and conformations of water-soluble peach gums via different preparation methods[J].Food Hydrocolloids,2019,95(5):571-579.
[8] 陈 婷.桃食性包装膜的制备和性能[D].广州: 暨南大学,2018.
CHEN T.The preparation and properties of the peach gum edible packaging film[D].Guangzhou: Jinan University,2018.
[9] LI C,TAO J,ZHANG H.Peach gum polysaccharides-based edible coatings extend shelf life of cherry tomatoes[J].Biotechnology & Applied Microbiology,2017,7(3):1-5.
[10] SHI Z,DENG J,WANG F,LIU,et al.Individual and combined effects of bamboo vinegar and peach gum on postharvest grey mould caused by Botrytis cinerea in blueberry[J].Postharvest Biology and Technology,2019,155(9):86-93.
[11] ZHANG L,KOU X,HUANG X,et al.Peach-gum: a promising alternative for retarding the ripening and senescence in postharvest peach fruit[J].Postharvest Biology and Technology,2020,161(3):111088.
[12] BAIMARK Y,NIAMSA N. Study on wood vinegars for use as coagulating and antifungal agents on the production of natural rubber sheets[J].Biomass and Bioenergy,2009,33(6-7):994-998.
[13] RATTANAWUT J,PIMPA O,VENKATACHALAM K,et al.Effects of bamboo charcoal powder,bamboo vinegar,and their combination in laying hens on performance,egg quality,relative organ weights,and intestinal bacterial populations[J].Tropical Animal Health and Production,2021,53(1):1-7.
[14] ZHANG H,HE P,KANG H,et al.Antioxidant and antimicrobial effects of edible coating based on chitosan and bamboo vinegar in ready to cook pork chops[J].Lwt-Food Science and Technology,2018,93(7):470-476.
[15] 陳 艺,黎 琴,吴亚倩,等.竹醋液壳聚糖复合涂膜对椪柑保鲜效果的研究[J].竹子学报,2019,38(1):46-51.
CHEN Y,LI Q,WU Y X,et al.Effects of the complex coating of chitosan plus bamboo vinegar on the preservation of Citrus reticulata cv. Ponkan fruit[J].Journal of Bamboo Research,2019,38(1):46-51.
[16] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:22-38.
CAO J K,JIANG W B,ZHAO Y M.Experimental Guidance for Physiology and Biochemistry on Postharvest Fruits andVegetables[M].Beijing:China Light Industry Press,2007:22-38.
[17] ZEGAOUI Z,PLANCHAIS S,CABASSA C,et al.Variation in relative water content,proline accumulation and stress gene expression in two cowpea landraces under drought[J].Journal of Plant Physiology,2017,218(11):26-34.
[18] ZHANG C H,XIONG Z H,YANG H Y,et al.Changes in pericarp morphology,physiology and cell wall composition account for flesh firmness during the ripening of blackberry(Rubus spp.) fruit[J].Scientia Horticulturae,2019,250(5):59-68.
[19] CHEN H J,GAO S F,FANG X J,et al.Changes infruit firmness,cell wall composition and cell wall degrading enzymes in postharvest blue berries during storage[J].Scientia Horticulturae,2015,188(6):44-48.
[20] BOSCH M,CHEUNG A Y,HEPLER P K. Pectin methylesterase,a regulator of pollen tube growth[J].Plant Physiology,2005,138(7):1334-1346.
[21] YANG R,LIN X,DOU Y,et al.Transcriptome profiling of postharvest kiwifruit in response to exogenous nitric oxide[J].Scientia Horticulturae,2021,277(7):109788.
[22] 李瑞娟,杨淑霞,王 丹,等.高能电子束辐照对猕猴桃细胞壁降解相关酶活性和基因表达的影响[J].食品工业科技,2022,43(1):326-334.
LI R J,YANG SH X,WANG D,et al.Effects of high-energy electron beam irradiation on the activity and gene expression of kiwifruit cell wall degradation-related enzymes[J].Food Industry Science and Technology,2022,43(1):326-334.
[23] CYBULSKA J,ZDUNEK A,KOZIO A.The self-assembled network and physiological degradation of pectins in carrot cell walls[J].Food Hydrocolloids,2015,43(1):41-50.
[24] CHEA S,YU D J,PARK J,et al.Fruit softening correlates with enzymatic and compositional changes in fruit cell wall during ripening in ‘Bluecrophighbush blueberries[J].Scientia Horticulturae,2019,245(1):163-170.
[25] SHI Z,YANG H,JIAO J,et al.Effects of graft copolymer of chitosan and salicylic acid on reducing rot of postharvest fruit and retarding cell wall degradation in grapefruit during storage[J].Food Chemistry,2019,283(12):92-100.
[26] POS S,PANIAGUA C,MATAS A J,et al. A nanostructural view of the cell wall disassembly process during fruit ripening and postharvest storage by atomic force microscopy[J].Trends in Food Science & Technology,2019,87(5):47-58.
[27] 高 萌,屈 魏,冉 昪,等.‘徐香與‘海沃德猕猴桃冷藏期间组织结构与生理变化差异[J].园艺学报,2020, 47(7):1289 -1300.
GAO M,QU W,RAN B,et al.Differences in tissue structure and physiological changes of ‘Xuxiang and ‘Hayward kiwifruit fruits during cold storage[J].Acta Horticulturae Sinica,2020,47(7):1289-1300.
[28] SINHA A,GILL P P S,JAWANDHA S K,et al.Composite coating of chitosan with salicylic acid retards pear fruit softening under cold and supermarket storage[J].Food Research International,2022,160(10):111724.
[29] LIN Y,LIN Y,LIN Y,et al.A novel chitosan alleviates pulp breakdown of harvested longan fruit by suppressing disassembly of cell wall polysaccharides[J].Carbohydrate Polymers,2019,217(8):126-134.
[30] RUGKONG A,ROSE J K C,LEE S J,et al.Cell wall metabolism in cold-stored tomato fruit[J].Postharvest Biology and Technology,2010,57(2):106-113.
[31] LIN Y,LIN Y,LIN H,et al.Effects of paper containing 1-MCP postharvest treatment on the disassembly of cell wall polysaccharides and softening in Younai plum fruit during storage[J].Food Chemistry,2018,264(20):1-8.
[32] NGUYEN T T,KATO M,MA G,et al.Electron beam radiation delayed the disassembly of cell wall polysaccharides in harvested mangoes[J].Postharvest Biology and Technology,2021,178(8):111544.
[33] REN Y,SUN P,WANG X,et al.Degradation of cell wall polysaccharides and change of related enzyme activities with fruit softening in Annona squamosa during storage[J].Postharvest Biology and Technology,2020,166(8):111203.
[34] CAO S,QU G,MA C,et al.Effects of melatonin treatment on the physiological quality and cell wall metabolites in kiwifruit[J].Food Science and Technology,2021, 42(3):85421.
[35] 何 慶,郑素慧,秦南南,等.采前喷施水杨酸对红地球葡萄采后果实软化的影响[J].食品与发酵工业,2022, 48(4):16-23.
HE Q,ZHENG S H,QIN N N,et al.Effect of spraying salicylic acid to pre-harvest fruit on softening of postharvest Vitis vinifera L. cv. red globe[J].Food and Fermentation Industries,2022,48(4):16-23.
Mechanism of Postharvest Softening of Kiwifruit Fruit Through Peach Gum and Bamboo Vinegar Coating
Abstract
To investigate the mechanism of postharvest kiwifruit fruit softening under different treatments involving peach gum and bamboo vinegar coating. ‘Cuiyu kiwifruit was used as the test material,and three coating treatments were applied: 2% peach gum,0.5% bamboo vinegar,and a composite coating of peach gum and bamboo vinegar. The fruits were soaked in these coatings for 3 min and stored in a cold storage at(5±1) ℃,with humidity of 90%-95%. The changes of fruit hardness,cell wall components,softening-related enzyme activities and gene expression were studied. The results showed that the composite coating treatment significantly inhibited the activities of polygalacturonase(PG),β-galactosidase(β-Gal),cellulase(Cx) and pectinesterase(PE),reduced the expression of PG,β-Gal,Cx and PE genes,and effectively inhibited the skeleton substances of the cell wall.The breakdown of protopectin and cellulose prevented the increase of soluble total sugar and protein content,retained the fruits hardness and delayed the fruits post-ripening softness. In conclusion,the composite coating film made from peach gum and bamboo vinegar has a greater preservation effect than a single treatment,which can delay the kiwifruit fruits cell wall metabolism and preserve fruit quality.
Key words Kiwifruit; Peach gum; Bamboo vinegar; Softening; Gene expression
