基于转录组测序技术分析补骨脂素对HepG2细胞的作用机制*
2024-03-14汪思云李艺博谭春霞卢涛
汪思云 李艺博 谭春霞 卢涛
北京中医药大学生命科学学院,北京 102488
肝细胞癌(hepatocellular carcinoma,HCC)在全球癌症相关死亡病例中位居第四,其发病率呈上升趋势,死亡率接近全球发病率[1]。HCC疾病的预后很差,因此寻找有效的治疗肝细胞癌的方法和药物是抗肿瘤的热点之一。
补骨脂有温肾助阳、纳气止泻的功效,具有免疫调节、抗炎、抗肿瘤和促进骨生长等多种药理作用[2]。补骨脂素(psoralen,PSO)是补骨脂的呋喃香豆素类化合物,有研究报道其对HepG2细胞有体外细胞毒性,且能够逆转阿霉素耐药[3]。补骨脂素还可通过调节Wnt/β-actin通路使MCF-7细胞周期停滞,抑制细胞增殖[4]。但是补骨脂素对肝癌HepG2细胞的作用机制研究尚不够深入。
RNA-seq技术是指利用高通量测序技术,将细胞或组织中的mRNA、微小RNA和长链非编码RNA进行高通量测序分析,在一定条件和时间下比较来自不同组织和条件的基因表达谱,进而得到差异表达基因[5],有助于认识疾病发生发展过程和药物在生命体的作用机制。
补骨脂素在抗肿瘤、治疗白癜风顽疾、白血病等方面有众多临床应用,本研究应用转录组测序技术分析补骨脂素对HepG2细胞作用后基因表达水平的差异,探索其可能的作用靶点和机制,为补骨脂素的临床合理用药研究和应用提供参考。
材料与方法
1 主要试剂和仪器
补骨脂素购于上海源叶生物科技有限公司(B20123-20 mg);细胞增殖及毒性检测试剂盒(CCK-8)增强型(CK001);二甲亚砜(dimethyl sulfoxide,DMSO)购于北京兰博利德生物技术有限公司(D5879-1);胎牛血清(04-001-1)、DMEM培养基(01-057-1A)、冻存液(05-065-1)均购于以色列Biological Industries公司;青、链霉素(Penicillin-Streptomycin)购于美国Gibco公司(15140122);天根总RNA提取试剂盒购于北京天根生化科技公司(DP451);细胞周期试剂盒购于碧云天生物技术公司(C1052);CytoFLEX流式细胞仪(Beckman Coulter CytoFlex S,美国);酶标仪Epoch,(BioTek,美国);qPCR引物由生工生物工程上海股份有限公司合成。
2 方法
2.1 细胞培养及分组给药
肝癌HepG2细胞购于中国科学院细胞库(北京),其培养条件为含有10%胎牛血清、1%青、链霉素的DMEM培养基,5% CO2的 37 ℃培养箱。用0.25%胰蛋白酶-0.02% EDTA消化传代。设置空白组、对照组及不同浓度的补骨脂素(62.5、125、250、500 μM)处理HepG2细胞12 h和24 h。
2.2 CCK-8法检测HepG2细胞存活率
取对数生长期的HepG2细胞以5.0×103个/孔接种于96孔板,按照2.1用不同浓度补骨脂素处理,每组设置6个复孔,加药后,培养液更换为含有10 μL CCK-8试剂的培养基,待培养箱孵育约1.5 h,用酶标仪检测450 nm吸光度(A450 nm)值,计算各组细胞存活率。细胞存活率(%)=(实验组A 450 nm-空白组A 450 nm)/(细胞对照组A 450 nm-空白组A 450 nm)× 100%。后续实验选择250 μM补骨脂素作用24 h。
2.3 细胞周期检测
将HepG2细胞以2.0×105个/孔接种于六孔板,用250 μM的补骨脂素处理24 h,胰酶消化并收集细胞沉淀,用1 mL的预冷的PBS重悬并1 000 g离心5 min,去上清,加入70%乙醇固定过夜。加入1 mL预冷的PBS重悬离心后,加入配置好的碘化丙啶染色液500 μL,37 ℃避光孵育30 min,上机检测,用ModFit LT 5.0软件分析数据。
2.4 RNA-seq测序分析
HepG2细胞的RNA-seq测序由深圳华大基因公司进行,平行设置3组对照组(Control组)和补骨脂素组(PSO组),利用试剂盒提取RNA构建文库上机测序,利用华大基因的Dr.Tom多组学交互系统(https://biosys.bgi.com)进行生物信息学分析,筛选差异表达的基因并绘制表达量聚类热图。
2.5 GO和KEGG富集分析
通过华大基因的Dr.Tom多组学交互系统进行GO功能富集分析,确定差异基因表达主要的生物学功能。通过KEGG通路富集分析差异基因的代谢和信号转导途径。以p-value值<0.05为差异基因中显著的GO注释和富集通路。
2.6 实时荧光定量PCR验证差异基因表达水平
将HepG2细胞以2.0×105个/孔接种于六孔板,给予补骨脂素250 μM(每组三个复孔)处理24 h后,利用试剂盒提取RNA并反转录成cDNA,采用两步法进行PCR荧光定量检测(反应条件为预变性95 ℃30 s,变性95 ℃ 10 s,退火&延伸60 ℃ 30 s),以β-actin为内参基因,采用2-ΔΔCt法计算目的基因的相对表达量(引物序列见表1),实验重复三次。

表1 qRT-PCR验证引物序列
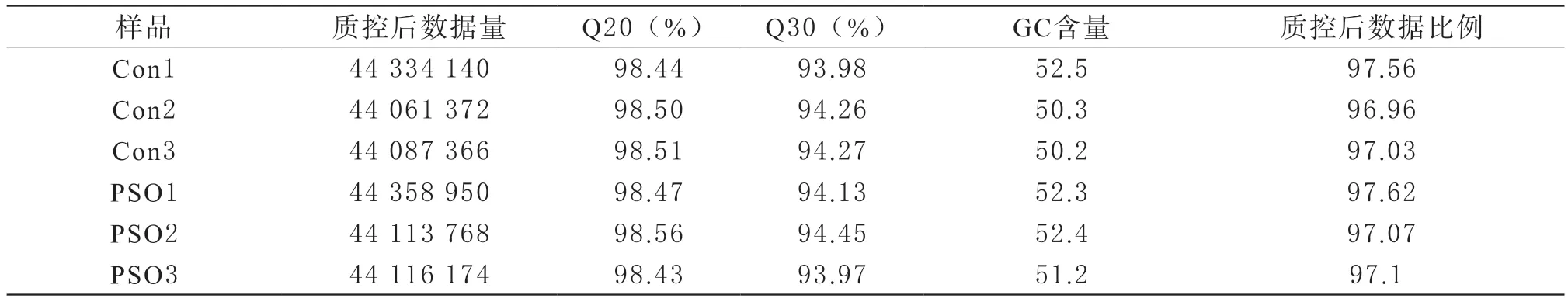
表2 reads过滤质量统计
2.7 统计学分析
细胞实验结果使用Prism 9.0进行数据分析,并以均值±标准差()表示。多组均数采用单因素方差分析,两组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
结 果
1 补骨脂素对HepG2细胞存活率的影响
CCK-8结果显示(图1),补骨脂素对HepG2细胞有明显抑制增殖作用,且呈剂量依赖性,与对照组相比250、500 μM的补骨脂素作用HepG2细胞12 h和24 h后,细胞存活率明显下降,差异有统计学意义(P<0.05,P<0.01),后续实验选择补骨脂素250 μM处理24 h。

图1 补骨脂素作用HepG2细胞的存活率()
2 补骨脂素作用HepG2细胞周期的变化
HepG2细胞经补骨脂素处理后,结果显示与对照组相比,细胞周期中处于G0/G1期比例明显增加,G2/M期比例明显减少(76.90%vs66.82%,7.91%vs16.64%)差异有统计学意义(P<0.05,图2)。
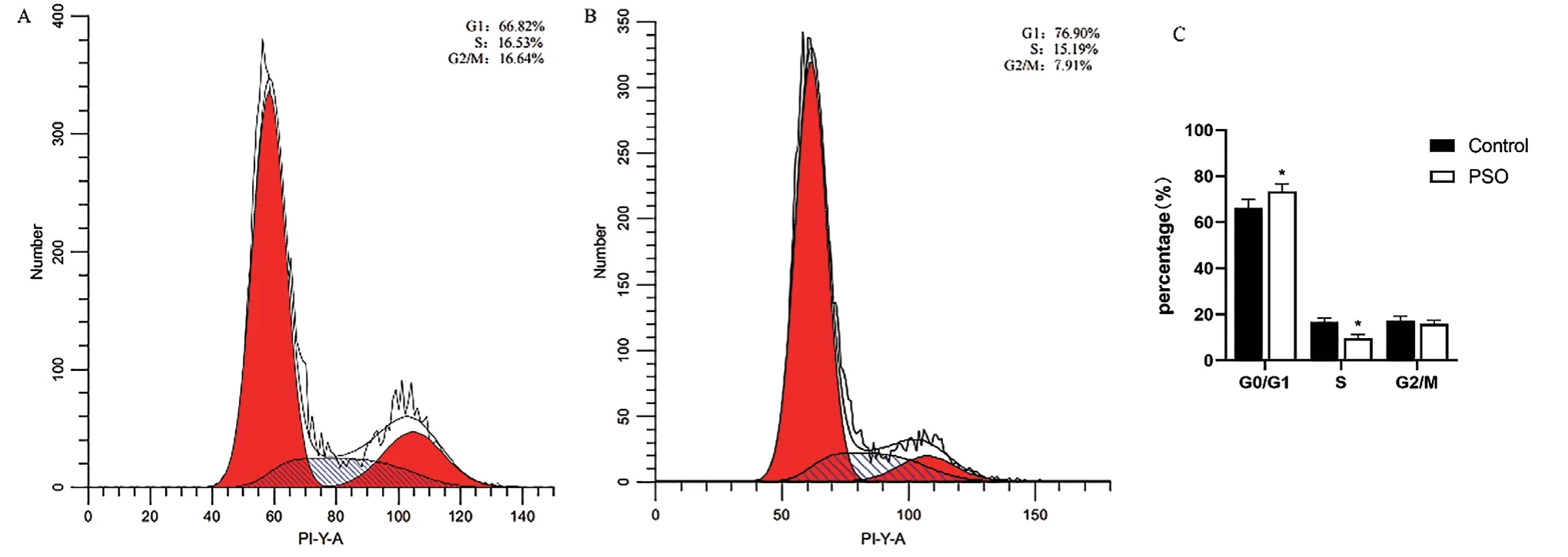
图2 补骨脂素对HepG2肝癌细胞周期的影响()
3 转录组测序数据过滤及质量评估
测序的原始数据包含低质量、接头污染以及未知碱基N含量过高的reads,数据分析之前需要去除这些reads以保证结果的可靠性。过滤后得到高质量的reads达到92%以上,GC平均含量为51.48%,说明测序质量较好,完整性高,可用于后续实验分析。
4 差异基因统计分析
分析补骨脂素处理组与对照组HepG2细胞的差异表达基因,以P<0.05且|log2FC|≥1.5为筛选条件。结果显示(图3)共有286个差异基因,其中上调130个,下调156个。差异基因热图聚类分析发现经补骨脂素干预HepG2细胞的生物学过程和功能区分明显(图4)。

图3 补骨脂素处理HepG2细胞的差异基因火山图

图4 补骨脂素处理HepG2细胞的差异基因热图
5 GO功能和KEGG通路富集分析
GO功能富集最显著的前20个注释进行分析,结果显示在生物学过程(biological process,BP)中主要富集在核糖体生物合成、有丝分裂、细胞周期、细胞凋亡的正向调节等过程。富集差异基因较多的细胞组分(cellular component,CC)主要包括细胞质、核小体、胞质。分子功能(molecular function,MF)主要是结合信号序列(图5)。KEGG富集分析结果显示(图6),差异表达基因共涉及354个通路,我们筛选出了前20个显著富集的KEGG通路,发现差异基因主要富集在核糖体蛋白、细胞周期信号通路、p53信号通路、剪切体等信号通路。其中,与细胞周期和细胞生长相关的通路中差异基因较多。
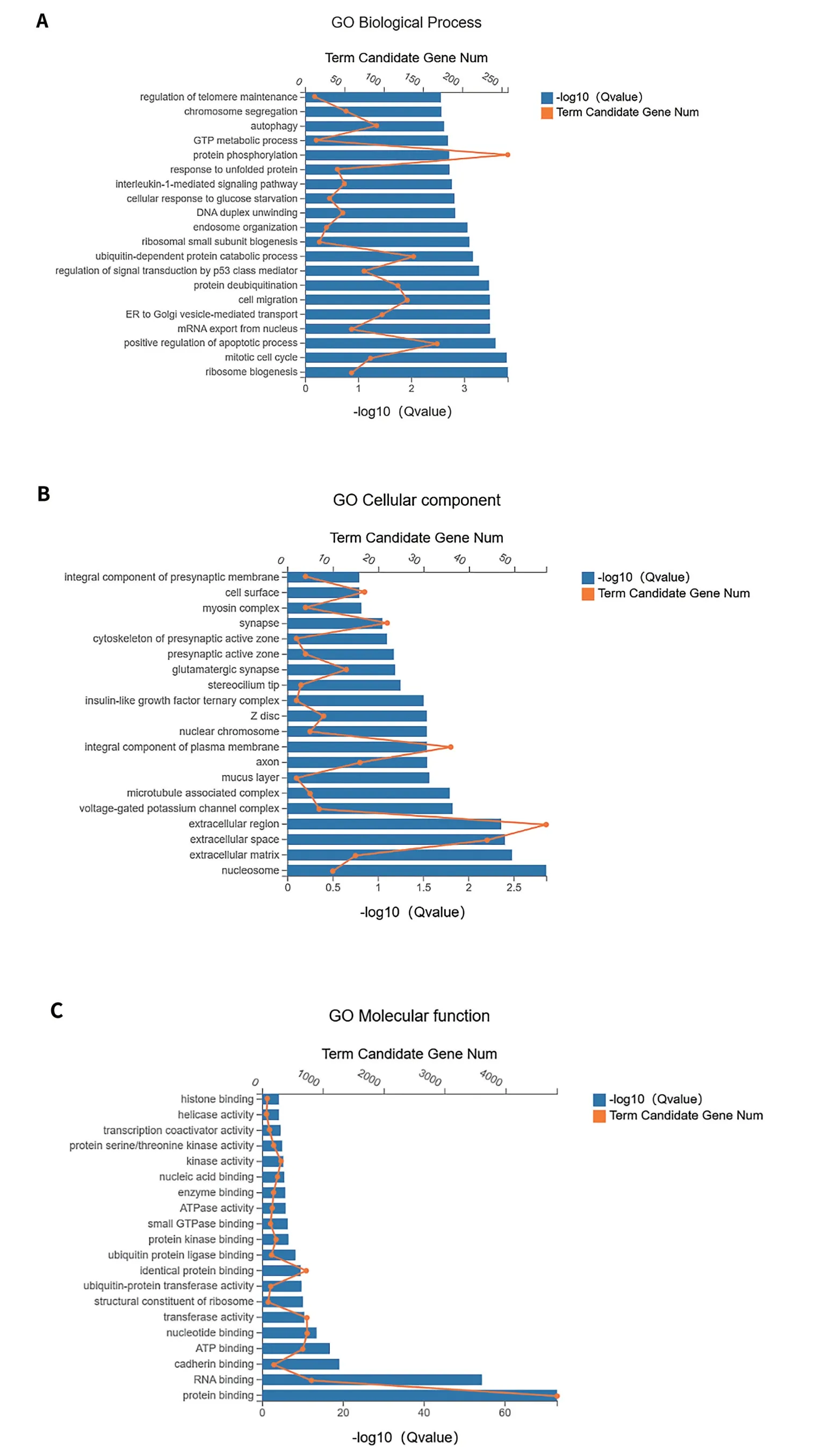
图5 补骨脂素显著差异基因GO功能富集分析
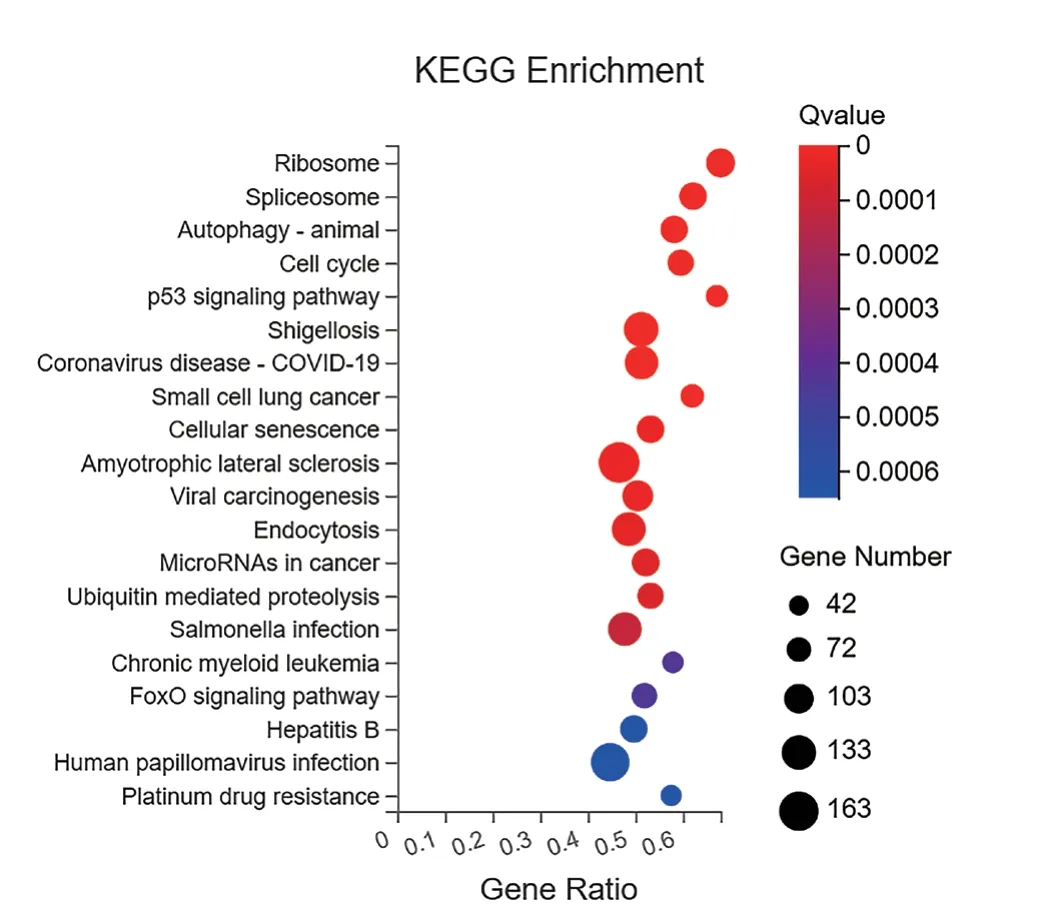
图6 KEGG信号通路富集气泡图
6 实时荧光定量qPCR验证差异基因
根据GO和KEGG差异基因富集的分析,补骨脂素作用于HepG2细胞与影响其细胞周期信号通路有关,因此选取与cell cycle通路和p53信号通路最显著的相关基因p53、GADD45B、CDK2、CDK4、RRM2、CCND1进行验证。结果显示(图7)p53、GADD45B基因上调(P<0.05,P<0.01);CDK2、RRM2、CCND1基因下调(P<0.05,P<0.01),与转录组测序结果一致。

图7 实时荧光定量PCR验证差异基因的表达
讨 论
有研究显示补骨脂素处理细胞24h后的IC50=176.5813 μM[6]。本研究CCK-8实验也证实了250 μM的补骨脂素可明显降低肝癌细胞的存活率,具有一定的细胞毒性作用。
RNA-seq测序技术是一种用于研究细胞或组织中全mRNA分子的高通量测序方法,其可以提供基因表达谱的分析,从分子层面了解在特定条件下的基因表达模式和功能调控机制[7]。利用RNA-seq测序技术,本研究发现HepG2细胞经过补骨脂素处理后在转录组水平的基因表达有明显差异。GO功能富集结果提示其在生物学过程、细胞组分、分子功能等方面均存在较大差异。KEGG通路富集分析提示差异显著基因主要富集在细胞周期通路,表明细胞周期可能在补骨脂素抑制肝癌细胞生长中发挥重要作用。
细胞生长、遗传物质复制和细胞分裂过程与细胞周期的高度调控密切相关,细胞周期在分子水平上由细胞周期蛋白依赖性激酶(CDKs)及细胞周期蛋白(Cyclins)介导[8-9]。Cyclin D和CDK4/6在细胞周期进程中发挥着关键的作用,可使Rb蛋白磷酸化和失活,阻滞细胞增殖周期进入S期[10]。CCND1(cyclin D1)基因的过表达是HCC发病的可能危险因素,其增强了肝癌细胞的增殖、侵袭和迁移,在细胞周期的G1-S期转变中起到关键作用[11]。p53是重要的肿瘤抑制基因,在正常情况下p53基因对细胞分裂起着减慢或监视的作用。有研究表明激活p53基因可以诱导肿瘤细胞的周期阻滞及凋亡,参与细胞的新陈代谢和DNA修复过程[12]。本研究表明补骨脂素可以上调p53基因的表达,下调CDK2和CCND1基因表达,阻滞肝癌细胞周期的进程,其中G0/G1期细胞比例增加,S期细胞比例降低。
核糖核苷酸还原酶M2(RRM2)是一种催化核糖核苷酸脱氧还原为脱氧核糖核苷三磷酸(dNTP)的酶,编码蛋白(M2)的合成以细胞周期依赖性方式进行调节,有研究表明其对DNA复制和修复至关重要[13]。RRM2基因的高表达能够促进癌细胞的增殖,可以作为几种癌症的潜在预后生物标志物[14]。YANG[15]等通过挖掘癌症基因组学和蛋白质组学数据,发现核糖核苷酸还原酶调节亚基M2(RRM2)是HCC的预后生物标志物和治疗靶点。生长抑制与DNA损伤修复基因B(GADD45B)基因与DNA修复、DNA甲基化、细胞周期、细胞生存、细胞炎症相关。研究表明索拉非尼等多种VEGFR靶向药物可通过促进GADD45B表达,来抑制癌细胞增殖[16]。有研究证明GADD45B在肝癌中表达特异性下调,且其表达与肝癌的组织分化、核分级等临床指标成负相关[17]。qPCR结果验证补骨脂素作用HepG2细胞后RRM2基因表达明显下调,GADD45B基因表达上调,提示其可能是潜在的作用靶标。
综上所述,补骨脂素可能通过HepG2细胞周期和p53信号通路发挥肿瘤抑制作用,与RRM2、p53、CDKs、GADD45B的调控有关。此外有补骨脂及其复方制剂在临床使用过程中引起肝脏不良反应的报道,其临床安全用药也面临着挑战。本文论述了其良好的临床应用潜力,为补骨脂素的进一步研究提供参考,但在临床用药时需建立全面系统的安全用药指南。
利益冲突所有作者均声明不存在利益冲突
