双重滤过血浆单采清除肾移植术前群体反应性抗体临床疗效及安全性观察
2024-03-14刁玉洁朱帮强闻慧琴王海婧胡艳程越卞茂红
刁玉洁 朱帮强 闻慧琴 王海婧 胡艳 程越 卞茂红
安徽医科大学第一附属医院输血科 230022
肾移植是治疗终末期肾衰竭(ESRD)的首选方法。与透析等其他肾脏替代疗法相比,肾移植术明显改善了患者的生活质量和预期寿命[1]。群体反应性抗体(panel reactive antibody,PRA),是人类白细胞抗原(human leukocyte antigen,HLA)致敏后产生的同种抗体,客观地反映了患者的致敏状态,是肾移植配型中重要的检测项目之一。PRA的特异性与肾移植术后超急性和急性排斥反应及移植肾存活密切相关。而肾移植患者由于术前输血、妊娠、既往移植等原因,会导致PRA增高,成为致敏受者。PRA会导致患者肾移植术后发生排斥反应[2]。
双重滤过血浆单采(double filtration plasmapheresis,DFPP)通过对一级分离后的致病血浆进行二级分离,将弃除致病因子后的血浆与血液有形成分一同输回体内,从而达到治疗疾病目的的一种选择性血浆分离疗法。相较于普通血浆置换,DFPP可以选择性清除大分子致病物质,去除肾移植患者体内的PRA,因此有利于预防术后超急性排斥反应和急性排斥反应。
为评估DFPP去除PRA的疗效及安全性,现对本院2021年1月—2023年6月11例肾移植术前PRA阳性患者接受DFPP治疗后疗效和安全性情况进行回顾性分析,报道如下。
资料与方法
1 临床资料
选取2021年1月—2023年6月本院收治的11例确诊为终末期肾病患者,肾移植术前检测PRA结果为阳性,为清除PRA行双重滤过血浆单采治疗。受者中男性2例,女性9例,年龄范围在26岁~42岁,平均年龄32岁。患者一般资料见表1。受者行DFPP治疗前签署治疗知情同意书。

表1 DFPP治疗患者基本信息
2 双重滤过血浆单采设备与耗材
血细胞净化机(健帆DX-10),一级膜型血浆分离器PE-08(日本旭化成),二级膜型血浆分离器EC-2A20(日本旭化成),透析型人工肾一次性使用血液回路导管BLS-121-DBB(天津哈娜好),氯化钠注射溶液(广州百特)。
3 方法
3.1 术前常规处理
在我院进行肾移植手术的患者,移植前常规进行1~4周免疫抑制剂预处理治疗,受者需要进行PRA抗体检查,PRA阳性受者推荐术前联合采用利妥昔单抗、三联常规免疫抑制剂(他克莫司+醋酸泼尼松+吗替麦考酚酯)+DFPP的预处理方案。《ABO血型不相容亲属活体肾移植临床诊疗指南(2017版)》[3]指出,根据患者CD19+B细胞比例对利妥昔单抗用量做出适当调整,我院采用的方案为早期、减量、分次应用利妥昔单抗,术前4周、2周和术前24 h推荐分别使用利妥昔单抗100、100、100 mg。同时挑选供体时,避免选择含有相应靶抗原的供肾。供者和受者需要进行HLA基因分型检查。
3.2 血管条件
患者确诊为终末期肾病且PRA阳性,采用DFPP去除抗体,治疗过程中需要保障足够的血液流速,血管通路一般采用深静脉置管或动静脉吻合瘘,有利于治疗的顺利进行。深静脉置管穿刺部位可选择颈内静脉或股静脉,患者深静脉置管前签署知情同意书。
3.3 治疗程序参数选择
在健帆DX-10血细胞净化机上设定血浆置换的治疗参数,运行双重滤过血浆单采程序,血流速度一般控制在(80~130)mL/min,分浆比FP/BP 设置为0.3,弃浆比DP/FP设定为0.2,置换液的补液速率弃浆速率比值设定为1,置换液加温温度设置为36℃~37℃。
3.4 肝素用量及治疗过程监测
置换液选择白蛋白或新鲜冰冻血浆,没有凝血功能障碍者,肝素起始用量为3 000 IU~5 000 IU静推,之后给予维持量泵入,术中主要监测患者血压、心率、血氧饱和度等生命体征的变化。
3.5 指标监测
除记录患者在施行DFPP治疗过程中总循环血量、弃浆量、补充新鲜冰冻血浆量/白蛋白剂量、肝素用量、治疗时长;主要监测患者在进行DFPP治疗前后血常规、肝功能、止凝血指标和PRA变化等。
3.6 不良反应的处理
治疗过程中需对症处理出现的不良反应。常见的不良反应是低血压,在治疗开始阶段要注意血液流速逐渐升高,在DFPP治疗过程中注意补充足量的白蛋白或血浆。
3.7 补体依赖的微量淋巴毒试验的测定
补体依赖的微量淋巴细胞毒(complement dependent cytotoxicity,CDC)交叉配型实验是作为移植前预防排斥反应发生的必须试验。一般情况下,淋巴细胞毒交叉配合试验小于10%才能施行肾移植手术。
3.8 PRA检测方法
1号~7号患者在我院中心实验室采用ELISA方法检测群体反应性抗体,数据单位为百分比,PRA检测结果大于10%判定为阳性,小于等于10%为阴性。随着技术的改进8号~11号患者在我院输血科使用luminex微珠法进行检测,最高微珠荧光值>500判读为阳性,最高微珠荧光值500~1 000判读为弱阳性,最高微珠荧光值<500判读为阴性。
4 统计学处理
应用统计学软件SPSS 23.0进行数据分析。计量资料数据符合正态分布资料采用表示,前后数值比较采用定量资料配对样本t检验。计量资料不符合正态分布数据采用中位数M(P25,P75)表示,采用配对设计资料的Wilcoxon符号秩和检验,P<0.05表示差异有统计学意义。
结 果
1 11例患者一般资料,见表1。
2 患者单次双重滤过血浆单采数值
总循环血量为(13 502±4 198)mL,弃浆量为(771±217)mL,肝素用量为(0.67±0.27)g,治疗时长为(135±46)min,补充白蛋白20 g~60 g。置换液一般选择20 g~60 g白蛋白或新鲜冰冻血浆。
3 DFPP治疗前后血常规、肝功能、止凝血指标监测变化情况
治疗前后RBC、HB、PLT、ALB、TBIL、PT、APTT、K、Na、Cl、HCO3-,差异无明显变化(P>0.05);患者DFPP治疗前后球蛋白(GLOB)、纤维蛋白原(FIB),含量有明显差异(P<0.05),见表2和表3。

表2 DFPP治疗前后患者血常规和止凝血指标变化
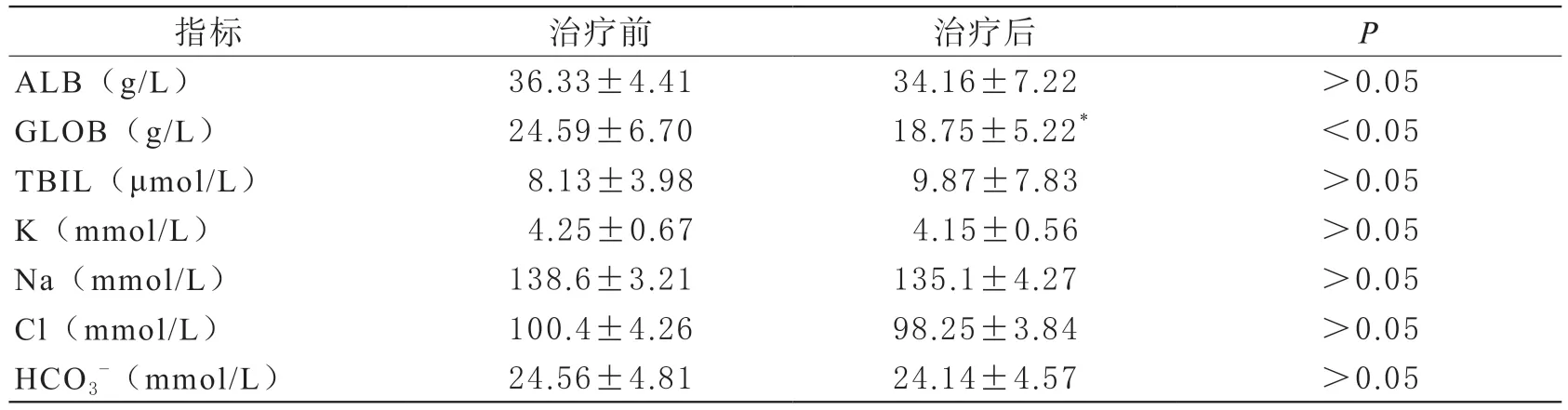
表3 DFPP治疗前后患者肝功能和电解质指标变化
4 肾移植术前淋巴细胞毒试验结果
见表4。
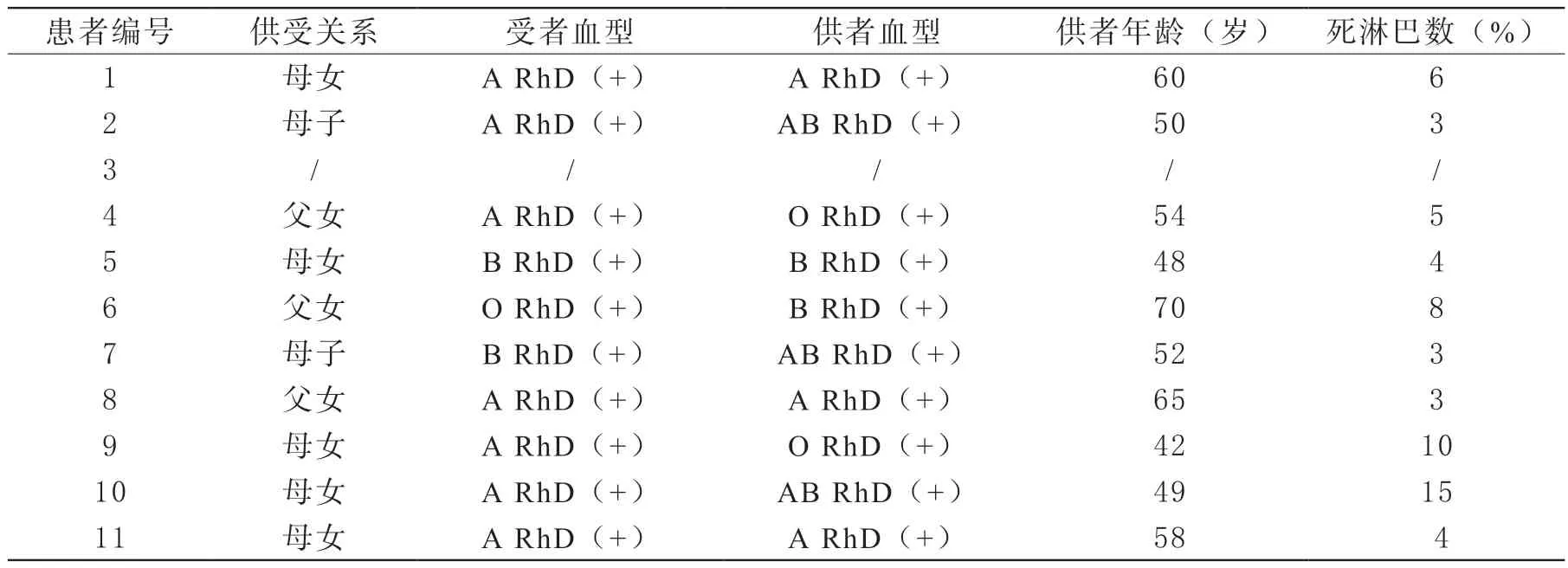
表4 术前淋巴细胞毒试验结果
5 DFPP治疗前后受者PRA抗体检测结果
3号患者进行一次DFPP治疗后,HLA-I结果由46.4降到17.9,因患者一般情况较差,放弃手术,自动出院。11号患者其HLA-I抗体由术前6 508.75最低降至565.9,HLA-Ⅱ类结果术前由4 497.38最低降至1 298.5,其余患者PRA结果由阳性降至阴性或弱阳性,达到临床肾移植手术标准。经配对秩和检验,DFPP治疗前后PRA变化具有统计学意义,P<0.05。PRA变化详见表5和图1。

图1 DFPP治疗前后PRA变化

表5 DFPP治疗前后患者PRA指标变化
讨 论
跨血型肾移植术前去除抗体的方法主要有血浆置换(TPE)、DFPP和血浆免疫吸附(immunoadsorption,IA)3种处理方式,TPE、IA和DFPP是ASFA(The American Society for Apheresis)最新第九版指南中提及的治疗方法[4]。TPE一般用于血型不合的肾移植同时合并凝血功能紊乱、严重低蛋白血症,使用AB型血浆作为置换液;TPE后推荐使用抗生素预防感染;TPE的不良反应主要包括过敏反应、低钾血症、低钙血症等。淋巴血浆置换(LPE)是在TPE的基础上的改良,在去除原有血浆的同时清除了体内的淋巴细胞,有效预防了术后产生新的血型抗体,抑制抗体快速上升,减轻排斥反应对移植肾脏的损害[5]。免疫吸附(IA)在肾移植术前去除抗体完全、彻底,回输给患者自身血浆,疗效和安全性等方面具有明显优势。有效的防止传染病的传播,避免了TPE中较常见的枸橼酸盐中毒、过敏反应、低血压及低钾血症等并发症。但是国内能生产特异性血型抗原吸附柱的厂家较少,且价格昂贵,限制了IA的应用。DFPP与上述两种方法相比较既可以有效清除PRA抗体,同时也明显降低血清补体水平,因此最有利于预防术后超急性排斥反应和急性排斥反应[3]。
PRA检测是一项重要的器官移植前评估指标,在肾移植术前高选择的清除患者体内的PRA,可以有效减少超急性和急性排斥反应的发生,提高移植肾的存活率[6]。对于有流产史或广泛接触血液制品的移植患者发生急性排斥反应的风险更大,这可能与PRA水平的峰值或升高有关[7]。
DFPP是清除体内PRA及大分子致病物质等最有效方式之一。在高脂血症、神经系统疾病、自身免疫性疾病、风湿免疫性疾病、肝肾移植中广泛应用[8-11]。相对于单重血浆置换,DFPP的优势在于高选择性的清除相对分子质量大于白蛋白的致病因子如抗体、抗原、球蛋白、免疫复合物、脂蛋白等,通过对一级分离后的致病血浆进行二级分离, 将弃除致病因子后的血浆与血液有形成分一同输回体内,减少了白蛋白等中小分子的丢失[12-13]。本报告中11例终末期肾衰竭患者术前进行了62次双重滤过血浆单采治疗,治疗过程中使用的二级血浆成分分离器,可将分离后的含大分子致病物质的血浆弃掉,而将含白蛋白等分子量相对较小的血浆蛋白回收到血液中,其截留分子量在100 kDa以上,可以将分子量在100 kDa以上的IgG等致病物质截留弃去,将67 kDa的白蛋白回收入血。TANABE报告在ABO不相容肾移植前使用DFPP作为治疗方法去除IgG和IgM的效果。当处理血浆容量为5 L时,IgG和IgM的去除率分别约为60%和70%,表明这两种物质的去除率都很高[13]。回顾性分析结果显示,11例患者经过1次或多次DFPP治疗后,其体内PRA水平均明显下降,由阳性转为阴性或弱阳性,达到临床肾移植手术标准,DFPP清除肾移植术前患者PRA的临床疗效确切。需要注意的是, DFPP治疗只能清除PRA,而不能抑制PRA的产生,采用DFPP治疗PRA阳性拟行肾移植的患者,当其PRA检测结果转为阴或者弱阳性并达到肾移植术前处理要求时,应在完善相关术前准备后尽快施行肾移植术。
本报告中11例终末期肾衰竭患者术前进行了62次DFPP治疗,观察治疗前后血常规指标发现,红细胞计数、血红蛋白水平较治疗前有所下降,但差异无统计学意义。肝功能指标中除GLOB下降明显,其余ALB、TBIL变化无统计学意义。K、Na、Cl、HCO3-,治疗前后差异无统计学意义。DFPP治疗过程平稳,安全有效。
FIB也是一种高分子量蛋白质,本研究中患者DFPP治疗前后FIB含量有明显差异(P<0.05)。在治疗过程中需要监测患者的凝血功能,包括FIB、PT、APTT等;并及时处理由此造成的凝血功能障碍,FIB在DFPP治疗中的的高消耗可能使患者出血风险增加。本研究中患者DFPP治疗前后未发生活动性出血等不良反应。一般在治疗过程中需要保证一次置换的量不宜太大。YEH等人的研究指出,在一次DFPP治疗后,纤维蛋白原需要3到4天才能恢复到治疗前水平[14]。如果术前纤维蛋白原过低,在进行肾移植手术之前应该适量补充纤维蛋白原。
DFPP常见的不良反应有低血压、溶血、出血、感染以及包括血管通路引起的血肿、血栓、导管相关性感染等并发症[15]。本研究中患者DFPP治疗前后GLOB含量有明显差异,主要是由于二级血浆分离器滤过大分子物质,导致血清GLOB量下降。GLOB的去除会导致的血浆胶体渗透压下降,可导致血管内脱水相关并发症,如低血压。在DFPP治疗期间,反应性低血压是常见的,在治疗过程中需要预防低血压。本研究病例均使用足量白蛋白或白蛋白加新鲜冰冻血浆作为置换液,治疗过程中患者未发生低血压等不良反应,治疗过程安全平稳。
综上所述,DFPP是降低肾移植术前高PRA有效手段之一,治疗后病人各项指标相对平稳。对于PRA抗体高的患者,应制定个体化高效的预处理策略,为肾移植患者提供良好的体内环境,提高患者的长期生存率,在治疗过程中密切监测可能出现的不良反应予以及时处理,确保治疗过程的安全。本研究的局限性在于纳入的患者数量较少,以及术后患者的转归未随访调查。
利益冲突所有作者均声明不存在利益冲突
