竹叶花椒锈病病原重寄生菌的分离鉴定及产孢条件优化
2024-03-09袁欢方浩楠徐秀张弛韩珊
袁欢,方浩楠,徐秀,张弛,韩珊
(四川农业大学林学院,成都 611130)
花椒锈病作为一种普遍发生的叶部病害,病原为花椒鞘锈菌Coleosporium zanthoxyli[1],其发病率可高达80%以上,对我国花椒栽培区造成了严重的经济损失。重寄生菌在植物病害生物防治中有着重要的作用机制,已有大量研究证实锈菌重寄生现象在自然界中非常常见[2-3],而通过重寄生菌来控制病原菌,符合我国农业绿色发展的要求,是农林生物保护可持续发展的重要手段[4]。重寄生菌对寄主菌的作用机制包括寄主菌形态学上的微小畸变、对菌丝的附着生长、侵入并产生吸器、菌丝的溶解,以及产生酶和抗生物质等[5]。已有研究表明,利用重寄生菌防治竹叶锈病[6]、落叶松褐锈病[7]、花棒锈菌[8]及华山松疱锈病[9]具有较好效果。
鞘柄锈柱隔孢菌Ramularia coleosporii寄主范围较广,目前发现能被寄生的锈菌有黄柏鞘锈菌C.phellodendr[4]、鸡蛋花鞘锈菌C.plumeria[10]、紫苏鞘锈菌C.perillae[11]、金丝桃栅锈菌Melampsora hypericorum[11]以及铁线莲柄锈菌Puccinia exhausta[12]等。鞘柄锈柱隔孢R.coleosporii作为重寄生菌,较有希望在植物锈病生物防治中发挥重要作用。分生孢子是重寄生菌研究中所采用的重要材料,足量的孢子悬液也是寄生性测定研究的前提。鞘柄锈柱隔孢作为重寄生菌,其生长速度缓慢、产孢量较低,目前对于该菌培养条件仅用单因素实验的方法进行了优化[4,13]。关于培养条件优化的方法有单因素法、全因素法、正交试验、Plackett-Burman设计法、响应面优化设计法和均匀设计法等[14],其中响应面方法(response surface methodology,简称RSM)被频繁用于培养条件的优化中[15-17]。本研究从花椒叶锈病的夏孢子堆中,筛选出具有较强重寄生作用的鞘柄锈柱隔孢菌,通过单因素实验和响应面法对该菌株的产孢条件进行优化,建立有利提高鞘柄锈柱隔孢菌分生孢子产量的培养基,为开发花椒锈病的生物菌剂提供理论参考。
1 材料和方法
1.1 供试材料
供试花椒:健康和感病的竹叶花椒(Zanthoxylum armatum)采自四川农业大学5教种植苗圃。(海拔:521 m,30°42′20″N,103°51′28″E)。均使用2 a生的竹叶花椒幼苗。
供试培养基:(1) PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,ddH2O 1 000 mL。(2) PSA培养基:马铃薯200 g,蔗糖20 g,琼脂18 g,ddH2O 1 000 mL。(3) PMA培养基:马铃薯200 g,麦芽糖20 g,琼脂18 g,ddH2O 1 000 mL。(4) 燕麦片琼脂培养基:燕麦片30 g,琼脂18 g,ddH2O 1 000 mL。(5) 10%花椒叶煎汁培养基:新鲜健康花椒叶片100 g,琼脂18 g,ddH2O 1 000 mL。(6) 20%花椒叶煎汁培养基:新鲜健康花椒叶片200 g,琼脂18 g,ddH2O 1 000 mL。(7) Richard培养基:蔗糖50 g,KNO310 g,KH2PO41 g,MgSO4·7H2O 2.5 g,FeCl30.01 g,KCl 0.5 g,琼脂18 g,ddH2O 1 000 mL。(8) Czapek培养基:蔗糖30 g,NaNO32 g,K2HPO41 g,MgSO4·7H2O 2.5 g,FeSO40.01 g,KCl 0.5 g,琼脂18 g,水1 000 mL。采用PDA培养基对重寄生菌进行分离纯化。
供试试剂:果糖、糊精、乳糖、麦芽糖、甘露醇、可溶性淀粉、蔗糖、硝酸钠、硝酸钾、甘氨酸、磷酸二氢铵、硫酸铵和天恩泽柱式真菌基因组DNA试剂盒。
1.2 产孢量计数方法、孢子悬浮液的制备
产孢量计数方法:采用血球计数板法计数产孢量[18]。
孢子悬浮液的制备:将菌株接种到PDA固体培养基上,待分生孢子形成后,用无菌水将孢子洗下,用血球计数板配制成1×105spores/mL浓度,作为后续重寄生菌的筛选。
1.3 重寄生菌的分离、筛选
采集带白色菌丝体的花椒锈病新鲜叶片。(1) 用灭菌接种针挑取带有菌丝体的夏孢子堆接种至PDA培养基上,置于光照12 h/黑暗12 h、(25±2) ℃条件下培养;(2)直接抖落夏孢子于PDA培养基上,置于光照12 h/黑暗12 h、(25±2) ℃条件下培养。待分离出菌落形态明显不同的单菌落后,挑取菌株单菌落纯化及PDA培养基斜面保存,并观察记录各菌株的形态特征。
将上述分离得到的所有菌株配制孢子悬浮液。将患有锈病且未产生重寄生现象的花椒叶片放入灭菌的培养皿中,叶背面向上,叶柄用棉花包裹喷水保湿,叶背面进行0.5 mL孢子悬浮液喷雾,以喷洒无菌水的叶片作为对照,每次30片叶片,每处理3次重复,(25±2) ℃培养3~10 d。通过每日观察夏孢子形态、颜色和夏孢子堆表面菌丝生长情况,筛选重寄生菌,同时将叶片用2.5%戊二醛固定,在SU8100型扫描电镜下镜检并拍照[19]。待显症后再次挑取上述叶片夏孢子堆上的菌丝体置于PDA培养基(25±2) ℃培养,观察菌落形态特征,并与原始菌株形态比较,以确认其菌株与原分离纯化的菌株一致,每处理重复3次。
1.4 重寄生菌的鉴定
1.4.1 形态学鉴定
将纯化后的重寄生菌接种到PDA培养基上,于(25±2) ℃培养箱内培养。待形成菌落后进行形态学观察,参照《真菌鉴定手册》[20]并结合Mycobank数据库进行鉴定。
1.4.2 分子学鉴定
根据柱式真菌基因组DNA试剂盒(天恩泽基因科技有限公司)提取DNA。ITS基因的扩增引物为ITS1:CTTGGTCATTTTAGAGGAAGTAA/ITS4:TCC TCCGCTTATTGATATGC;LSU基因扩增引物为LROR:ACCCGCTGAACTTAAGC/LR5:TCCTGAGG GAAACTTCG和ACT基因扩增引物为ACT-512F:ATGTGCAAGGCCGGTTTCGC/ACT-783:TACGAGT CCTTCTGGCCCAT。
PCR反应体系均为25 μL:上游引物1 μL;下游引物1 μL;DNA模板2 uL;2×EasyTaq®PCR Super-Mix 12.5 μL;ddH2O 8.5 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环34个周期,然后在72 ℃终延伸10 min。扩增产物以1%琼脂糖凝胶电泳检测后送至成都擎科生物技术有限公司测序。将测序结果用NCBIBLAST进行同源比对分析,下载高度同源菌株序列后,基于获得的ITS[21]、LSU[22]和ACT[23]基因片段利用PhyloSuite v1.2.2软件构建贝叶斯(Bayesian inferences,BI)系统发育树,系统发育树图使用Figtree v.1.3.1显示。
1.5 重寄生菌产孢条件优化
1.5.1 基础培养基的筛选
将重寄生菌在PDA平板上(25±2) ℃活化15 d后,沿菌株外侧边缘打制5 mm菌饼,接种到1.1节的供试培养基中,接种后置于(25±2) ℃培养箱里12 h光照/12 h黑夜培养15 d,每种处理3次重复。无菌水洗涤菌丝去除培养基残留物,收集孢子悬浮液后,用血球计数板测定产孢数量和菌丝生长速率。
1.5.2 最适培养温度筛选
采用1.5.1节筛选的基础培养基,分别于10 ℃、15 ℃、20 ℃、25 ℃和30 ℃下培养15 d,统计产孢数量,筛选出最适宜菌株生长的温度。接种方法和测量方法同1.5.1。
1.5.3 最适培养基组分筛选
采用1.5.1节筛选出的基础培养基,按2%的添加量分别加入果糖、糊精、乳糖、麦芽糖、甘露醇和可溶性淀粉作为碳源,其他组分不变,统计产孢量,筛选出最适宜菌株生长的碳源。在筛选的最适碳源基础上,按2%的添加量分别加入硝酸钠、硝酸钾、甘氨酸、磷酸二氢铵和硫酸铵作为氮源,其他组分不变,统计产孢量,筛选出最适宜菌株生长的氮源。每个处理重复3次,接种方法和测量方法同1.5.1。
1.6 单因素优化实验
1.6.1 最佳pH筛选
种子液的制备:将菌株接种到上述优化的固体培养基中,25 ℃恒温培养15 d,用无菌水将分生孢子洗下,用血球计数板配制成1×105spores/mL的孢子悬浮液,以10%的接种量转接于装液100 mL的液体培养基中,在25 ℃、180 r/min恒温摇床中培养10 d,作为后续种子液。
采用上述优化的培养基,制成液体培养基,采用单因素实验确定最佳产孢条件。用HCl或NaOH溶液调整培养基pH值分别为4、5、6、7和8,接种菌株到液体培养基中,以接种量3%、转速180 r/min和1.5.2节筛选的最适温度为初始培养条件,培养10 d后用血球计数板统计产孢数量,根据产孢数量高低筛选出较为适宜的pH段,每个处理重复3次。在适宜的pH段之间以0.2为梯度,进行细化,每个处理重复3次。
1.6.2 最佳碳源添加量筛选
采用上述优化的pH值,在最适碳源基础上以0.5%为梯度(1.5%、2%、2.5%、3%),筛选最佳碳源添加量。每个处理重复3次,接种方法和测量方法同1.6.1。
1.6.3 最佳氮源添加量的筛选
采用1.6.2优化的碳源添加量,在最适氮源基础上以0.5%为梯度(1.5%、2%、2.5%、3%),筛选最佳氮源添加量。每个处理重复3次,接种方法和测量方法同1.6.1。
1.7 响应面实验
在单因素筛选实验的基础上,选定氮源(A)、碳源(B)和pH值(C)作为3个变量因素,各设3个水平(表1),以菌株HC30的产孢量为考察指标,选用响应面法进行最佳产孢条件优化试验。接种方法和测量方法同1.6.1。
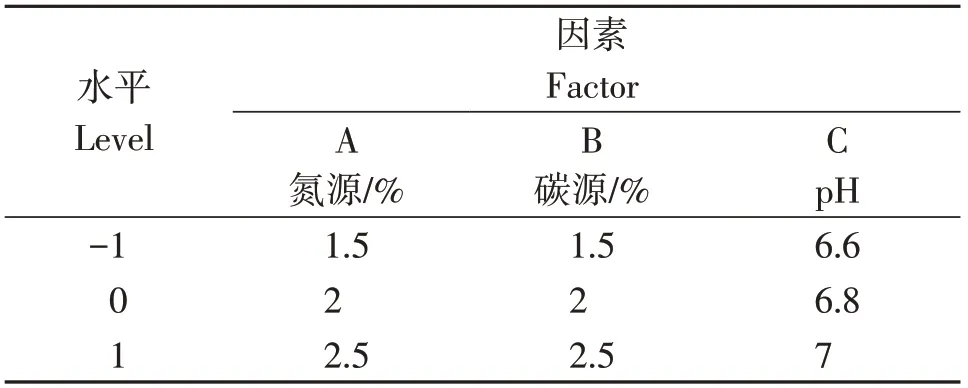
表1 试验因素与水平Table 1 Factors and levels in the experiment
1.8 添加花椒鞘锈菌对HC30产孢量和菌丝生长速率的影响
将1.7优化后的培养基添加花椒鞘锈菌夏孢子粉,配制浓度分别为:0.25 g/L、0.5 g/L、1 g/L和2 g/L,以不添加花椒鞘锈菌夏孢子粉为对照,接种方法和测量方法同上。每处理6个重复。
1.9 数据处理与分析
所有数据均采用单因素方差分析和显著性差异检验(P<0.05)。统计分析使用SPSS(SPSS, Version17.0 for Windows, SPSS Inc, Chicago, USA)进行;响应面作图分析采用Design-Expert 12.0和Origin 2021。
2 结果与分析
2.1 重寄生菌的分离、筛选
从竹叶花椒锈病的夏孢子中分离得到30株真菌,菌株命名为HC1~HC30。通过形态学鉴定和ITS序列分析,分离的真菌包括镰刀菌Fusarium、拟盘多毛孢Pestalotiopsis、枝孢菌Cladosporium、链格孢Alternaria Nees、柱隔孢Ramularia等。
通过寄生能力测定,筛选出1株(HC30)对病原菌有明显抑制作用的菌株,寄生能力为89.4%。接种4 d后,HC30在夏孢子堆表面产生点状白色菌丝,随后白色菌丝逐渐覆盖整个夏孢子(图1A),限制了夏孢子的释放。挑取少量夏孢子在显微镜下镜检发现,HC30的菌丝在夏孢子体内生长,并缠绕夏孢子,夏孢子的颜色由黄色变为无色,其内涵物质溢出(图1C)。用扫描电镜观察可见该重寄生菌的菌丝缠绕在夏孢子堆上,分生孢子穿透夏孢子使孢子外壁破裂,细胞壁向内凹陷,丧失萌发和侵染的能力(图1D-E)。

图1 重寄生菌寄生花椒鞘锈菌C.zanthoxyli夏孢子堆Figure 1 The condition of the hyperparasite parasitized on uredia of C.zanthoxyli
2.2 重寄生菌的鉴定
由图2可知,在PDA上培养15 d后,菌落呈白灰色;分生孢子串生和单生,呈卵形、椭圆形,无色透明,表面平滑,大小为4.15~20.43×3.24~5.38 μm(n=50)。其形态特征与鞘柄锈柱隔孢菌的描述一致[20]。分子鉴定:经真菌通用引物ITS、LSU和ACT获得的基因序列分析,菌株HC30为Ramularia coleosporii(保藏号:CGMCC NO.40896,保存于中国普通微生物菌种保藏管理中心)。琼脂糖凝胶电泳结果表明,菌株HC30的序列长度为909 bp、537 bp和190 bp (图3)。通过BLAST结果显示,菌株HC30的ITS、LSU和ACT序列(登录号 ON149795、ON138871和ON164836)与鞘柄锈柱隔孢菌(KX287364、KX287075、KX287652)有100%的同源性,在系统进化树中,菌株HC30与R.coleosporiiCBS 131767的距离最近(图4),外源菌为Verticillium nubilumCBS45751。结合形态特征及序列的分析结果,鉴定菌株HC30为鞘柄锈柱隔孢菌。

图2 花椒鞘锈菌重寄生菌菌落培养性状及分生孢子Figure 2 Colony cultural character and mycelial morphology of C.zanthoxyli

图3 重寄生菌HC30琼脂糖凝胶电泳图Figure 3 R.coleosporii HC30 purified by agrose electrophoresis
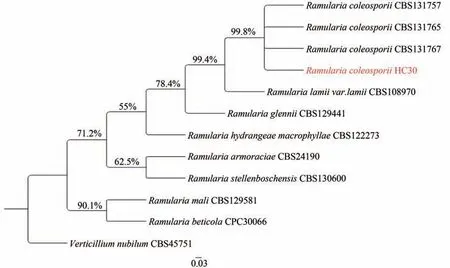
图4 基于ITS、LSU和ACT序列的重寄生菌HC30系统发育树Figure 4 The phylogenetic tree of ITS、LSU and ACT sequence of R.coleosporii HC30
2.3 重寄生菌产孢条件的优化
2.3.1 基础培养基的筛选
从表2可以看出,PSA培养基上鞘柄锈柱隔孢菌的产孢量(35.4)显著多于其他培养基;PMA培养基上该菌株菌丝生长很快,但产孢量较少。以产孢数量为指标,在后续优化试验中,采用PSA培养基对该菌株进行培养。

表2 不同培养基对鞘柄锈柱隔孢菌HC30产孢量和菌丝生长速率的影响Table 2 Effect of different fundamental culture medium on sporulation and mycelium growth rate of R.coleosporii HC30
2.3.2 最适温度的筛选
由表3可以看出,随着温度升高,产孢量和菌丝生长速率均先增长后减少,5 ℃和35 ℃时鞘柄锈柱隔孢菌不生长,15 ℃和30 ℃时菌株生长缓慢,差异不显著;25 ℃时菌株产孢量和菌丝生长速率明显高于其他处理组,其次是20 ℃。因此,选择25 ℃为最适菌株产孢的温度。

表3 不同温度对鞘柄锈柱隔孢菌HC30产孢量和菌丝生长速率的影响Table 3 Effect of different temperature on sporulation and mycelium growth rate of R.coleosporii HC30
2.3.3 最适培养基组分筛选
如表4可知,当碳源为麦芽糖时,其产孢量最大为3.5,与优化前鞘柄锈柱隔孢菌产孢量36.5相比,6种不同碳源添加反而对菌落产孢及生长具有砠碍作用。因此,最适菌株生长的碳源仍为蔗糖。

表4 碳源和氮源对菌株HC30产孢量和菌丝生长速率的影响Table 4 Effect of carbon sources and nitrogen sources on sporulation and mycelium growth rate of strian HC30
添加不同供试氮源后,菌株HC30产孢量差异显著(P<0.05)。当氮源为硫酸铵时,鞘柄锈柱隔孢菌丝生长较快,但产孢量非常少;当氮源为硝酸钾时,菌株产孢量(54.4)显著高于其他处理,其次为硝酸钠。以最高产孢数量为选择依据,因此确定硝酸钾为最适氮源。
2.4 单因素优化实验
2.4.1 最佳pH筛选
由图5A可知,随pH增加,菌株HC30的产孢量先增长后下降。pH为7时,菌株HC30产孢量(1.24)显著高于其他pH处理,之后呈下降趋势;pH为5时,菌株HC30产孢量(1.19)仅次于pH7。因此,为获得较准确的最佳pH值,将pH 6~7再次检测。从复筛的结果(图5B)可以看出,pH 7.0和6.8时均较高,且二者差异不显著,当pH低于6.6时菌株HC30产孢量有所降低。综上将6.6~7.0作为鞘柄锈柱隔孢的最优pH,并选取pH 6.6~7.0进行响应面试验。

图5 单因素实验Figure 5 Univariate testing
2.4.2 最佳碳源添加量筛选
为筛选最佳碳源添加量,以0.5%为梯度进行细化。从图5C可知,菌株HC30产孢量呈先增长后降低的趋势。当蔗糖含量为1%和3%时,产孢量最少(0.96和1.03);当蔗糖含量为2%时,产孢量明显高于其余处理,2.5%添加量使产孢量显著降低。因此,碳源选择1.5%、2%和2.5%进行响应面优化试验。
2.4.3 最佳氮源添加量筛选
由图5C可以看出,随硝酸钾添加量的增加,鞘柄锈柱隔孢菌的产孢量呈先增长后降低。添加量为2.5%时,产孢量最高,与2%差异显著。当添加量为1%时产孢量最低,3%次之,说明氮源添加过高或过低都不利于对鞘柄锈柱隔孢菌的生长和繁殖。因此,选择1.5%、2%和2.5%进行响应面优化试验。
2.5 响应面实验
以氮源(A)、碳源(B)和pH值(C)作为3个变量因素,以产孢量为指标,进行响应面实验,结果如表5,在氮源2.5%、碳源2%和pH7条件下,培养得到的HC30产孢量最多,显著高于其他处理组。

表5 筛选鞘柄锈柱隔孢菌HC30产孢条件的响应面实验结果Table 5 Response surface test of culture conditions of R.coleosporii
由表6可知,3个因素F值由大到小依次为氮源>pH>碳源,因此可以推测出对鞘柄锈柱隔孢产孢量的影响程度大小顺序为氮源>pH>碳源。以鞘柄锈柱隔孢产孢量为响应值,利用Design-Expert 12统计分析软件对氮源、碳源和pH进行多元回归拟合,建立二次多项式回归模型:产孢量=-15.284+1.699×A+1.049×B+3.622 5×C+0.05×A×B-0.175×A×C+0.275×B×C-0.061×A2-0.741×B2-0.256 25×C2。回归方差模型P值<0.000 4,模型极显著;失拟项P值为0.873 7 (P>0.05),表明其模型失拟项不显著;该模型的负相关系数为R2=0.96>0.9,说明实际试验中约96%的结果可以通过拟合模型进行解释。校正回归系数AdjR2=0.908 6,信噪比Adeq Precision=15.030 6>4,由此可确定本试验所建立的模型可靠。
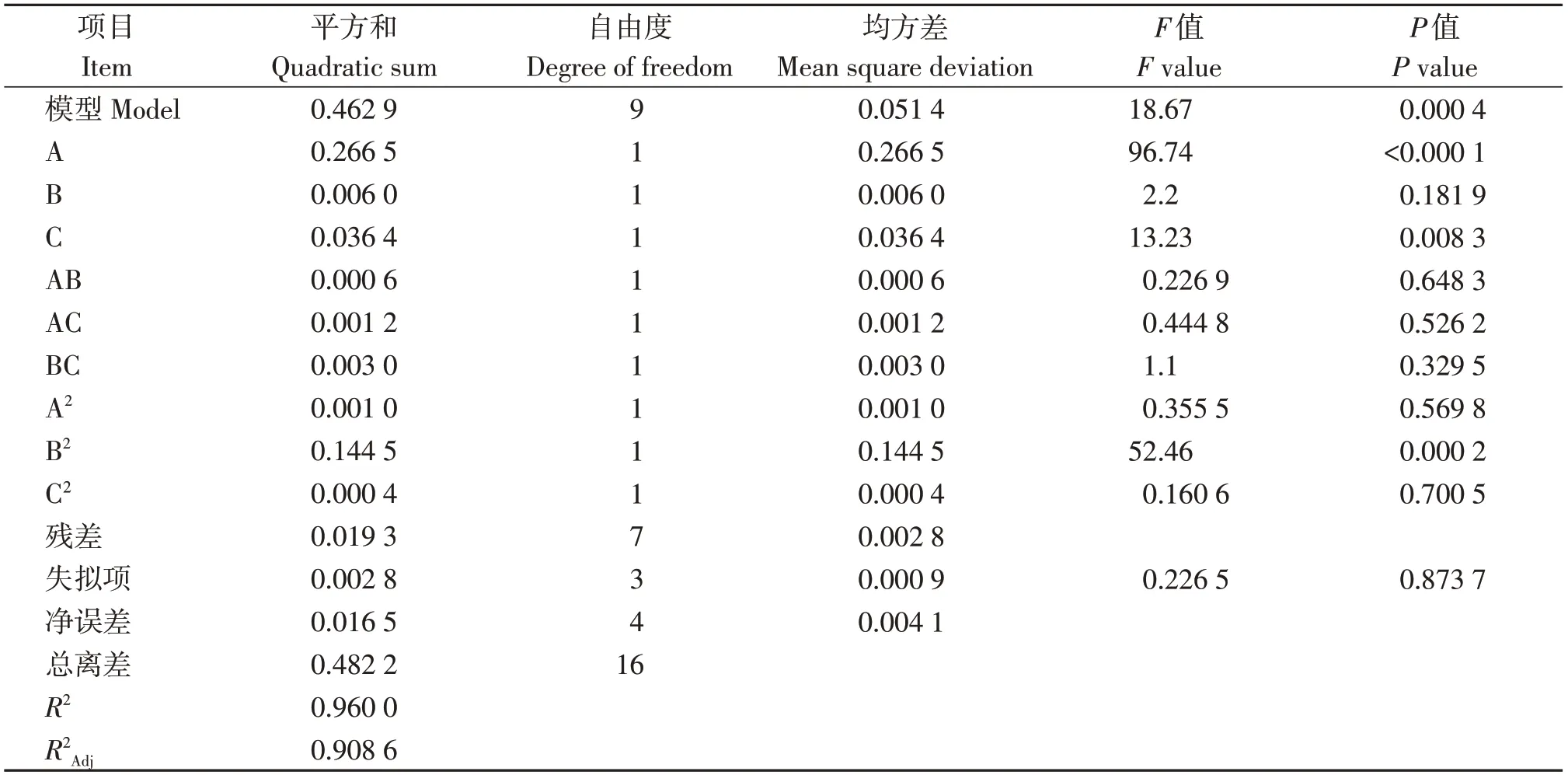
表6 回归方程的方差分析Table 6 Analysis of variance for the regression equation
在回归模型方差分析结果的基础上绘制响应面图,并进一步分析氮源、碳源和pH之间的交换作用对产孢量的影响。当固定氮源、碳源和pH其中一个因素时,其他两个因素间的交互作用结果见图6。由响应曲面图可知,氮源和pH之间的交互作用对鞘柄锈柱隔孢菌的产孢量影响较大,碳源和pH的交互作用以及氮源和碳源的交互作用对产孢量的影响不明显。

图6 碳源和氮源交互作用对鞘柄锈柱隔孢菌HC30产孢量的影响Figure 6 Interaction of carbon sources and nitrogen sources on sporulation of R.coleosporii HC30
图6表示pH在中心水平时,反应了氮源和碳源对产孢量的影响。当氮源一定时,随碳源添加量的增加,产孢量呈先增长后降低的趋势;当碳源一定时,随氮源添加量的增加,产孢量缓慢增长。
图7表示碳源在中心水平时,氮源和pH两个因素之间的交互作用。当氮源添加量在较高的情况下,菌株HC30的产孢量随pH的增加而增加。

图7 pH和氮源交互作用对鞘柄锈柱隔孢菌HC30产孢量的影响Figure 7 Interaction of pH and nitrogen sources on sporulation of R.coleosporii HC30
图8表示了在碳源添加量较低的情况下,随pH的增加,得到的产孢量呈增长趋势;当pH在较高水平时,随碳源添加量的增加,鞘柄锈柱隔孢产孢量先增长达到一定值后又降低。

图8 pH和碳源交互作用对鞘柄锈柱隔孢菌HC30产孢量的影响Figure 8 Interaction of pH and carbon sources on sporulation of R.coleosporii HC30
在本试验设定范围内,预测鞘柄柱隔孢菌最大产孢量是1.561×108spores/mL,最佳参数为氮源2.5%,碳源2.1%,pH 6.99。为了验证实际操作的可能性,将菌株HC30的最佳产孢条件修正为氮源2.5%,碳源2.1%,pH 7,进行3次重复试验,实际测到的鞘柄锈柱隔孢产孢量分别为1.558、1.549和1.554,平均值为1.553,与理论预测值基本吻合,说明所建模型具有可靠性,修正的参数最有利于菌株产孢。
2.6 添加花椒鞘锈菌对HC30产孢量和菌丝生长速率的影响
在优化出的培养基中添加花椒鞘锈菌可增加重寄生菌的生长速率。由图9可以看出,随着花椒鞘锈菌夏孢子粉浓度增加,产孢量先增长后降低,花椒鞘锈菌夏孢子浓度为0.5 g/L菌株HC30产孢量明显高于其他处理组,为2.28×108spores/mL。而添加2 g/L显著低于对照CK。因此,0.5 g/L为最适添加浓度。
3 讨论与结论
柱隔孢属(Ramularia)在现代分类系统中隶属于无性态真菌(Anamorphic fungi)丝孢纲(Hyphomycetes)丛梗孢科(Moniliaceae),其有性型为子囊菌门球腔菌科Mycosphaerellaceae[24],我国目前记载的柱隔孢属真菌有80种[12]。本研究从花椒叶锈病的夏孢子堆中筛选重寄生菌,发现菌株HC30的菌丝缠绕在夏孢子堆上,分生孢子穿透夏孢子的细胞壁,对花椒鞘锈菌有破坏作用,结合形态学特征以及ITS(核糖体DNA内转录间隔区)、LSU(大亚基)和ACT(肌动蛋白)联合序列分析,鉴定菌株HC30为鞘柄锈柱隔孢菌。
重寄生菌培养条件的研究,是利用重寄生菌制定生物防治措施的重要依据之一,而培养基成份是提高菌株产孢量的关键。响应面法作为一种优化方法,可快速有效地确定多因子系统的最佳条件[25-27],同时具备试验次数少,周期短、精度高等优点[28],以响应面实验进行培养条件的优化较单因素实验更为有效。本试验通过单因素实验和响应面法确定了PSA培养基为鞘柄锈柱隔孢菌的最佳产孢培养基。本试验获得分离自花椒鞘锈菌的鞘柄锈柱隔孢菌最大产孢量为1.5×108spores/mL,培养条件优化并添加花椒鞘锈菌夏孢子粉后产孢量增加至2.28×108spores/mL该结果与杨望飞[13]分离自花椒鞘锈菌的鞘柄锈柱隔孢菌最大产孢量为15.8×106spores/mL的结果相比,增加显著。这可能是由于花椒鞘锈菌可为重寄生菌-鞘柄锈柱隔孢菌提供更利于吸收的营养物质,但具体种类还未明确,有待于进一步研究。吴云[4]对分离自黄柏鞘锈菌的鞘柄锈柱隔孢菌的培养条件也进行了优化,获得最佳pH为7,最佳温度25 ℃,最适碳源为麦芽糖,最适氮源为硝酸钠,当20%黄柏叶煎汁作为培养基时,最大产孢量为14.73×108spores/mL;与本试验结果有所不同,这可能是由于不同寄主真菌的重寄生菌株对营养物质的需求有所差异,这也对研究鞘柄锈柱隔孢菌株之间的遗传多样性提供了理论依据。
通过筛选具有破坏作用的重寄生菌来控制病原菌是有效的生物防治措施。重寄生菌作为生防菌的一种,对病原菌的防治效果也受到多种因素共同作用。鞘柄锈柱隔孢菌寄主范围广,作为重寄生菌具有较大的潜在的应用价值,下一步研究将以本试验优化的条件为基础,进一步优化其他培养参数,并通过代谢组学等手段明确花椒鞘锈菌提供的营养物质,为重寄生菌的生物制剂的研制提供理论依据。
