不同光源条件下与花生株高变化相关基因的转录组分析
2024-03-09杨永庆马晓蕾李玉荣王瑾
杨永庆,马晓蕾,李玉荣,王瑾
(河北省农林科学院粮油作物研究所/河北省作物遗传育种实验室,石家庄 050035)
花生(Arachis hypogaeaL.)是高品质食用油的主要来源之一,也是我国最主要的油料作物之一[1-2]。机械化是现代农业的重要标志,相比玉米、小麦及大豆等主要粮油作物,花生机械化程度相对落后[3-4]。虽然花生每亩产油量要远高于大豆、油菜等油料作物,亩产效益高,但受限于机械化程度低,农民种植花生耗时、耗力、投入成本高,净收益提升不上去,极大影响了农民种植花生的积极性。采收是花生机械化过程中重要一环,株型是影响采收效率最主要因素之一,并且株型的优劣对产量也具有显著影响,因此培育株型适宜机械化的花生品种实现农业现代化的必要前提。
作物株型是一个复杂的综合性性状,它由株高、分枝和节间距等多种性状组成,而每一个性状又受环境和遗传等多种因素影响。其中株高是株型最主要的组成因素之一,它对作物丰产性、耐肥性及抗逆性都有重要作用。20世纪60年代,美国育种学家诺曼·布劳格,育成了矮秆小麦品种,该品种耐高肥、抗倒伏,极大解决了施肥引起的倒伏问题[5]。此外水稻的育种家也利用了中国的一个矮秆品种,也培育出了耐高肥、抗倒伏的品种。正是由于矮秆品种的广泛应用,突破了施肥后作物容易倒伏,导致减产的限制因素,全世界水稻和小麦的产量也因此翻了一倍,这一农业事件被称为“绿色革命”,而这也说明株高在农业生产中起着至关重要的作用。
传统育种耗时、费力以及育种周期长,而分子标记辅助育种有助于育种家针对性开展育种工作。一些“绿色革命”基因,例如水稻中的sd1[6]、小麦的Rht[7-8]和玉米dwarf1[9]等基因的克隆极大加速看新品种的选育进程。此外,大豆中控制株高的Dt1和Dt2等基因的克隆[10-11],也极大地便利于分子设计育种的开展。科学家们针对这些基因的分子功能也进一步展开了广泛的研究,研究发现植株矮化的本质归于赤霉素的效应,赤霉素能够促进DELLA蛋白的降解,而DELLA蛋白是植物的抑制因子,它的积累阻遏了植物生长,使植物变矮[12-14],而清晰的遗传规律和分子机制对水稻、小麦和玉米等作物的育种家深刻理解品种本质具有重要作用。
由于花生具有地上开花,地下结果的特殊习性,不同株型的品种对机械化收获方式的需求具有显著差别,然而相比于其他作物,花生株型的相关研究几乎没有。花生株型可以大致分为3种类型,直立型、半直立型和匍匐型[15-16],其中直立型品种主茎高度与侧枝高度几乎一致,而匍匐型品种侧枝长度远大于主茎高度。而有些品种的株型也受种植密度或光照强度的影响,例如本课题组培育的冀花18号,在密植或弱光条件下呈现直立型株型,但疏植或强光条件下,呈现半直立甚至匍匐型形态,然而冀花18号这种形态变化的分子机制还不清楚。本研究拟利用冀花18号的双亲冀花5号(直立型)和开选01-6(匍匐型)为材料,通过在不同光照条件下种植,观察两者对不同光的形态学反应。进一步,通过高通量转录组测序技术检测不同条件下两种株型材料基因组的表达情况,深入探究与株高相关的分子调控网络。研究结果将为深入理解花生株高的形成提供理论基础。
1 材料和方法
1.1 试验材料
本试验中使用的直立型花生品种冀花5号为河北省农林科学院粮油作物研究所培育,匍匐型花生品种开选01-6为开封市农林科学研究院培育。
1.2 盆栽方法和条件
2个品种分别选取籽仁大小一致的花生种子100~120个。以1∶1混合的蛭石和营养土作为基质对花生苗进行培育,每盆播种3~5粒健康种子,所有盆栽材料均置于温室环境下进行培养。在出苗后5 d,剔除弱苗和病苗,保留两棵长势一致的健康苗。此时,每个品种选取5~10盆分别置于控温的人工气候室(LED灯光)和玻璃温室(自然光)条件下进行培养,温度均为白天25 ℃,晚上18 ℃,人工气候室采用空调控温,玻璃温室采用水帘和空调联合控温,出苗后25 d左右选取均匀一致的6株统计株型数据。其中,人工气候室LED灯光的强度为30 klx,连续给光时间为14 h/d。玻璃温室中的光源主要以屋顶投射太阳光为主,试验在5—6月份进行,此时石家庄昼长在13.5~15 h之间。
1.3 材料取样
出苗后25 d左右,等量选取每棵植株主茎和侧枝顶端部位器官组织3~4 g混合,将3株的样品混合一起置于液氮中速冻后,研磨混匀作为一个样品,每个处理条件下取3个生物学重复。最终获取的12个样本送到广州基迪奥公司进行转录组测序及分析。
1.4 转录组测序数据质控及比对分析
为了保证数据质量,首先对原始数据进行过滤,利用fastp[17]对raw reads进行质控,过滤低质量数据得到clean reads。过滤条件如下:①去除含adapter的reads;②去除含N比例大于10%的reads;③去除全部都是A碱基的reads;④去除低质量reads(质量值Q≤20的碱基数占整条read的50%以上)。
根据HISAT2的比对结果,利用Stringtie[18]组装转录本,并利用RSEM[19]计算每个样本中所有基因的表达量。表达量以原始reads count和FPKM展示,原始reads count表示该转录本所包含的reads数目,但受测序量和基因长度的影响,原始reads count不利于样本间的差异基因比较。为保证后续分析准确性,先对测序深度进行校正,再对基因或转录本的长度进行校正,获得基因的FPKM值后,再进行后续分析。
1.5 数据处理
本试验中的用到的PCA分析、差异分析、GO和KEGG等注释分析均在基迪奥公司在线分析网站www.omicsmart.com/上进行分析和作图,差异基因热图使用TBtools进行绘制[20]。
2 结果与分析
2.1 不同类型花生品种对不同光源的形态反应
为了探究不同光源对冀花5号(直立型)和开选01-6(匍匐型)株高的影响,分别在人工气候室LED灯光和玻璃温室自然光条件下进行盆栽试验,出苗后25 d进行表型统计。试验结果显示,冀花5号在不同光照条件下株型变化幅度显著大于开选01-6(图1A,1B)。与LED光照条件下相比,自然光条件下冀花5号和开选01-6主茎高度分别显著降低39.26%和15.81%(图1C),侧枝长度分别显著降低46.59%和20.27%(图1D)。此外,自然光条件下冀花5号的叶柄角度也显著增大,变化幅度约34.62%,但开选01-6角度变化不显著(图1E)。以上结果表明,冀花5号对光照反应敏感,开选01-6对光照反应相对迟钝,这为后续分析不同光源条件下与株高变化相关的基因提供了良好材料。

图1 不同光照对花生株型影响Figure 1 Effect of different light on peanut plant type
2.2 转录组测序数据质控和比对分析
为了深入探究不同光照条件下与株高相关的基因表达变化,利用转录组对冀花5号和开选01-6出苗后30 d的基因表达网络进行分析。通过分析文库测序结果显示(表1),12个样品间的数据量和质量差异不大,平均读段数约为4 802万个,原始和有效平均数据量均大于7 G。此外,原始数据中,样品的Q20和Q30平均占比分别为97.55%和93.25%,GC含量平均占比为44.66%;有效数据中,样品的Q20和Q30平均占比分别为97.74%和93.47%,GC含量平均占比为44.60%。以上研究结果表明,不论在数据量上或质量控制方面,12个样品的指标均符合要求,可以用于后续分析。

表1 转录组测序原始数据与有效数据质控分析Table 1 Quality analysis of raw-data and clean-data for transcriptome sequencing data
进一步将获得的有效数据与花生参考基因组Arachis hypogaea v1.0(https://phytozome-next.jgi.doe.gov/)进行比对分析。结果显示(表2),12个样品用于比对的平均读段数约为47.7万左右。其中,平均3.15%数据未比对到基因组上,83.50%的数据只比对到一个位置,有13.36%的数据比对到多个位置,总比对上的占比平均为96.85%。此外,从比对到编码区域分析,12个样品平均有86.18%、6.78%和7.04%分别比对到外显子、内含子和基因间隔区域。以上结果表明,获得的有效数据多数由花生基因组转录,数据可以很好预测花生基因组中基因的表达水平。

表2 转录组测序数据与参考基因组比对分析Table 2 Analysis of transcriptome sequencing data and reference genome alignment
2.3 不同株型花生品种对不同光的基因差异表达分析
对2种株型品种在不同光源条件下处理后,首先以植株基因表达水平为向量进行主成分分析(PCA)。PCA结果显示第一主成分(PC1);纵坐标和第二主成分分别占比47.1%和32.7%,两者对样品差异的贡献值超过79%,表明可以很好代表样品间差异情况(图2A)。此外,结果还显示LED日光灯光源下冀花5号(GJH5)和开选01-6(GKX01-6)距离相对较近,自然光源下冀花5号(NJH5)和开选01-6(NKX01-6)距离较近,说明光照对基因表达的影响大于基因型间的差异影响。不同光源处理下,NJH5比GJH5上调和下调表达基因数目分别为991和1 000,NKX01-6比GKX01-6与上调和下调表达基因数目分别为1 106和593(图2B)。进一步对这些上下调表达基因进行韦恩分析,结果显示受不同光源的影响,分别有436个和313个表达基因,在冀花5号和开选01-6中均出现上调或下调表达;分别有555个上调和687个下调基因,仅在冀花5号中特异响应;分别有670个上调和280个下调基因在开选01-6中特异响应(图2C,D)。以上结果表明,不同株型品种对光源的响应存在显著的差异,这些差异表达基因,尤其是不同株型品种间特异性差异表达基因是影响株高的关键基因。

图2 不同株型花生品种对不同光的基因差异表达分析Figure 2 Differential gene expression of peanut germplasm with different plant types under different light
2.4 差异表达基因的GO分析
为进一步分析上述差异基因的类型,按照受不同光源处理后,在冀花5号和开选01-6中均有差异表达(图3A),只在冀花5号中差异表达(图3B)及只在开选01-6中差异表达(图3C)等3类基因进行GO分析。结果显示(图3),铁离子结合(iron ion binding)、氧化还原酶(oxidoreductase activity)、转移酶活性(transferase activity)等一些类型基因在3类差异基因中均显著富集。此外,在冀花5号中还特异性富集了一些参与脂类生物合成过程(lipid biosynthetic process)和脂质代谢过程(lipid metabolic process)的基因,而在开选01-6中特异性富集了光合作用、光收获(photosynthesis,light harvesting)、萜烯合酶活性(terpene synthase activity)、作用于磷酸盐碳氧裂解酶活性(carbon-oxygen lyase activity,acting on phosphates)及膜(membrane)。以上研究结果表明,不论在差异表达数目或是类型上,冀花5号和开选01-6对不同光源的响应存在显著差异,说明不同株型的品种在对不同光源的响应过程中存在基因表达特异性。

图3 差异表达基因的GO分析Figure 3 GO analysis of differentially expressed genes
2.5 差异表达基因的KEGG分析
为深入探究不同光源影响花生株高变化的关键调控基因,对上述获得的3类差异基因进行KEGG分析,分析其参与的主要调控代谢途径。结果显示(图4),上述3类差异基因在类黄酮生物合成(flavonoid biosynthesis),植物昼夜节律(circadian rhythm-plant)、次生代谢产物的生物合成(biosynthesis of secondary metabolites)、苯丙素的生物合成(phenylpropanoid biosynthesis)等合成途径上均具有显著的富集。尤其是在植物昼夜节律相关的通路发生了显著变化,说明该调控途径对株高的变化具有重要作用。此外,在冀花5号和开选01-6中也在一些其他调控通路上特异富集。如在冀花5号中苯丙烷代谢(phenylalanine metabolism)、亚麻酸代谢(alpha-Linolenic acid metabolism)和异黄酮生物合成(isoflavonoid biosynthesis)等调控途径受光照影响后,发生显著改变(图4B),而在开选01-6中二苯乙烯类,二芳基庚烷类和姜辣酚的生物合成(stilbenoid,diarylheptanoid and gingerol biosynthesis)、光合作用—捕光天线蛋白(photosynthesis-antenna proteins)、萜类化合物生物合成支柱(terpenoid backbone biosynthesis)等调控途径受光照影响后,发生显著改变(图4C)。结果还显示,受光照影响后的调控途径多与物质的代谢或合成相关。以上研究结果表明不同光源对花生的物质成分具有显著影响,其中3类差异基因在植物昼夜节律相关的通路中均有显著富集,说明植物昼夜节律基因对花生株高的调控具有重要作用。
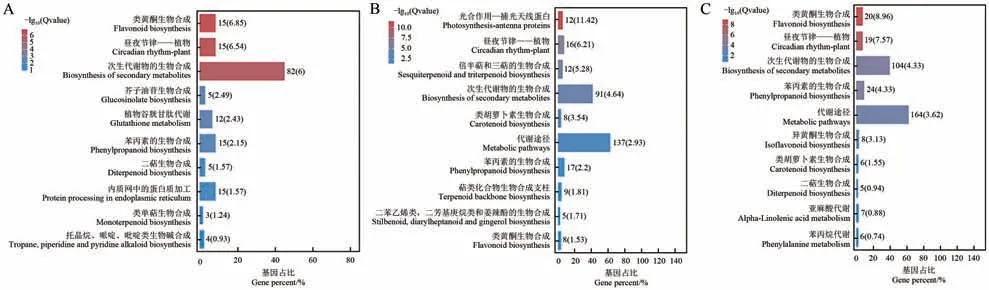
图4 差异表达基因的KEGG分析Figure 4 KEGG analysis of differentially expressed genes
2.6 植物昼夜节律通路中差异基因分析
为了进一步探究植物昼夜节律(circadian rhythm-plant)相关基因在株高形成过程中的调控作用,对不同株型品种受不同光源处理后,植物昼夜节律通路基因的变化进行分析。结果显示共有50个基因出现了差异变化(图5)。2种株型品种中有15个具有相同变化趋势的基因,其中7个和8个基因分别在自然光源和LED日光灯光源下高表达,在LED光源下高表达的均为查尔酮合成酶(CHS)基因(图5A);在开选01-6中有16个特异变化的基因,其中自然光源和LED光源条件下高表达的基因分别有11个和5个,编码7种类型的基因;此外,在冀花5号中分别有2个和17个在自然光源和LED光源下高表达,值得注意的是LED光源下高表达的均为CHS基因,在自然光源下仅有2个编码PIL15基因高表达。以上研究结果表明受不同光源处理后开选01-6在植物昼夜节律网络通路上的响应更为广泛,说明这些特异表达的基因对开选01-6株高对不同光源的不敏感性具有重要调节作用。
2.7 生长素调控基因的变化
植物激素信号转导(plant hormone signal transduction)是植物发育的主要调控通路,对株型建成具有关键调控作用。通过分析共鉴定出34个差异表达基因,其中10个基因在冀花5号和开选01-6中共性表达(图6A);不同光照条件下,分别有6个和17个基因在开选01-6和冀花5号中特异响应(图6B、C)。其中有多个生长素基因的表达在2种株型品种间呈现显著差异。例如,开选01-6在自然条件下有2个生长素编码基因Ahy.92FFKE和Ahy.987W5L高表达,而冀花5号在自然条件下17个基因中的14个表达量变低,其中包含生长素响应因子ARF基因,生长素反应基因AUX/IAA等。以上结果表明,不同光源显著影响了植物激素信号转导网络变化,但不同株型品种对光照的响应存在显著差别。
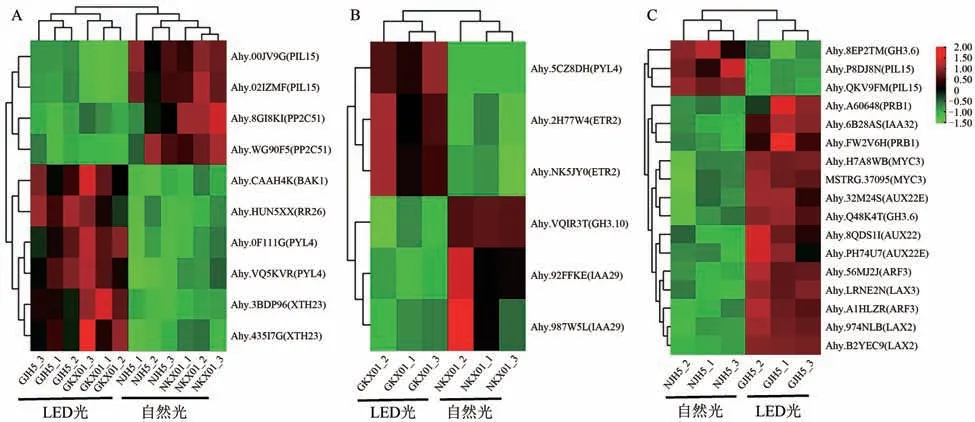
图6 不同株型品种植物激素信号转导相关基因的表达分析Figure 6 Expression analysis of plant hormone signal transduction related genes in different plant types
3 讨论
光照是植物生长和发育的必要条件,植物本身不可移动,因此在不同的光照条件下,会通过改变自身形态以获取更多的光源来趋利避害。例如,农业生产上发现密植条件下,单个植株获得光变少,为了获得更多光源,植株株高变高,抗倒伏性变差。花生在种植过程中也存在类似现象,密植导致株高变高、变细,后期植株易倒伏,暗示着光在花生株型形态建成的过程中起着关键作用。本研究中使用了2种光源开展对比试验,其中LED光源属于弱光,模拟田间密植条件下光照弱和不足的情况,而玻璃温室则主要是太阳投射光,模拟自然状态下的生长状况。结果发现冀花5号株高反应相对敏感,LED光源下株高显著变高,叶片夹角也一定程度收缩变小,这与田间密植情况类似。此外,开选01-6株高对不同光源的反应似乎不太敏感,但LED光源下株高也出现了显著升高。不论如何,这些结果说明LED光源可以一定程度上模拟田间密植情况。
研究表明,ELONGATED HYPOCOTYL5 (HY5)和(constitutively photomorphogenic,COP)1为光信号转导的下游调控因子,也是植物光形态建成的核心调控因子,两者对植物株型的性状均有重要调节作用。其中,HY5主要起到对下胚轴等器官发育的抑制作用,例如hy5突变体会导致侧根的分枝和长度增加、增快下胚轴表皮细胞和根毛细胞的伸长等[21]。而COP1则与HY5功能相反,在黑暗条件下COP1蛋白会大量聚集在核内,抑制HY5功能发挥;在光照条件下,COP1蛋白会从核内转移出去,解除了对HY5的抑制[22],从而调控植株株高的形态,以上研究表明HY5和COP1的功能发挥光照关系密切。在本研究中我们鉴定出2个HY5-homologous基因(HYH)差异表达基因Ahy.7JYX6X和Ahy.8U3XLV,在自然光源下两者在冀花5号和开选01-6中均显著高表达,这与HY5对光的响应一致,暗示着两者行使类似HY5的功能。有意思的是,自然光条件下花生中HY5的抑制因子COP1基因(Ahy.NA6SJF)在开选01-6中显著上调表达,而在冀花5号中无显著变化。这说明在不同光源条件下,冀花5号中的COP1基因对HY5的抑制能力没有显著变化,但自然光源条件下,冀花5号中HY5的表达显著升高,这就导致自然光照条件下HY5对株高的抑制能力增强。与此相反,自然光源条件下,开选01-6中HY5和COP1的表达同时显著升高,因此对株高的影响有限。以上结果也很好地解释了冀花5号和开选01-6的株高对不同光源的敏感程度出现显著差异的原因。
生长素(Auxin)是最早发现的植物激素,其参与多种植物组织器官生长和发育,并且在响应逆境胁迫过程中也发挥重要的调控作用[23],而生长素响应因子(auxin response factors,ARF)是一类能够识别并结合生长素响应元件AuxREs[24-26],调控生长素响应基因表达的转录因子。ARF与Aux/IAA均是生长素的信号转导途径中的重要调控因子,其在植物体内广泛存在,并对一些生理过程发挥着重要的调控作用。本研究通过对生长素信号转导途径中的基因筛选发现,不同光源条件下,冀花5号中生长素基因响应比较强烈,共有17个出现显著变化,其中有2个ARF基因Ahy.56MJ2J和Ahy.A1HLZR在LED光源下显著上调表达,与此同时有4个Aux/IAA家族基因也出现显著上调表达;相比之下,开选01-6中仅有6个基因发生显著变化,有意思的是2个IAA家族基因Ahy.92FFKE和Ahy.987W5L在自然光源下显著上调表达,这与冀花5号中的生长素上调趋势相反。结合冀花5号和开选01-6株高变化趋势,以上这些结果暗示着生长素相关基因ARF和Aux/IAA参与了冀花5号在不同光源下的株高变化。
尽管以上结果可以从一定程度上发现与株高变化的相关分子调控通路或基因,但相同环境下,导致不同品种中这些基因出现差异表达的遗传因素仍需进一步鉴定,这对今后分子设计育种工作具有重要指导作用。
4 结论
本研究通过对不同光照条件下两种株型品种的形态观察,发现在株高变化上直立型品种冀花5号对光照反应比匍匐型开选01-6敏感。通过转录组学发现,冀花5号主要通过HY5-COP1途径感受光源的变化,并影响生长素的信号转导途径中的重要调控因子ARF、Aux/IAA等的变化,从而达到调控株高的变化。
