氨对蚤状溞诱导型反捕食生活史防御的抑制效应
2024-03-02孙运菲
刘 琪,孙运菲,谷 磊,杨 州
(南京师范大学生命科学学院,江苏 南京 210023)
枝角类是水生生态系统的重要组成部分,它们不仅是影响藻类群落组成和丰富度的主要牧食者,也是鱼类和其他无脊椎动物捕食者的重要食物资源[1]。枝角类通常可以感知捕食者释放的信息素,并表现出多样的诱导型反捕食防御特征,例如改变行为(包括垂直迁移、趋光性和逃逸行为等[2-3])、变化形态(包括产生颈齿、角突、头冠、增长尾刺等[4-6])、调整生活史策略(包括成熟体长减小、繁殖提前、后代数目增加等[7-8])。这些防御性状可以有效降低枝角类被捕食的风险,使种群得以延续。然而,在复杂且多样的水体环境中,枝角类诱导型防御的表达通常会受到包括污染物在内的多种环境因素的干扰[9-11]。例如,当水体中的钙离子浓度降低时,枝角类的生活史防御受损,但与生殖性能有关的防御特征增强[12];水温升高加速了枝角类诱导型形态防御的形成,但降低了形态防御性状的表达强度[13];接触低浓度的铜扰乱了枝角类的嗅觉系统,从而影响其诱导型防御的形成[14]。因此,了解枝角类在环境污染下对捕食风险的响应,有助于合理评估多样化的环境胁迫对种间关系(如捕食者-猎物)的影响以及实际效应。
氮污染是水生生态系统中的潜在环境问题。它不仅可以通过城市废水排放和动物排泄含氮废物等方式直接进入水生生态系统,也可以通过污染沉积物中含氮有机物的分解而间接进入[15-17]。氨氮是水体中氮污染的主要存在形式,包括非离子氨(NH3)和离子铵(NH4+),其中NH3不带电荷,具有较高的脂溶性,能够穿透细胞膜,可对水生生物产生严重毒害作用[18-19]。根据相关报道,为了避免对鱼类等水生生物产生有害影响,养殖水体中的氨浓度不应超过0.1 mg·L-1[20]。然而,在富营养化水体中聚集的蓝藻降解会产生大量的氨,该过程使得水体中局部区域的氨浓度始终保持在很高的水平。例如,太湖蓝藻水华污染湖区的氨浓度能够达到0.2~3.4 mg·L-1,甚至在2007年无锡太湖蓝藻爆发期间,局部峰值高达12 mg·L-1,远远超过了水生生物所能承受的安全浓度范围[21]。
事实上,关于氨对水生生物的负面影响已被广泛报道。例如,氨胁迫显著影响了白对虾的非特异性免疫,并且还可能破坏其抗氧化系统的平衡[22]。长期的氨暴露不仅会严重损害淡水涡虫的行为活动,甚至会导致涡虫死亡[23]。在枝角类中,随着氨浓度升高,大型溞(Daphniamagna)性成熟和首窝产卵时间均延迟,总产卵量减少,蜕皮次数显著降低[24]。然而,目前尚不清楚氨是否会干扰枝角类对捕食风险的响应以及捕食风险是否会影响枝角类对氨胁迫的敏感性。
为此,研究选择枝角类代表性物种蚤状溞(Daphniapulex)作为受试生物,观察并测定了它们在氨和鱼类信息素联合处理条件下的各项诱导型防御指标,以期从种间关系的角度揭示氨的负面作用。笔者提出以下科学假设:(1)高浓度氨会抑制蚤状溞的诱导型生活史防御;(2)氨对蚤状溞诱导型生活史防御的抑制作用存在时间累积效应;(3)捕食风险会降低蚤状溞对氨胁迫的耐受性。
1 材料与方法
1.1 枝角类与藻类的培养
研究使用在实验室培养多年的蚤状溞克隆进行实验,该克隆采自蓝藻水华暴发期间的巢湖(30°25′ N, 117°16′ E)[25]。蚤状溞长期培养在含有1.5 mg·L-1(以C计)蛋白核小球藻(Chlorellapyrenoides,FACHB11)的COMBO培养基中,每2 d更换1次培养基并重新添加定量的食物。培养温度为25 ℃,光照强度为40 μmol· m-2·s-1,光暗比为14 h∶10 h。
蛋白核小球藻在含有2 L BG-11培养基的锥形瓶中进行无菌培养,培养条件与上述蚤状溞的培养条件相同。待藻类生长到对数期,以5 000 g离心力离心15 min收获藻细胞,随后将其储于4 ℃冰箱中冷藏保存。
1.2 氨的制备与浓度测定
实验药物为NH4Cl(CAS编号 12125-02-9,分析纯,纯度99.5%),购自 Aladdin 公司(中国上海)。实验前用无氨水配制氯化铵母液,并用纳氏试剂分光光度法(HJ 535-2009)测定其准确浓度(以N计)。根据EMERSON等[26]的方法,使用以下公式将测定得到的氯化铵母液浓度转换为氨浓度:
(1)
K=0.090 18 + 272 9.92/T。
(2)
式(1)~(2)中,A为氨质量浓度,mg·L-1;N为实际的氯化铵母液的质量浓度,包括溶解的未电离的氨和离子形式的氨,mg·L-1;K为解离常数,pKa;T为开氏温度,K。实验时按比例稀释至所需浓度。基于蓝藻爆发期间水体中的氨浓度[27],并结合水生生物的耐受浓度[23],实验共设置了5种氨质量浓度:0、0.01、0.10、0.30和0.60 mg·L-1。为了保证整个实验周期中氨浓度的稳定,每天随机取样监测浓度变化。
1.3 鱼类信息素的制备
根据现有的研究,已鉴定到的鱼类信息素的具体物质成分有5α-鲤胆甾醇硫酸酯(5α-cyprinol sulfate)[28]、鱼类表皮黏液中的氨基糖[29]以及鱼类表皮黏液中的细菌[30]等。其中,5α-鲤胆甾醇硫酸酯和鱼类表皮黏液中的细菌均已被证明能够引起枝角类的行为防御响应[28,30]。实验中所使用的能够诱导枝角类表现出生活史防御的鱼类信息素是一种产生于鱼类肠道的食物依赖型信息素,这种信息素对猎物的作用效果高度依赖于捕食者所摄入的食物与猎物的亲缘关系[31]。因此,为了体现出这种食物依赖型信息素的整体生态效应并防止其他外界因素干扰,实验使用捕食者鱼类(以蚤状溞为食)的生活滤液作为信息素,研究蚤状溞的诱导型防御响应。这种方法也是国际上关于枝角类诱导型防御研究的通用做法[32]。鱼类信息素的具体制备方法参照GU等[4]所述,挑选8只体长3~5 cm的高体鳑鲏鱼(Rhodeusocellatus),每只投喂约200只蚤状溞,喂食6 h。随后,将鳑鲏鱼转移到4 L COMBO培养基中释放信息素18 h,期间不投喂食物。为了尽可能去除能够有效降解鱼类信息素的细菌[30],使用0.22 μm孔径滤膜(Millipore,美国)过滤经鳑鲏鱼处理后的COMBO培养基。过滤后获得的鱼类信息素于-20 ℃条件下冷冻保存。正式实验时鱼类信息素添加到培养体系中的最终稀释浓度为每10 L培养基1条鱼,该浓度已被证明足够诱导枝角类产生防御响应[8]。
1.4 实验设计
为了排除母体效应并尽量减少实验个体之间的差异,随机收集同步发育的母体蚤状溞的第3代第3窝新生幼体(<12 h)用于正式实验。为了研究氨对蚤状溞经鱼类信息素诱导的反捕食防御的影响,每个氨浓度下均包含了有、无鱼类信息素2种处理。每个处理设置10个重复,每个重复包含1个新生幼体,所有实验个体均在50 mL小烧杯中单独培养。整个实验过程在25 ℃、光照强度为40 μmol·m-2·s-1、光暗比为14 h∶10 h的条件下进行。为了保证实验过程中氨浓度的稳定以及食物和信息素水平的恒定,每天更换各处理中的培养基,并提供含碳量为1.5 mg·L-1的蛋白核小球藻。蛋白核小球藻的碳含量通过元素分析仪(Vario EL Ⅲ,Elementar,德国)测定,随后建立碳含量与细胞数之间的线性关系,以确定每个蛋白核小球藻细胞的平均碳含量。根据每个细胞的碳含量,计算出质量浓度为1.5 mg·L-1时所需的细胞密度,最后计算培养获得的小球藻的总细胞数,并将其稀释至1.5 mg·L-1。
实验共持续14 d,这样的暴露时间足以显示出氨对蚤状溞的影响和蚤状溞的诱导型反捕食防御反应。实验过程中每天记录蚤状溞的生活史参数:存活数、首窝产卵时间、性成熟体长、性成熟尾刺长、第14天体长、第14天尾刺长、相对尾刺长、产卵窝数、总产卵量、平均每窝产卵量等。为了精确获得每个个体的首窝繁殖时间,在蚤状溞性成熟怀卵后,每3 h检查1次烧杯中是否出现新生幼体。将相同处理下的第1窝所有后代移出并混合在一起,随机选取10只幼体,测量体长、尾刺长等形态指标。对第3窝后代也进行相同操作。
1.5 数据分析
通过双因素方差分析(two-way ANOVA)并进行Tukey′s HSD检验,分析不同氨浓度和鱼类信息素处理对蚤状溞性成熟体长、性成熟尾刺长、第14天体长、第14天尾刺长、相对尾刺长、产卵窝数、总产卵量、幼体体长、幼体尾刺长等防御指标的影响。
相对尾刺长(LRS)的计算公式为
LRS=LS/LB。
(3)
式(3)中,LS为尾刺长,μm;LB为体长,μm。
生长速率(G)的计算公式为
G=(lnWt-lnW0)/t。
(4)
式(4)中,Wt为第t天的个体干重,μg;W0为初始干重,μg;t为天数,d。
个体干重(W)的计算公式为
lnW=lnLB×2.635-16.016。
(5)
式(5)中,W为干重,μg。
为了评估氨对鱼类信息素作用的影响,计算每个氨浓度下鱼类信息素处理组相比于对照组引起的变化百分比(R),计算公式为
(6)
式(6)中,Vt和Vc分别为蚤状溞的特定防御性状在存在和不存在鱼类信息素时的表达值。
使用以下方程评估氨对鱼类信息素诱导的蚤状溞防御性状的干扰程度(ID):
(7)
式(7)中,CN和CA分别表示蚤状溞性状在没有鱼类信息素存在时对无氨和有氨的响应情况;FN和FA分别表示蚤状溞性状在鱼类信息素存在时对无氨和有氨的响应情况。
所有数据统计分析均使用SigmaPlot 14.0软件进行。数据均表示为平均值±标准误的形式。当P<0.05 时,统计检验被认为具有显著性差异。
2 结果与分析
2.1 存活时间和生长速率
在研究所设任何氨浓度下,对照组和信息素处理组间蚤状溞的存活时间均未表现出显著差异。随着氨浓度增加,不同处理组中蚤状溞均在氨浓度为0.3或0.6 mg·L-1时出现死亡,尤其在氨浓度为0.6 mg·L-1时,对照组和信息素处理组中蚤状溞的存活时间分别降至13.4和13.2 d(图1)。就蚤状溞的生长速率而言,鱼类信息素和氨均显著降低了蚤状溞的生长速率,并存在显著的交互作用(表1)。在高浓度氨的影响下,经鱼类信息素诱导的蚤状溞生长速率的相对变化也显著减小(图2)。
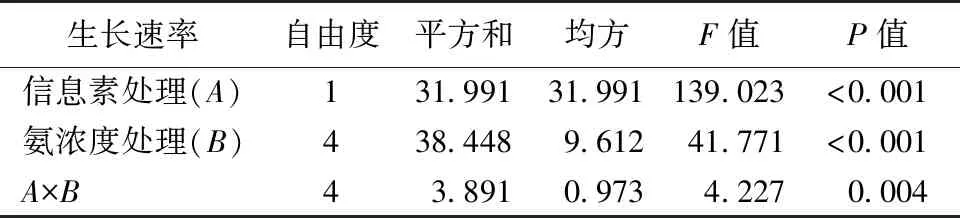
表1 鱼类信息素和氨对蚤状溞生长速率影响的双因素方差分析
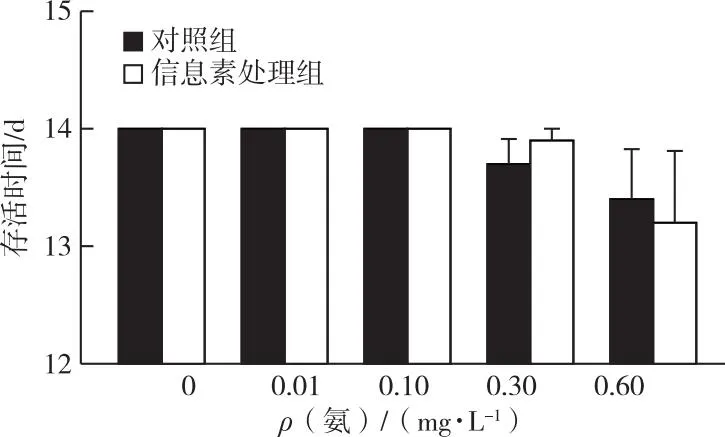
图1 不同氨浓度对蚤状溞存活时间的影响
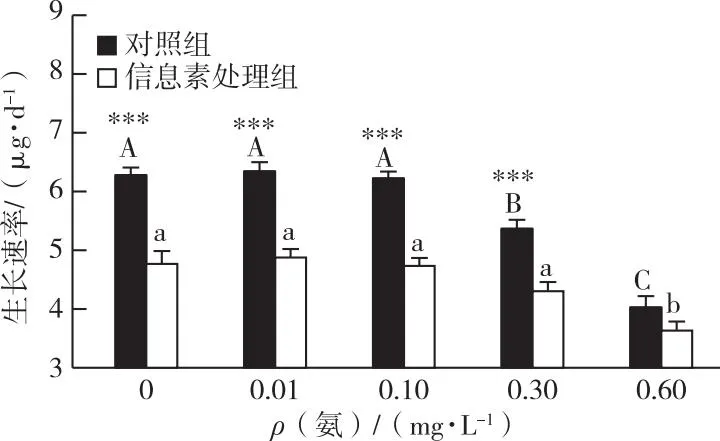
英文大写或小写字母不同分别表示不同氨浓度之间生长速率存在显著差异(P<0.05)。***表示相同氨浓度下对照组或信息素处理组之间生长速率存在显著差异(P<0.01)。
2.2 形态指标
方差分析结果表明,添加鱼类信息素显著减小了蚤状溞的性成熟体长和第14天体长、增加了性成熟尾刺长和第14天尾刺长;氨浓度的升高显著削弱了蚤状溞的性成熟体长、第14天体长、性成熟尾刺长和第14天尾刺长(表2、图3)。鱼类信息素和氨浓度处理之间无明显交互作用。值得说明的是,0.6 mg·L-1的氨浓度显著削弱了鱼类信息素诱导下蚤状溞性成熟体长和第14天体长的相对变化率,即高浓度氨显著抑制了蚤状溞体长对鱼类信息素的响应强度。
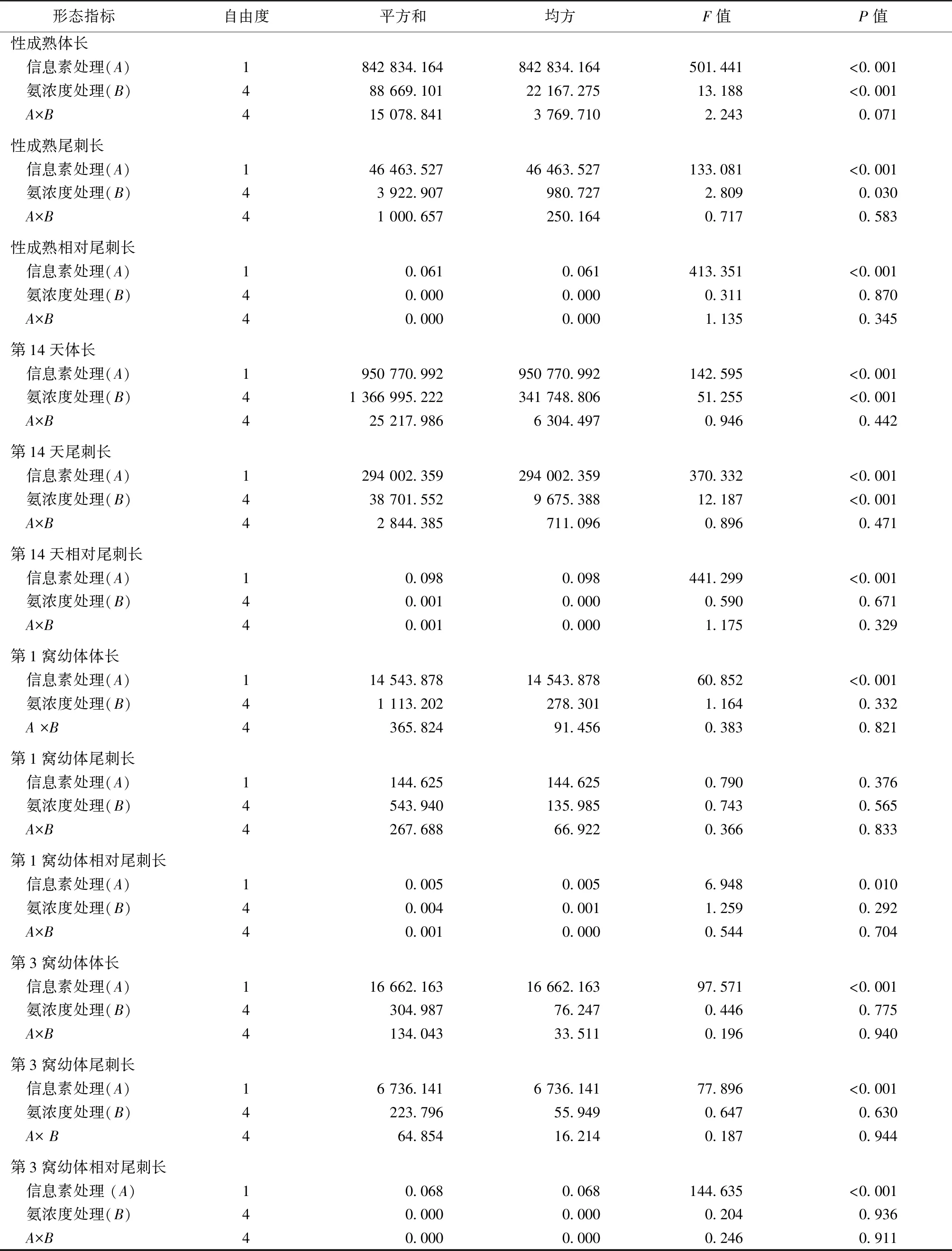
表2 鱼类信息素和氨联合对蚤状溞及其幼体形态指标影响的双因素方差分析

英文大写或小写字母不同表示不同氨浓度之间某指标存在显著差异(P<0.05)。***表示相同氨浓度下对照组和信息素处理组之间某指标存在显著差异(P<0.01)。
就蚤状溞后代的形态指标而言,鱼类信息素显著减小了蚤状溞第1窝和第3窝后代的体长,增加了第3窝后代的尾刺长和相对尾刺长;而氨浓度对蚤状溞第1窝和第3窝后代的所有形态指标均无显著影响(表2、图4)。值得说明的是,蚤状溞第1窝后代的尾刺长和相对尾刺长在有、无鱼类信息素的处理下均无显著差异。
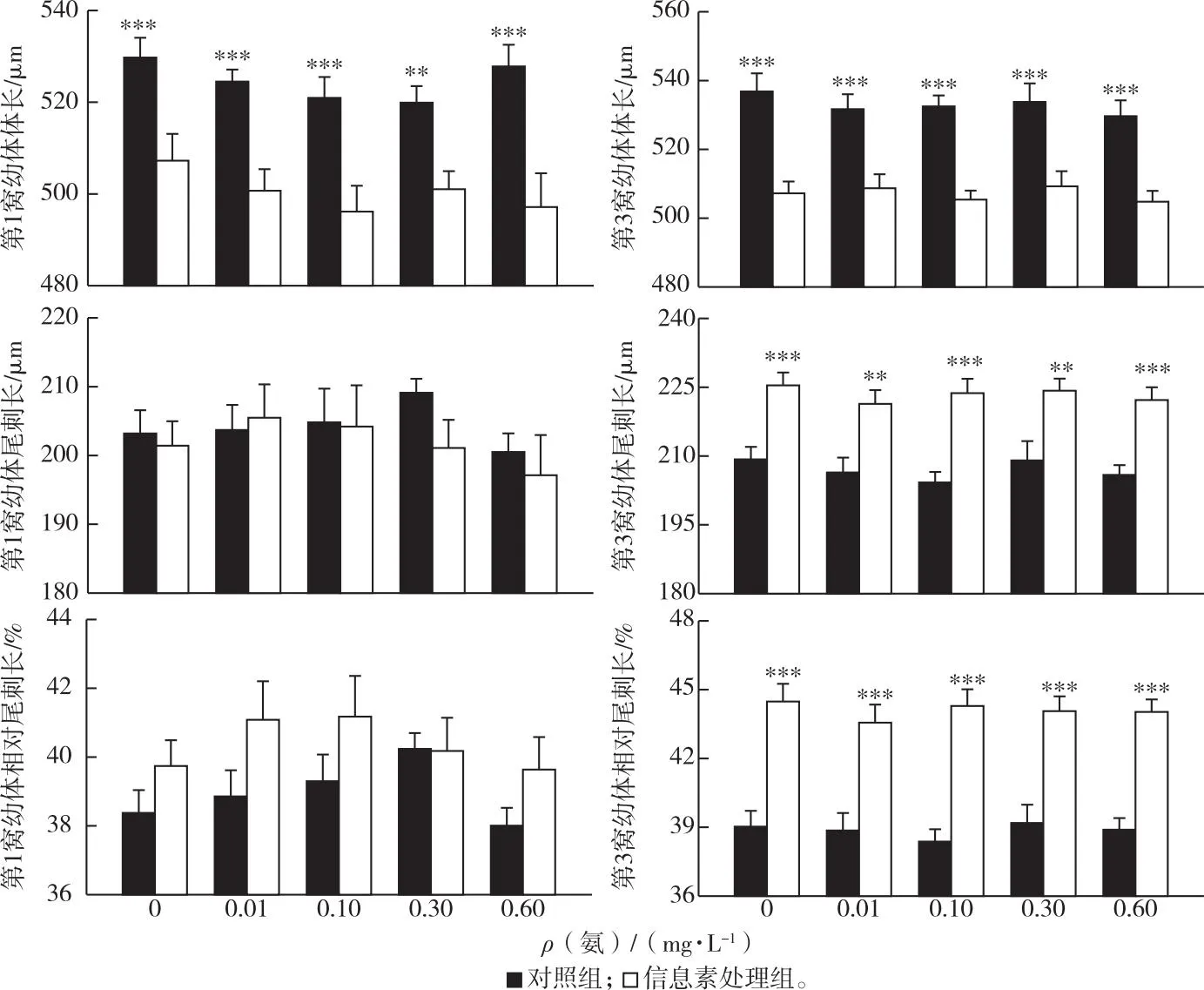
星号表示相同氨浓度下对照组和信息素处理组之间存在显著差异(***P<0.001,**P<0.01)。
2.3 繁殖指标
添加鱼类信息素显著提前了蚤状溞的首窝产卵时间,削减了平均每窝后代数和总后代数;高浓度氨显著延长了蚤状溞的首窝产卵时间,削减了产卵窝数、平均每窝后代数和总后代数(图5、表3)。鱼类信息素和氨仅对蚤状溞的总后代数存在显著的交互作用。

表3 鱼类信息素和氨浓度联合对蚤状溞繁殖指标影响的双因素方差分析
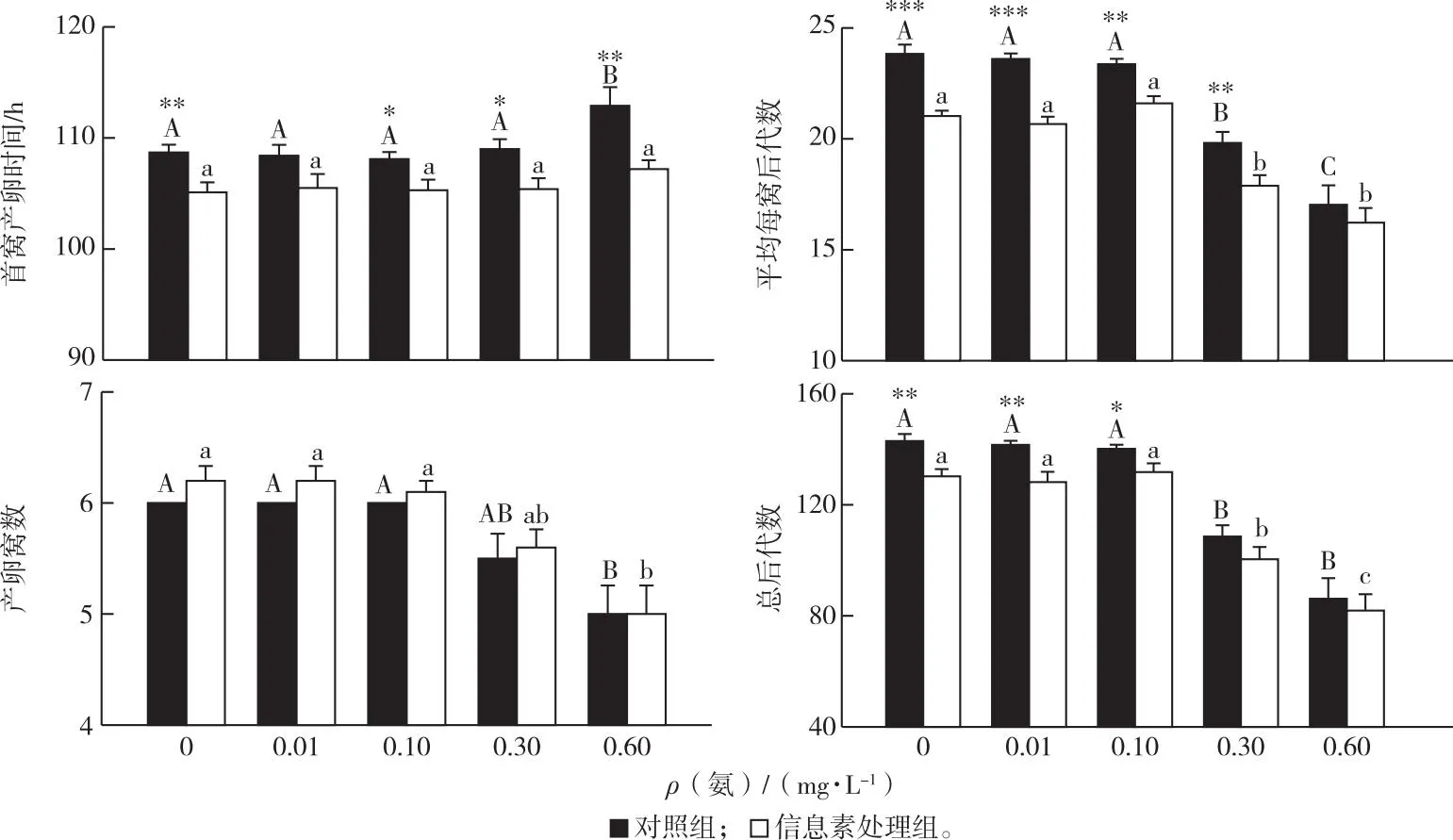
英文大写或小写字母不同表示不同氨浓度之间某指标存在显著差异(P<0.05)。星号表示相同氨浓度下对照组和信息素处理组之间某指标存在显著差异(*P<0.05,**P<0.01,***P<0.001)。
在任何氨浓度条件下,鱼类信息素处理组中蚤状溞的首窝产卵时间均显著早于对照组。随着氨浓度的增加,当氨浓度达到0.6 mg·L-1时,对照组和鱼类信息素处理组中蚤状溞的首窝产卵时间分别延迟了4.2和2.1 h。此外,随着氨浓度的升高,蚤状溞的总后代数、平均每窝后代数及产卵窝数均显著下降。当氨浓度达到0.6 mg·L-1时,对照组和鱼类信息素处理组中蚤状溞的总后代数分别降低了39.7%和42.7%,平均每窝后代数分别降低了28.5%和31.9%。
2.4 氨对防御指标的干扰程度
在鱼类信息素处理下,蚤状溞的主要防御特征表现为生长速率减缓、体长减小、尾刺长增长、相对尾刺长增加、总后代数和平均每窝后代数减少、窝数增加(图1~5)。
就表现在形态上的防御指标而言,氨对成熟时蚤状溞表现在形态上的防御指标的干扰并不显著。然而随着实验时间的延长及氨浓度的增加,蚤状溞第14天的形态防御指标受到显著干扰(图6)。总之,除了成熟时蚤状溞表现在形态上的防御指标外,随着氨浓度的增加,氨对蚤状溞其他防御指标的干扰程度均显著增强。
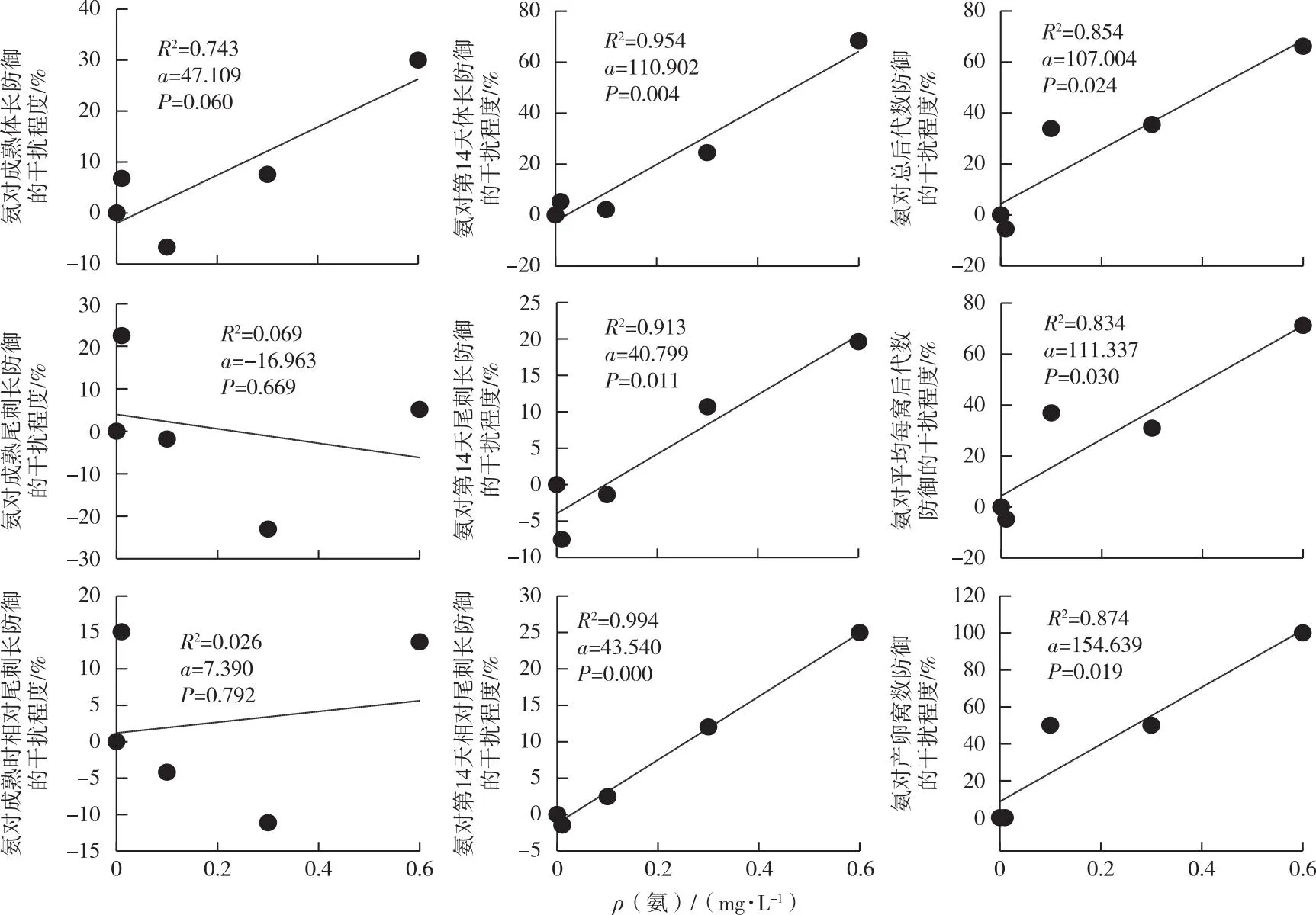
直线通过线性回归拟合,a代表拟合线的斜率。
3 讨论
氨是淡水环境中的主要污染物之一,水体中高浓度的氨会对多种水生生物产生严重毒害作用[18-19]。随着氨浓度的升高,蚤状溞响应鱼类捕食风险而表现出的体长减小、生长速率减缓、产卵提前等防御表现被明显削弱。并且随着暴露时间的延长,氨对蚤状溞及其反捕食防御特征的抑制作用加剧。此外,鱼类信息素的存在增强了高浓度氨对蚤状溞部分生活史性状(如首窝产卵时间、繁殖数量等)的不利影响。这些结果很好地支持了该研究的科学假设,即氨胁迫干扰了枝角类经捕食者信息素诱导的防御响应,同时捕食风险也降低了枝角类对氨胁迫的耐受性。
3.1 氨对蚤状溞生活史特征的影响
关于高浓度氨作用于枝角类产生的一系列生理后果已被广泛报道,包括产卵时间延迟、种群数量下降、死亡率增加等[19-21]。该研究中,高浓度氨同样延迟了蚤状溞的产卵时间、削减了蚤状溞的后代数量,还对蚤状溞的存活构成威胁。此外,随着实验时间的延长,高浓度氨显著削减了大型溞的体长,这说明氨对蚤状溞的毒性作用可能存在时间累积效应,即氨可能会通过长期慢性接触而损害枝角类的生长发育[33]。事实上,除氨以外,这种时间累积效应在其他污染物(如光污染、抗抑郁药舍曲林、微塑料等)对枝角类的毒性研究中也有报道[6]。
3.2 氨对蚤状溞诱导型生活史防御策略的影响
捕食者(如鱼类)信息素会诱导枝角类在生长和繁殖之间进行能量权衡,即削弱用于生长的能量并增加用于繁殖的能量(体型显著减小和繁殖力增加),这种权衡不仅有利于降低枝角类被视觉性捕食者鱼类发现的可能性,还有利于增加被捕食前的繁殖概率和输出[7]。然而,水体中的其他环境胁迫可能改变枝角类的能量权衡,从而干扰其经捕食者诱导的这种反捕食防御反应[34]。高浓度氨同时抑制了蚤状溞表现在生长速率、体长和繁殖数量上的防御。据报道,枝角类的繁殖指标对含氮污染物的敏感性远高于生长指标对其的敏感性[35]。因此推测在捕食风险和氨共存的情况下,枝角类可能会放弃在繁殖上过多的能量消耗,优先把能量分配给生长指标,从而干扰或抑制了枝角类表现在生长指标上的防御。这表明在自然环境中受到多重环境胁迫的枝角类为了有利于自身生存,会将能量重新投资分配给生长、繁殖,这种资源再分配会干扰它们为了适应性地应对捕食风险而表现出的资源分配权衡[5,14],从而可能导致枝角类的诱导型防御受到抑制。此外,应对压力(包括枝角类应对捕食压力)是动物消耗能量的过程,可能会影响新陈代谢。LYU等[36]的研究显示,氨可以诱导氧化应激并破坏枝角类的正常代谢,因此这也可能是氨干扰枝角类应对捕食风险响应的重要原因之一。
在鱼类信息素作用下,蚤状溞后代亦表现出明显的防御特征。值得说明的是,随着氨浓度的升高和暴露时间的延长,蚤状溞后代表现出的防御特征不仅没有被抑制和影响,反而在第3窝时后代表现出更加稳定的防御,即相比于无信息素的对照组体长显著减小,尾刺长和相对尾刺长显著增加。相反,蚤状溞母体表现出的诱导防御则随着暴露时间的延长而被高浓度氨显著抑制。一般来说,环境胁迫会降低反捕食防御带来的个体生存机会和繁殖成功率,但是一旦成功繁殖,枝角类则会以削弱自身防御为代价,通过母体效应将其长时间应对捕食风险而产生的防御更好地传递给后代[7,37],以增强后代应对捕食风险的能力[10]。
3.3 捕食风险对枝角类耐受氨胁迫的影响
该研究中,在高浓度氨胁迫下蚤状溞的繁殖特征受到明显抑制,其中鱼类信息素处理组中蚤状溞总后代数和每窝后代数的削减率(42.7%和31.9%)均高于对照组(39.7%和28.5%)。不仅如此,高浓度氨下鱼类信息素处理组中蚤状溞的平均存活时间缩短至13.2 d,而对照组则缩短至13.4 d,这表明经鱼类信息素诱导后形成反捕食防御的枝角类更容易受到环境压力的胁迫。事实上,早在20世纪90年代就有研究报道幽蚊幼虫释放的化学物质能够降低枝角类(Daphniaambigua)对环境胁迫(如高温、食物短缺、低溶氧等)的耐受性[38]。近年来,YIN等[39]亦研究发现,暴露于捕食风险的盔形溞更容易受到随后的寄生虫感染。一方面,捕食者诱导的防御会改变猎物的能量分配和消耗能量[34],由此可以预期在捕食风险下枝角类耐受其他环境胁迫的能力会减弱。另一方面,捕食者暴露会削弱猎物的免疫反应[40],从而增加猎物对环境胁迫和病原体的易感性。总之,投资防御威胁生命的捕食者会降低枝角类对环境胁迫的耐受。
4 结论
综上所述,随着暴露时间的增加,高浓度的氨不仅能够改变蚤状溞的生长和繁殖特性、抑制蚤状溞响应捕食风险的能力,同时捕食风险下的蚤状溞也会反过来削弱蚤状溞对高浓度氨的耐受性。捕食风险下枝角类耐受环境胁迫(如高浓度氨)的能力降低,这可能会加速环境胁迫对枝角类反捕食防御的抑制作用,增加其防御特征被削弱的程度,从而进一步增加枝角类被捕食的风险,最终影响湖泊中枝角类的种群稳态。该研究不仅促进了对枝角类如何在环境胁迫下响应捕食风险的理解,而且为捕食风险如何改变枝角类对环境胁迫的耐受性提供了新的见解。
