施硅提高玉米抗蚜性的组成型和诱导型生理代谢机制
2021-10-24戚秀秀刘艺凝韩燕来
戚秀秀,刘艺凝,魏 畅,王 祎,姜 瑛,韩燕来
(河南农业大学资源与环境学院,河南郑州 450002)
玉米是我国第一大粮食作物,其产量和质量安全在农业生产中占有重要地位。近年来,随着全球温度上升,玉米病虫害不断加剧,严重影响了玉米的产量和品质[1],其中蚜虫是我国夏播玉米的主要害虫之一[2]。常见的玉米蚜虫有玉米蚜 (Rhopalosiphum maidis)、禾谷缢管蚜 (Rhopalosiphum padi)、荻草谷网蚜 (Macrosiphum miscanthi) 和麦二叉蚜 (Schizaphis graminum),其中禾谷缢管蚜是危害玉米最为严重的种群[3]。蚜虫体型小,具有繁殖快、适应性强、世代重叠等生物学特性[4],一方面以成、若虫刺吸植株汁液,在其表皮造成轻微的创伤,直接影响玉米的生长发育;另一方面在叶片上分泌蜜露污染茎叶,形成霉污,导致玉米抽穗后玉米的花粉成熟受阻,影响植株光合作用和授粉质量,同时传播玉米病毒等,间接造成玉米产量和品质下降[5-6]。目前蚜虫防治的主要方法是化学防治,但随着农药的大量使用,不仅导致蚜虫的抗药性增加,农药残留也会导致食品安全问题。因此,寻找一种绿色高效的蚜虫防治方法是当前解决蚜虫危害的热点之一。
实际上,植株与植物病虫害的长期协同进化过程中,形成了多种有效的防御响应机制,其中包括组成型防御和诱导型防御机制[7-9]。组成型防御机制是植物本身存在的一种防御机制,包括物理和化学防御,研究发现叶片上茸毛的密度、蜡质含量、叶片的颜色、叶表皮层厚度、叶肉细胞排列紧密程度、pH、渗透压等都会影响蚜虫取食和繁殖[10-13],抗麦长管蚜的小麦品种在分蘖期、茎伸长期和旗叶发育期具有较高的组成型PAL、PPO和POD活性[14]。诱导型防御机制是植物在受到病虫害危害的过程中,发展出一系列可精密调控的防御机制[15]。研究表明当植物受到蚜虫侵害时,植物体内的活性氧 (ROS)水平上升,活性氧代谢系统的平衡会被打破,体内膜脂过氧化和膜脂脱脂作用被启动,从而破坏膜结构[16-19],而超氧化物歧化酶 (SOD)、过氧化氢酶(CAT) 等抗氧化酶能有效地去除植物体内过量的ROS,减少ROS自由基对生物体的伤害[20-21]。同时ROS作为一种信号物质还能够诱导植物部分防御酶和激素介导的防御反应下游基因大量上调,激活JA和SA防御信号反应途径[7,22-23],改变植物体内的苯丙氨酸解氨酶 (PAL)、脂氧合酶 (LOX) 和多酚氧化酶 (PPO) 等防御酶活性[14,24],提高植物体内次生防御物质 (如酚类、木质素等) 的含量[25-26],增强植物的抗性。研究发现,蚜虫取食诱导后,不同抗性水平的植株体内PPO、过氧化物酶(POD)及PAL的酶活性增加[27]。此外,多种农业防治措施能够改变植物体内防御物质,提高其对昆虫的防御能力。前人通过在作物上施入N、P、K、Si 等元素来提高作物体内的防御物质含量[28-29],研究发现,施钾能够降低小麦组成型游离氨基酸、诱导型游离氨基酸和可溶性蛋白的积累,提高诱导型可溶性糖的积累,共同降低小麦苗期麦长管蚜密度[30],氮能够提高超氧化物歧化酶 (SOD)、过氧化物酶 (POD) 和过氧化氢酶(CAT) 活性,有效抑制蚜虫的繁殖[31]。
硅是地壳中的第二大元素,以许多有益的方式影响植物的生理生化,如促进植物的生长发育,提升作物品质,降低植物的生物和非生物胁迫[32-34]。前人已经做了很多关于施硅通过改变植物代谢途径,提高植物抗性的研究[35-36]。研究表明,施硅和病虫害侵染均能够诱导SA、JA信号传导途径,提高植物体内防御酶活性和次生代谢物质[37],激活植物的诱导型防御机制。研究表明在单子叶和双子叶植物中,植物体内硅含量与抗虫性呈正相关[38]。外源硅能提高玉米的抗虫性[39],调控油菜体内防御酶活性和基础代谢,提高油菜抗虫性[40];氮硅配施能够提高小麦叶片和穗部可溶性糖、总酚和单宁的含量,降低蚜虫的种群数量[41]。可溶性硅可作为第二信使、防御反应调节剂或启动剂[42-43],参与植物体内生理代谢活动,诱导植物激素信号传导,调节抗氧化酶活性,降低活性氧含量[44-46],同时诱导类黄酮、木质素、酚类化合物和植物抗毒素的积累[46-48],提高植物的抗虫性。然而从玉米组成型和诱导型抗氧化系统、次生代谢和信号传导三方面探究施硅提高玉米抗蚜性的研究还鲜有报道。
本研究从抗氧化系统、次生代谢和信号传导方面探究施硅对增强玉米组成型和诱导型抗性的生理生化机制,进一步明确施硅提高玉米抗蚜性的内在机理。
1 材料与方法
1.1 试验材料
1.1.1 玉米品种 供试玉米品种为郑单958,将玉米种子挑选、清洗后,用10%的双氧水消毒30 min,蒸馏水洗涤干净,室内浸泡24 h,25℃催芽。将萌发状况相同的玉米,移栽到塑料盆中,在光照培养室中培养,待用。
1.1.2 蚜虫 供试蚜虫为禾谷缢管蚜 (Rhopalosiphumpadi),饲养设定温度为20℃,相对湿度为70%,光照 (LED灯) 周期为L∶D = 14∶10,光强为3000 lx。选择大小和日龄相同的无翅成虫用于试验。
1.1.3 营养液制备 供试营养液为Hoagland营养液:Ca(NO3)2·4H2O 472.3 mg/L、K2SO4130.6 mg/L、MgSO4·7H2O 160.2 mg/L、KCl 7.455 mg/L、KH2PO440.8 mg/L、K2HPO4·3H2O 5.7 mg/L、FeSO4·7H2O 27.9 mg/L、Na2EDTA 37.22 mg/L、NaFeEDTA 44.21 mg/L、H3BO30.06183 mg/L、MnSO4·H2O 0.16901 mg/L、ZnSO4·7H2O 0.2875 mg/L、CuSO4·5H2O 0.02497 mg/L、(NH4)6MoO2·H2O 6.179 mg/L、CaCl2211.9 mg/L。
1.1.4 硅试剂的制备 供试硅试剂为硅酸四乙酯,首先将4 mL无水乙醇与190 mL 蒸馏水充分搅拌0.5 h,将0.1344 mL硅酸四乙酯 (TEOS)、4 mL无水乙醇以及 2 mL吐温80的混合液缓缓滴入,充分搅拌2 h,配制成总体积为200 mL的硅制剂。
1.2 试验设计
试验于2019年5月6—30日在河南农业大学光照培养室进行,采用水培试验,设置不施硅不接蚜虫 (-Si-A)、不施硅接蚜虫 (-Si+A)、施硅不接蚜虫(+Si-A)、施硅接蚜虫 (+Si+A) 4个处理,每个处理在玉米两叶一心、三叶一心时分别喷施200 mL的硅制剂,每个处理重复3次,每盆留1株苗。于玉米四叶一心时使用毛笔将无翅成虫接到玉米叶片上,每株玉米接30头蚜虫,为防止蚜虫从接虫植株上迁出,用上端开口的玻璃纸罩将植株罩住,开口处再盖上用0.178 mm (80目) 的尼龙做成的盖子。于温度为24℃,相对湿度为70%,光照 (LED灯) 周期为L∶D = 14∶10,光强为3000 lx的光照培养室内培养。
分别在蚜虫侵染后48、60、72、96、120 h时对蚜虫密度进行统计,同时对玉米植株进行动态取样。
1.3 测定指标与方法
1.3.1 酶活性以及过氧化氢、丙二醛含量测定 将收集到的鲜样放入预冷过的瓷研钵中,进行液氮研磨。称取约0.1 g研磨好的植株鲜样,加入1 mL提取液,进行冰浴匀浆,8000 × g、4℃离心10 min,取上清液,置于冰上待测。
超氧化物歧化酶 (SOD) 采用 NBT 还原法[49],在黄嘌呤氧化酶藕联反应体系中抑制百分率为50%时,每mL反应体系中的超氧化物歧化酶活力定义为一个酶活力单位 (U);多酚氧化酶 (LOX)[50]、脂氧合酶 (PPO)[51]、苯丙氨酸解氨酶 (PAL)[52]采用紫外分光光度法,以每g组织每mL反应体系中每min吸光值变化0.01个单位为一个酶活力 (U) 单位表示,单位均为U/g, FW;过氧化氢酶 (CAT) 采用愈创木酚法[52],以每g组织每min催化1 μmol过氧化氢降解为一个酶活力单位表示,单位为μmol/(g·min), FW;丙二醛 (MDA) 含量测定参照赵世杰等[53]的测定方法,单位为nmol/g, FW,过氧化氢 (H2O2) 含量测定参照Gong等[54]的测定方法,单位为ng/g, FW。
1.3.2 木质素以及信号传导物质含量测定 木质素含量测定:小麦叶片在95%乙醇和适量石英砂研钵中,研磨至匀浆转移到离心管中13860 × g下离心5 min,倒出上清液,95%乙醇清洗沉淀物3次,乙醇∶正己烷 = 1∶2 (v∶v) 冲洗2次,收集沉淀物使其自然干燥,加入2 mL乙酰溴∶乙酸 = 1∶3 (v∶v)70℃水浴加热30 min,使沉淀溶解,冷却后加入0.9 mL氢氧化钠 (2 mol/L) 和0.1 mL羟胺盐酸 (7.5 mol/L),用乙酸定容至10 mL。在13860 × g离心5 min后,在280 nm (A280) 处测量上清液的吸光度,单位为 ng/g, FW[55]。
茉莉酸(JA)含量通过GC-MS-SIM测定[56]。用丙酮和50 mmol/L柠檬酸 (70:30,v/v) 溶液提取0.5 g干燥样品,离心取上清,并用10 mL乙醚萃取3次。[9, 10-2H2]-JA (20 ng) 作为内标。用10 mL乙醚和乙酸 (98:2,v/v) 洗脱JAs (内源性JA和内标物)。蒸发溶剂并用过量重氮甲烷醚化残余物后,用二氯甲烷将样品调节至50 mL,采用GC-MS-SIM对提取物进行分析,单位为mg/g, FW。
水杨酸(S A)含量采用高效液相色谱法(HPLC)[57]测定。用90%和100%甲醇依次提取0.2 g冻干样品。两种提取物都在真空中干燥。加入2.5 mL 5% 三氯乙酸,并用乙酸乙酯/环戊烷/异丙醇 (49.5∶49.5∶1,v∶v) 分离上清液。将顶层转移到4 mL小瓶中并用纯化氮气干燥。将SA再次悬浮于1 mL 70%甲醇中并通过HPLC进行分析,单位为mg/g, FW。
1.4 数据处理
玉米组成型抗性为不接蚜虫处理所测得的指标含量;诱导型抗性为接虫处理下指标含量与不接虫处理下指标含量的差值。采用 Microsoft Office 2010、SPSS 23.0 和Metabo Analyst进行数据的统计和分析,Origin 6.0作图,单因素方差分析采用LSD法检验处理间的差异显著性 (P < 0.05为差异显著),相关性采用Pearson相关性分析,施硅、蚜虫侵染、侵染后时间的交互作用采用三因素方差分析。
2 结果与分析
2.1 施硅对蚜虫种群密度的影响
由表1可知,随着时间的推移,蚜虫种群密度逐渐增加,不施硅处理下,接虫后60、72、96、120 h蚜虫数量分别比接虫后48 h时显著增加了12.50%、16.96%、27.68%、40.18%;施硅处理下,分别显著增加了12.36%、19.66%、35.95%、49.44%。在同一时间点,施硅处理的蚜虫种群密度均显著低于不施硅处理,在接虫后48~120 h时间段显著降低了15.29%~20.64%,其中在接虫后60 h时降低幅度最大,为20.64%。

表1 施硅对蚜虫种群密度的影响Table 1 Effects of Si application on the population density of aphids
2.2 施硅对玉米抗氧化系统中组成型抗性与诱导型抗性的影响
由表2可知,施硅、蚜虫侵染与侵染后时间三者的交互作用显著影响了玉米体内SOD、CAT活性、H2O2和MDA含量。如果将不接虫玉米体内的抗氧化物质含量和相关酶活性定义为组成型抗性,接虫前后抗氧化物质含量和酶活性的差值即可视为诱导性抗性。在培养各时间点,与不施硅处理相比,施硅均可提高玉米体内组成型CAT、SOD活性,增幅分别为24.91%~66.27%、30.70%~45.71%;降低了组成型H2O2和MDA含量,降幅分别为4.41%~15.35%、5.35%~17.95%;施硅使诱导型SOD活性显著降低了54.89%~74.44%,诱导型CAT活性在侵染后60、96和120 h分别显著增加了73.84%、60.66%和128.86%,诱导型H2O2含量显著降低 (除侵染后60 h显著升高外),诱导型MDA含量先增加后降低,在各时间点差异性不显著。在同一培养时间点,无论是否施硅,组成型SOD、CAT活性、H2O2和MDA含量均显著高于诱导型。

表2 施硅及蚜虫侵染对玉米体内抗氧化物质含量及相关酶活性的影响Table 2 Antioxidant substance contents and related enzyme activities in maize as affected by Si application and aphid infestation
2.3 施硅对次生代谢中玉米组成型抗性与诱导型抗性的影响
由表3可知,施硅、蚜虫侵染与侵染后时间三者的交互作用显著影响了玉米体内PAL、LOX、PPO活性和木质素含量。在整个培养期间,施硅条件下的组成型PAL、LOX、PPO活性和木质素含量高于不施硅处理,分别增加了7.05%~16.26%、12.13%~55.88%、0.41%~12.27%和1.92%~46.78%,其中除侵染后96 h的LOX活性和侵染后48 h的木质素含量外,其他时间点均达到显著水平,且组成型PAL活性的增幅先降低后增加,组成型LOX活性增幅先增加后降低,侵染后60 h组成型PPO活性和侵染后96 h组成型木质素含量的增幅最大;与不施硅处理相比,施硅处理下诱导型PAL活性先升高后降低,诱导型PPO和木质素含量降低,分别降低了64.43%~92.50%、3.18%~90.80%,其中除侵染后48 h诱导型木质素含量外,其它时间点均达到显著水平,诱导型LOX活性除侵染后72和96 h外均降低,且在各个时间点均达到显著水平。在同一培养时间点,无论是否施硅,组成型PAL、LOX、PPO活性和木质素含量均显著高于诱导型。

表3 施硅及蚜虫侵染对玉米体内次生代谢物质及相关酶活性的影响Table 3 Secondary metabolites and related enzyme activities in maize as affected by Si application and aphid infestation

续表3 Table 3 continued
2.4 施硅对信号传导中玉米组成型与诱导型抗性的影响
由表4可知,施硅、蚜虫侵染与侵染后时间三者的交互作用显著影响了玉米体内JA和SA含量。在整个培养时间内,与不施硅处理相比,施硅处理均提高了组成型JA和SA含量,分别显著增加了0.12%~29.47%、4.62%~19.55%,且组成型JA含量的增幅先增加后降低,SA含量的增幅先降低后增加,两者增幅呈现相反的趋势;施硅处理可降低诱导型JA含量,显著降低了29.57%~94.54%,显著增加了43.77%~117.48%的诱导型SA含量,且在各时间点均达到显著水平。在同一培养时间点,无论是否施硅,组成型JA和SA含量均显著高于诱导型。
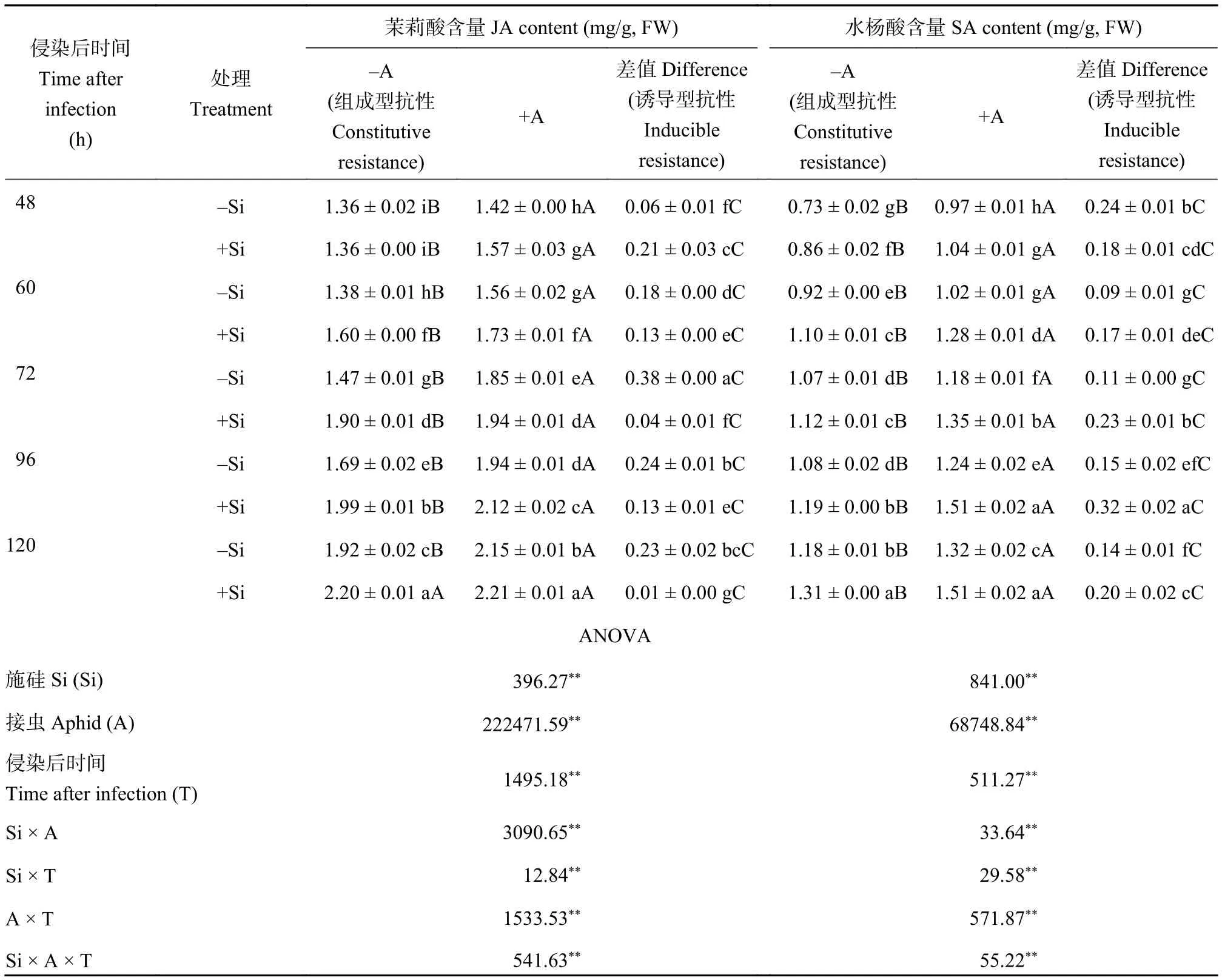
表4 施硅及蚜虫侵染对玉米体内信号传导物质的影响Table 4 Signal transduction substances in maize as affected by Si application and aphid infestation
2.5 玉米体内组成型和诱导型抗氧化物质、次生物质和信号传导物质的主成分分析
通过主成分分析 (PCA),探究施硅对玉米体内组成型和诱导型抗氧化物质及其酶活性、次生代谢物质及其酶活性和信号转导物质分布的影响。主成分分析结果 (图1A) 显示,PC1和PC2对总方差的贡献分别为86.0%和3.8%。PCA图显示对照组和处理组之间指标的分离情况,除48 h的施硅和不施硅处理外,其余时间点下的不同处理均被PC2显著分离,侵染后120 h施硅处理被PC1显著分离。此外,玉米体内组成型CAT活性和MDA含量以及诱导型PPO活性、MDA、木质素和SA含量对PC1和PC2均有显著影响 (图1B),诱导型PAL活性和H2O2含量对PC1影响显著。组成型和诱导型SOD活性、组成型LOX活性、H2O2和木质素含量、诱导型CAT活性以及蚜虫数量显著影响了PC2,其中对主成分贡献最大的为组成型和诱导型CAT、SOD活性和诱导型H2O2、SA含量。
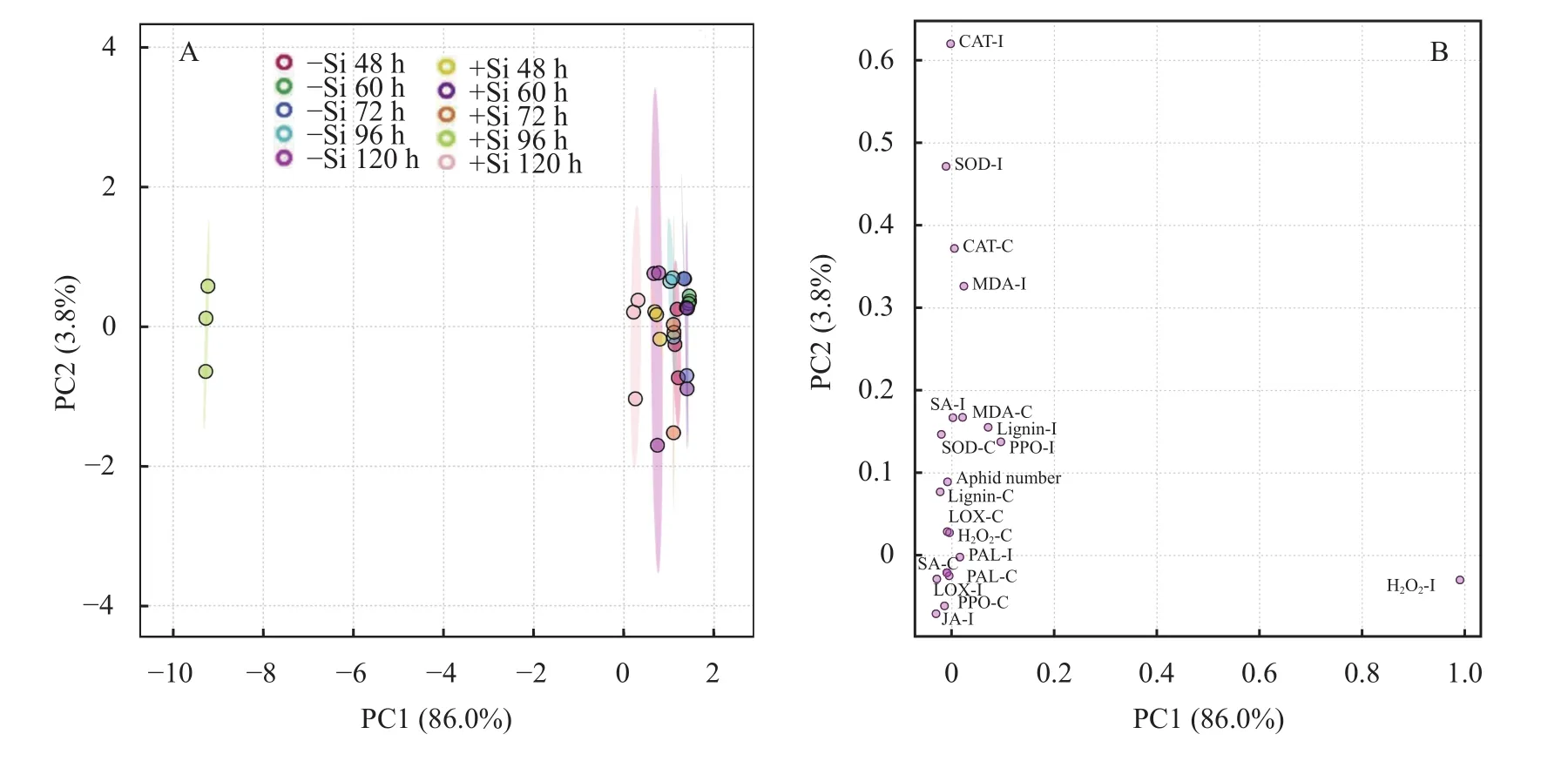
图1 硅诱导玉米组成型抗性和诱导型抗性中防御酶活性、次生代谢产物和信号转导物质变化的主成分分析 (PCA)Fig. 1 Principal component analysis (PCA) of Si induced variation in the defense enzymes activity, secondary metabolites and signal transduction substances of maize
2.6 施硅对玉米体内组成型和诱导型各指标的相关性分析
相关性分析结果 (图2、表5)表明,在蚜虫侵染后的48、60、96和120 h,蚜虫种群密度与玉米抗氧化系统中组成型CAT、SOD活性呈显著性负相关,与组成型H2O2和MDA含量呈正相关,且均在侵染后60和96 h时达到显著水平,与侵染后60、96和120 h时诱导型CAT活性呈显著性负相关,与诱导型SOD活性和H2O2含量呈正相关,且均在侵染后48、60、96和120 h时达到显著水平;次生代谢中,蚜虫的种群密度除侵染后72 h外与组成型和诱导型PAL活性、组成型PPO活性、侵染后48、60、120 h组成型LOX活性、侵染后60、96和120 h木质素含量呈显著性负相关,与侵染后60~120 h诱导型PPO活性和木质素含量、侵染后48、60、120 h LOX活性呈显著正相关,与侵染后48 h诱导型PPO活性、侵染后72、96 h LOX活性呈显著负相关;在蚜虫侵染后的各时间点与信号传导中组成型JA和SA呈负相关,与除侵染后48 h以外的其它时间点的诱导型JA含量呈显著性负相关,与诱导型SA呈显著性正相关。

表5 蚜虫侵染后不同时间各指标组成型、诱导型抗性与蚜虫密度相关性分析Table 5 Correlation of the resistance of measured items with the aphid population density at different time after aphid infestation

图2 硅诱导玉米组成型抗性 (C) 和诱导型抗性 (I) 中防御酶活性、次生代谢产物和信号传导物质的聚类分析Fig. 2 Analysis of Si induced variation in the defense enzymes activity, secondary metabolites and signal transduction substances of maize by cluster analysis
蚜虫种群密度与组成型CAT、SOD、PAL、PPO、LOX活性和木质素、JA、SA含量呈负相关,与组成型H2O2、MDA含量呈正相关,与诱导型CAT、侵染后60 h SOD、侵染后48 和72 h PAL活性、侵染后72和96 h LOX活性、除侵染后48 h外JA含量、侵染后48 h PPO活性和SA含量呈显著负相关,与诱导型SOD活性、H2O2、MDA含量、侵染后96和120 h PAL活性、侵染后60~120 h PPO活性、木质素、SA含量、侵染后48、60和120 h LOX活性、侵染后48 h JA含量呈显著正相关。
3 讨论
植物的抗性包括植物本身产生的组成型抗性和病虫害侵染后所表现出来的诱导型抗性[7]。植物的组成型抗性是植物体内固有的,跟自身基因型有关,具有全株性,贯穿植物一生并始终起作用[58-59],而诱导型抗性是对环境变化的一种应激反应,具有明显的时空效应,根据危害的部位可以分为局部性和全株性[60],根据危害时间的长短可分为快速诱导反应和慢速诱导反应,快速诱导反应是当植物被病虫危害时立即被激活,慢速诱导反应需要较长时间的虫害诱导才被激活,虽然反应时间缓慢但能维持较长时间,并抵御后来昆虫的袭击[15]。
研究表明,施硅能够降低昆虫的取食和发育,增强植物对植食性昆虫的抗性[35],与本研究结果中施硅能够降低蚜虫的种群密度相一致。前人在甘蓝和水稻上研究发现施硅能够降低蚜虫的取食以及内禀增长率和净生长率[36,61],进一步证明了施硅能够降低蚜虫的种群密度,提高农作物的抗蚜性。随着侵染后时间的延长,施硅处理下蚜虫增长的速度小于不施硅处理。可能是因为玉米叶片表面喷施硅,使叶表黏附了很多细密的硅颗粒,这些硅颗粒使玉米表皮角质层形成硅质化细胞提高茎叶的硬度,降低了玉米叶的适口性,从而有效抑制蚜虫的生长繁殖,蚜虫生殖能力下降,也可能与二氧化硅诱导植株表皮或叶肉释放抗虫化学物质有关[39-48]。
本研究结果表明,施硅提高了玉米体内组成型SOD、CAT活性、诱导型CAT活性,与前人在水稻上研究发现的施硅能够提高水稻体内CAT和SOD活性的结果相类似[62],但降低了诱导型SOD活性、组成型H2O2和MDA的含量,诱导型H2O2和MDA含量先升高后降低。MDA作为脂质过氧化主要物质之一,能与细胞内各种成分发生反应,导致蛋白质、核酸、糖和膜脂分子的氧化破坏[63],其含量常被作为脂质过氧化程度的重要指标[64],蚜虫侵染导致玉米体内活性氧 (ROS) 含量升高,脂质氧化水平上升,其中 SOD 可歧化 O2·产生H2O2,导致前期MDA和H2O2含量增加,氧化代谢失衡,诱导玉米自身产生诱导型抗性,同时硅可通过调节玉米体内代谢,影响抗氧化酶活性[65],CAT可清除过量H2O2,避免其对玉米产生毒害[17-19],提高玉米的抗性。本试验相关性分析表明,蚜虫密度与组成型和诱导型CAT和组成型SOD活性呈显著负相关,与诱导型SOD活性、组成型和诱导型H2O2、MDA的含量呈显著性正相关,这与在茄子[66]和小麦[67]上的研究结果相类似。同时本研究结果还发现,在同一培养时间,无论是否施硅,诱导型防御酶活性、H2O2、MDA、木质素、JA和SA含量均显著低于组成型,可能是因为本研究先进行施硅处理,硅通过叶片喷施,迅速形成多硅酸复合物在叶面沉积,同时硅作为防御反应调节剂或启动剂[42],率先启动玉米组成型中的物理和化学防御,当蚜虫开始侵染时,组成型抗性作为防御的第一道屏障进行防御的同时,诱导型抗性中的快速诱导物质也开始进行防御,随着时间的延长,蚜虫的种群密度增加,慢速诱导反应逐渐被激活[15],但仍以组成型抗性为主。
Ye等[48]研究发现,蚜虫生殖能力下降可能与二氧化硅诱导植株表皮或叶肉释放抗虫化学物质有关。本研究通过对次生代谢相关酶活性和木质素含量进行分析发现,施硅能提高玉米体内组成型PPO、PAL、LOX和木质素含量,这与前人的研究[68-70]相一致。PAL和PPO作为大多数酚类物质的关键酶,可以催化木质素的形成[71],促进细胞壁和组织的木质化,增加植物体的硬度,降低昆虫的消化率[72-73]。LOX作为植物诱导的防御物质,是活性氧的来源之一,以非酶促方式启动膜脂质过氧化,促进脂氧化反应及其相关防卫基因的表达[74]。相关研究发现,硅与芳香族代谢中的关键酶 (PAL)、木质素和其他细胞壁成分具有相关性[28-75]。本相关性研究表明,蚜虫密度与侵染后48、60、96、120 h组成型防御酶活性、木质素含量和侵染后48 h诱导型PAL、PPO活性、侵染后72 h PAL、LOX活性、侵染后96 h LOX活性呈显著性负相关,与侵染后96、120 h诱导型PAL、侵染后60~120 h诱导型PPO活性和木质素含量以及除侵染后72、96 h外的LOX活性呈显著性正相关。组成型次生代谢物质和侵染后72、96 h诱导型LOX活性与吕敏[76]等的研究发现,蚜虫侵染能够提高LOX活性的结果相类似,而侵染后96、120 h诱导型PAL、侵染后60~120 h PPO活性和木质素含量所表现出的正相关,可能是因为组成型抗性是植物的固有特性,是植物在遭受侵害前就己存在的抗性,且贯穿植物的一生[15,77],能够迅速对蚜虫取食做出反应,且不同的物质对蚜虫侵染所做出反应的时间段有一定的差异[78],随着蚜虫密度的增加,组成型抗性作为第一道防线被攻破,诱导反应被激活,从而提高诱导型防御酶活性。在蚜虫侵染后48 h时,施硅处理下的诱导型PAL和PPO活性显著高于不施硅处理,研究发现可溶性硅可作为第二信使、防御反应调节剂或启动剂,启动信号传导途径,调控植物体内PAL、PPO、CAT等防御酶活性、木质素和酚类化合物等的含量[42,79]。在整个培养时间内,施硅降低了诱导型PPO活性和木质素含量,诱导型PAL活性先升高后降低,而LOX活性则呈现出先降低后升高随后又降低的趋势。当玉米在感应到蚜虫的侵染时,不同的物质对蚜虫侵染所做出反应的时间段有一定的差异[78],快速诱导物质在蚜虫侵染时被激活,活性或含量随之增加,如本研究中的诱导型PAL活性;随着侵染后时间的延长,慢速诱导物质被激活,活性或含量开始升高[15],如本研究中的诱导型LOX活性,但诱导型PPO活性和木质素含量在整个培养时间内均呈降低趋势,可能是因为该防御物质主要以组成型为主,且不同的物质对蚜虫侵染所做出反应的灵敏度也有一定的差异[78]。
研究发现,在植物与蚜虫的互作中,植物通过激活茉莉酸 (JA) 和水杨酸 (SA) 途径的拮抗或协同交互作用来激活植物对蚜虫的防御[80-82]。本试验相关性研究表明,组成型SA、JA含量和诱导型SA含量与蚜虫密度呈显著性负相关,诱导型JA含量与蚜虫密度呈显著性正相关,且与不施硅处理相比,施硅处理提高组成型JA含量、组成型和诱导型SA含量,降低诱导型JA含量,可能是施硅诱导了玉米体内组成型和诱导型SA途径的传导,对组成型JA和诱导型JA途径产生了协同或拮抗作用,在植物与蚜虫互作中发现,水杨酸途径的相关基因被激活,而茉莉酸途径的相关基因被抑制[83],但在苜蓿中发现,蓝绿蚜侵染会诱导水杨酸途径与茉莉酸途径相关的基因同时表达[84],这与Bonnet等[85]发现的SA和JA信号传导通路之间可能会发生拮抗或协同交互作用,其中一条通路的诱导会对其他通路产生积极或消极的调节作用的结果相一致。此外,SA是植物体内普遍存在的内源信号分子之一,能诱导植物对蚜虫等植食性昆虫产生防御反应[86],SA和JA在生成的过程中会产生对蚜虫有很强毒害作用的次生代谢物质 (如单宁、总酚、黄酮等)[79,87]。
4 结论
施硅可通过增强玉米体内组成型和诱导型JA和SA之间的协同和拮抗作用,激活信号传导途径,提高玉米抗氧化系统中组成型CAT和SOD活性、次生代谢系统中组成型次生防御物质含量及其相关酶活性,降低抗氧化系统中组成型H2O2和MDA含量,调控抗氧化系统中快速诱导反应的诱导型CAT、慢速诱导反应的诱导型SOD活性、次生代谢系统中慢速诱导反应的诱导型PPO活性和木质素含量,共同降低蚜虫的种群密度,其中组成型和诱导型CAT、SOD活性和诱导型H2O2、SA指标贡献性最高,共同揭示施硅提高玉米抗蚜性的组成型和诱导型生理代谢机制。
