形态动力学联合减数分裂纺锤体观测在卵裂期胚胎筛选中的应用
2024-03-01郑爱燕蒲艳孟庆霞王玮廖桂芝李红丁洁
郑爱燕,蒲艳,孟庆霞,王玮,廖桂芝,李红,丁洁
(南京医科大学姑苏学院,南京医科大学附属苏州医院,苏州市立医院,苏州 215002)
体外受精-胚胎移植技术(IVF-ET)助孕过程中,胚胎发育潜能是影响妊娠成功与否的关键因素之一,因此如何筛选一枚最佳发育潜能的胚胎成为亟待解决的问题。尽管囊胚移植的出现使胚胎种植率有了一定提升,但囊胚移植需延长胚胎的体外培养,可能会增加产科并发症发生,损害围产期结局[1-2],另外囊胚移植也可能导致胎儿出生性别比升高[3]。因此,我们期望找到能在胚胎发育早期阶段预测胚胎发育潜能的指标和方法。
时差培养(Time-lapse)技术可以在维持胚胎培养环境稳定的条件下,连续观察胚胎的整个发育状态,包括细胞分裂时间点和异常分裂行为。研究发现胚胎发育动力学参数和特殊分裂方式可以影响胚胎发育潜能[4-6]。而纺锤体对卵母细胞染色体的分配、运动、平衡以及极体的排列有着至关重要的影响。纺锤体实时观察仪的出现,使人们可以进行活体纺锤体观测。研究发现减数分裂纺锤体(MS)存在与否会影响卵母细胞正常受精和胚胎发育及妊娠结局[7-9]。因此本研究拟结合早期胚胎发育形态动力学参数和MS形态,建立卵裂期胚胎筛选模型。
材料与方法
一、研究对象
回顾性分析2020年8月至2022年6月在苏州市立医院生殖与遗传中心行ICSI,同时行卵母细胞MS观测和胚胎实时观测培养患者的临床资料。这些患者的正常受精胚胎均于Time-lapse时差培养箱(Embryoscope Plus,Vitrolife,丹麦)进行培养。纳入标准:患者该周期的全部正常受精胚胎均行全囊胚培养。排除标准:(1)获卵数<5枚;(2)夫妻双方任意一方有染色体异常;(3)女方为赠卵周期;(4)子宫畸形,严重输卵管积水等影响妊娠的因素。
本研究共纳入46个周期,459枚成熟卵母细胞(MⅡ卵),行ICSI注射后最终获得335枚卵裂期胚胎,均行囊胚培养。
二、研究方法
1.分组:根据ICSI注射时卵母细胞的MS形态分为MS正常组(239枚)和MS异常组(96枚);根据是否出现直接分裂(DC)分为无DC组(285枚)和DC组(50枚),其中DC组又分为DC1组(胚胎第1次卵裂时卵裂球一分为三,20枚)和DC2组(除第1次卵裂外,其余胚胎发育阶段卵裂球一分为三,30枚);根据是否出现逆分裂(RC),分为RC组(9枚)和无RC组(326枚);根据传统形态学评分将D3胚胎分为D3优质胚胎组(209枚)和D3非优质胚胎组(126枚)后,对D3优质胚胎组和非优质胚胎组按照胚胎发育结局分别分组,形成可利用囊胚的为囊胚组(分别为166枚和31枚),未形成可利用囊胚而丢弃的为废弃组(分别为43枚和95枚)。
2.促排卵与取卵:根据患者基本情况,进行常规促排卵,当B超提示3枚优势卵泡直径达18 mm或4枚优势卵泡直径达17 mm时注射HCG(艾泽,默克,德国)扳机,扳机后36 h在阴道B超引导下取卵。获得的卵丘卵母细胞复合体(COCs)漂洗干净后置于含G-IVF Plus(Vitrolife,瑞典)的4孔皿。2~4 h后用透明质酸酶(Sage,美国)消化去除COCs周围的颗粒细胞,将成熟卵母细胞(MⅡ卵)置于G1 Plus(Vitrolife,瑞典)中培养1~2 h等待授精。上述培养条件均为37℃、6.2%CO2、5%O2。
3.纺锤体观测与ICSI:ICSI时将MⅡ卵置于纺锤体观测专用玻璃皿(D910400,OLYMPUS,日本),利用纺锤体观测系统(IX-ROBOPola system,OLYMPUS,日本)观察MS形态。若呈现明亮的椭圆形则为正常MS,其余状态均为异常MS,包括MS形态异常、亮度异常和未见MS。ICSI时将MS置于12点钟方向后进行注射,若未见MS,则将第一极体置于12点钟方向后行注射。
4.胚胎培养:ICSI后立即将卵母细胞按顺序置于含G1 Plus的16孔培养皿(Vitrolife,丹麦),放入胚胎时差培养箱进行培养。于受精后第3天(D3)和第5天(D5)进行G2 Plus(Vitrolife,瑞典)半量更换,培养至受精后第6天(D6)。培养条件为37℃、6.2%CO2、5%O2。
5.Time-lapse系统和胚胎评分:时差培养箱拍摄平面11层,时间间隔为10 min。利用Time-lapse图像分析软件收集胚胎发育资料[10],包括各个细胞分裂时间点:原核形成(tPNa)、原核消失(tPNf)、2细胞(t2)、3细胞(t3)、4细胞(t4)、5细胞(t5)、8细胞(t8),以及特殊分裂模式:DC和RC。2细胞到3细胞的发育时间cc2=t3-t2,3细胞到5细胞的发育时间cc3=t5-t3,3细胞到4细胞的发育时间s2=t4-t3,5细胞到8细胞的发育时间s3=t8-t5。
D3胚胎卵裂球数目≥7,胚胎碎片≤20%,且卵裂球均匀者为形态学优质胚胎,此外为非优质胚胎。囊胚形态学评分采用Gardner评分体系[11],可利用囊胚为囊胚腔扩张≥3期,内细胞团细胞数≥B级,滋养层细胞数≥C级。囊胚形成率=可用囊胚数/卵裂胚胎数×100%。
三、统计学分析
结 果
一、纳入患者基本情况
本研究共纳入46个周期,459枚成熟卵母细胞,行ICSI注射后最终获得335枚卵裂胚胎。纳入患者平均年龄为(35.1±4.9)岁,体质量指数(BMI)为(21.3±4.0)kg/m2,不孕年限为(3.4±2.7)年,FSH为(8.0±2.7)U/L,E2为(51.9±26.2)pmol/L、LH为(5.0±3.7)U/L,抗苗勒管激素(AMH)为(4.8±4.1)ng/ml,获卵数为(12.4±5.7)枚,成熟卵数为(10.4±4.7)枚,正常受精数为(7.7±4.5)枚,形成可利用囊胚数为(4.4±3.7)枚。
二、MS形态对囊胚形成的影响
MS正常组囊胚形成率为63.6%,显著高于MS异常组(46.9%)(P<0.05)(表1)。
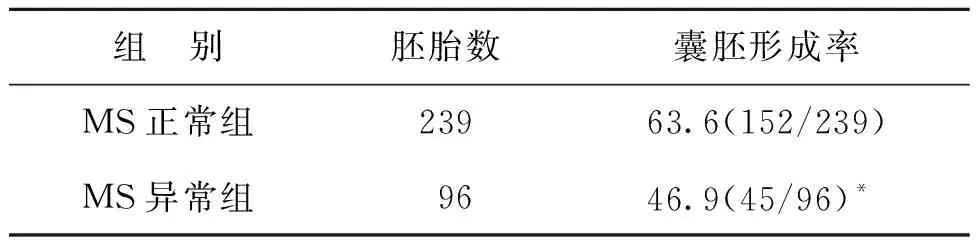
表1 MS形态对囊胚形成的影响(%)
三、胚胎异常分裂模式对囊胚形成的影响
DC1组的囊胚形成率显著低于DC2组和无DC组(P<0.05);与无RC组比较,RC组的囊胚形率差异无统计学意义(P>0.05)(表2)。
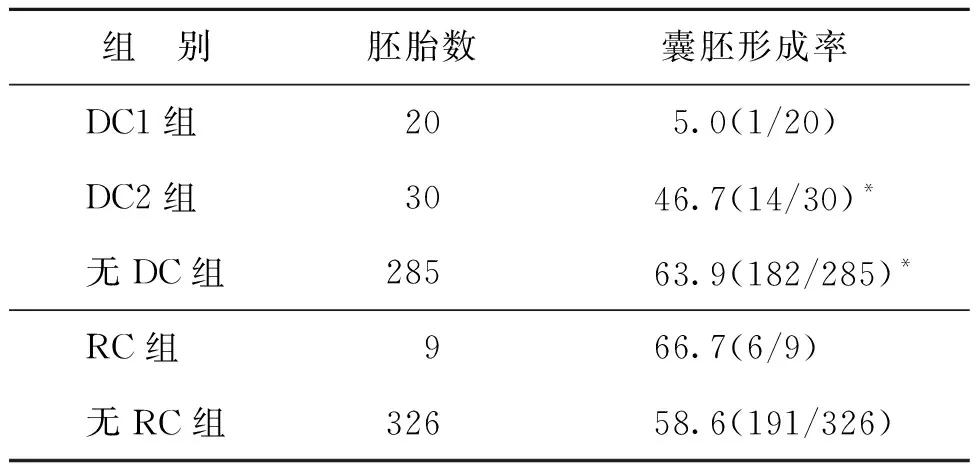
表2 异常分裂模式对囊胚形成的影响(%)
四、胚胎形态学评分对囊胚形成的影响
D3形态学优质胚胎的囊胚形成率显著高于D3形态学非优质胚胎(P<0.05)(表3)。D3形态学非优质胚胎中,卵裂球数≥6个的胚胎其囊胚形成率显著高于卵裂球数<6个的胚胎(P<0.05)(表4)。
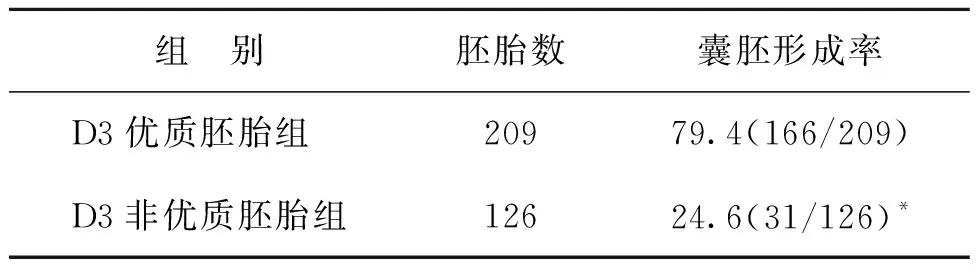
表3 传统形态学评分对囊胚形成的影响(%)

表4 D3非优质胚胎的卵裂球数对囊胚形成的影响(%)
五、胚胎动力学参数对囊胚形成的影响
对于D3形态学优质的胚胎,囊胚组的平均年龄、t2和s3均显著小于废弃组(P均<0.05),而t3、t5、cc2和cc3均显著大于废弃组(P均<0.05),其余参数在两组间差异均无显著意义(P均>0.05)(表5)。
表5 D3优质胚胎的囊胚组与废弃组间年龄及动力学差异(-±s)
对于D3形态学非优质的胚胎,囊胚组的t2显著小于废弃组(P<0.05),而年龄、tPNa、tPNf在两组间差异均无显著意义(均P>0.05)(表6)。
表6 D3非优质胚胎的囊胚组与废弃组间年龄及动力学差异(-±s)
六、影响囊胚形成的多元Logistic回归分析
在D3形态学优质胚胎中,将t2、t3、t5、cc2、cc3、s3均按照二分位分为两类,t2、t3、t5、cc2、cc3、s3中位数分别为24.7、34.6、46.9、10.7、12.8和6.3;年龄根据高龄分类,分为≥38岁和<38岁两类;MS按照形态分为正常和异常两类,然后将上述参数进行多因素Logistic回归分析。结果显示年龄、cc3、s3和MS形态与囊胚形成之间存在相关(统计学参数分别为OR=2.966,P=0.007;OR=0.240,P=0.017;OR=2.922,P=0.015;OR=2.448,P=0.028)(表7)。
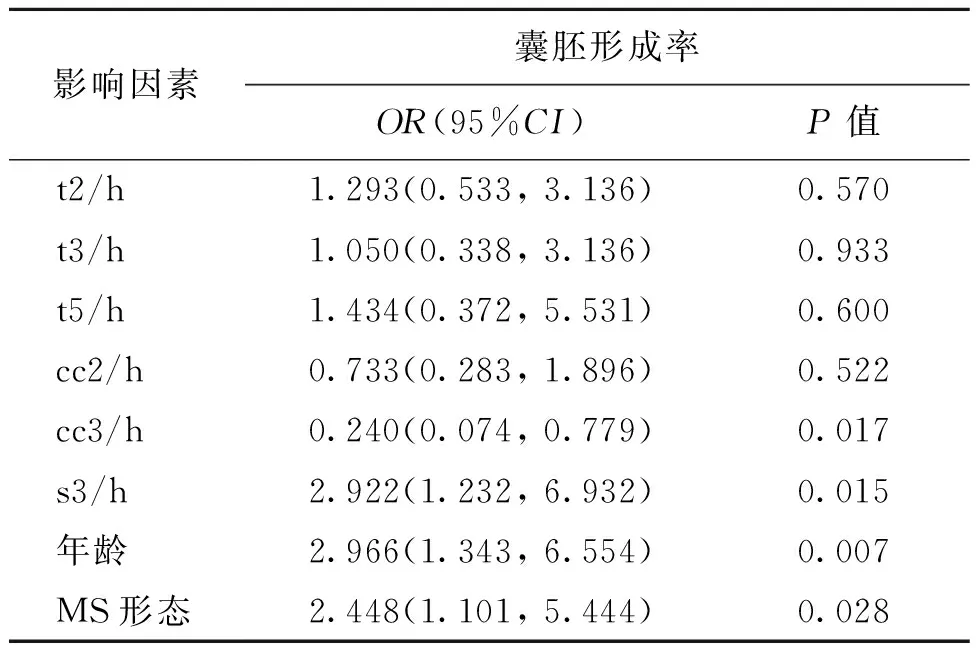
表7 D3形态学优质胚胎囊胚形成率的多元回归分析
在D3形态学非优质胚胎中,将t2按照二分位分为两类,其中位数为28.4;卵裂球数目分为<6个卵裂球的胚胎和≥6个卵裂球的胚胎两类,然后将上述参数进行多因素Logistic回归分析。结果显示仅卵裂球数目对囊胚形成有统计学意义(OR=4.161,P=0.003)(表8)。
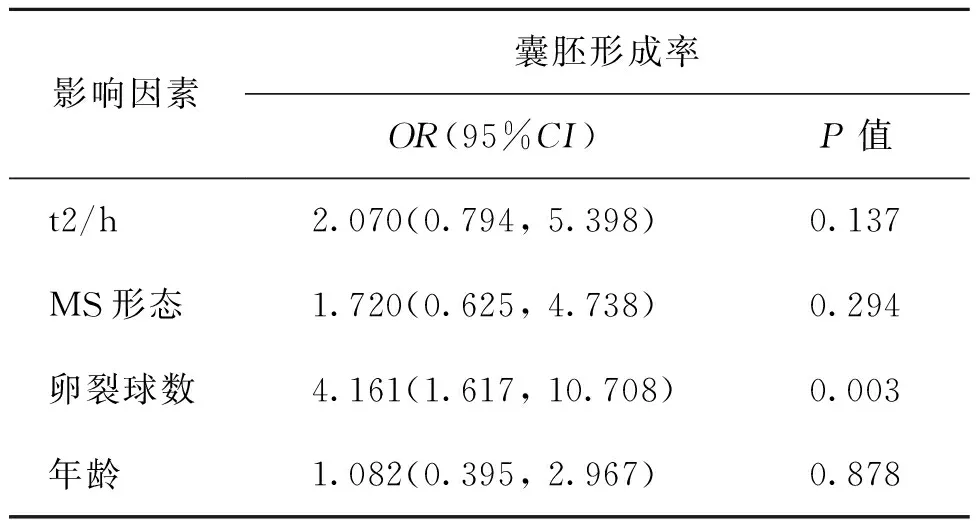
表8 D3形态学非优质胚胎囊胚形成率的多元回归分析
七、卵裂期胚胎分层筛选模型的建立
在20枚DC1胚胎中,仅1枚形成可利用囊胚,其囊胚形成率为5.0%。因此,将DC1作为首要排除指标,将发生DC1的胚胎定义为K级。未发生DC1的胚胎按照D3胚胎形态学评分进行筛选,形态学优质胚胎的等级高于形态学非优质胚胎。在D3形态学优质胚胎中,根据Logistic回归分析中3个意义指标的P值大小进行逐级分层选择,依次为s3、cc3和MS形态。尽管年龄与该组囊胚形成存在相关,但胚胎筛选的目的是为同一患者胚胎进行排序,以选择最具发育潜能的胚胎进行移植,提高患者的临床妊娠率,因此建立胚胎筛选模型时将年龄排除。故,s3≤6.3 h、cc3>12.8 h的胚胎中,MS正常胚胎为A级,MS异常胚胎为B级;s3≤6.3 h、cc3≤12.8 h的胚胎中,MS正常胚胎为C级,MS异常胚胎为D级;s3>6.3 h、cc3>12.8 h的胚胎中,MS正常胚胎为E级,MS异常胚胎为F级;s3>6.3 h、cc3≤12.8 h的胚胎中,MS正常胚胎为G级,MS异常胚胎为H级。而在D3形态学非优质胚胎中,根据卵裂球数目,≥6的为I级,<6的为J级。故D3胚胎分层筛选模型共分为11等级,A级为最佳,按字母依次降低,K级最劣(图1)。

图1 D3胚胎分层筛选模型
八、胚胎分层筛选模型的ROC曲线验证
用D3胚胎分层筛选模型进行胚胎选择并赋值,将其与是否形成囊胚作ROC曲线,求出曲线下面积。结果显示ROC曲线的曲线下面积为0.857,95%CI为(0.816,0.899),P=0.000(图2),表明D3胚胎分层筛选模型对囊胚形成有较好的预测价值。

图2 胚胎分层筛选模型对胚胎发育结局预测的ROC曲线
讨 论
在对卵裂期胚胎进行选择时,许多生殖中心依然沿用传统的形态学评分,这种分类方法通过特定时间点的参数来区分胚胎优劣,其信息是点状的,不能代表胚胎发育全貌。因此,我们期望通过增加卵母细胞和胚胎早期生长发育过程中的额外关键信息,以获得更精准、有效的胚胎选择方法。Time-lapse不仅可以维持胚胎培养环境稳定,而且可以实时观测胚胎生长发育全过程,捕获胚胎异常分裂行为。同时,卵母细胞质量也是影响胚胎早期质量的关键,纺锤体在胚胎分裂过程中起着重要作用,且大量研究证实纺锤体形态与囊胚形成相关[12-13]。
本研究中DC1的发生率为6.0%(20/335),其囊胚形成率显著低于DC2和无DC的胚胎(5.0% vs. 46.7% vs. 63.9%,P<0.05)。以往研究证实DC可导致分裂过程中染色体分离异常[14]。本研究中发生DC1的20枚胚胎仅1枚形成囊胚,且为非优质囊胚。因此,推测DC1可使胚胎发育潜能受损,故将DC1作为D3胚胎分层筛选模型的首层排除指标。
胚胎的形态学评分也是影响囊胚形成的一个重要指标。有研究表明胚胎形态和发育阶段与胚胎发育能力密切相关[15]。本研究中D3形态学优质胚胎的囊胚形成率显著高于D3形态学非优质胚胎(79.4% vs. 24.6%,P<0.05)。可见,形态学评分对胚胎发育潜能的预测有意义。对于胚胎生长发育缓慢或碎片较多的胚胎,常常因为细胞分裂时间点难以评判或获得,而导致胚胎动力学参数标记不全。因此,本文在研究动力学对胚胎发育潜能影响时,将D3胚胎按照形态学分类后进行。故D3胚胎的形态学分类归为第二层筛选指标,且优质胚胎的分级高于非优质胚胎。
在D3形态学优质胚胎中,s3、cc3和MS形态与囊胚形成之间存在相关(P<0.05),根据P值大小将s3、cc3和MS形态作为模型的第一、第二和第三亚筛选参数;而在D3非优质胚胎中,仅卵裂球数目与囊胚形成之间存在相关(P<0.05),故卵裂球数目为第一亚筛选参数。由此经过逐层筛选,建立了预测囊胚形成的D3胚胎分层筛选模型,该模型分为A级~K级11个等级,且评分由A级到K级依次递减。该模型对囊胚形成预测ROC曲线的曲线下面积为0.857,95%CI为(0.816,0.899),P=0.000,具有较好的预测价值。
既往关于囊胚预测模型的研究中,Cruz等[4]利用Time-lapse动力学特征,以t5为主要变量,s2为次要变量,将胚胎分为A~D 4个等级,结果显示囊胚形成率由A到D级分别为77.0%、72.0%、64.9%和53.6%,呈递减趋势。该模型中t5和s2(即t4-t3)均为较早期的分裂指标,但各级胚胎囊胚形成率之间差异不大。Motato等[5]以tM为主要变量,s3为次要变量,将胚胎分为A~D 4个等级,结果显示囊胚形成率由A到D级分别为84.4%、75.0%、28.2%和13.8%,呈递减趋势。该模型中主要选择参数tM是开始形成桑椹胚的时间,该时间一般发生于受精后第4天(D4),出现时间较晚,进而削弱了模型在早期卵裂期胚胎选择的意义。Yang等[16]以细胞碎片、DC、RC和细胞发育阻滞为主要变量,以tPNF、t2和t4为次要标量,将胚胎分为A~D 4个等级,结果显示A、B、C、D级的囊胚形成率分别为80.0%、77.8%、53.7%和22.2%(P<0.001)。该模型建立在138枚胚胎的小样本基础上,且参数的划分较粗略,一个分层选择涉及多项变量。而本研究将特殊分裂模式DC、形态学评分、动力学评分和纺锤体形态评分联合应用,模型建立的指标分类更为全面。特别是将D3形态学优质和非优质胚胎的动力学参数进行精细化分类评估,将那些动力学参数标记不全或动力学参数评估模糊的胚胎归为一类,仅进行tPNa、tPNf和t2的评估。而对于D3形态学优质的胚胎,进行全部的胚胎早期细胞分裂时间点、细胞分裂周期和细胞分裂同步性分析,从而为进一步鉴别常规形态学优质胚胎的等级找到了评定指标。
另外,本模型中引入了MS形态,且MS形态与囊胚形成相关,可作为胚胎筛选的参数。Holubcová等[12]将MS按照形态分为双极纺锤体(A级)、畸形/半透明纺锤体(B级)、未见双折射纺锤体(C级)和微管桥纺锤体(D级)四类,结果发现B、C、D级纺锤体胚胎囊胚形成率显著低于A级。Asa等[13]也发现MS形态与胚胎形态呈正相关,且MS形态不佳的卵母细胞,其形成的胚胎碎片程度较高。MS改变可能会引起染色体完整性的改变,促使染色体不分离导致非整倍体,不平衡的染色单体连接产生结构异常,以及染色体缺失,进而影响胚胎发育能力[17]。而Alegre等[18]在胚胎形态动力学基础上引入胚胎培养液氧化状态(H2sm),建立了胚胎质量分级模型(A~F级),从A级到F级种植率在76.5%到29.2%之间,且依次递减。因此,认为形态学、动力学和胚胎培养基氧化状态相结合的评估模型可能有助于改进现有的胚胎选择方法;胚胎形态动力学与其它指标相结合可用于胚胎选择模型的建立。
各中心以胚胎形态动力学为基础建立的胚胎选择模型均可有效地预测本中心胚胎的发育潜能,但是由于胚胎发育对环境条件(如培养液种类、温度及气体浓度等)十分敏感[19-21],各中心的选择参数不尽相同。因此到目前为止并没有适用于各实验室的通用模型。Barrie等[21]根据已发表的6个胚胎选择模型,对来自884个治疗周期的977枚已知种植结局的胚胎进行回顾性分析,结果显示并不能获得理想的预测效果,提示这些模型进行外部应用时可能会失去应用价值,因此开发针对患者、治疗和环境的内部模型十分重要。
此外,本研究以是否形成囊胚为模型的最终指标,而非胚胎种植结局,是考虑到胚胎能否种植受胚胎质量、子宫内膜状态和患者自身情况等多种因素共同作用;即便整倍体胚胎也会出现种植失败的情况。另外,大部分以种植为结局的研究,并非建立在单胚胎移植基础上,对于移植两枚胚胎仅单胎妊娠的患者,会因无法明确具体种植的胚胎而被排除在统计之外,进而可能会引起数据的严重偏移[22]。
最后,本研究中MS异常卵母细胞形成的胚胎数量较少,故MS形态仅分为正常和异常,实际上在异常的MS中又可详细分为诸如形状异常、亮度异常和未见纺锤体等。且文章仅将胚胎结局分为废弃组和囊胚组,实际上囊胚组还可细分为优质囊胚和非优质囊胚。因此,本研究可积累数据后进行进一步深入分析。
综上,本研究中以胚胎形态学、动力学联合MS形态分析建立的D3胚胎分层筛选模型,对胚胎发育潜能具有较好的预测能力。
