红曲霉与植物乳杆菌发酵普洱茶的抗氧化活性比较
2024-02-28黄媛于娟江小丽任玲董蕊鲁倩王建飞李亚莉周红杰
黄媛,于娟,江小丽,任玲,董蕊,鲁倩,王建飞,李亚莉,周红杰
(云南农业大学茶学院,云南昆明 650201)
普洱茶(熟茶)是以云南特有的大叶种晒青毛茶为原料,经适度潮水和一定时间的微生物发酵制成的茶叶[1]。大量研究证实普洱熟茶具有降脂[2]、降血糖[3]、减肥[4]、抗氧化等[5]诸多保健功效,这与普洱茶丰富的内含物质有关。颜学行等[6]研究认为将不同有益微生物应用于普洱茶的发酵中,可以提高普洱茶的品质。例如,用紫色红曲霉(Monascus purpureus)Mp-21 次级代谢产物进行分离纯化,发现该菌种具有开发成抗氧化、降血糖等功能性食品的潜力[7];乳酸菌发酵红酸汤可以明显减少亚硝酸盐的含量并缩短发酵时间[8];阿曲霉A1(Aspergillus amstelodamiA1)发酵可改变茶叶的特征成分,提高普洱茶的感官品质[9]。可见利用微生物发酵对茶叶功效和品质有一定的提升作用,通过工艺的改善有利于茶叶的发酵并提高其附加值。
红曲霉(Monascus)是腐生真菌,生长的最适pH 值为3.5~5,生长温度为26~42 ℃,最适温度为32~35 ℃[10],可以代谢分泌多种功能性产物,包括酶、脂肪酸、有机酸、油脂、色素、洛伐他丁、麦角固醇、γ-氨基丁酸等物质[11,12]。红曲霉代谢物丰富,应用广泛,徐文流等[13]用红曲霉发酵金银花,发现发酵后的红曲金银花具有较强的自由基清除能力,其中ABTS+自由基清除能力提高了61.39%,DPPH 自由基清除能力提高了59.28%。植物乳杆菌(Lactobacillus plantarum)是最广为人知的乳杆菌种之一,是一种公认的益生菌[14,15],该菌属于短杆菌(Brevibacterium),厌氧或兼性厌氧,不产芽孢,最适生长温度为30~35 ℃,最适pH 值为6.5 左右,属于同型发酵乳酸菌[16,17]。在许多食品发酵中有应用,成堃等[18]以金银花、枸杞、全脂奶粉为原料,接种乳杆菌等微生物进行发酵,制作了具有独特中药风味的金银花枸杞酸奶。王姣琳等[19]以藜麦为原料,利用红曲霉与乳酸菌混合发酵制备降压肽,得到的该抑制肽能保持良好的活性。暂未见关于两个菌种混合发酵普洱茶的探究,且外源菌种发酵普洱茶的抗氧化活性研究较少。因此,本文以晒青毛茶为原料,利用外源添加红曲霉和植物乳杆菌发酵普洱茶,探讨两个菌种对发酵普洱茶的生化成分影响,并进一步探究其生物活性的差异,为普洱茶的深加工开发提供一定的参考依据。
1 材料与方法
1.1 材料与设备
材料:红曲霉来源于实验室保存的专利菌株MPT13,专利号:201010182965.9;植物乳杆菌菌种L34 购于宁波明舟生物科技有限公司,编号为:BMZ 144978;晒青毛茶茶样购于云南临沧。
试剂:琼脂(分析纯),广州硕谱生物科技有限公司;DPPH 试剂、福林酚(分析纯),上海源叶生物科技有限公司;香兰素、碱式醋酸铅(均为分析纯),天津市科密欧化学试剂有限公司;三氯化铝、磷酸二氢钾、磷酸氢二钠、碳酸氢钠、氯化亚锡(分析纯),天津市风船化学试剂科技有限公司;水合茚三酮、葡萄糖(分析纯),广东光华科技股份有限公司;蒽酮(分析纯),国药集团化学试剂有限公司;95%乙醇、正丁醇、乙酸乙酯、甲醇(均为分析纯),天津市富宇精细化工有限公司;浓硫酸、浓盐酸(均为分析纯),重庆市川东化工(集团)有限公司;羟自由基清除能力、ABTS+自由基清除能力及总抗氧化能力(FRAP法)测定试剂盒,苏州格锐思生物科技有限公司。
设备:DY04-13-38-00 BL-75G 灭菌锅,上海博迅实业有限公司医疗设备厂;SW-CJ-2D 超净台,苏州净化设备有限公司;HPX-250B 恒温恒湿培养箱,金坛市杰瑞尔电器有限公司;SKY-210Z 摇床,苏坤实业有限公司;UV-5100H 外可见分光光度计,海元析仪器有限公司。
1.2 试验方法
1.2.1 红曲霉、植物乳杆菌的孢子悬浮液制备
将红曲霉以三点法点涂到PDA 培养基中,于温度28 ℃,湿度70%的恒温恒湿培养箱培养,在平板中培养6~8 d后,将菌丝刮入50 mL的无菌水中,制备成孢子悬浮液;将植物乳杆菌以划线法培养于MRS 培养基中,于温度28 ℃,湿度70%的恒温恒湿培养箱培养,在平板中培养2~3 d 后,将菌丝刮入50 mL 的无菌水中,制备孢子悬浮液。
1.2.2 普洱茶固态发酵实验
实验室进行发酵试验,称取50 g 晒青毛茶装于玻璃罐中,进行潮水使茶叶中含水量达35%,在121 ℃、20 min 条件下高温高压灭菌,灭菌后接入等量的红曲霉、植物乳杆菌的孢子悬浮液10 mL,控制温度35±5 ℃、湿度在70%~80%,于恒温恒湿箱发酵6 周,发酵过程中每周都接入相应等量的10 mL 孢子悬浮液并定期翻堆、潮水;不接菌种发酵的茶样为对照组(CK)。此外,实验设置了接种红曲霉的基础上在不同周期再添加植物乳杆菌发酵,以不接种菌株为对照。发酵茶样处理及编号见表1。

表1 发酵茶样处理Table 1 Treatment of fermented tea samples
1.2.3 生化成分测定
水浸出物测定按照GB/T 8305-2013《茶水 浸出物测定》规定方法测定;氨基酸测定按照GB/T 8314-2013《茶 游离氨基酸总量的测定》规定方法测定;咖啡碱测定按照GB/T 8312-2013《茶 咖啡碱测定》规定方法测定;茶多酚测定按照GB/T8 313-2018《茶叶中茶多酚和儿茶素含量的检测方法》规定方法测定;茶红素、茶黄素、茶褐素采用萃取分离分光光度法[20]测定;可溶性总糖测定按照蒽酮—硫酸比色法测定;黄酮测定按照三氯化铝比色法测定;儿茶素测定按照香荚兰素比色法测定。
1.2.4 抗氧化活性测定
茶样水提物的制备:准确称取磨碎试样3 g;加450 mL 沸水,在沸水浴中浸提45 min,每一个样品设立3 个平行,每隔10 min 摇瓶一次,过滤。洗涤残渣,滤液合并于500 mL 容量瓶中,加水定容至刻度,摇匀,备用。
DPPH 自由基清除能力:DPPH 的清除能力测定参照文献[21],稍作修改。
羟自由基清除能力:按照羟自由基清除能力试剂盒加样表严格加样。
ABTS+自由基清除能力:按照ABTS+自由基清除能力试剂盒加样表严格加样。
总抗氧化能力(FRAP 法):按照总抗氧化能力(FRAP 法)试剂盒加样表严格加样。
1.3 数据处理
采用Excel 2010 进行图表制作,数据处理;SPSS 64.0 软件进行显著性分析,相关性分析。
2 结果与讨论
2.1 不同菌种发酵普洱茶的主要生化成分分析
如表2 所示,不同处理的茶样之间生化成分存在一定差异。茶样的水浸出物在50.64%~52.50%之间,高于国家标准中对普洱茶(散茶)规定的标准要求(≥28%)[1]。7 个茶样之间R 和H 存在显著差异(P<0.05),其余茶样之间无显著差异。其中R水浸出物含量最高为52.50%,其次是B 为51.46%,这与茶样发酵方式有关系,因添加菌种的不同会影响茶叶的水浸出物含量[22]。R 水浸出物含量最高为52.50%,其次是B 为51.46%,有研究表明,植物乳杆菌会抑制多酚类和蛋白质结合[23],使结合态的多酚类物质释放变成游离态,同时植物乳杆菌会保持发酵过程中多酚物质的活性[24]。可能是植物乳杆菌的双重作用下,促进茶多酚的释放,同时增加蛋白质的水解,使氨基酸含量增加,从而提高了R 的水浸出物含量。与原料相比,A(50.67%)、B(51.46%)、C(50.90%)的水浸出物含量有变化,但无显著差异,可能与植物乳杆菌和红曲霉之间的拮抗作用有关,发酵过程中的具体作用机制有待研究。
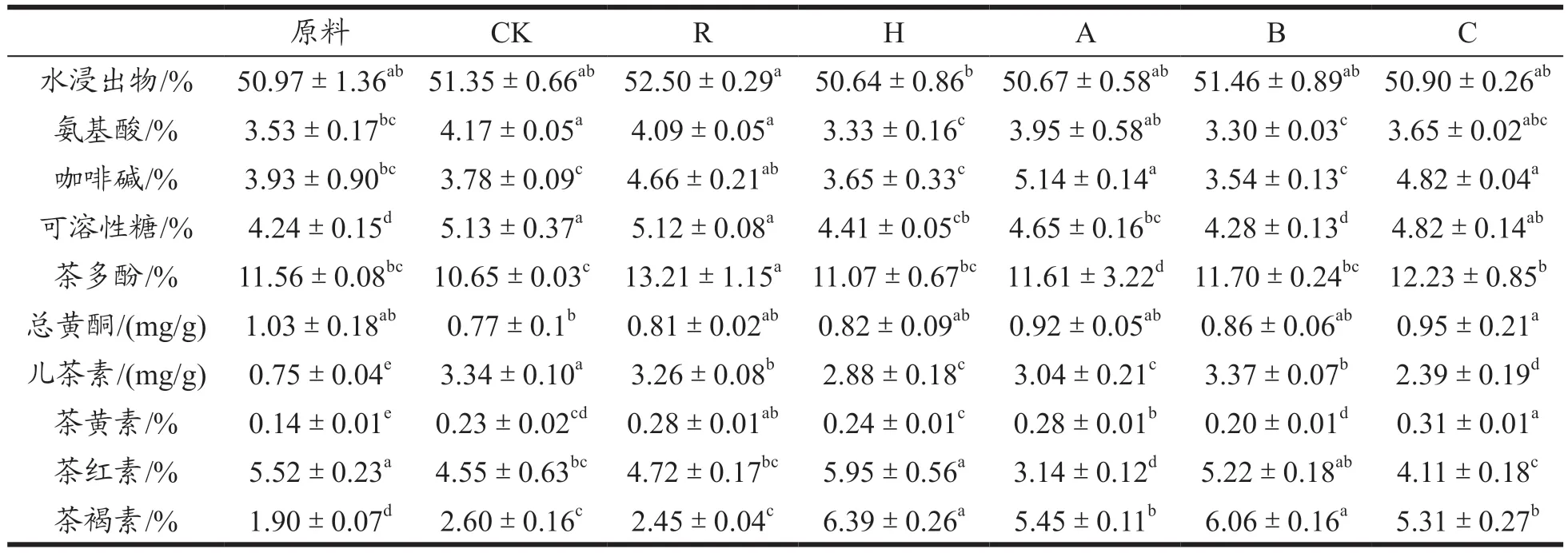
表2 茶样主要生化成分含量Table 2 Contents of main biochemical components in tea samples
氨基酸的含量范围是3.30%~4.17%,CK 的氨基酸含量最高为4.17%,其次是R(4.09%),与原料含量存在显著差异(P<0.05),且都比原料(3.53%)的含量高,赵苗苗等[22]研究红紫芽发酵熟茶发现,氨基酸随着翻堆次数的增加呈递减的趋势,发酵后的茶叶氨基酸含量比晒青原料高,与本文结果不一致,可能与本文的发酵方式有关,无菌条件下发酵产生的菌种单一减少了氮源的消耗;植物乳杆菌在发酵过程中大量繁殖并分泌大量酸类物质[15],也会导致氨基酸含量的增加。咖啡碱的氨基酸含量范围为3.54%~5.14%,含量最高的是R。原料(4.24%)与CK(5.13%)、R(5.12%)、H(4.41%)、A(4.65%)、C(4.82%)的可溶性糖之间存在显著差异(P<0.05),其中对照组可溶性糖最高的是CK,发酵过程中双糖和多糖在淀粉酶、果胶酶等物质的作用下水解成分子量较小的单糖。微生物的生长需要一定的营养物质,碳水化合物是其生长的主要营养物质,红曲霉以糖类为碳源[12],添加红曲霉发酵的H、A、B、C 可溶性糖都较低,最低的是B(4.28%),其次是H(4.41%),可能是接种的红曲霉利用了茶叶中的糖类物质为生长基质,导致发酵后茶叶的可溶性糖含量降低。
茶黄素是多酚类物质的氧化产物,与原料相比,CK、R、H、A、B、C 都具有显著性差异;CK 和R、A、C 之间具有显著性差异(P<0.05),与H、B 之间不存在显著性差异;茶褐素含量在普洱茶中高于茶黄素和茶红素[22]。CK 和H、A、B、C 相比具有显著性差异,R 与H、A、B、C 的茶褐素含量之间具有显著性差异(P<0.05),可能与红曲霉生长过程中会产生大量红曲色素转化有关[12]。在普洱茶传统加工过程中发现茶多酚、黄酮类、茶红素的含量大幅度减少,其中茶多酚的主要成分在多酚氧化酶作用下,发生氧化成邻醌等物质而减少[25],实验发现,CK 与原料相比茶多酚含量减少,原料与R、A 之间存在显著差异(P<0.05),与赵苗苗等[22]的研究结果一致。R 和C 的茶多酚含量有明显增加且存在显著差异(P<0.05),其中R 的含量最高为13.21%,植物乳杆菌在发酵过程中可产生相关酶,通过分解酚环上的羟基产生酚酸来增加总酚含量[26],接种植物乳杆菌有利于茶多酚的转化。黄酮类化合物具有抗氧化[27]、降血糖等[28]多种药理作用,测得样品的黄酮含量为0.77~1.03 mg/g。其中原料的含量最高为1.03 mg/g,CK 含量最低为0.77 mg/g,R、H、A、B、C 黄酮含量比CK 的含量高,红曲霉能够代谢分泌的β-葡糖苷酶,可以将其黄酮糖苷转化为黄酮苷元,从而使得黄酮类化合物的含量增加[29],植物乳杆菌对植物中的黄酮化合物代谢能力较低[30],但两个菌种在茶叶中的转换机制有待进一步探究。
2.2 不同菌种发酵普洱茶的抗氧化活性分析
2.2.1 普洱茶的清除率分析
对6 个不同处理发酵的普洱茶检测发现,红曲霉和植物乳杆菌发酵普洱茶都具有抗氧化能力,不同处理的茶样之间抗氧化活性不同。单一的抗氧化方法实验不能反映茶样的自由基清除率,实验选用了DPPH 自由基、ABTS+自由基、羟自由基清除率三种方法进行测定,发现接种外源菌种发酵的普洱茶抗氧化活性都有所提高。如图1 所示6 个茶样对DPPH 自由基的清除能力差异显著,清除率都在75%以上,DPPH 自由基清除率最强的是R,达到91.59%,这可能与植物乳杆菌具有较强的清除自由基的能力有关[31],该菌种的添加进一步促进茶叶抗氧化能力的提升;CK 的清除率最低为76.45%,R 和C清除率在88%以上,两者存在显著差异(P>0.05),H 和CK 两者也存在明显差异(P>0.05)。DPPH自由基的清除率R>C>A>B>H>CK。
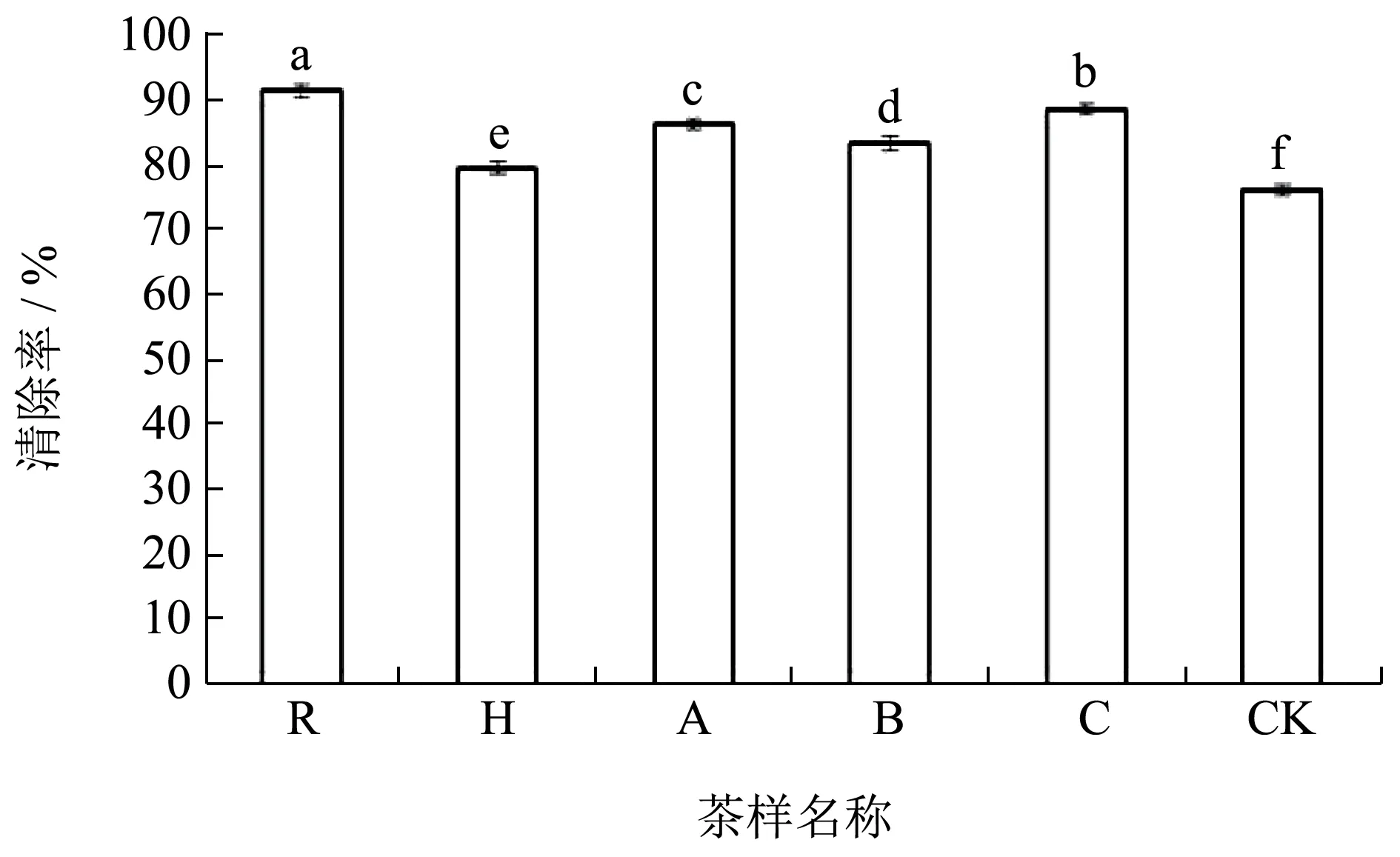
图1 不同茶样的DPPH 自由基清除率Fig.1 DPPH free radical scavenging rate of different tea samples
如图2 所示,茶样对ABTS+自由基的清除能力普遍较好,清除率在66.34%~78.98%之间,A 的清除能力最强,清除率为78.98%,B 的清除能力最弱,清除率为66.34%,R 和H 的ABTS 自由基清除能力没有显著差异(P>0.05),R、B、C、CK 之间存在显著差异(P<0.05),检测结果显示,ABTS自由基的清除能力A>R>H>C>CK>B。

图2 不同茶样的ABTS+自由基清除率Fig.2 ABTS+ free radical scavenging rate of different tea samples
如图3 所示,6 种茶样的羟自由基清除率都相对较低,检测值范围在22.29%~29.43%,R、H、A 和CK的羟自由基清除率互相存在显著差异(P<0.05),B和C 互相不存在显著差异(P>0.05),羟自由基清除率R>A>H>C>B>CK。红曲霉发酵茶叶提高其抗氧化活性,与红曲霉发酵金银花的抗氧化结果一致[13]。付依依等[30]发现植物乳杆菌可以增加沙棘原浆风味挥发物质并提高其抗氧化能力,与本文植物乳杆菌发酵普洱茶结果一致。但植物乳杆菌与红曲霉混合发酵的普洱茶其抗氧化活性欠佳,具体原因还需进一步研究说明。

图3 不同茶样的羟自由基清除率Fig.3 Hydroxyl radical scavenging rate of different tea samples
2.2.2 普洱茶的清除能力分析
不同的检测方法测定茶样的抗氧化能力,茶样间的抗氧化能力不同,如图4 所示,对6 个普洱茶样品检测发现,不同样品间存在一定差异性。茶样对ABTS+自由基清除能力较高,其中最高的是A 为3 172.09 μg Trolox/mL,B 最低为2 666.70 μg Trolox/mL,R、A、B、C、CK 之间存在显著差异(P<0.05)。ABTS+自由基的清除率与清除能力结果一致。FRAP 法测定茶样的抗氧化能力都比较低,R 与H、A、B、C、CK 之间存在显著差异(P<0.05),R 的抗氧化能力最强,为10.36 μg Trolox/mL,这可能与植物乳杆菌具有较强的还原铁离子的能力有关[31],CK 的抗氧化能力最低,为8.64 μg Trolox/mL,总抗氧化能力R>A>H>C>B>CK。抗氧化结果显示,添加外源菌种发酵有利于普洱茶抗氧化能力的提升,但混合发酵的普洱茶效果都不如单接两个菌种发酵的好,这可能与植物乳杆菌和红曲霉之间存在一定的拮抗作用有关。

图4 不同茶样的抗氧化能力Fig.4 Antioxidant capacity of different tea samples
2.3 生化成分与抗氧化活性的相关性分析
从表3 可知,茶样的抗氧化活性与氨基酸、咖啡碱、可溶性糖、茶多酚、总黄酮、茶黄素含量呈正相关,水浸出物中含有多酚类、咖啡碱、可溶性糖等物质,影响茶叶抗氧化性的水溶性成分较复杂[32],其中氨基酸、可溶性糖等物质具有一定的抗氧化活性,但是相比于茶多酚、维生素类强抗氧化剂,抗氧化活性相对较小相关性偏低;茶红素、茶褐素与抗氧化能力都呈负相关,这两种物质的转化不利于抗氧化能力的提升;儿茶素总量与ABTS+自由基清除能力、羟自由基清除率和DPPH 自由基清除率呈负相关,相关系数分别为-0.47、-0.04、-0.29,因茶叶水提物成分复杂,多酚类物质除儿茶素之外,还有槲皮素、山柰酚等,并且水提物中还有茶多糖、茶氨酸等物质,影响其抗氧化能力[33]。不同方法测定下其物质的抗氧化效果不同,其中咖啡碱与DPPH 自由基清除率有极显著相关性(P<0.01),相关系数为0.74,与ABTS+自由基清除能力、羟自由基清除率有显著相关性(P<0.05),相关系数为0.67、0.61;总黄酮与与DPPH 自由基清除率有显著相关性(P<0.05),相关系数为0.54;茶黄素与ABTS+自由基清除能力有极显著相关性(P<0.01),相关系数为0.78,与DPPH 自由基清除率有显著相关性(P<0.05),相关系数为0.69;茶多酚抗氧化能力呈正相关[33],其中与总抗氧化能力和DPPH自由基清除率有极显著相关性(P<0.01),相关系数为0.74、0.95,与羟自由基清除率有显著相关性(P<0.05),相关系数为0.66,茶多酚是普洱茶发挥抗氧化能力的重要成分,R 的茶多酚含量最高,抗氧化效果最好。杨雪梅等[32]对不同年份普洱生茶抗氧化活性研究发现,茶叶中茶多酚具有良好的抗氧化性能,与本文研究结果一致。
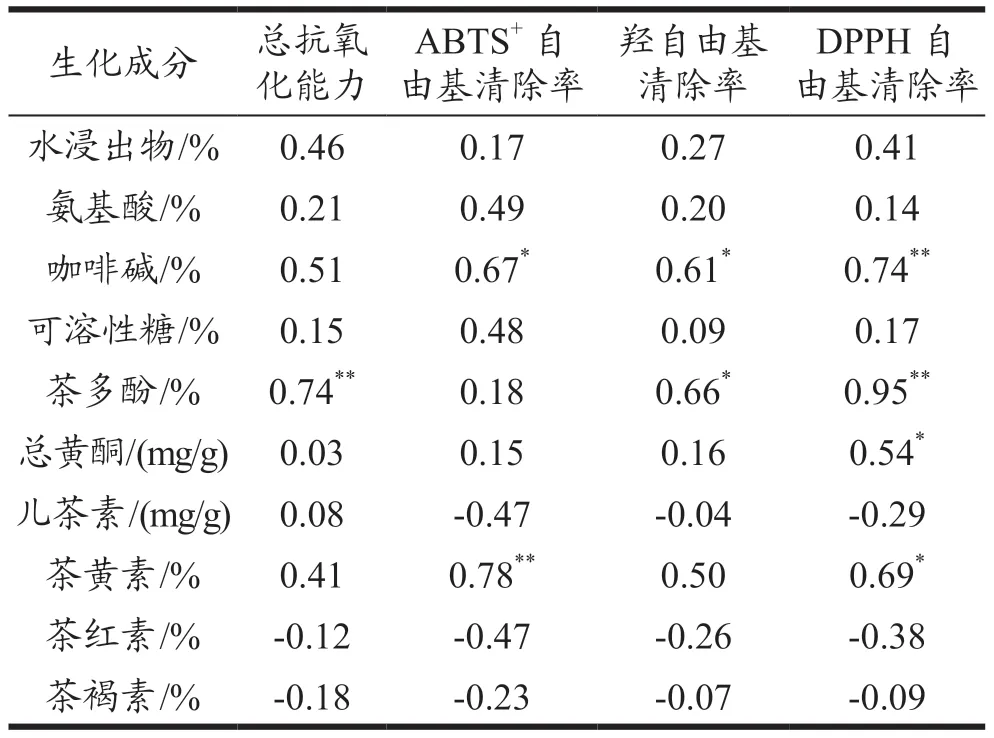
表3 体外抗氧化活性与生化成分的相关性分析Table 3 Correlation analysis of antioxidant activity and biochemical components in vitro
3 结论
本实验测得不同菌种处理的普洱茶主要化学成分含量存在差异,混合菌种发酵普洱茶的总黄酮含量整体偏高,最高的是C,含量为0.95 mg/g;R的水浸出物和茶黄素的含量最高,分别为52.50%、0.28%;H 的茶红素、茶褐素最高为5.95%、6.39%;R 的茶多酚含量最高为13.21%,与原料、H、A、B、C、CK 存在显著差异(P<0.05)。通过抗氧化能力的测定发现,普洱茶都有较强的抗氧化能力,与CK 相比,添加植物乳杆菌、红曲霉发酵普洱茶有利于茶叶抗氧化能力的提升,R 的总抗氧化能力、DPPH 自由基清除率和羟自由基清除率最高,分别是10.36 μg Trolox/mL、91.59%、29.43%。相关性显示,咖啡碱、茶多酚、茶黄素、总黄酮指标与抗氧化能力都有一定的显著相关性,其中茶多酚对抗氧化活性的影响最大,茶多酚含量与总抗氧化能力、DPPH 自由基清除率呈极显著相关性,相关系数为0.74、0.95。外源菌种对发酵普洱茶的生化成分和抗氧化活性有较大影响,与R、H 相比,A、B、C的抗氧化能力较弱,利用红曲霉和植物乳杆菌发酵开发不同风味和作用的普洱茶有一定意义,为普洱茶的深加工产品提供一定的理论基础。
