邻甲苯磺酰胺三元复配缓蚀剂的缓蚀性能研究
2024-02-28田会娟郭强强
田会娟,赵 玥,郭强强,洪 岩
(1.唐山学院 新材料与化学工程学院,河北 唐山 063000;2.唐山师范学院 化学系,河北 唐山 063000;3.迁安市宏奥工贸有限公司,河北 迁安 064400)
碳钢由于自身优异的力学性能与加工性能,可用于石油管道、航空航天、建筑工程、机械制造等领域[1],是目前应用最广泛的金属之一。然而,碳钢在使用过程中,由于酸洗、除垢、油井酸化等原因,极易受到含氯离子、硫酸盐、亚硝酸盐离子的酸性溶液介质的腐蚀。腐蚀是钢结构失效的主要原因[2],将造成巨大的经济损失,甚至威胁到人的生命。因此,碳钢在酸性介质中的防护十分必要。硫酸是一种价格便宜的强酸,常用于酸洗、酸化、水处理、化学清洗等过程中,不可避免地与碳钢接触,造成碳钢腐蚀。目前防止金属腐蚀的有阴极保护法、阳极保护法、金属表面覆盖法和缓蚀剂法等方法。缓蚀剂法是添加少量能阻止金属腐蚀或减缓金属腐蚀的物质以保护金属的方法[3],是最常用的金属防护方法之一。
根据化学成分的不同,缓蚀剂主要分为无机缓蚀剂和有机缓蚀剂两大类。早期,无机缓蚀剂使用较多,但随着研究的深入,大多数无机缓蚀剂的毒性较大,在低剂量下容易引起局部腐蚀。有机缓蚀剂符合可持续发展的理念,对环境友好,大多数分子中含有杂原子(氮、氧、硫或磷)、不饱和键或分子结构中具有平面共轭结构的芳环[4],可提供孤对电子对与Fe2+结合,使缓蚀剂分子吸附在碳钢表面,形成化学吸附。缓蚀剂分子与带电荷的碳钢表面之间的静电相互作用也可以形成物理吸附[5]。缓蚀剂分子的吸附可以在金属表面形成一层保护层,取代覆盖在金属表面的水分子层,减少反应的活性位点或改变电荷转移的反应机理,从而减缓金属的腐蚀速度[6]。常见的有机缓蚀剂有酰胺类[7‑8]、有机杂环类[9‑11],氨基酸类[12‑14]及植物提取物[15‑17]等缓蚀剂。
本文选用邻甲基苯磺酰胺(OTS)为缓蚀剂,研究了其在硫酸介质中对碳钢的缓蚀作用,OTS 分子中除含有氮、硫和氧等杂原子外,还含有苯环,可有效吸附在碳钢表面形成防护层,目前对其缓蚀效果的研究尚未见报道。为了进一步提高缓蚀率,降低添加量,利用缓蚀剂之间的协同效应进行了三元复配,研制出了以OTS为主剂的三元复配缓蚀剂。
1 实 验
1.1 材料与仪器
本实验主要实验材料及仪器见表1和表2,实验用去离子水为自制。Ⅱ型碳钢片的表面积为20 cm2。邻甲基苯磺酰胺(OTS)结构式如图1所示。
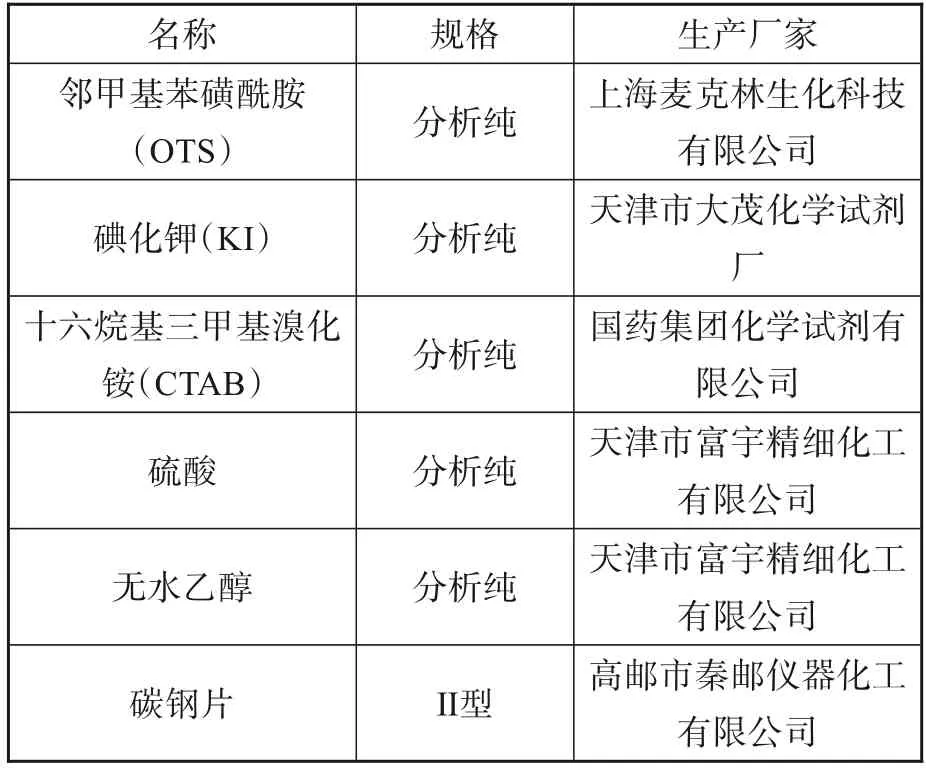
表1 实验材料Tab.1 Experimental materials

表2 实验仪器Tab.2 Experimental instruments
1.2 失重法测试
碳钢片是无油封包装,只需用脱脂棉蘸取无水乙醇后擦拭碳钢片表面,冷风干燥后在电子天平上称重,精确到0.0001 g。将碳钢片悬挂在一定温度下添加了缓蚀剂的0.5 mol·L‑1硫酸溶液中(将碳钢片全部浸入溶液中,并使其顶端距离溶液表面1 cm以上)。浸泡腐蚀8 h后,取出碳钢片,先用去离子水冲洗,再用橡皮擦拭除去腐蚀产物,蒸馏水冲洗,乙醇擦拭,冷风干燥后,称重。设计空白对照组,只加入腐蚀介质,不加入任何缓蚀剂。
实验结果用腐蚀速率v和缓蚀率来表示,计算公式如式(1)和(2)所示。
式中:v是碳钢腐蚀速率,g·cm‑2·h‑1;m0是浸泡前的碳钢片质量,g;m是腐蚀后的碳钢片质量,g;s是碳钢片的表面积,20 cm2;t是腐蚀时间,8 h。
式中:ηv是失重法的缓蚀率,%;v0是未添加缓蚀剂硫酸介质中碳钢片的腐蚀速率,g·m‑2·h‑1;v是添加了缓蚀剂硫酸介质中碳钢片的腐蚀速率,g·m‑2·h‑1。
1.3 电化学测试
电化学测试在30 ℃、0.5 mol·L‑1硫酸溶液中进行,采用三电极体系,对电极为铂电极、参比电极为饱和甘汞电极和工作电极为处理过的碳钢片,用环氧树脂涂抹碳钢片表面,留下1 cm×1 cm 的工作面积,固化24 h 后即可作为工作电极。三个电极被放置在电解池中,并确保它们之间有一定距离,尽量让对电极与参比电极保持平行。将工作电极浸泡在腐蚀溶液中至少30 min,保持开路电位稳定后,再进行电化学测试。
极化曲线扫描范围为-250~+250 mV,扫描速率为0.5 mV·s‑1。由极化曲线可以得到腐蚀电流密度与腐蚀电位之间的关系,并采用式(3)计算极化曲线法的缓蚀率[18]。
式中:ηi是极化曲线法的缓蚀率,%是未添加缓蚀剂硫酸介质(空白溶液)中碳钢片的腐蚀电流密度,μA·cm‑2;iinh是添加缓蚀剂硫酸介质中碳钢片的腐蚀电流密度,μA·cm‑2。
电化学阻抗谱测试频率为10 mHz~10 kHz,并利用阻抗分析软件对阻抗结果进行拟合。采用式(4)计算电化学阻抗谱法的缓蚀率。
2 结果与讨论
2.1 失重法分析
2.1.1 单一缓蚀剂
首先采用失重法对OTS 在30 ℃、0.5 mol·L‑1硫酸溶液中OTS 浓度对碳钢片的腐蚀速率和缓蚀率进行了研究,实验结果如图2 所示。从图2 可以看出,随着OTS 浓度的增大,缓蚀率逐渐增大,腐蚀速率逐渐减小。在实验浓度范围内,当OTS 的浓度为800 mg·L‑1时,缓蚀率可达到70.76 %,之后随着浓度增加到1000 mg·L‑1时,缓蚀率稍微有所提高,但考虑到经济因素,选取800 mg·L‑1为最佳浓度。OTS含有苯环、氨基、S 原子和O 原子等,会吸附在金属表面形成保护膜,抑制碳钢片的腐蚀。
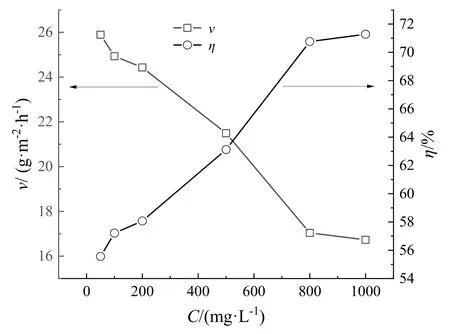
图2 OTS浓度对碳钢片的腐蚀速率和缓蚀率的影响Fig.2 Influence of OTS concentration on corrosion rate and corrosion inhibition efficiency of carbon steel
2.1.2 三元复配缓蚀剂
为了进一步提高缓蚀率,同时减少缓蚀剂用量,降低经济成本,利用缓蚀剂间的协同效应[19]进行了缓蚀剂的复配研究。有机物与卤素离子的缓蚀协同效应的研究开展较早,且对协同机理认识较清楚,有机胺、季铵盐类、硫脲等均与卤素离子在酸性介质中存在明显的缓蚀协同效应。在缓蚀剂中加入少量的表面活性剂,可增强竞争吸附和协同效应,从而提高缓蚀率[19]。经过实验筛选,选取KI 和CTAB 与OTS进行三元复配。设计正交试验并确定各组分浓度,通过实验探索确定了实验的因素和水平如表3 所示。选取L9(34)正交表,进行三元复配,如表4所示,分别计算出相应的腐蚀速率和缓蚀率,并进行极差分析得到RB>RA>RC,表明3 种缓蚀剂浓度对缓蚀率均有影响[20],其中KI 浓度影响最大,其次为OTS浓度,影响最小的为CTAB浓度。经分析可知,最优组合为A3B3C3,OTS 浓度为75 mg·L‑1,KI 浓度为30 mg·L‑1,CTAB 浓度为25 mg·L‑1,即三元缓蚀剂总浓度为130 mg·L‑1,浓度比OTS∶KI∶CTAB=15∶6∶5,因正交试验表中并无此组合,又通过3 次失重实验进行了验证,最终得到三元最优复配浓度的平均缓蚀率为98.18 %。下文出现的三元缓蚀剂均指最优浓度配比下的三元缓蚀剂。
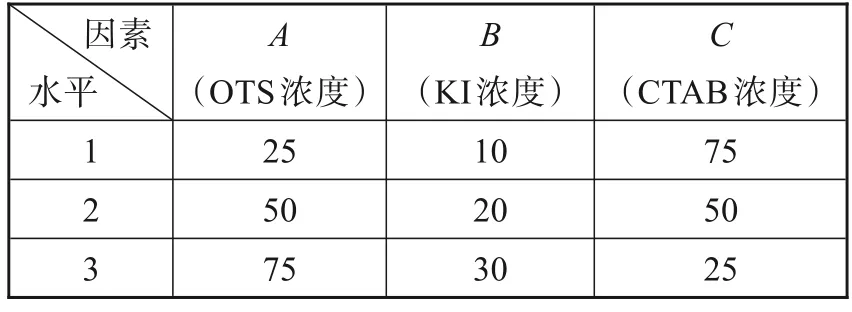
表3 因素水平表Tab.3 The table of factors and levels

表4 正交试验表Tab.4 The table of orthogonal experiment
2.1.3 温度的影响
通过失重法研究了三元缓蚀剂对温度的适应性。不同温度(20~60 ℃)下,碳钢片在未添加任何缓蚀剂和添加了三元缓蚀剂的0.5 mol·L‑1硫酸溶液中的腐蚀速率如图3 所示,由此计算得到的缓蚀率见图4。由图3可知,碳钢在空白溶液及含三元缓蚀剂的硫酸溶液中的腐蚀速率均随温度升高而增加,可能是因为温度升高会加大分子之间的热运动,从而加速了碳钢的腐蚀。但温度相同时,碳钢在空白溶液中的腐蚀速率远远大于添加了三元缓蚀剂的硫酸溶液。由图4可知,在实验温度范围内,三元缓蚀剂对碳钢的缓蚀率均在90 %以上,说明三元缓蚀剂对温度有较好的适应性。随着温度上升,缓蚀率稍有下降,说明三元缓蚀剂的缓蚀率与温度有关。因此可采用Arrhenius 方程计算腐蚀过程的活化参数。
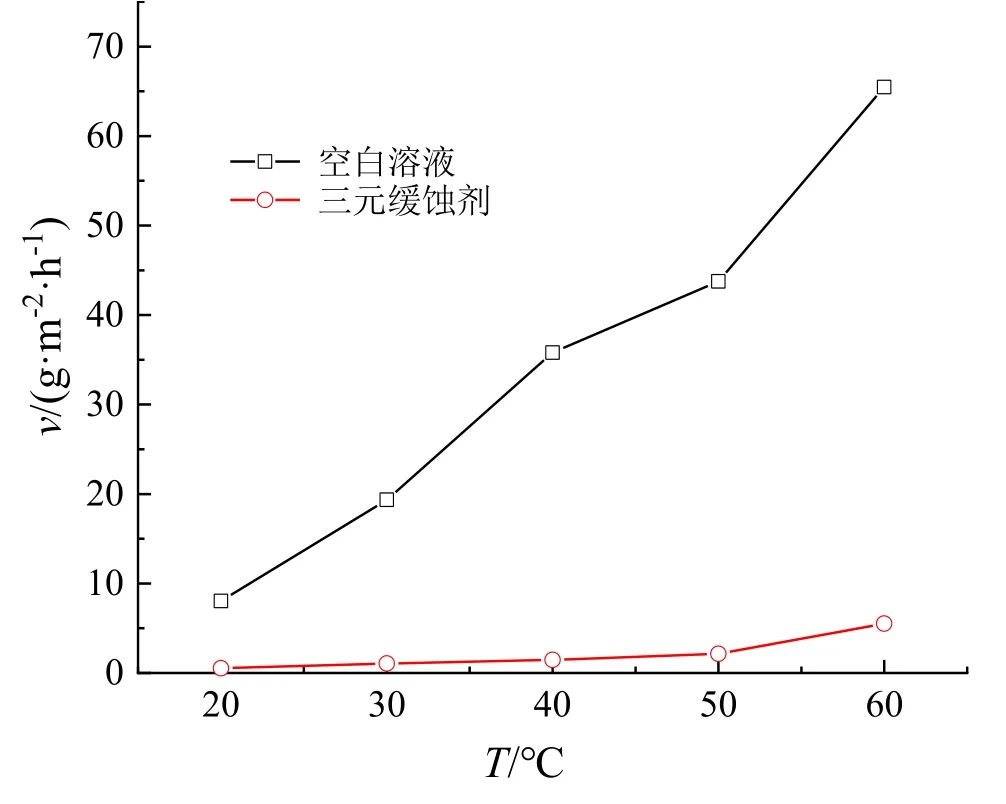
图3 温度对碳钢腐蚀速率的影响Fig.3 Effect of temperature on corrosion rate of carbon steel
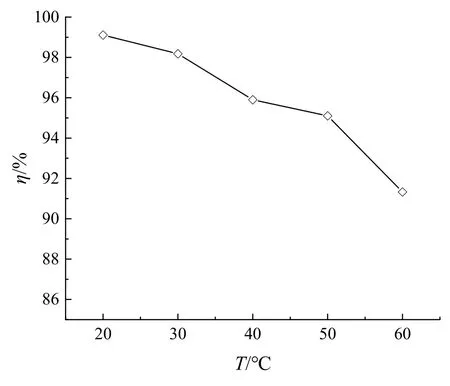
图4 不同温度下三元缓蚀剂对碳钢的缓蚀率Fig.4 Corrosion inhibition efficiency of carbon steel with ternary corrosion inhibitor at different temperatures
根据Arrhenius方程[21]可得:
式中:v是碳钢片腐蚀速率;Ea是腐蚀过程的活化能;R是气体常数;T是绝对温度;A是指前因子。
对lnv与1/T进行线性回归,如图5所示,空白溶液和三元缓蚀剂的线性回归系数分别为0.9391 和0.9997,均接近于1,表明可以用动力学模型来解释碳钢在硫酸溶液中的腐蚀。通过斜率计算出了腐蚀活化能,其在空白溶液和加入三元缓蚀剂的硫酸溶液中的活化能分别为40.99 kJ·mol‑1、79.58 kJ·mol‑1,表明添加了三元缓蚀剂后腐蚀活化能增大。根据文献[22‑23]所述,有缓蚀剂存在时腐蚀过程的活化能比无缓蚀剂存在时更高,是由于缓蚀剂的物理吸附形成的吸附膜,减缓了电荷的传递过程。
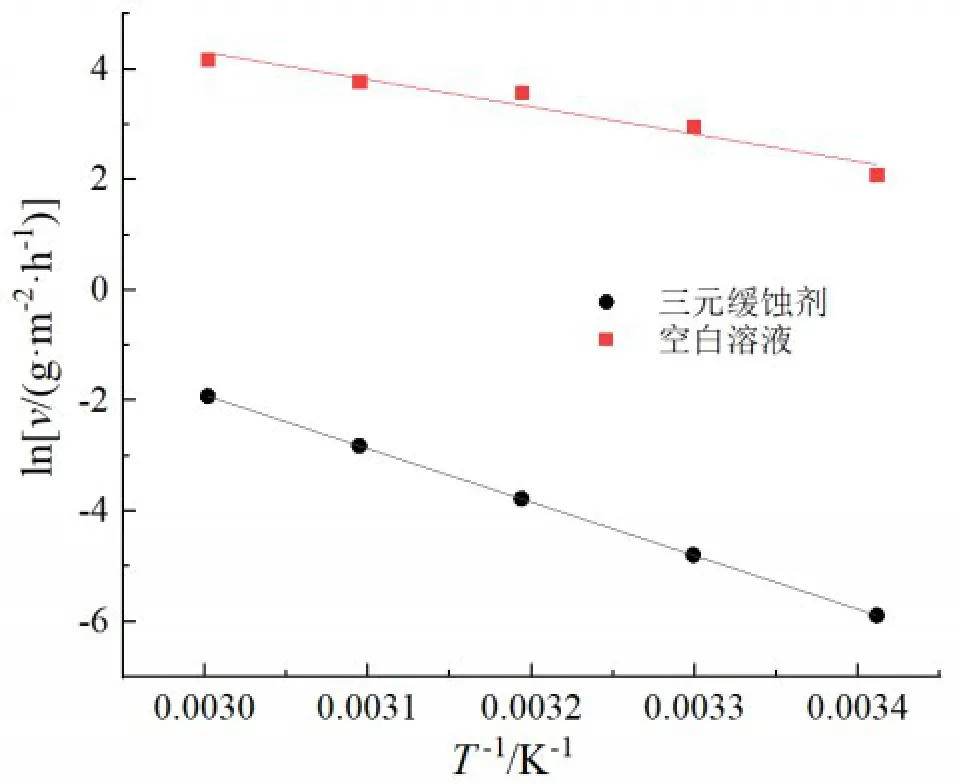
图5 碳钢在空白溶液和添加了三元缓蚀剂的硫酸溶液中的Arrhenius图Fig.5 Arrhenius diagram of carbon steel in sulfuric acid so‐lution without and with ternary corrosion inhibitor
2.1.4 吸附等温模型
为了更全面了解三元缓蚀剂与碳钢之间的相互作用,采用三元缓蚀剂对30 ℃、0.5 mol·L‑1硫酸溶液中的失重法实验数据进行了热力学研究,通过拟合发现Langmuir 等温式描述三元缓蚀剂的吸附行为最合适。Langmuir 等温式如式(6)所示,吸附平衡常数Kads与吸附自由能ΔGads之间的关系如式(7)所示[24]:
式中:C是添加的缓蚀剂浓度;θ是缓蚀剂在碳钢表面的覆盖率,θ=ηv;R为气体常数;T为绝对温度;55.5为溶液中水的浓度。
C和C/θ间的关系,如图6 所示。通过拟合发现,线性相关系数为0.9938,说明C与C/θ具有良好的线性关系,且斜率接近1,表明三元缓蚀剂在碳钢表面的吸附过程符合Langmuir 等温式。通过截距求出Kads,由式(7)可计算出ΔGads=-35.75 kJ·mol‑1,吸附自由能为负值说明反应能自发进行,20 kJ·mol‑1<|ΔGads|<40 kJ·mol‑1介于物理吸附和化学吸附之间,表明三元缓蚀剂在实验条件下,在碳钢表面的吸附过程既有静电相互作用的物理吸附又有电荷共用的化学吸附,为自发的弱化学吸附过程[25‑26]。
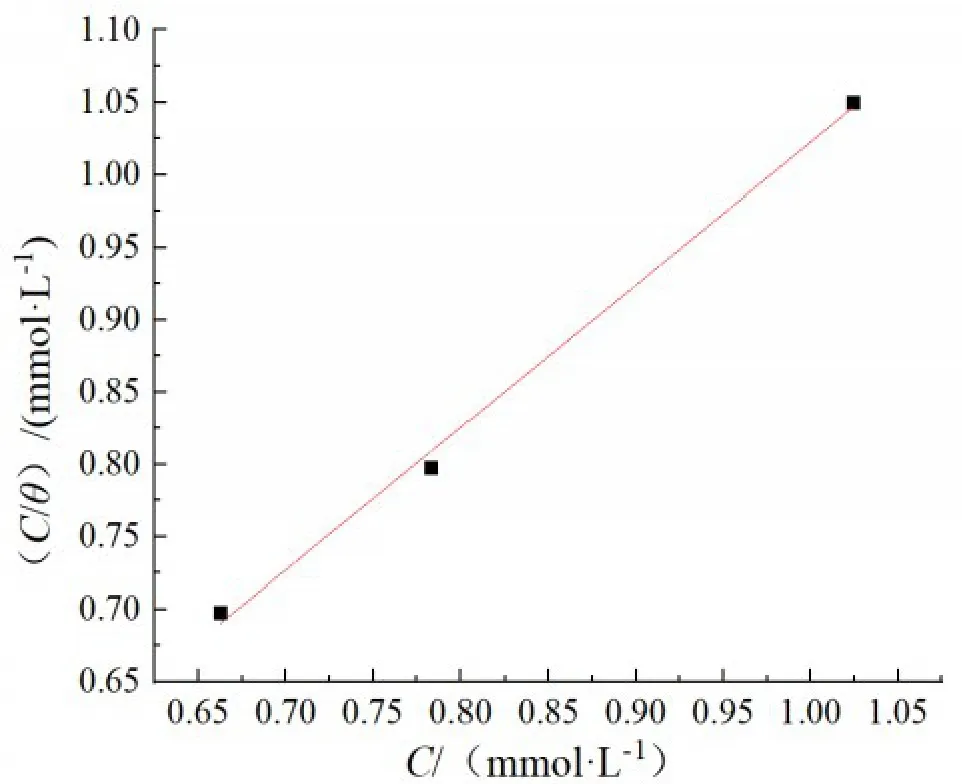
图6 三元缓蚀剂在30 ℃、0.5 mol·L-1硫酸溶液中在碳钢表面的Langmuir吸附等温模型Fig.6 Langmuir isothermal adsorption model of ternary corrosion inhibitor on carbon steel surface in 0.5 mol·L-1 sulfuric acid solution at 30 ℃
2.2 电化学分析
2.2.1 极化曲线法
通过极化曲线法和交流阻抗法等电化学方法进一步研究了三元缓蚀剂在碳钢表面的吸附过程。碳钢分别在不添加任何缓蚀剂、添加800 mg·L‑1OTS和添加三元缓蚀剂的30 ℃、0.5 mol·L‑1硫酸溶液中极化曲线如图7 所示。由图7 采用塔菲尔外推法得到的腐蚀电位Ecorr和腐蚀电流密度icorr以及由式(3)计算得到的缓蚀率ηi见表5。缓蚀率与失重法测得的结果一致。与空白对照组相比,加入OTS 后,腐蚀电位正移,阳极腐蚀电流密度降低。加入三元缓蚀剂后,腐蚀电位显著正移,阴极和阳极腐蚀电流密度均有大幅度降低。说明OTS 为阳极型缓蚀剂,而三元缓蚀剂能同时抑制阳极铁溶解反应和阴极析氢反应,是以抑制阳极反应为主的混合型缓蚀剂[24]。

图7 碳钢在不添加和添加不同缓蚀剂的硫酸溶液中的极化曲线Fig.7 Polarization curves of carbon steel in sulfuric acid solutions without and with different corrosion inhibitors

表5 碳钢在添加不同缓蚀剂的硫酸溶液中的电化学参数Tab.5 Electrochemical parameters of carbon steel in sulfuric acid solution without and with different corrosion inhibitors
2.2.2 电化学阻抗法
缓蚀剂在金属表面的吸附会导致腐蚀体系阻抗的增加,从而引起电荷转移过程中电阻的增加。因此,缓蚀性能可以通过阻抗测量来确定。碳钢分别在不添加任何缓蚀剂、添加800 mg·L‑1OTS 和添加三元缓蚀剂的30 ℃、0.5 mol·L‑1硫酸溶液中的Ny‑quist 图如图8 所示。由图8 可看出,所有的Nyquist图都呈压扁的容抗弧,容抗弧的半径表示金属腐蚀时电荷转移电阻Rct的大小,半径越大,表明缓蚀效果越好[27]。为了得到更准确的结果,采用图8 中插图所示的等效电路对阻抗谱图进行拟合,等效电路是电荷转移电阻(Rct)和恒相位元件(CPE)的并联组合,再与溶液电阻(Rs)串联,拟合所得参数见表6,CPE‑T 和CPE‑P 是CPE 的两个参数。由表6 可知,加入三元缓蚀剂后缓蚀率高到96.42 %,说明三元缓蚀剂在碳钢表面形成的保护膜起到了抑制金属腐蚀的作用。

图8 碳钢在不添加和添加不同缓蚀剂的硫酸溶液中的Nyquist图Fig.8 Nyquist plot of carbon steel in sulfuric acid solutions without and with different corrosion inhibitors

表6 阻抗谱图拟合参数Tab.6 Fitting parameters of Nyquist plot
2.3 碳钢表面形貌分析
采用扫描电镜对碳钢表面形貌进行了检测,在不同实验条件下的碳钢表面形貌如图9 所示。图9(a)为浸泡前的新碳钢片,可观察到表面平整,纹路清晰规律。图9(b)是未添加任何缓蚀剂的0.5 mol·L‑1的硫酸溶液,即空白对照组中浸泡8 h 后的表面形貌,与浸泡前相比,碳钢表面粗糙,腐蚀严重。图9(c)是在添加了800 mg·L‑1OTS 的0.5 mol·L‑1硫酸溶液中浸泡了8 h 后的表面形貌,与空白组相比,表面受损较小,有一定的缓蚀效果,但并不理想。图9(d)是在添加了三元缓蚀剂的0.5 mol·L‑1硫酸溶液中浸泡了8 h 后的表面形貌,可看出几乎无腐蚀痕迹,由此可知三元缓蚀剂具有优异的缓蚀效果。

图9 碳钢片在不同腐蚀条件下的表面形貌Fig.9 Surface morphology of carbon steel sheet under different corrosion conditions
2.4 缓蚀机理探讨
在酸性溶液中缓蚀剂分子可以通过一种或多种方式吸附在碳钢/酸性溶液界面上:静电相互作用、芳香环π 电子与铁的空d 轨道之间的相互作用及缓蚀剂杂原子的孤对电子与铁的空d轨道之间的相互作用。
在酸性溶液中,碳钢中的铁与酸发生反应,生成Fe2+,因此碳钢表明带有正电荷。当加入三元缓蚀剂后,KI在酸性溶液中水解生成带负电荷的I‑,由于库仑力的作用首先吸附在碳钢表面[28]。CTAB 是一种阳离子表面活性剂,在强酸性溶液中,CTAB 电离生成CTA+并带正电荷。OTS 在酸性介质中质子化生成OTSH+,也带正电荷。通过静电吸引,CTA+和OTSH+容易到达碳钢表面,I‑起到架桥的作用,极性基团氨基在碳钢表面吸附后,非极性基团—R 一端在金属表面定向排列,形成了一种吸附复合膜[29‑30],减小了碳钢的腐蚀速率。
从热力学和极化曲线结果分析可知,三元缓蚀剂在碳钢表面的吸附既有物理吸附也有化学吸附,因此除了上述静电相互作用的物理吸附以外,还存在化学吸附。OTS 分子中的苯环及O、N、S 杂原子均与铁的空d 轨道之间的可形成配位化学吸附[31]。物理吸附和化学吸附的双重作用,使得吸附膜致密牢固,因此三元缓蚀剂的缓蚀效果优异。
3 结论
(1)OTS、KI和CTAB组成的三元缓蚀剂最优浓度为OTS 浓度75 mg·L‑1,KI 浓度30 mg·L‑1,CTAB浓 度25 mg·L‑1,即在三元缓蚀剂总浓度为130 mg·L‑1,浓度比OTS∶KI∶CTAB=15∶6∶5 时,缓蚀率为98.18 %。
(2)添加了三元缓蚀剂后由于形成了吸附膜,减缓了电荷的传递过程,腐蚀活化能增大。吸附自由能ΔGads=-35.75 kJ·mol‑1,表明三元缓蚀剂在实验条件下,在碳钢表面的吸附过程既有静电相互作用的物理吸附又有电荷共用的化学吸附,为自发的弱化学吸附过程。
(3)极化曲线表明:加入三元缓蚀剂后,腐蚀电位显著正移,阴极和阳极腐蚀电流密度均有大幅度降低,三元缓蚀剂能同时抑制阳极铁溶解反应和阴极析氢反应,是以抑制阳极反应为主的混合型缓蚀剂
(4)SEM 结果表明:添加了三元缓蚀剂后的碳钢表面形貌几乎无腐蚀痕迹,三元缓蚀剂各组分之间的缓蚀协同作用,使得吸附膜致密牢固,三元缓蚀剂表现出了优异的缓蚀效果。
