电化学实验教学中极化曲线的测量与应用
2017-03-07杨余芳

摘要:采用三价铬溶液体系,设计了线性扫描伏安法实验。介绍了极化曲线的测定和实验数据的处理方法,确定了三价铬还原的活化能、交换电流密度和电子交换系数。阐明了极化曲线的作用及其与电化学反应活化能、动力学参数的关系。
关键词:极化曲线;线性扫描;电化学实验
中图分类号:O646.54 文献标志码:A 文章编号:1674-9324(2017)07-0276-03
一、前言
电化学课程理论性强,难度大。通过实验,可加深学生对电化学理论的理解、熟练基本操作、掌握基本方法,培养严谨求实的作风和动手能力。电化学研究方法较多,而极化曲线的测定是研究电极过程的基本方法[1]。本文以Cr3+的电沉积为例,设计了线性扫描伏安法实验,采用电化学工作站进行测量。通过实验数据处理,加深学生对线性扫描法的特点和基本原理的理解,掌握极化曲线的定量分析和线性扫描伏安法实验技巧。
二、基本原理
1.极化曲线。电流密度与电势的关系曲线即极化曲线,通过极化曲线可求得某一电流密度下的超电势,了解电势随电流密度的变化规律,反映电极电位与电化学反应速度的关系。通过极化率Δφ/Δi可衡量极化的程度、判断电极反应的难易。极化率越小,电极反应越容易进行。通过极化曲线的数据处理,可获得重要的动力学参数,比如交换电流密度、电子传递系数、电化学反应级数和活化能等。在电化学工业生产中,通过对稳态极化曲线的测定,可确定电镀液的最佳配方、最佳工艺条件及添加剂的适宜浓度。
三、实验
1.仪器与试剂。在三电极体系中,以直径1mm的铜丝为研究电极、大面积铂片为对电极,饱和甘汞电极为参比电极,以250mL砂芯H型玻璃槽作为电解槽,用鲁金毛细管消除液接电势。实验前将铜电极用细金相砂纸抛光,用丙酮和无水乙醇清洗,用稀盐酸活化,再蒸馏水洗涤。
电解液:氯化铬25g/L,硼酸50g/L,柠檬酸49g/L,NaBr 20g/L,十二烷基硫酸钠0.1g/L。pH为2.3,用分析纯试剂和蒸馏水配制溶液,用稀硫酸、NaOH调节pH值。溶液陈化后,通入N2 15min除去溶液中的溶解氧。仪器有电化学工作站CHI660E、恒温水浴、pH计等。图1为测量示意图。
2.实验步骤。
(1)接通电化学工作站,打开电脑,进入CHI660E。
(2)在设置菜单点击“实验技术”,选择“线性扫描伏安法”。
(3)在控制菜单点击“开路电位”,测量开路电位。
(4)选择参数:初始电位(伏)=开路电位,终止电位(V)=-1.5,扫描速度(V/s)=0.001,采样间隔(V)=0.001,静置时间(s)=2,灵敏度(A/V)=1.0e-5。或自行设置参数。
(5)点击“运行实验”,测量阴极极化曲线。暂停或停止实验,点击“暂停”或“停止实验”。如出现一水平直线,说明数据溢出,需停止实验,不能直接关闭CHI660E或进行其他操作。增大灵敏度数值,数据便不会溢出。
(6)扫描完毕,保存数据。
(7)在文件菜单中点击“转换为文本”,将文件转换为文本文件。
(8)实验完毕,退出CHI660E,关闭电化学工作站。
四、数据处理
1.活化能测定[3]。图2为Cr3+在不同温度下的阴极极化曲线。随着温度升高,铬离子扩散和迁移速度加快,溶液中活化离子的百分数增大。阴极极化曲线向正电位方向移动,阴极极化减小,电流密度增大,电化学反应速度加快,Cr3+沉積速度提高。
同样,可以得出不同超电势下Cr3+电沉积的表观活化能,如图4所示。
当超电势为0.6V~1.1V时,Cr3+电沉积的表观活化能为45.61~78.37kJ/mol,大于40kJ/mol,表明Cr3+的电沉积属于电化学步骤控制。Cr3+电沉积的表观活化能随着超电势的增大而减小,说明电极电位较负,有利于Cr3+电沉积反应速度的提高。
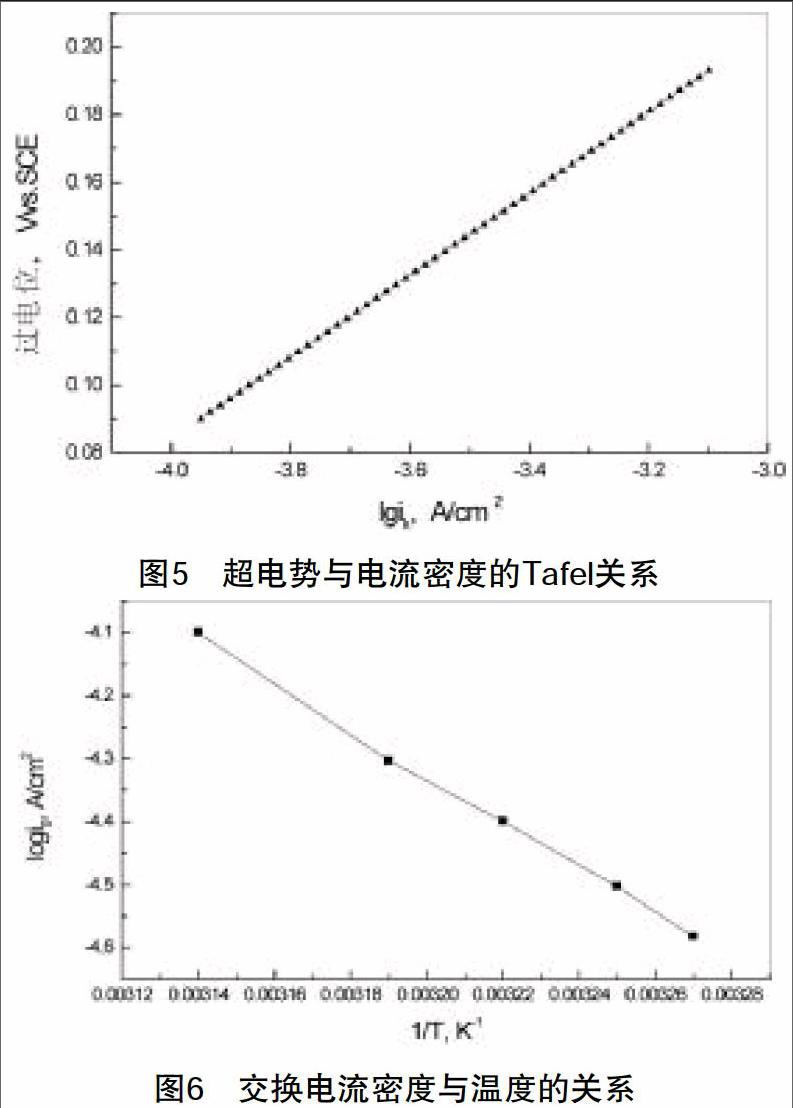
2.动力学参数的测定。图5为25℃时Cr3+电沉积的Tafel曲线,斜率为0.121V,截距为0.568,根据Tafel方程,求得Cr3+电沉积的表观电子传递系数a为0.49,交换电流密度i0为2.02×10-5A·cm-2。
除此以外,通过极化曲线,还可以确定电化学反应的标准速度常数、扩散系数、反应级数,在此不再赘述。只有将理论知识融会贯通,才能得心应手地设计实验并解决问题。通过本文,希望能提高学生的电化学实验兴趣,熟练运用作图软件,正确进行数据处理和数据分析,对其他电化学研究方法起到触类旁通的作用,逐步达到自行设计实验的境界。
参考文献:
[1]舒余德,陈白珍.冶金电化学研究方法[M].长沙:中南工业大学出版社,1990.
[2]龚竹青.理论电化学导论[M].长沙:中南工业大学出版社,1997.
[3]杨余芳.Ni-Fe、Ni-Fe-Cr合金箔及Ni-Cr合金电沉积工艺和基础理论研究[D].中南大学博士论文,2006:121.
Abstract:The linear sweep voltammetry experiments were designed in the trivalent chromium solution. The determination of polarization curves and the processing methods of experimental data were introduced.The activation energy,the exchange current density and the electron exchange coefficient of trivalent chromium reduction were determined.The role of the polarization curves and its relationship between the electrochemical activation energy and the kinetic parameters were explained.
Key words:polarization curve;linear sweep;electrochemical experiment
