基于低共熔溶剂的分散液液微萃取法测定茶饮料中68种农药残留
2024-02-23王华威陈文辉陈升凡李倩倩杜丽平丰李建勋
王华威 陈文辉 陈升凡 李倩倩 杜丽平 叶 丰李建勋 李 熠
(1中国农业科学院农产品加工研究所,北京 100193; 2天津科技大学生物工程学院,天津 300457)
茶是世界上最受欢迎的三种非酒精类饮料之一[1],它拥有众多健康益处,能预防神经系统疾病和心血管疾病[2-3]。随着生活方式和社会环境的变化,人们对即饮茶的需求不断增长,大幅度促进了茶饮料的发展。2021 年,全球茶饮料市场规模为443 亿美元[4]。在有大需求量的同时,茶饮料饮用安全问题也不可忽视。在茶叶种植过程中,为减少病虫害及提高茶叶产量,种植者会施用农药或其他农化产品,过量或不当施用往往会导致农药残留或饮用安全问题,威胁人类身体健康。因此,对茶饮料中的农药残留进行监测十分必要。
目前常用的样品前处理技术主要有QuEChERS(快速、简单、低廉、有效、稳定和安全)[5-6]、固相萃取(solid phase extraction,SPE)[7-8]、固相微萃取(solid-phase microextraction,SPME)[9]和液液萃取(liquid-liquid extraction,LLE)[10-11]。为了有更高灵敏度和痕量化,国内外不断投入研究,以发展新型萃取技术[12]。2006年,Rezaee等[13]首次提出了分散液液微萃取技术(dispersive liquid-liquid microextraction,DLLME),并成功将其用于萃取水中的有机氯和有机磷农药。DLLME 因具有操作简单、快速、有机试剂用量少、成本低、回收率高优势而备受关注,该技术已广泛应用于茶叶、果蔬、茶饮料、果汁等食品中农药的提取。然而,使用含氯的高毒性有机溶剂(如C2Cl4、CCl4)作为萃取溶剂会增加试验人员中毒风险与环境污染负担。尽管基于离子液体(ionic liquid,IL)的DLLME 比基于有机溶剂的DLLME具有显著的生态友好优势[14],但IL 的缺点同样不可忽视,如复杂的合成过程、较高的价格和潜在的毒性。因此,寻找低成本、无毒、绿色环保的溶剂是DLLME 开发和应用中的重要任务。
低共熔溶剂(deep eutectic solvent,DES)是一种新型的环保溶剂,由氢键供体(hydrogen bond donor,HBD)和氢键受体(hydrogen bond acceptor,HBA)组成,熔点极低,其远低于各单一组分的熔点[15-16]。常用加热搅拌法合成DES,还有真空蒸发法和冷冻干燥法等。DES制备简单,成本低,且具有可降解和生物相容性好等特有性能[17-19],成为近些年来研究的热点,已被广泛应用于植物中有效成分的提取[20]。
本研究使用的绿色低共熔溶剂以氯化胆碱(choline chloride,ChCl,无毒害)为氢键受体,六氟异丙醇(hexafluoroi-sopropanol,HFIP)为氢键供体。以该DES为萃取剂,利用DLLME法对茶饮料中的农药进行萃取,结合高效液相质谱-串联质谱(high-performance liquid chromatography-tandem mass spectrometry,HPLCMS/MS)进行检测,并全面优化前处理条件和分析方法。旨在为茶饮料食用与进出口安全提供保障。
1 材料与方法
1.1 材料与试剂
15 种茶饮料包括康师傅(茉莉清茶、冰红茶、绿茶、茉莉蜜茶)、统一(冰红茶、绿茶)、三得利(乌龙茶)、东方树叶(红茶、青柑普洱、绿茶、茉莉花茶)、茶π(柚子绿茶、柠檬红茶、蜜桃乌龙茶、青提乌龙茶);乙腈、甲醇(纯度99.9%,色谱纯),赛默飞世尔科技(中国上海)有限公司;甲酸(纯度99.5%,分析纯),北京市通广精细化工有限公司;氯化胆碱(ChCl,纯度98%)、六氟异丙醇(HFIP,纯度99.5%),北京索莱宝科技有限公司;68种农药标准品(纯度≥95%),上海泰坦科技股份有限公司;ACQUITY UPLC®BEH C18(2.1 mm×50 mm,1.7 μm)色谱柱,美国沃特世公司。
本研究选取统一牌绿茶饮料作为代表样品进行方法优化和验证,参考GB/T 23200.13-2016《食品安全国家标准 茶叶中448种农药及相关化学品残留量的测定 液相色谱-质谱法》[21]以及欧盟、国际法典委员会制定的茶叶中农药最大残留限量值(maximum residue limits,MRLs),并通过前期研究基础和调研文献,将检出率较高、不合格率高的部分农药汇总,最终选取茶叶中68种农药残留进行测定。
1.2 仪器与设备
Agilent 1290-6495 高效液相色谱三重四极杆质谱联用仪,美国Agilent 公司;HMS-901磁力搅拌器,深圳市博大精科技实业有限公司;Milli-Q Synergy 超纯水系统,美国Millipore 公司;TG18.5 台式高速离心机,长沙综仪生物科技有限公司;MS200多管涡旋混匀仪,杭州瑞诚仪器有限公司;Vortex-Genie2 涡旋振荡器,美国Scientific Industries(SI)公司;XPR303SN/AC 电子天平,梅特勒托利多科技(中国上海)有限公司。
1.3 试验方法
1.3.1 制配标准溶液 将每种农药标准物质用甲醇稀释成100 mg·L-1的标准储备液,避光-20 ℃保存。将每种标准储备液精确量取至同一个10.00 mL 容量瓶中,甲醇定容,获得1 mg·L-1的混合标准溶液,避光保存于-20 ℃冰箱中备用。
1.3.2 样品前处理 以绿茶饮料为基质,取适量体积于4 ℃下保存。
1.3.3 DES的制备 如图1所示,其中ChCl为氢键受体,HFIP 为氢键供体。根据物质的量比1∶2(ChCl∶HFIP)来称量,将其与磁转子一起放入10.00 mL 圆底烧瓶中,后放于磁力搅拌器上,经80 ℃恒温水浴加热后,形成透明均一的液体,将其密封保存,放置在-20 ℃下保存。经过24 h 的观察,如DES 无絮状沉淀和凝胶现象且保持澄清透明,则表明DES 能够使用[22]。
图1 DES合成路线Fig.1 DES synthesis route
1.3.4 DLLME 步骤 精确吸取5.0 mL 茶饮料置于15.00 mL 离心管中,加入200 μL DES、1.6 mL 乙腈。将混合溶液进行涡旋2 min,随后在6 000 r·min-1的转速下离心6 min,水相位于上层,DES相位于底层。去除上层水相后,下层DES相过0.22 μm滤膜,后进样分析。
1.3.5 色谱条件 柱温35 ℃,流速为0.3 mL·min-1,进样量5.0 μL。以0.1%的甲酸-水溶液作为流动相A,以乙腈作为流动相B,采用梯度洗脱方法,程序见表1。

表1 梯度洗脱表Table 1 Gradient elution procedure
1.3.6 质谱条件 采用电喷雾离子源(electrospray ionisation source,ESI);扫描模式:动态多反应监测模式(dynamic multi-response monitoring model,DMRM);喷嘴电压2 000 V;离子源温度280 ℃;干燥气流速12 L·min-1;雾化器压力206.85 kPa;鞘气温度350 ℃,流速10 L·min-1。表2为68种农药的质谱参数。

表2 68种农药的质谱参数Table 2 Mass spectral parameters of 68 pesticides
1.4 数据处理
通过MassHunter workstation B.07.00 提取保留时间和色谱峰面积,以及重复测定的试验结果的回收率和相对标准偏差(relative standard deviation,RSD)。使用Excel 2019 软件处理数据,使用Origin 8.0 制图软件绘制谱图及图表。
2 结果与分析
2.1 质谱条件优化结果
为优化质谱参数,将100 μg·L-1的单一标准溶液作为对照品,首先,在电喷雾离子源正离子电离(electrospray ionization+,ESI+)下进行全扫描,获得响应较高的母离子信息;其次,进行子离子扫描,选择两个丰度较高的特征碎片离子,并在DMRM 模式下优化碰撞能,确定最佳质谱参数信息,参数详见表2。
2.2 前处理方法优化结果
2.2.1 离子强度 溶液中离子强度会因为NaCl等无机盐的盐析作用而改变,从而减小目标物在水相中的溶解度,促使其转入萃取相中,提高萃取率[23]。试验选取的NaCl添加梯度为0、0.02、0.05、0.08、0.01 g·mL-1。结果显示(图2),NaCl 添加浓度对茶饮料基质中农药回收率的影响不明显;不添加NaCl 时,平均回收率处于最大值;当添加浓度为0.02~0.08 g·mL-1时,平均回收率无明显变化,但0.1 g·mL-1添加浓度时的平均回收率明显降低,可能是离子强度增大后,降低了溶液的传质效率,最终导致萃取效果降低。因此,本试验选择不添加NaCl。

图2 离子强度的影响Fig.2 Effect of ionic strength
2.2.2 萃取剂体积 针对ChCl-HFIP 体积进行优化,选取DES 体积为100、150、200、250、300、350、400 μL。结果如图3 所示,随着萃取剂体积增加,各类农药回收率均保持先上升后下降的趋势。当萃取剂DES 用量为100 μL 时,其在待测液中体积过小,在乳化剂作用下也无法形成DES 相;当DES 用量为150~200 μL 时,萃取效果较佳,各类农药的平均回收率均大于70%,DES 用量为200 μL 时,回收率达最大值;当萃取剂用量高于200 μL 时,回收率均明显下降。因此,萃取剂DES最佳选用量为200 μL。
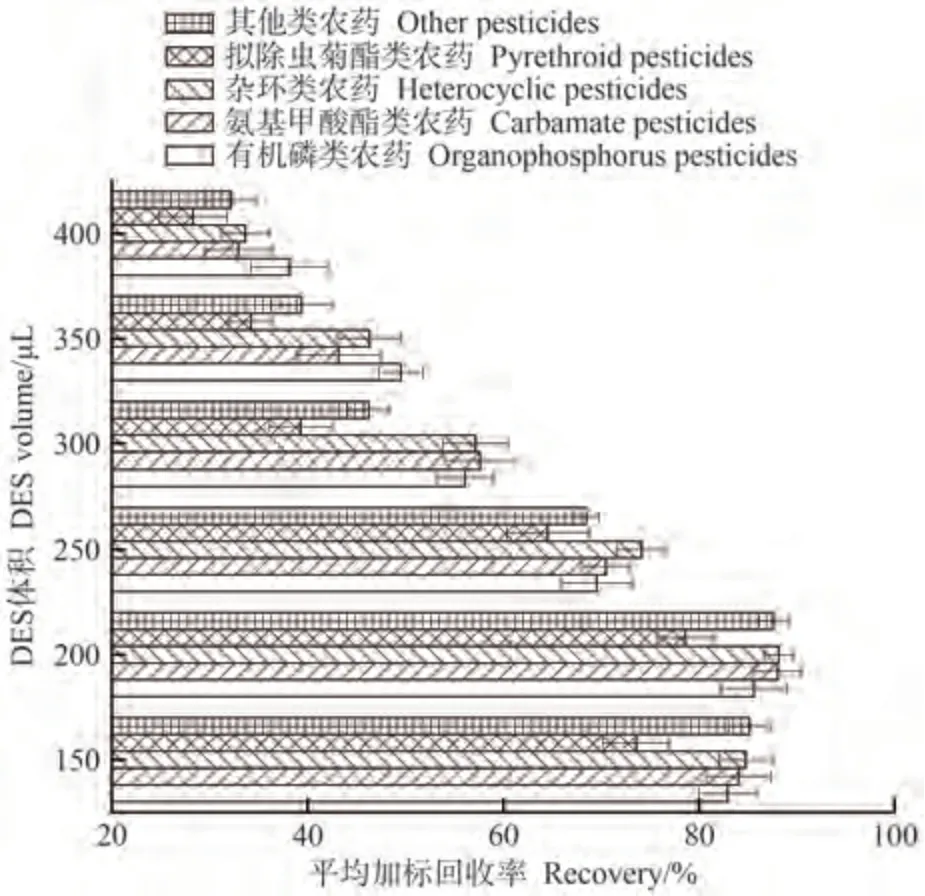
图3 萃取剂用量的影响Fig.3 Effects of extractant volume
2.2.3 乳化剂体积 在待测液中加入适量乳化剂可诱导DES 的快速生成并富集于样品溶液底部,有利于DES相的回收。本试验选择乙腈作为乳化剂,考察用量1.0、1.2、1.4、1.5、1.6、1.8、2.0 mL 对回收率的影响。结果表明(图4),萃取效果随着乙腈用量增加而先增大后降低,当添加量为1.6 mL 时,平均回收率达到最大值。因此,后续试验选择添加乳化剂体积为1.6 mL。

图4 乳化剂用量的影响Fig.4 Effects of emulsifier volume
2.2.4 涡旋时间与超声时间 本研究针对涡旋时间10、30、60、120、180、240 s进行优化。结果如图5所示,在涡旋时间10~120 s 范围内,各类农药回收率随涡旋时间的延长呈上升趋势,在120 s 时回收率达到极值;涡旋时间超过120 s 后,回收率无明显变化,因此选择120 s为最佳涡旋时间。进一步优化超声时间(0、3、5、10、15、20 min),结果如图5 所示,不超声时,各农药残留的萃取效果最佳;超声时间在1~10 min 范围时,各类农药回收率变化不明显;萃取时间超过10 min后,各类农药回收率明显下降,可能是超声时间过长导致部分农残降解[24]。因此,在前处理中不选择超声步骤。

图5 涡旋时间、超声时间的影响Fig.5 Effect of vortex time and ultrasonic time
2.3 基质效应评价
基质效应(matrix effect,ME)是指非待测物对目标物浓度的影响,普遍存在于茶叶及茶饮料农残检测,会对检测结果造成影响,普遍是制作基质匹配标准曲线对农药残留检测的基质效应进行校正[25]。本研究采用基质加标法评估基质效应。制得100 μg·mL-1的茶饮料基质匹配标准溶液,与对应的标准溶液峰面积进行对比得到每种农药的基质效应。根据公式[26]计算基质效应:
68 种农药在茶饮料基质中的基质效应结果如图6所示,ME值范围为-47.5%~33.2%,负值居多,说明基质抑制效应更明显。本试验利用茶饮料基质匹配标准曲线来减少基质效应对农药残留定量结果的影响。
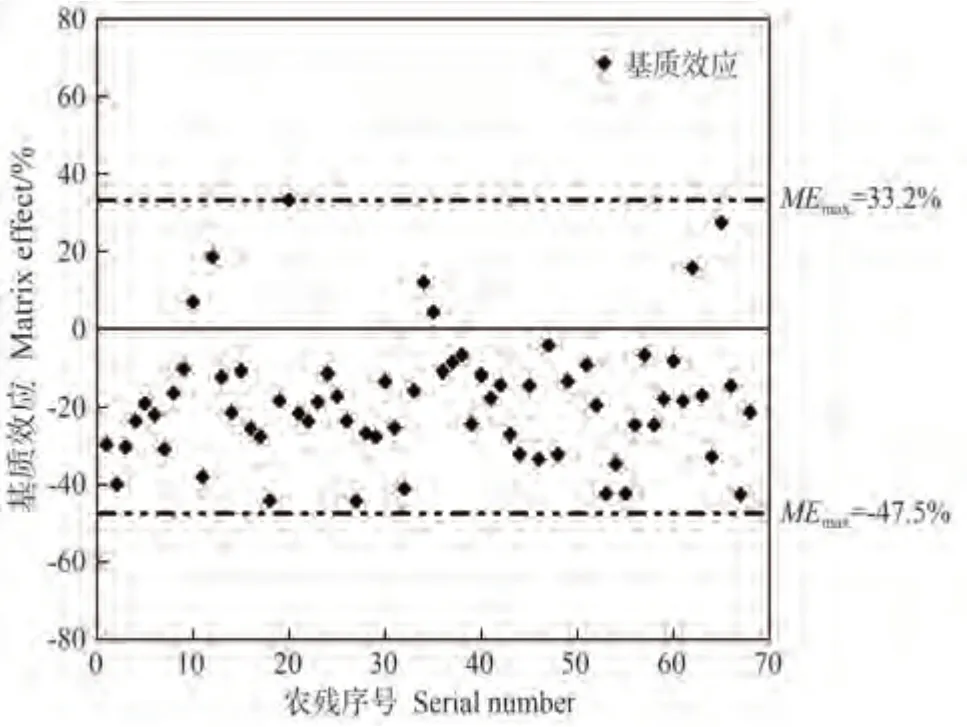
图6 68种农药在液体基质的基质效应Fig.6 Matrix effects of 68 pesticides in tea beverage matrices
2.4 方法学验证
2.4.1 线性范围和定量限 由表3 可知,多数农药在1~500 或10~500 μg·L-1浓度范围线性关系良好,个别农药化合物线性范围较小,如乐果、异丙隆等,相关系数(r2)皆大于0.995,定量下限(lower limit of quantification,LOQ)选择信噪比为10 的定量离子对色谱峰,本方法的定量限为0.2~10.0 μg·kg-1。

表3 68种农药线性关系、定量限、基质效应与方法的精密度Table 3 The linearity,limit of quantification,matrix effects and method precision of 68 pesticides
2.4.2 准确度与精密度 各农药回收率和相对标准偏差由加标回收试验得到。在3 个加标水平(10、50、100 μg·kg-1)下68 种农药的平均回收率分别为59.1%~103.6%、67.3%~105.4%和70.5%~113.7%,RSD 均小于10.0%,结果重现性好,符合检测要求。
2.5 实际样品测定
为验证上述前处理方法的适用性,对15 种常见市售的茶饮料(统一、康师傅、东方茶叶、茶π 等)进行农药残留检测。共检出5 种农药,结果如表4 所示,通过与欧盟委员会(EC)和中国国家标准GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》[27]发布的MRLs标准对比,均未发现超标现象。
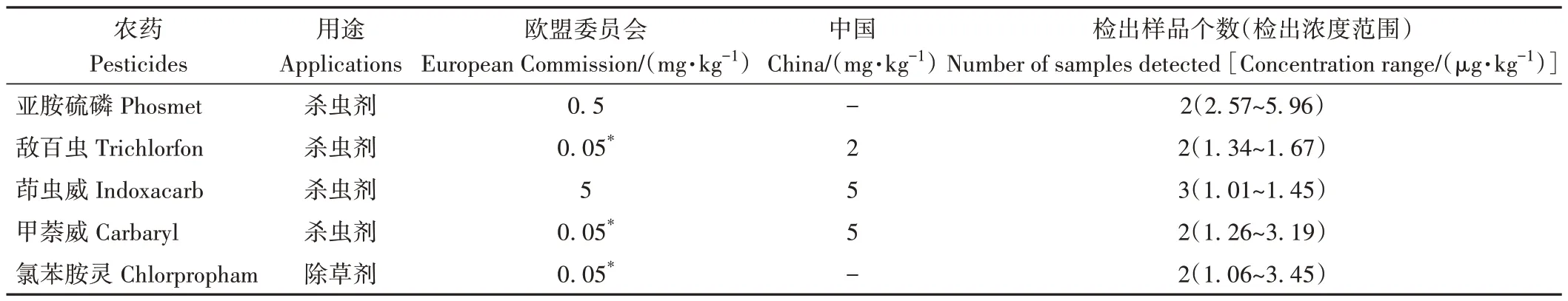
表4 15种市售茶饮料实际样品检测结果Table 4 The actual sample detection results of 15 kinds of marketing tea beverage
3 讨论
本研究基于DES 的分散液液微萃取前处理方法,结合HPLC-MS/MS 测定了茶饮料中的68种农药残留,与传统方法相比具有一定优势。
傅强等[28]采用固相萃取技术测定茶饮料中5种农残含量,使用乙腈提取并经过Florisil柱净化,氮吹复溶后进行气相色谱串联质谱仪(gas chromatography-mass spectrometry,GC-MS)分析,该方法预处理时间较长,而本研究极大缩短了预处理时长,30 min 以内即可完成预处理操作。聂宏骞等[29]使用分散液液微萃取结合气相色谱-三重四级杆质谱法(gas chromatography-triple quadruple mass spectrometry,GC-MS/MS)测定茶饮料中的5 种农药残留时,采用了具有挥发性和较强毒性的四氯甲烷,会威胁试验员和环境安全,而本研究采用DES 作为萃取剂,无毒性,是一种绿色环保的前处理方法。
宋宁慧等[30]采用固相萃取技术结合GC-MS 测定12种拟除虫菊酯类农残,用20 mL乙酸乙酯萃取3次并通过固相萃取净化,得到12 种农药回收率为71.8%~104.2%,但该方法有机试剂使用量较大,步骤也较为繁琐。
本研究采用DES 作为萃取剂,结合HPLC-MS/MS对茶饮料中的68 种农残含量进行检测,通过前处理优化试验,包括离子强度、萃取剂体积、乳化剂体积、涡旋时间和超声时间等,获得最佳前处理条件,通过方法学考察,得到68种农药平均加标回收率为59.1%~113.7%,符合农残检测要求,在预处理时长、有机试剂的使用量、环保等方面上较上述方法均有较大优势。
但本研究也存在基质效应问题,因此后续可比较研究不同种类低共熔溶剂对茶饮料中农药多残留的萃取效果,以降低基质效应,进一步降低农药残留的检出限,为茶饮料的相关检测技术提供更加新颖的预处理方法。
4 结论
本研究建立了一种DLLME-HPLC-MS/MS 测定茶饮料中68 种农药残留的方法,以绿色环保的DES(ChCl-HFIP)为萃取剂,并以乙腈为乳化剂。全面优化前处理条件后,回收率最优组合为:ChCl 与HFIP 的物质的量配比为1∶2,添加200 μL DES、1.6 mL 乙腈,再进行2 min 涡旋震荡。此方法快捷且灵敏,LOQ 为0.2~10.0 μg·kg-1,回收率高、绿色环保且成本低,可作为一种全新并快速有效的技术手段应用于茶饮料中农药多残留的检测。
