辣椒交替氧化酶全基因家族的鉴定及表达分析
2024-02-23张赐楷殷菲胧杨丁招曲德智刘云芬
宋 茜 帅 良 张赐楷 殷菲胧 杨丁招 曲德智 刘云芬,
(1广西科技大学生物与化学工程学院,广西 柳州 545006; 2南昌师范学院,化学与食品科学学院,江西 南昌 330023;3贺州学院食品与生物工程学院/广西康养食品科学与技术重点实验室,广西 贺州 542899)
辣椒(CapsicumannuumL.)为茄科(Solanaceae)辣椒属(Capsicum)一年或有限多年生的双子叶植物,是生长于热带亚热带地区的重要经济作物和粮食作物,也是我国蔬菜的核心产业之一[1]。因其喜温,不耐热和冷,最适生长温度为20~30 ℃,环境温度过高或过低都会导致植株萎蔫,授粉率和坐果率降低,从而造成产量严重下降[2]。因此,挖掘与辣椒抗逆性相关的基因,对提高辣椒抗逆性具有重要意义。
植物线粒体电子传递链中包含两种末端氧化酶,一种是常见的细胞色素氧化酶,另一种则是交替氧化酶(alternative oxidase,AOX)[3-4]。交替氧化酶也称抗氰氧化酶,是位于线粒体内膜的抗氰化物呼吸的末端氧化酶,广泛存在于高等植物以及部分真菌和藻类的线粒体电子传递链中[5]。当细胞色素氧化酶被氰化物等抑制时,交替氧化酶通过绕过复合物Ⅲ和复合物Ⅳ,直接将泛醇氧化并将分子氧还原为水来提供和维持稳态,此过程不产生腺嘌呤核苷三磷酸(adenosine triphosphate,ATP),大部分能量以热量的形式消散[6-7]。AOX由高等植物中一个小的多基因家族编码,该基因家族可根据序列同源性和系统发育关系分为两个亚家族,即AOX1和AOX2[8]。AOX1和AOX2存在于双子叶植物中,而单子叶植物中仅存在于AOX1[9]。据报道,AOX1 参与调节植物各种生物和非生物胁迫,而AOX2 则在发育上表达[10]。有证据表明,某些植物中的AOX2 也参与响应渗透胁迫等非生物胁迫[11]。如DcAOX2a在胡萝卜(DaucuscarotaL.)根的次生生长和冷胁迫响应中具有双重作用[12];IbAOX1a和IbAOX1b参与甘薯(Ipomoea batatasL.)低温胁迫[9];AtAOX1d响应拟南芥(Arabidopsis thalianaL.)砷胁迫[13];原花青素通过下调荔枝(Litchi chinensisSonn.)果皮和果肉LcAOX1的表达来降低呼吸速率,进而延缓荔枝褐变[14]。同时AOX介导的信号传导和代谢功能在植物生长发育、衰老、死亡中也起着重要作用。抑制AOX活性显著影响了番木瓜愈伤组织的分化,并完全抑制了体细胞胚的分化,证明AOX对番木瓜体细胞胚分化至关重要[15]。此外,外源H2S通过激活抗氰呼吸进而促进拟南芥种子萌发[16]。Oliveira等[7]研究发现,AOX途径还参与木瓜后熟。以上研究表明,AOX在植物的生长发育以及抗逆性中发挥着重要作用。
到目前为止,已从拟南芥、水稻、玉米、毛竹等植物中分离鉴定出AOX基因[17-19],但关于辣椒AOX 基因家族的研究仍鲜有报道。鉴于此,本研究通过Blastp 结合结构域筛选的方法,以拟南芥蛋白序列为参考序列从辣椒基因组检索鉴定出交替氧化酶基因相关家族成员,并对这些家族成员基因进行了生物信息学、组织特异性以及非生物胁迫表达分析,以期为后期研究AOX功能奠定理论基础。
1 材料与方法
1.1 试验材料与试剂
本研究采用中椒6 号辣椒种子为试验材料,购自贺州市种子公司。Quick RNA Isolation Kit植物总RNA提取试剂盒和SuperScript cDNA Synthesis Kit 反转录试剂盒均购自北京华越洋生物科技有限公司;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂购自加拿大abm公司;其余试剂均为国产分析纯。
1.2 样品处理
辣椒种子经浸泡过夜后,于(28±1)℃条件下催芽,出芽后播种于塑料营养钵,置于恒温培养箱中养护,养护条件为:温度(25±1)℃,光照16 h。待植株长至5~6片真叶时,采集其根、茎、叶,于花期采集辣椒花,每个组织样品分成3 份,用于不同组织荧光定量分析。选取长势良好、长势基本一致的幼苗(约40 d)进行高、低温胁迫和植物激素处理。分别设置低温胁迫[(4±1)℃][20]、高温胁迫[(42±1)℃]、脱落酸(abscisic acid,ABA)处理(30 μmol·L-1)[21]和赤霉素(gibberellins,GA)处理(150 mg·L-1)[22],以正常室温栽培下清水浇灌作为对照(CK)。每组处理10棵幼苗,每个处理设3 次重复。经高温、低温胁迫处理0、1、2和4 h后分别取辣椒第3~第4 片叶,激素处理0、2、4 和6 h 后取辣椒第3~第4 片叶,用于后续基因定量分析。辣椒组织样品经液氮速冻后立即放入-80 ℃超低温冰箱保存备用。
1.3 植物总RNA的提取及cDNA的合成
采用植物总RNA 提取试剂盒提取辣椒不同组织的总RNA,具体操作方法参照说明书。使用超微量分光光度计(北京凯奥科技发展有限公司)和1%琼脂糖凝胶电泳检测RNA的质量。以提取的总RNA为模板,利用反转录试剂盒合成cDNA,合成方法参照说明书,合成的cDNA于-20 ℃冰箱中保存备用。
1.4 CaAOXs的表达分析
以CaActin为内参,所用荧光定量引物详细信息见表1,CaAOXs的相对表达量采用2-△△Ct法计算。每个样品的表达量均为3次重复的平均值。

表1 CaAOXs的qRT-PCR引物序列Table 1 qRT-PCR primer sequences of CaAOXs
1.5 辣椒AOX基因家族鉴定
辣椒的基因组数据从NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中获得,并从NCBI 数据库中搜索下载拟南芥的5 个AOX 蛋白序列(AT1G32350、AT3G22360、AT3G22370、AT3G27620 和AT5G64210)。以拟南芥的AOX 蛋白序列作为参考序列,利用TBtools 2.012 与辣椒基因组中进行Blastp 比对。将所获得的候选序列基于AOX 结构域进行进一步比对筛选。根据在进化树上的分类及其在染色体上的位置信息对筛选后的辣椒AOX基因家族成员进行命名。
1.6 生物信息学分析
生物信息学分析参考帅良等[23]的方法进行。使用在线分析工具ExPASy(http://web.expasy.org/protparam/)对辣椒AOX 家族蛋白质的分子量、氨基酸数、理论等电点(pI)、稳定性以及亲/疏水性等理化性质进行分析统计。使用TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行跨膜结构分析;SignalP(http://www.cbs.dtu.dk/services/SignalP-4.1/)进行信号肽预测;PRABI(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白质二级结构分析;SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白质三级结构。利用MEGA7 软件构建系统发育树;通过MEME(http://meme-suite.org/tools/meme)预测保守基序;利用Plant CARE(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析辣椒AOX启动子区域顺式作用元件并通过生物信息学分析工具TBtools 对上述结果进行分析与可视化。
1.7 统计分析
使用Excel 2019进行数据处理和分析,使用Origin 8.5 作图,并使用Adobe Illustrator 2022 软件进行图形美化和编辑。
2 结果与分析
2.1 辣椒全基因组的AOX 基因鉴定及其蛋白质理化性质分析
通过Blastp 结合结构域筛选的方法,从辣椒基因组搜索鉴定出AOX基因家族成员,最终得到12个辣椒AOX基因序列,分别命名为CaAOX1c11、CaAOX1a19和CaAOX1b11、CaAOX2d11、CaAOX2a16、CaAOX2a11、CaAOX2c13、CaAOX2a18、CaAOX2b13、CaAOX2a13、CaAOX2a22、CaAOX2b19。
使用ExPASy中的Protparam模块预测AOX蛋白的理化性质(表2),结果表明12 个辣椒AOX 蛋白的氨基酸数为146~513;理论等电点为4.41~8.80,表明12 个CaAOXs 蛋白中既有酸性蛋白又存在碱性蛋白;除CaAOX1b11、CaAOX1c11、CaAOX2a11、CaAOX2a13 为稳定的亲水性蛋白,以及CaAOX2c13 为稳定的疏水性蛋白外,其余AOX蛋白均为不稳定的亲水性蛋白。CaAOXs蛋白跨膜结构和信号肽预测结果表明,仅有3 个CaAOXs 蛋白(CaAOX2b13、CaAOX2a11 和CaAOX2c13)存在跨膜结构,且CaAOXs 蛋白均无信号肽,表明CaAOXs 蛋白不是分泌性蛋白。染色体定位结果表明,12 个CaAOXs分布在辣椒的6 条染色体上,其中CaAOX1b11、CaAOX1c11、CaAOX2a11和CaAOX2d11位于11 号染色体,CaAOX2a13、CaAOX2b13和CaAOX2c13位于13 号染色体,19 号染色体上包含CaAOX1a19和CaAOX2b19;CaAOX2a16、CaAOX2a18和CaAOX2a22则分别位于16、19和22号染色体,暗示CaAOXs可能具有不同的功能性质。亚细胞定位预测结果显示,CaAOX2a22 定位于叶绿体;CaAOX2d11 定位于核;CaAOX2b19 定位于细胞质或者线粒体;CaAOX2a16 则定位于线粒体或者核,其余的AOX 蛋白均定位于线粒体。这表明AOX蛋白可能在线粒体中起着重要作用。
2.2 植物AOX蛋白进化分析
对拟南芥(5 个,AtAOXs)、水稻(3 个,OsAOXs)、甘薯(2 个,PeAOXs)、番茄(2 个,SlAOXs)以及辣椒12 个AOX 蛋白的氨基酸序列使用邻接法构建系统进化树,结果如图1 所示,24 个AOX 蛋白可分为AOX1 和AOX2 两个亚家族,其中辣椒的CaAOX1c11、CaAOX1a19 和CaAOX1b11 隶属于AOX1 亚族,而其余9个蛋白均属于AOX2亚族。此外,辣椒与番茄同为茄科亲缘关系比较接近,与拟南芥、甘薯以及水稻亲缘关系较远。
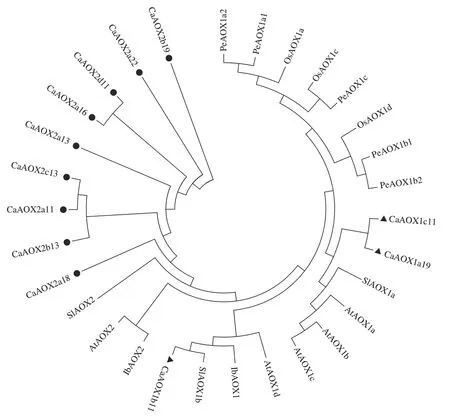
图1 CaAOXs系统进化树分析Fig.1 Phylogenetic tree analysis of CaAOXs
2.3 CaAOXs蛋白二级结构及三级结构预测分析
使用PRABI 对CaAOXs 蛋白二级结构进行预测,结果如表3 所示,α-螺旋、β-折叠、延伸链和无规则卷曲在CaAOX1 亚族蛋白中分别占49.58%~60.99%、4.40%~6.27%、9.72%~13.73% 和22.53%~31.37%;在CaAOX2 亚族蛋白的二级结构中分别占45.85%~63.70%、3.92%~9.34%、8.96%~17.51%和19.18%~36.26%。
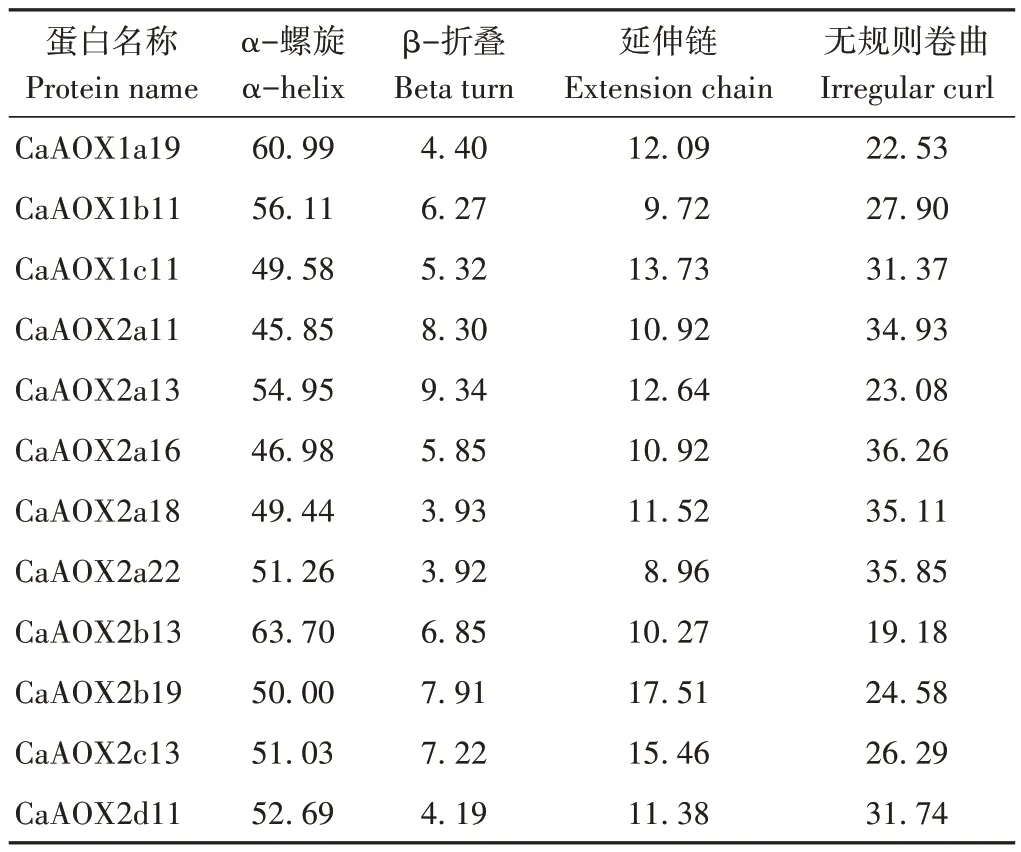
表3 辣椒AOX蛋白二级结构预测分析Table 3 Secondary structure prediction of peper AOX protein
通过SWISS-MODEL预测辣椒12个AOX蛋白三级结构,结果如图2 所示,除CaAOX2b19 编码的蛋白质三级结构差异较大外,其余的CaAOXs 蛋白三级结构相似。
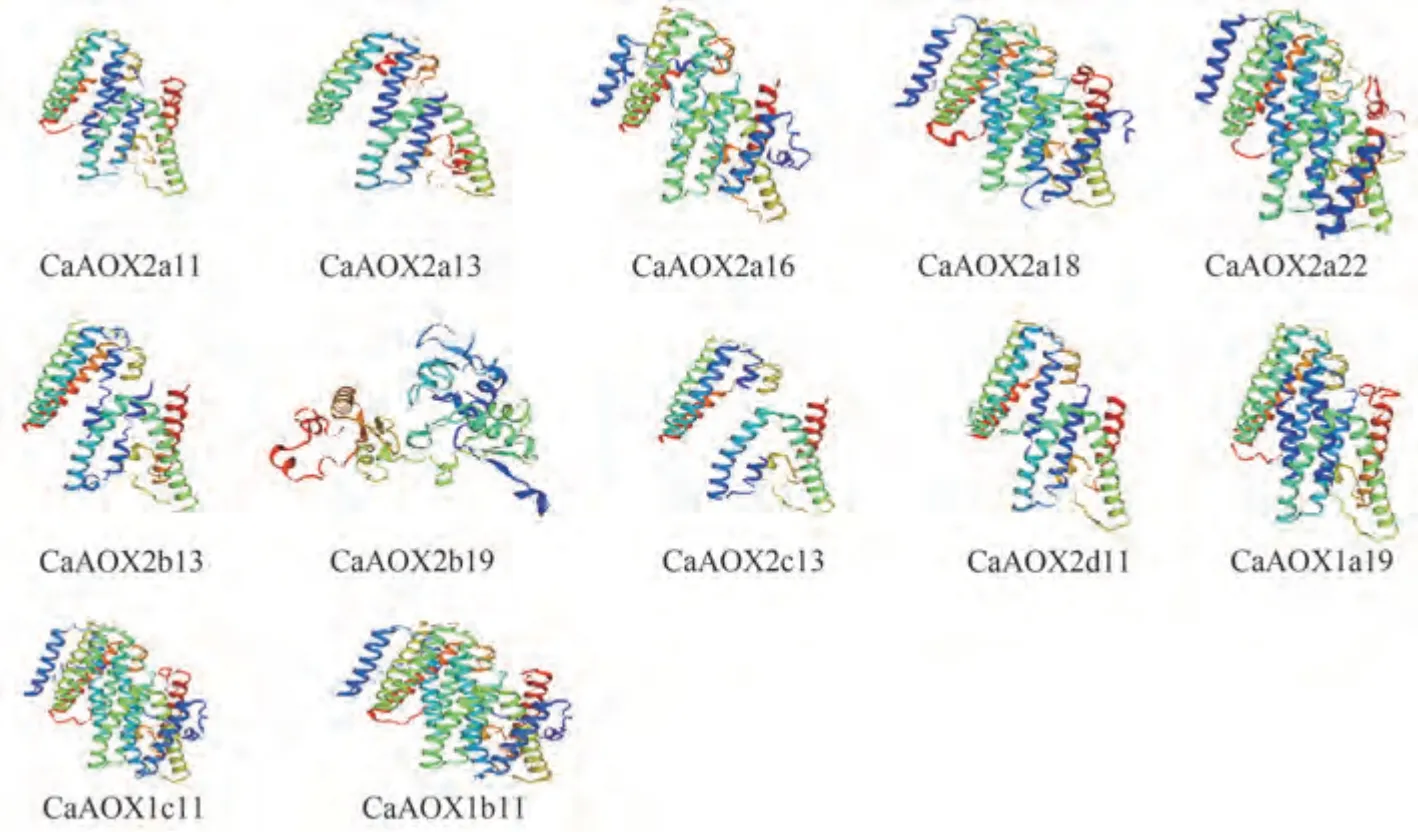
图2 辣椒AOX蛋白三级结构预测结果Fig.2 The tertiary structure prediction results of pepper AOX protein
2.4 CaAOXs蛋白结构域分析
通过对辣椒12 个交替氧化酶蛋白序列进行结构分析发现(图3),辣椒AOX 蛋白序列在C 端十分保守,仅在N 端有较小差异,且CaAOXs 蛋白均含有典型的PLN02478 结构域。CaAOX2a11 和CaAOX2a16 除含有典型结构域外,还含有PHD_SF superfamily 结构域。CaAOX2b19 不仅含有典型结构域,还包含DUF4219 和Glycosyltransferase_GTB-type superfamily 结构域,这一点与CaAOXs蛋白三级结构分析一致。由图3可看出,除Motif8 外,其余保守基序与AOX 特征结构域-PLN02478密切相关。进一步分析发现,大部分保守基序位于AOX 结构域的C 端,这可能与CaAOXs 功能有关。从出现频率来看,Motif1、Motif2、Motif3、Motif4、Motif6 和Motif10 的出现频率较高,几乎涵盖了所有亚族,表明Motif1、Motif2、Motif3、Motif4、Motif6 和Motif10是CaAOXs的重要保守基序。此外,CaAOX1亚族中的保守基序组成和排列方式基本相同,推测其基因功能可能相似。从整体来看,CaAOXs 所含保守基序数量、类型、排列上的差异,可能揭示了各个基因具有不同的功能。结合蛋白质保守结构域分析发现,三级结构相似的CaAOXs 蛋白在C 端具有相似的蛋白结构域,而CaAOX2b19 编码的蛋白质在C 端具有不同的结构域,导致CaAOX2b19编码的蛋白质三级结构差异较大。

图3 辣椒AOX蛋白质结构分析Fig.3 Protein structure analysis of pepper AOX
2.5 辣椒AOX顺式作用元件分析
利用在线网站PlantCARE 对12 个CaAOXs启动子区域进行顺式作用元件预测,结果如表4所示,CaAOXs启动子区域含有多种功能调控元件,如脱落酸、茉莉酸甲酯、赤霉素、生长素、水杨酸等激素响应元件;缺氧、低温、干旱、防御和应激等逆境胁迫响应元件以及光、厌氧、昼夜节律等环境适应元件。除此之外还含有分生组织诱导表达元件。由表4 分析结果可知,脱落酸响应元件几乎涵盖所有CaAOXs启动子区域,表明CaAOXs可能积极响应脱落酸。以上结果表明,CaAOXs启动子区域含有脱落酸、茉莉酸甲酯、赤霉素、生长素和水杨酸等激素响应元件,说明CaAOXs的表达受激素的影响;此外,CaAOXs启动子区域还含有缺氧、低温、干旱以及防御和应激等逆境胁迫响应元件,由此推测CaAOXs可能响应逆境胁迫与激素应答,同时也暗示了CaAOXs可能具有多种功能。

表4 CaAOXs 启动子元件分析Table 4 Analysis of CaAOXs promoter elements
2.6 CaAOXs在不同组织的表达分析
对CaAOXs在辣椒不同组织中的表达模式进行分析发现,CaAOXs在辣椒的根、茎、叶和花中均有表达,且具有较为明显的组织表达特异性(图4)。CaAOXs在花中的表达量显著上调(P<0.05),其中CaAOX2a13、CaAOX2a11和CaAOX2c13在花中高表达;CaAOX2a22、CaAOX2a13和CaAOX1c11在叶片中高表达;CaAOX2a22在茎中表达量最高;根中除CaAOX2d11表达下调外,其余表达均上调。不同CaAOXs在组织中表达的差异性表明了CaAOXs在功能上存在分化。

图4 CaAOXs在不同组织中的表达热图Fig.4 Expression heatmap of CaAOXs in different tissues
2.7 CaAOXs在非生物胁迫下的表达分析
为研究CaAOXs在非生物胁迫下的表达模式,分别对辣椒进行了高温[(42±1)℃]、低温[(4±1)℃]、常温[(25±1)℃]以及喷施GA、ABA处理。不同温度处理结果如图5-A所示,CaAOX2a22在不同温度处理下表达均上调,但低温和高温处理其表达量上调更明显(P<0.05),表明CaAOX2a22对不同温度的敏感性不同。CaAOX1c11在低温和高温胁迫下表达均显著上调(P<0.05),其中对高温胁迫的响应更为明显,其表达量分别是常温处理的25.21、114.25、58.40 倍,暗示CaAOX1c11可能在辣椒遭受高温胁迫时发挥重要作用。同样CaAOX2b19均响应了高、低温胁迫,表明CaAOX2b19参与响应辣椒高、低温胁迫。此外,CaAOX1b11响应了高温胁迫;CaAOX2d11、CaAOX2b13和CaAOX2c13在常温下表达上调。以上分析结果表明CaAOXs对不同温度的敏感性不同,并且可能在辣椒高、低温胁迫下发挥着不同的功能。

图5 CaAOXs 在非生物胁迫处理下的表达热图Fig.5 Hotmap of CaAOXs expression under abiotic stress treatment
辣椒叶片经激素处理后,CaAOXs的表达热图如图5-B 所示。多数CaAOXs在GA 和ABA 处理后表达上调,这与顺式作用元件分析中CaAOXs响应GA 和ABA 相一致。GA 处理除CaAOX2a22、CaAOX2c13、CaAOX1b11和CaAOX2b13表达下调外,其余CaAOXs表达均上调。其中CaAOX2d11、CaAOX2a13、CaAOX2a16、CaAOX2a18、CaAOX2a11和CaAOX1a19在GA 处理2 h后表达显著上调(P<0.05);喷施ABA 后除CaAOX2c13和CaAOX2b19表达下调外,其余表达均上调。ABA 处理4 h 时为CaAOXs的表达高峰,均明显响应了ABA 处理(P<0.05)。从整体上看,ABA 诱导的表达量显著高于GA,表明CaAOXs均能响应辣椒GA、ABA,且对ABA的响应更强烈。
3 讨论
在高等植物中,AOX基因由细胞核编码,AOX蛋白家族由两个亚族(AOX1和AOX2)组成,在植物非生物胁迫中发挥重要作用。目前已对高等植物(水稻[24]、香蕉[25]等)、真菌(糙皮侧耳[26]、埃默森小芽枝霉[27]等)、细菌(嗜芳烃新鞘氨醇菌[28]、大肠杆菌[29]等)以及部分藻类(莱茵衣藻[30]等)进行了分析鉴定。本研究通过生物信息学方法,从辣椒全基因组筛选得到12个AOX基因,分别为CaAOX1c11、CaAOX1a19、CaAOX1b11、CaAOX2d11、CaAOX2a16、CaAOX2a11、CaAOX2c13、CaAOX2a18、CaAOX2b13、CaAOX2a13、CaAOX2a22、CaAOX2b19。
系统发育结果表明,辣椒AOX基因同样分属为AOX1和AOX2两个亚家族,该结果与前人研究一致[19]。AOX 基因家族的构成因植物物种而异。例如,拟南芥有5 个AOX基因,分别为AtAOX1a、AtAOX1b、AtAOX1c、AtAOX1d和AtAOX2[17];甘薯包含3个AOX基因:IbAOX1a、IbAOX1b和IbAOX2[31];水稻AOX基因仅由AOX1 亚族组成(OsAOX1a、OsAOX1b和OsAOX1c)[18]。进一步分析结果表明,不同植物中AOX基因具有多样性,其所含亚族与基因数量存在差异。将不同物种的AOX基因编码蛋白构建进化树分析发现,AOX 在不同物种中具有较高的保守性,且同一亚族的同源性较高,同科植物的同源性也较高。说明同科植物的AOX 蛋白可能具有相似的功能。
CaAOX 家族成员在不同组织器官的表达谱表明,CaAOXs可能具有特异和冗余功能,分析发现CaAOXs在4 个组织中均有表达,但表达水平差异显著(P<0.05)。CaAOXs在花和叶中整体表达上调,且花中的表达量高于叶;不同CaAOXs在茎中的表达趋势不同,表明CaAOXs具有组织特异性。前人研究表明,AOX1亚族受大多数非生物胁迫诱导且响应强烈,如干旱、高温、高盐、低温、重金属等[25,32-33]。在本研究中,辣椒AOX1亚家族成员CaAOX1c11、CaAOX1a19和CaAOX1b11均响应了低温、高温、GA 以及ABA 胁迫的诱导。同样AOX2 亚家族中的成员也响应了低温、高温、GA 以及ABA 处理,这证实了AOX2 不仅在植物发育中有所表达还参与响应非生物胁迫。顺式作用元件的分析结果暗示了辣椒在胁迫处理(低温和高温)和激素应答(GA和ABA 的处理)下有较强的表达。Chen 等[34]研究发现,与对照相比,黄体酮有效提高了甘薯块茎中IbAOX1的转录水平和AOX 活性,维持了细胞膜完整性并调节抗氧化系统和脯氨酸代谢来降低贮藏过程中甘薯冷害的发生。同样Kang 等[3]研究表明,当番茄(Solanum lycopersicumL.)受到干旱胁迫时,ABA 迅速积累诱导上调SlAOX1a的表达,有助于清除过多的ROS 以提高番茄耐旱性。LeAOX表达水平降低的番茄植株表现出成熟延迟,类胡萝卜素、呼吸作用和乙烯生成减少以及成熟相关基因表达下调。相反,过表达LeAOX1a的番茄果实表现出累积更多的番茄红素,表明LeAOX1a可能在番茄成熟过程中起重要作用[35]。此外,AtAOX1a的过表达提高了拟南芥对较高剂量UV-B 的适应[36]。由此可推测,CaAOXs在辣椒生长发育、逆境胁迫与激素应答反应中发挥重要作用。
4 结论
本试验共从辣椒全基因组鉴定出12 个CaAOXs,并对其基因家族、基因结构等生物信息及其在辣椒组织、逆境胁迫以及激素应答中的表达模式进行了分析。初步预测CaAOXs在辣椒中的基因功能——参与辣椒的生长发育,在辣椒逆境胁迫和激素应答中发挥重要作用。因此,CaAOXs可作为辣椒非生物胁迫抗性转基因育种的候选基因。
