致病疫霉菌效应蛋白Pi05440毒性功能验证及寄主候选靶标筛选
2024-02-23陈胜男王荟洁王洪洋
张 蝶 陈胜男 赵 迪 王荟洁 王洪洋 刘 晶
(云南师范大学,云南省马铃薯生物学重点实验室,云南 昆明 650500)
马铃薯(Solanumtuberosum)富含碳水化合物、维生素、矿物质和抗氧化物质等营养成分,对人类健康和可持续农业发展至关重要[1]。然而,马铃薯生产过程中会面临许多病害的威胁,其中最为严重的是由致病疫霉菌(Phytophthorainfestans)引起的晚疫病。致病疫霉菌是一种卵菌,可以通过空气、土壤、水体等途径进行传播,侵染马铃薯块茎、茎、叶片等组织,严重发生时可造成马铃薯绝收[2]。
为了成功入侵植物,致病疫霉菌会分泌一系列效应蛋白进入寄主细胞,通过操纵寄主靶标抑制植物免疫反应。根据作用部位不同,可将效应蛋白分为质外体效应蛋白和胞质效应蛋白两大类。质外体效应蛋白主要为一些蛋白酶抑制子,如葡聚糖酶、半胱氨酸蛋白酶抑制子及NEP1-like 家族蛋白等。胞质效应蛋白主要包括RxLR和CRN类效应蛋白[3],其中,P.infestans菌株T30-4中RxLR类效应蛋白有563个,研究发现RxLR类效应蛋白显著影响P.infestans的致病性[4],而CRN蛋白家族可以使寄主叶片皱缩和坏死[5-7]。
相较于胞质效应蛋白,质外体效应蛋白的研究较少,但其在植物病原菌致病过程中具有一定重要性。大豆疫霉菌(Phytophthorasojae)产生的效应蛋白PsAvh240,通过抑制大豆(Glycinemax)植物免疫系统中的天冬氨酸蛋白酶GmAP1的分泌来破坏植物免疫力,从而促进感染。PsAvh240 位于质外体并与GmAP1 在质膜上进行相互作用。研究表明,PsAvh240 在质膜上的定位和二聚化是其发挥致病作用的关键[8]。蛋白酶抑制子在病原菌致病性方面扮演着重要的角色,一些病原菌会通过分泌蛋白酶抑制子来抑制植物的防御反应,从而促进病原菌自身的生长和侵染[9]。EPICs 是一类由P.infestans分泌的半胱氨酸蛋白酶抑制子。EPICs 通过靶向半胱氨酸蛋白酶C14 干扰植物的免疫反应[10]。P.infestans分泌的半胱氨酸蛋白酶抑制子EPIC2B与番茄中的半胱氨酸蛋白酶PhytophthoraInhibited Protease 1(PIP1)发生互作并抑制PIP1的酶活[11]。
前期研究发现,质外体效应蛋白编码基因Pi05440(Genbank: XM_002999037.1,EPI6)是一种Kazal型丝氨酸蛋白酶抑制子[12]。Pi05440在致病疫霉菌侵染马铃薯36 h 时上调表达[13],说明该基因参与致病疫霉菌侵染过程。然而,有关效应蛋白Pi05440 在植物体内的靶标蛋白和如何发挥毒性功能尚不清楚。因此,本研究对Pi05440 进行生物信息学分析和毒性功能鉴定,并以Pi05440 为诱饵筛选其在马铃薯中的寄主靶标蛋白,旨在为进一步揭示效应蛋白Pi05440 调控植物免疫分子机理提供依据。
1 材料与方法
1.1 材料与试剂
致病疫霉菌株88069 由云南师范大学云南省马铃薯生物学重点实验室(本实验室)保存,菌株生长和保存采用黑麦培养基。本氏烟栽种于校内恒温育种温室内。
DH5α 感受态、GV3101 电击感受态、酵母NMY51菌株、pTSU2-APP、pOst1-NubI、pNubG-Fe65、pPR3-N,购自上海欧易生物科技有限公司。高保真酶(Phanata®Super-Fidelity DNA Polymerase)、反转录试剂盒、无缝克隆试剂盒,购自南京诺唯赞生物科技股份有限公司。DNA纯化回收试剂盒、酵母质粒提取试剂盒,购自北京天根生物技术有限公司。酵母缺陷培养基SD/-Leu、SD/-Trp、SD/-Leu/-Trp、SD/-Leu/-Trp/-His、SD/-Leu/-Trp/-His/-Ade、SD/-Trp/-His/-Ade 液体培养基、XGal、鲑鱼精DNA,购自宝生物工程(大连)有限公司。琼脂糖凝胶DNA 回收试剂盒(增强型)、质粒小提试剂盒、3-氨基-1,2,4-三唑(3-amino-1,2,4-triazole,3-AT),购自北京天根生物技术有限公司。
1.2 仪器与设备
ZQZY-78CV震荡培养箱,上海知楚仪器有限公司;WPL-230BE 电热恒温培养箱,天津泰斯特仪器有限公司;BBS-DDC 医用洁净工作台,济南鑫贝西生物技术有限公司;A300DNA 扩增仪,杭州朗基科学仪器有限公司;GelView 5000Plu 全自动凝胶成像分析系统(广州博鹭腾生物科技有限公司);Power-B 电泳仪,北京凯元信瑞仪器有限公司;NP80 Touch 超微量紫外可见分光光度计,Implen 公司(德国);LSM 900 激光共聚焦显微镜,Zeiss公司(德国)。
1.3 试验方法
1.3.1 目的基因编码的氨基酸序列分析 在NCBI中的Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析结构域;预测目的基因编码蛋白在SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)在线网站上预测信号肽。
1.3.2 Pi05440 表达载体的构建 从NCBI 获取Pi05440 的编码序列(coding sequence,CDS)并使用SignalP 4.1在线网站预测其信号肽区域;将去除信号肽Pi05440 的CDS 序列插入pRI101-GFP 载体[14],构建pRI101-GFP-Pi05440。以致病疫霉菌生理小种88069基因组DNA 为模板,以pRI101-GFP-Pi05440为基因引物(表1),使用高保真酶体系扩增目的片段,将PCR产物通过电泳切胶回收纯化后,测定其浓度。通过无缝克隆技术将目的基因Pi05440连接到相应酶切位点的pRI101-GFP载体中,进行大肠杆菌(E.coil)DH5α热激转化,倒置培养16 h左右,将分离的单克隆菌落用LB液体培养基培养,采用菌落PCR方法对其进行鉴定并测序。将测序正确的质粒转化到农杆菌GV3101细胞中。
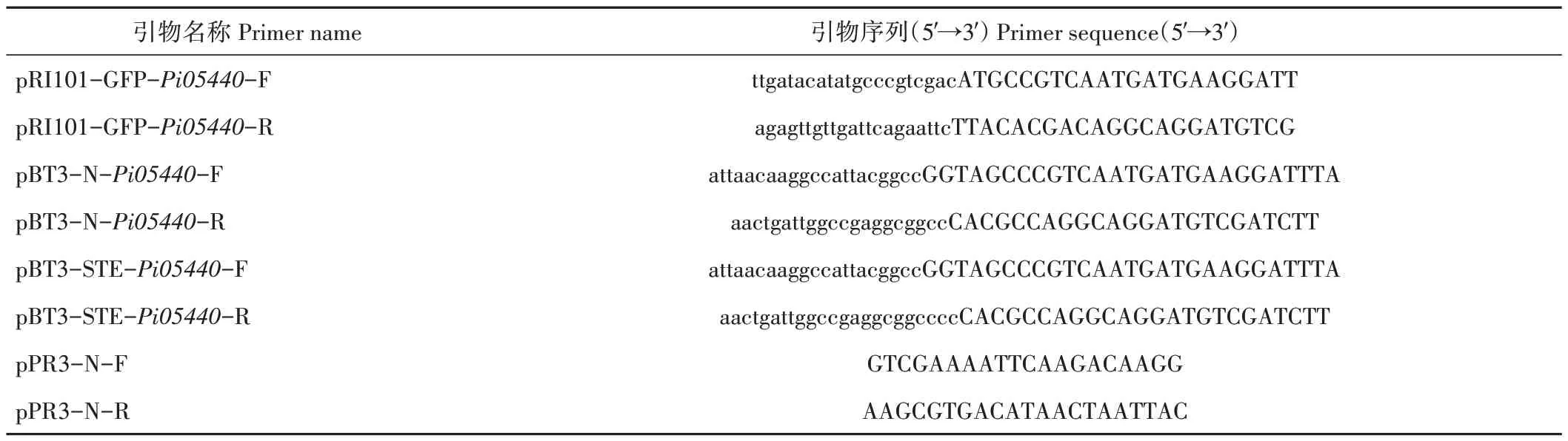
表1 引物序列Table 1 Primers used in this study
1.3.3 Pi05440亚细胞定位和毒性功能分析 将含有pRI101-GFP、GFP-Pi05440 以及转录沉默抑制子P19[15]的农杆菌在含有50 mg·mL-1卡那和25 mg·mL-1利福平抗生素的LB 平板上进行活化。参照孙春莲等[15]方法进行操作,将农杆菌pRI101-GFP、GFP-Pi05440悬浮液调至OD600=0.01 与农杆菌P19(OD600=0.005)等体积混匀,避光静置1~2 h 后,将混合后的菌液用去除针头的1 mL 注射器在生长4 周的本氏烟背面进行注射,使菌液浸润整个叶片,每株取3 片叶,重复3 次,共9 株。表达2 d 后,用镊子撕取叶片下表皮并用4%NaCl 处理15 min 后进行荧光显微镜观察。另将pRI101-GFP、GFP-Pi05440 与P19 农杆菌悬浮液OD600值调至0.1 后等体积混匀,将混合液分别注射至本氏烟左右两边,瞬时表达24 h 后,接种孢子量约为100~150 个的致病疫霉菌88069,24 h 黑暗处理,接种6 d后,用游标卡尺测量病斑面积(S=1/4×π×长×宽),用Excel 2021 软件对病斑面积进行t测验(两尾检验),分析其差异显著性。
1.3.4 Pi05440诱饵载体的构建 根据酵母双杂交膜系统cDNA 文库筛库要求,诱饵蛋白需要先构建在pBT3-N 和pBT3-STE 这2 种诱饵载体上,以验证诱饵蛋白是否能够在酵母中正常表达,从而进行后续酵母筛库试验。根据2 种诱饵载体的多克隆位点,分别设计Pi05440基因引物(表1),以致病疫霉菌生理小种88069基因组DNA为模板进行PCR扩增。之后使用限制性核酸内切酶SfiI 对pBT3-N、pBT3-STE 质粒及Pi05440基因扩增产物进行酶切。最后用T4 DNA ligase 对酶切后的Pi05440基因产物和线性化载体进行重组连接,连接后转化至大肠杆菌DH5α 中,筛选阳性克隆并鉴定。
1.3.5 诱饵载体功能验证及自激活检测 质粒组合pTSU2-APP+pNubG-Fe65 为阳性对照,质粒组合pTSU2-APP+pPR3-N 为阴性对照,将构建好的pBT3-STE-Pi05440 和 pOst1-NubI、pBT3-N-Pi05440 和pOst1-NubI分别加入到制备好的酵母感受态中进行功能验证,同时按照相同转化方法将质粒组合pBT3-STE-Pi05440+pPR3-N、pBT3-N-Pi05440+pPR3-N 分别转化进行自激获验证。之后将菌液涂布至营养缺陷型平板上SD-Trp-Leu(DDO)、SD-Trp-Leu-His(TDO)及SD-Trp-Leu-His-Ade(QDO),培养3~5 d后,观察酵母生长情况。所有DDO 平板应出现100~1 000 个克隆,若低于此数量则说明转化效率低,需重新转化;在阳性对照和阴性对照生长情况符合条件情况下,若在TDO、QDO 平板生长率达到10%~100%,则说明诱饵蛋白在膜体系酵母双杂中功能正确表达;若在TDO、QDO平板上无生长则说明诱饵蛋白不存在自激活,反之则需要进行筛选合适浓度的3-AT抑制自激活。
1.3.6 筛选合适3-AT浓度 通过醋酸锂法将自激活较弱的pBT3-STE-Pi05440 质粒转入NMY51 酵母菌株,再将质粒pPR3-N 转入含诱饵质粒pBT3-STEPi05440 的NMY51 酵母菌株,分别涂布于含0、0.25、0.5、1、1.5、2、3、4 mol·L-13-AT 的TDO 平板上,同时转化pTSU2-APP和pNubG-Fe65作为阳性对照用以验证转化体系,将其涂布于不含3-AT 的TDO 平板。上述平板均倒置于30 ℃恒温培养箱培养3~5 d,观察酵母生长情况,按照自激活酵母单克隆生长量最少确定合适的3-AT浓度。
1.3.7 酵母双杂交膜系统cDNA 文库筛选 将含有pBT3-STE-Pi05440 质粒的NMY51 酵母在SD/-Leu 液体培养基中过夜培养,测量OD546值,计算OD546值所需菌液数量;将菌体重悬于30 ℃预热的2×酵母膏胨葡萄糖腺嘌呤(yeast peptone dextrose adenine,YPDA)液体培养基中使得菌液OD546值为0.15,恒温摇床培养3~5 h至OD546值为0.6~0.7。以马铃薯栽培种合作88叶片为材料,采用Gateway 技术对叶片总RNA 处理后将其克隆到pPR3-N 载体中形成膜文库质粒。将诱饵载体和膜文库质粒共转化到酵母菌中,涂布在DDO 平板,用于验证转化效率;将剩余重悬菌液涂布于含20 mg·L-1X-gal和3-AT的TDO平板上,倒置于30 ℃恒温培养箱培养3~5 d,观察菌落生长情况。挑取TDO平板上长出的蓝色单克隆,在含20 mg·L-1和X-gal 的QDO 平板上划线,倒置于30 ℃恒温培养箱培养3~5 d 观察酵母生长及变蓝情况。
为了验证酵母双杂交初筛阳性克隆是否与Pi05440发生互作,将阳性克隆质粒与诱饵质粒pBT3-STEPi05440 进行酵母回补验证。阳性对照为pTSU2-APP+pNubG-Fe65,阴性对照为pTSU2-APP+pPR3-N,涂布在DDO 平板和含有3-AT 和20 mg·L-1X-gal 的QDO 平板上。30 ℃倒置培养3~5 d,根据生长情况,判断初筛互作蛋白是否与Pi05440发生互作。
2 结果与分析
2.1 效应蛋白Pi05440的生物信息学分析
2.1.1 效应蛋白Pi05440 的保守结构域分析 基因Pi05440全长969 bp,通过NCBI 比对得到效应蛋白Pi05440 氨基酸序列,该效应蛋白共编码322 个氨基酸,含有典型的KAZAL 区域,是KAZAL 型丝氨酸蛋白酶抑制子家族蛋白,可作为丝氨酸蛋白酶抑制子(图1)。
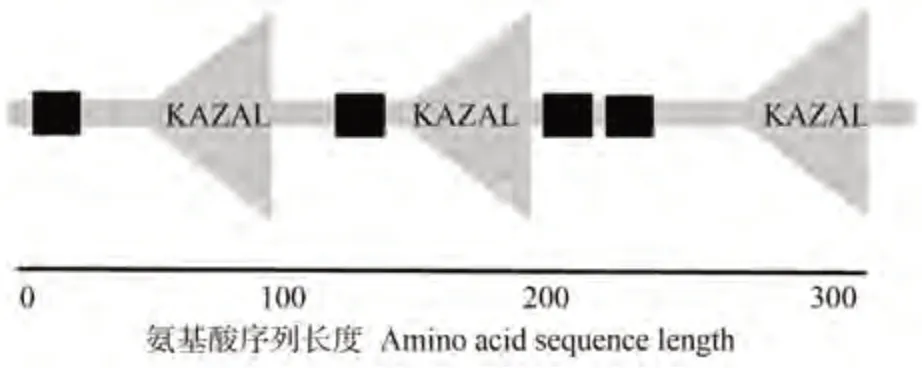
图1 效应蛋白Pi05440的保守结构域分析Fig.1 Conserved structural domain analysis of effector protein Pi05440
2.1.2 效应蛋白Pi05440的信号肽分析 经SignalP4.1在线网站分析,发现效应蛋白Pi05440 信号肽的长度为20个氨基酸。信号肽切割位点C的最高值为0.684,位于第20 位氨基酸;而信号肽分数S 的最高值为0.880,位于第1 位氨基酸。合并后的切割位点Y 在第20 位氨基酸处,最高值约为0.740。预测表明Pi05440信号肽序列为1~20位氨基酸(图2)。
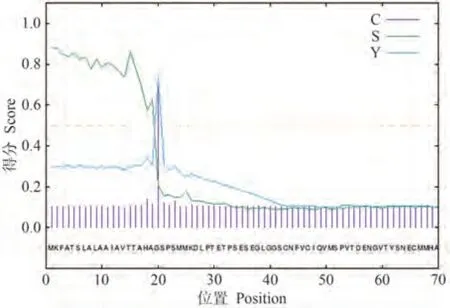
图2 效应蛋白Pi05440信号肽预测Fig.2 Effector protein Pi05440 signal peptide prediction
2.2 效应蛋白Pi05440毒性功能分析
将含有GFP、GFP-Pi05440 质粒的农杆菌菌液与含有P19 的农杆菌按照等体积混匀,分别注射至本氏烟的左右两边,瞬时表达24 h 后,接种致病疫霉菌88069,6 d 后观察发病情况。与对照GFP 相比,表达GFP-Pi05440的发病面积极显著增大(图3),结果说明瞬时表达该基因可以促进致病疫霉菌定殖。
图3 效应蛋白Pi05440对致病疫霉菌侵染的作用Fig.3 Effect of effector protein Pi05440 to P.infestans colonization
2.3 效应蛋白Pi05440定位
为了探究效应蛋白Pi05440 在植物细胞中的定位情况,对融合蛋白GFP-Pi05440 表达的本烟细胞进行质壁分离,结果发现GFP 荧光主要在质膜和细胞间隙中积累表达(图4)。说明Pi05440 是一个定位在质膜和细胞间隙的质外体效应蛋白。
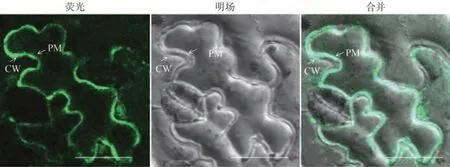
图4 效应蛋白Pi05440亚细胞定位Fig.4 Subcellular localization of effector protein Pi05440
2.4 诱饵载体功能验证与自激活检测
将共转后含有不同质粒组合的NMY51 酵母菌株涂布于不同营养缺陷培养基上,30 ℃培养5 d。功能验证反应中,pBT3-N-Pi05440+pOst1-NubI、pBT3-STEPi05440+pOst1-NubI 在QDO 平板上均正常生长,这表明Pi05440基因在诱饵载体pBT3-N、pBT3-STE 下能正确表达蛋白。自激活检测显示,含有诱饵载体pBT3-N-Pi05440+pPR3-N 空载的酵母菌株在QDO 平板上呈强生长现象,推测其在功能验证反应中的出现的生长现象是其自激活导致,表明诱饵载体pBT3-N不适用Pi05440酵母双杂交膜系统的cDNA 文库筛选。另外,含pBT3-STE-Pi05440+pPR3-N空载的酵母菌株在QDO 平板上存在较弱的自激活现象(图5)。综合考虑,选定pBT3-STE 为诱饵载体用于后续酵母双杂交膜系统cDNA文库筛选。

图5 诱饵载体功能验证与自激活检测Fig.5 Functional validation and self-activation detection of decoy carriers
2.5 筛选条件分析
使用醋酸锂法将转化后的酵母菌株分别涂布在含有不同浓度3-AT 的TDO 平板上。试验结果如图6 所示,阳性对照酵母正常生长,表明转化体系正常。当抑制剂3-AT 浓度设定为2 mol·L-1时,可以有效抑制pBT3-STE-Pi05440 的自激活反应。考虑到较高浓度的3-AT可能会影响存在弱互作蛋白的筛选,所以在后续的酵母双杂交膜系统cDNA 文库筛选和回补试验中均采用2 mol·L-1的3-AT浓度。

图6 筛选条件分析Fig.6 Analysis of filtering conditions
2.6 Pi05440互作蛋白筛选及验证
以pBT3-STE-Pi05440 为诱饵进行酵母双杂交膜系统cDNA 文库筛选。筛选结果表明,涂布稀释10 倍的筛选转化菌液平板约有900个克隆,涂布稀释100倍的重悬菌液平板约有80 个克隆,说明筛库效率较好(图7-A)。通过在含20 mg·L-1X-gal、2 mol·L-13-AT的TDO 平板筛选,获得了蓝色的酵母单克隆。挑取这些单克隆并在含20 mg·L-1X-gal、2 mol·L-13-AT 的QDO 方形平板上划线,在30 ℃条件下培养5 d,生长正常且变蓝的酵母单克隆被认为Pi05440 的候选互作靶标(图7-B)。挑取候选互作靶标于SD/-Leu/-Trp 液体培养基中培养,提取酵母质粒,以载体克隆通用引物(pPR3-N-F 和pPR3-N-R)进行PCR 扩增,扩增产物直接进行纯化、回收和测序。测序结果在NCBI数据库中进行blast 比对分析,去除相同序列的阳性克隆,初步获得3个候选靶标蛋白。

图7 Pi05440互作蛋白筛选Fig.7 Screening of host protein of Pi05440
为了进一步验证候选靶标与Pi05440 的互作,将上述3 个候选靶标质粒与pBT3-STE-Pi05440 质粒共转化进入NMY51 酵母感受态进行酵母双杂交回补验证。挑取DDO 平板上长出的单菌落按10-1、10-2、10-3和10-4稀释梯度进行稀释,然后点在含有20 mg·L-1X-gal、2 mol·L-13-AT 的QDO 平板上。结果发现待测酵母菌均能正常生长(图7-C),说明这3 个候选靶标蛋白均与效应蛋白Pi05440互作。3个靶标蛋白注释分别是马铃薯过氧化氢酶12(Solanumtuberosumperoxidase 12)、马铃薯几丁质酶(Solanumtuberosumchitinase,chtB3)以及马铃薯MYB-like A 蛋白(SolanumtuberosumMYB-like protein A)(表2)。

表2 马铃薯效应蛋白Pi05440候选互作蛋白Table 2 The candidate interaction proteins of effector Pi05440 in potato
3 讨论
在植物和病原菌的长期进化中,病原菌会释放蛋白酶抑制子来抑制植物蛋白酶的活性[11]。例如通过蛋白互作和酶活检测发现,叶霉菌(Cladosporiumfulvum)分泌蛋白酶抑制子Avr2 与番茄半胱氨酸蛋白酶Rcr3pim互作并可以抑制其酶活[16]。另外,P.infestans分泌的蛋白酶抑制子EPIC1 和EPIC2B,也可同样靶向Rcr3pim并抑制其活性,从而干扰植物免疫反应[16]。因此,宿主蛋白酶与病原菌蛋白酶抑制子间相互作用是决定病原菌能否成功侵染的关键因素。通过筛选与鉴定效应蛋白的寄主互作靶标,对进一步揭示效应蛋白毒性功能和P.infestans致病机理至关重要。根据效应蛋白Pi05440 的结构域分析,发现Pi05440 是一种KAZAL 型蛋白酶抑制子。通过酵母双杂交技术初步筛选出3 个互作蛋白,分别是马铃薯过氧化氢酶12(Solanumtuberosumperoxidase 12)、马铃薯几丁质酶(Solanumtuberosumchitinase,chtB3)以及马铃薯MYBlike A 蛋白(SolanumtuberosumMYB-like protein A)。由于酵母双杂交存在一定的假阳性,后续需要通过双分子荧光互补试验(Bimolecular Fluorescent Complimentary,BiFC)、荧光素酶互补试验(Luciferase Complementation Assay,LCA)和免疫共沉淀(Co-Immunoprecipitation,Co-IP)等技术验证候选蛋白是否与效应蛋白Pi05440真实互作。
结合瞬时表达效应子Pi05440和P.infestans接种鉴定结果,发现Pi05440可以降低植物抗病性,促使病斑面积显著增大(图3)。该结果与前人报道质外体效应蛋白作为蛋白酶抑制子促进植物感病结果一致[9-10]。另外,亚细胞定位证明Pi054440 确实定位在细胞间隙和质膜上,属于P.infestans质外体效应蛋白(图4)。这些结果暗示Pi05440 有可能作为蛋白酶抑制子靶向植物蛋白酶及其他因子发挥毒性功能。
过氧化物酶在植物中的作用广泛,如调节植物对病原菌的抗性和产生一系列重要信号分子(过氧化氢、超氧阴离子等)[17]。如过表达过氧化物酶基因PRX33和PRX34激发过氧化氢等活性分子在植物体内积累,从而增强植物对芸薹生链格孢(Alternariabrassicicola)的抗性[18-19]。抑制过氧化物酶基因M21334会导致植株体内H2O2积累减少和茉莉酸(jasmonic acid,JA)合成基因表达下调,从而降低马铃薯对P.infestans的抗病性[20]。候选靶标peroxidase 12 作为Pi05440 的互作蛋白,可能与马铃薯的晚疫病抗性可能存在关联,对于peroxidase 12 和Pi05440 如何协同调控马铃薯对晚疫病的抗性尚需深入研究。
几丁质酶是植物合成的一种抗真菌蛋白。在植物免疫系统中,几丁质酶通过降解病原菌细胞壁中的几丁质来抑制病原菌生长,从而提高植物的抗病性[21-22]。在辣椒中沉默几丁质酶编码基因CaChiIII7会导致病程相关基因CaPR1和CaPR5表达下调,H2O2积累、电导率、脯氨酸合成和根活性等显著降低,从而增强植株对尖孢炭疽菌(Colletotrichumacutatum)的感病性[23]。chit36是来自棘孢木霉(Trichodermaasperelleoides)T203真菌的一种几丁质酶基因,过表达chit36可激发拟南芥CREK1/LysM RLK1受体激酶介导的信号传导,增强植株与对盐、重金属胁迫及灰霉菌(Botrytiscinerea)侵染的耐受性[24]。推测候选靶标几丁质酶chtB3 可能参与马铃薯抗晚疫病抗性,而效应蛋白Pi05440 是否通过靶向几丁质酶chtB3 调控马铃薯抗性反应有待进一步研究证实。
MYB 是植物中数量最多、功能最多样化的转录因子家族之一,其在植物抗病防御过程中发挥重要作用[25]。过表达R2R3 型MYB 转录因子TaMYB391,可激活多个防御信号转导通路相关基因表达,其中包括活性氧,病程相关基因和丝裂原活化蛋白激酶,从而提高小麦对条锈菌(Pucciniastriiformisf.sp.tritici)的抗性[26]。拟南芥MYB 转录因子AtMYB44通过激活活性氧爆发和细胞死亡增加拟南芥对灰霉菌的感病性[27]。此外,MYB 转录因子在晚疫病抗性调控方面也有少量报道。超量表达番茄SlMYB49基因,能够显著增强番茄抗晚疫病和耐干旱能力[28]。利用基因编辑技术敲除番茄SlMYBs2基因后,发现抗病相关和活性氧清除相关基因表达下调,降低了番茄对P.infestans的抗性[29]。上述研究证实了MYB转录因子是调控晚疫病抗性的重要因子。本研究发现作为MYB转录因子成员MYB-like A蛋白,可与效应蛋白Pi05440 发生互作。这为以后研究Pi05440 除可以靶向植物蛋白酶以外,还可通过靶向其他类型蛋白调控植物免疫反应提供参考。
4 结论
致病疫霉菌基因Pi05440全长969 bp,编码322个氨基酸。其所编码的效应蛋白质包含典型KAZAL区域,属于KAZAL型蛋白酶抑制子。效应蛋白Pi05440可以促进病原菌侵染,并且定位在细胞间隙和质膜上。利用酵母双杂交技术鉴定到3个与Pi05440互作的靶标蛋白,分别为了马铃薯过氧化氢酶12、马铃薯几丁质酶、马铃薯MYB-like蛋白。
