多组学分析揭示三七镰刀菌属致病菌的生物学差异
2024-02-23张丽燕聂红艳闻进蕊廖洪新凌翠琼徐福荣
张丽燕 聂红艳 闻进蕊 廖洪新 凌翠琼 徐福荣 董 鲜
(云南中医药大学中药学院,云南 昆明 650500)
三七[Panaxnotogineseng(Burk.) F.H.Chen]是我国传统名贵中药材,为五加科多年生草本植物,具化瘀止血、补血活血定痛的功效[1]。三七喜温暖、阴暗潮湿的生长环境,而这种特殊的生长环境有利于病原菌生存,使得三七易受到各种病害的侵染[2]。引起三七发病的病原种类较多,包括真菌、细菌和线虫等,但以真菌为主要病原[3-4]。据报道,三七常见病害中以黑斑病、疫病、灰霉病、圆斑病和根腐病的发生较为常见,尤其以根腐病的危害最为严重[5-6]。
镰刀菌属(Fusarium)病原菌是自然界中广泛存在的致病菌之一,能够侵染并引发多种作物病害的发生,从而导致严重的经济损失[7]。研究发现镰刀菌属类病原菌可从根部侵染植株维管束系统,利用菌丝附着于主根表面并定殖于植株根部,继而延伸发育形成菌丝网络,导致植株地上部发病[8-9]。大量研究表明,三七根腐病的发生由多种病原真菌共同作用导致。缪作清等[10]报道三七根腐病由尖孢镰刀菌(F.oxysporium)、腐皮镰刀菌(F.solani)、毁灭柱孢菌(Cylindrocarpondestructans)及双孢柱孢菌(Cylindrocarpon didynum)等病原菌群引起。文增叶等[11]报道尖孢镰刀菌(F.oxysporium)是引起三七苗期根腐病的病原真菌。本课题组前期从三七的腐烂根部分离出了尖孢镰刀菌(F.oxysporium)、层出镰刀菌(F.proliferatum)、腐皮镰刀菌(F.solani),结合科赫氏法则确定这3种镰刀菌均可以引发三七根腐病的发生[12]。目前对三七根腐病致病机制的研究多集中在病原菌的分离鉴定及转录组分析上,而对其代谢组的研究报道较少。鉴于此,本研究通过对3 个不同种镰刀菌的菌丝进行转录组和代谢组的测序鉴定,对3 个镰刀菌不同种的差异表达基因和差异积累代谢物进行分类、功能注释和富集分析,旨在了解镰刀菌不同种的基因表达模式和代谢特征,初步探究氨基酸类代谢物在镰刀菌不同种中的差异表达情况,揭示其对三种镰刀菌之间菌丝生长的影响,以期为三七镰刀菌属根腐病害的防控提供理论依据。
1 材料与方法
1.1 试验材料与试剂
三七块根购买于云南省文山市顺巧经营部,三七病株采自云南省文山州三七种植基地。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,无菌水1 000 mL。产孢培养基(Bilay’s):磷酸二氢钾1 g,氯化钾0.5 g,硝酸钾1 g,硫酸镁0.5 g,葡萄糖0.2 g,蔗糖0.2 g,淀粉0.2 g,无菌水1 000 mL。酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YEPD):酵母膏10 g,蛋白胨20 g,葡萄糖20 g,无菌水1 000 mL。1/3马铃薯葡萄糖水培养基(potato dextrose broth,PDB):马铃薯50 g,葡萄糖5 g,无菌水750 mL。
蛋白胨、琼脂、淀粉,购自北京索莱宝科技有限公司;其余试剂均为国产分析纯。
供试菌株分离自三七根腐病发病植株根部,其测序鉴定结果分别与尖孢镰刀菌(F.oxysporium,Fo)、层出镰刀菌(F.proliferatum,Fp)、腐皮镰刀菌(F.solani,Fs)的序列同源,同源性为100%,三者在GeneBank 的登录号分别为OQ080022.1(F.oxysporium)、OP430570.1(F.proliferatum)、OQ080021.1(F.solani)。在PDA 培养基上活化备用。
1.2 试验仪器
THZ-98C 恒温振荡器、DHP-9051 微生物培养箱,上海一恒科学仪器有限公司;3K15台式高速冷冻离心机,北京五洲东方科技发展有限公司;Axio Imager M2正置荧光显微镜,德国Carl Zeiss 公司;XS-212-202 双目生物显微镜,苏州胜视电子设备有限公司。
1.3 试验方法
1.3.1 真菌形态观察 将病原真菌在PDA 培养基上培养7 d 后观察菌落形态。使用荧光显微镜对病原菌显微特征进行观察,用无菌注射器针头挑取适量菌丝置于载玻片中央,滴加2滴无菌蒸馏水,用针头轻轻拨动菌丝,以免菌丝成团,不利于观察,盖上盖玻片后在显微镜下观察分生孢子等性状。
1.3.2 病原菌孢子萌发率的测定 取培养7 d的病原真菌,用无菌注射器划成小块置于产孢培养基中,用封口膜密封,置于恒温振荡器(28 ℃、180 r·min-1)摇培5 d后,经4 层475855-1R 无菌神奇滤布[西格玛奥德里奇(上海)贸易有限公司]过滤,3 000 r·min-1慢速离心5 min,弃去上清液,加入无菌水清洗、离心,即得孢子悬浮液,最后配成1×106个·mL-1菌悬液。在无菌条件下,向每个离心管中加入1/3 PDB 2 mL 和菌悬液0.25 mL,每个处理3 个重复,置于恒温振荡器(28 ℃、180 r·min-1)黑暗摇培3、6、9 h。取菌悬液于载玻片上,在双目生物显微镜下随机选取5 个视野统计孢子总数及萌发孢子数,当芽管长度超过孢子长度的1/2 即为孢子萌发[13],并计算孢子萌发率:
孢子萌发率=萌发孢子数/孢子总数×100%。
1.3.3 病原菌的生长曲线测定 将活化好的菌株接入新的PDA 培养基,置于微生物培养箱中28 ℃恒温培养7 d至菌丝长满整个培养皿后,选取生长趋势相同的3 种镰刀菌,在无菌操作条件下,沿菌落边缘用5 mm打孔器打取菌块,接种于PDA 培养基中央,置于28 ℃培养箱培养,每个菌株设5个重复。自第2天起,用“十字交叉法”测量菌落直径,连续测量7 d[14]。将所得数值绘制成折线图,即得3种镰刀菌的生长曲线图。
1.3.4 病原菌孢子产量的测定 取1.3.3 中生物量一致的菌盘,用无菌注射器少量多次加入20 mL 无菌水冲洗菌盘,并将培养基上的菌丝轻轻刮下,再用4层无菌神奇滤布过滤2 次除去菌丝及杂质,最后用无菌水定容至30 mL,得孢子悬浮液,在显微镜下用血球计数板观察并计算孢子数量。
1.3.5 病原菌对鲜三七致病力的测定 选取健康、大小均匀的三七块根,清洗后切成5 mm厚的三七片,在75%乙醇中消毒1 min,用无菌水冲洗表面,再用1%次氯酸钠消毒7 min,共2次,用无菌水冲洗表面。待表面水分稍干,用5 mm打孔器取在PDA培养基中生长良好的病原菌,倒置接种在三七片中间,置于水琼脂培养皿中,密封放置于26 ℃培养箱中,观察菌落情况,计算侵染率:
侵染率=菌圈面积/三七片面积×100%。
1.3.6 菌丝体的制备及取样 参考1.3.2 的方法制备孢子悬浮液,取3 种镰刀菌的纯净孢子悬浮液2 mL分别加入250 mL YEPD 培养基中,每个样本3个重复,共计9 份样品,恒温振荡器摇培4 d 后收集菌丝,立即用液氮冷冻,在-80 ℃条件下保存。
1.3.7 代谢组检测与分析 将1.3.6 中取得的样本送武汉迈维代谢生物科技有限公司进行测序分析。采用广泛靶向的代谢组学方法对Fo、Fp 和Fs 菌丝体的3 个重复进行代谢物分析。通过R软件(www.r-project.org)对样本间代谢物进行主成分分析(principal component analysis,PCA)和层次聚类分析;采用偏最小二乘法判别分析(partial least squares-discriminant analysis,PLS-DA)筛选不同样品间差异积累代谢物(differential accumulated metabolites,DAMs)。采取差异倍数值(fold change)和正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)模型的变量重要性投影(variable importance in project,VIP)值相结合的方法来筛选差异代谢物,选取VIP值≥1、fold change≥2和fold change≤0.5的代谢物。利用京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库对差异代谢物进行途径富集分析。
1.3.8 转录组测序与分析 采用NEBNext®UltraTM RNA Library Prep Kit for Illumina®(New England Biolabs,美国)进行文库构建,利用Illumina 平台对每个样本生成的mRNA文库进行测序。所有转录本都从数据库中进行了注释,包括NCBI 非冗余蛋白序列(NCBI nonredundant protein sequences,NR)数据库、基因本体(Gene Ontology,GO)数据库、KEGG数据库,同源蛋白簇(euKaryotic Orthologous Groups/Clusters of Orthologous Groups of proteins,KOG/COG)数据库、Swiss-Prot(A manually annotated and reviewed protein sequence database)手动注释和审查的蛋白质序列数据库、蛋白家族(Protein family,Pfam)数据库。使用RSEM v1.3.1软件对转录本的基因表达水平进行定量,基因表达水平采用每千个碱基转录物片段数/百万片段(fragments per kilobase of transcript per million fragments mapped,FPKM)进行测量。利用DESeq2 v1.22.1 软件对两组之间的差异表达基因进行显著性分析,差异表达基因的筛选条件为|log2Fold Change|≥1,且错误发现率(false discovery rate,FDR)<0.05。
1.4 统计分析
本研究中的每个样本均设置3 个重复,采用SPSS 19.0 软件对数据进行单因素方差分析(one-way ANOVA),采用Turkey检验,P<0.05为差异显著。本研究所有数据均以“平均值±标准误”表示,结果图选用Adobe Illustrator 2022和GraphPad Prism 9软件绘制。
2 结果与分析
2.1 病原菌的形态学特征
通过形态学观察(图1)结合显微形态(图2),可以得出尖孢镰刀菌、层出镰刀菌、腐皮镰刀菌三者主要的区别,结果如表1所示。

表1 3种镰刀菌的形态特征Table 1 Morphological characteristics of three Fusarium species
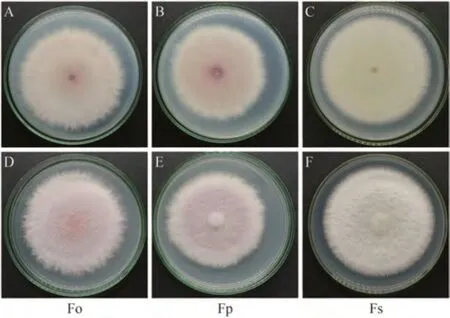
图1 3种镰刀菌的培养性状Fig.1 The culture traits of three Fusarium species
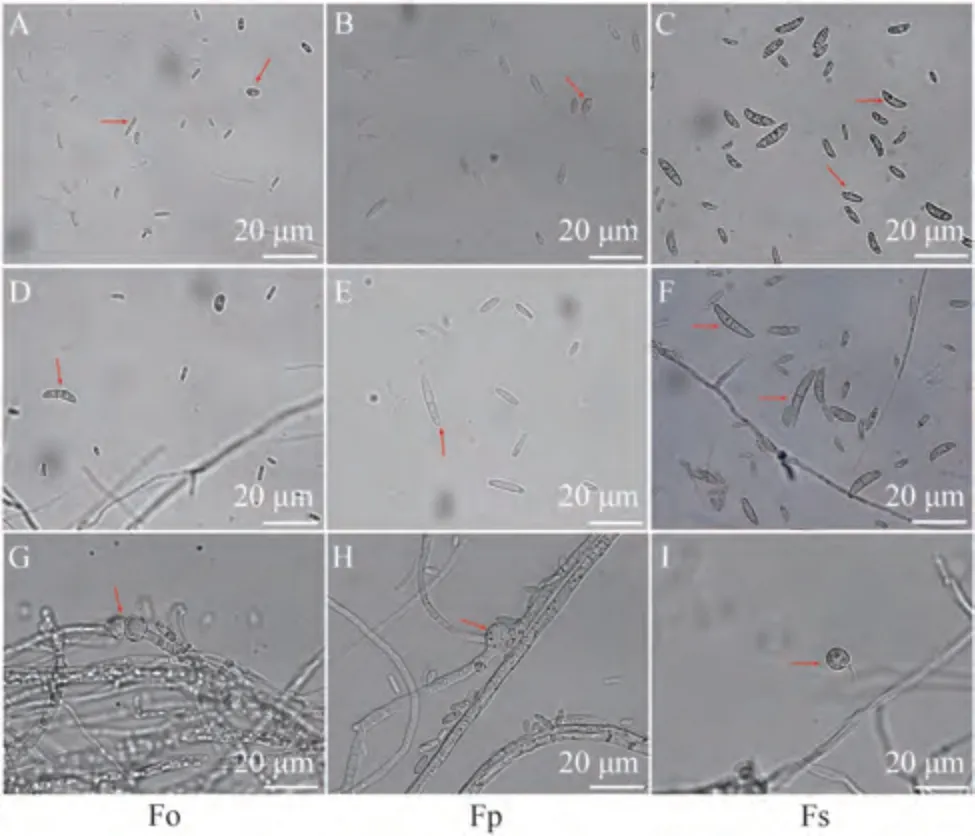
图2 3种镰刀菌的显微形态Fig.2 The micromorphology of three Fusarium species
2.2 不同病原菌的孢子萌发率
相同培养条件下,腐皮镰刀菌的孢子萌发最快,层出镰刀菌次之,尖孢镰刀菌最慢(图3-A)。随着培养时间的延长,孢子芽管逐渐增长,孢子萌发率增高。萌发3 h时,尖孢镰刀菌、层出镰刀菌、腐皮镰刀菌三者的孢子萌发率分别是3.24%、5.62%、21.76%,腐皮镰刀菌与尖孢镰刀菌、层出镰刀菌之间存在显著差异(P<0.05),而尖孢镰刀菌与层出镰刀菌之间孢子萌发率没有显著差异。萌发6 h时,三者的孢子萌发率没有显著差异。尖孢镰刀菌和腐皮镰刀菌在萌发9 h时具有显著差异(P<0.05)。
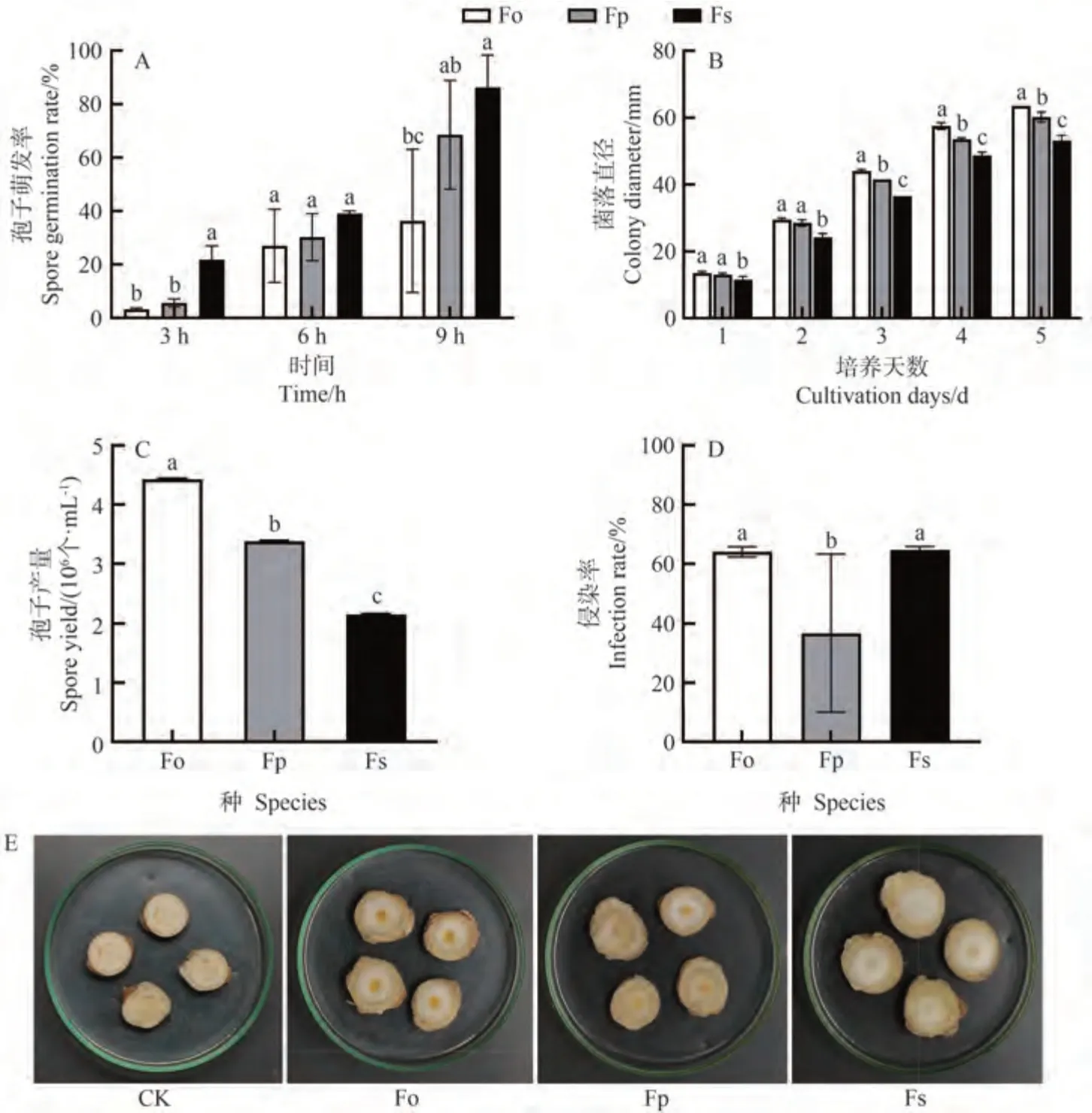
图3 3种镰刀菌的孢子萌发率、菌丝生长、孢子产量及致病力差异Fig.3 Differences in spore germination rate,hyphae growth,spore yield and pathogenicity of three Fusarium species
2.3 不同病原菌的菌丝生长
相同培养条件下,尖孢镰刀菌菌丝生长较层出镰刀菌、腐皮镰刀菌快,腐皮镰刀菌生长最慢,层出镰刀菌次之(图3-B)。从第1天开始,腐皮镰刀菌与尖孢镰刀菌、层出镰刀菌相比开始呈现显著差异(P<0.05)。在第5天时,尖孢镰刀菌、层出镰刀菌、腐皮镰刀菌三者的菌落直径分别为63.5、60.0、53.2 mm,且尖孢镰刀菌、层出镰刀菌、腐皮镰刀菌三者的菌落直径具有显著差异(P<0.05)。
2.4 不同病原菌的孢子产量
将生物量一致的3 种病原菌菌盘用定量无菌水冲洗得到孢子悬浮液,用血球计数板在显微镜下观察。尖孢镰刀菌产孢量4.425×106个·mL-1,层出镰刀菌产孢量为3.375×106个·mL-1,腐皮镰刀菌产孢量2.150×106个·mL-1(图3-C),且三者的分生孢子产量具有显著差异(P<0.05)。上述结果表明,尖孢镰刀菌的孢子产量最高,层出镰刀菌次之,腐皮镰刀菌最低。
2.5 侵染试验结果
侵染试验结果如图3-D、E所示,接种4 d后,与对照组相比,尖孢镰刀菌、层出镰刀菌、腐皮镰刀菌均能侵染三七,在菌落覆盖范围内三七出现了一定程度的腐败。将3种病原菌对鲜三七的侵染力进行比较发现,尖孢镰刀菌、腐皮镰刀菌的侵染率显著高于层出镰刀菌(P<0.05),腐皮镰刀菌和尖孢镰刀菌对三七侵染率之间无明显差异。
2.6 三个镰刀菌种间的代谢差异
采用超高效液相色谱串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)分析方法对Fo、Fp、Fs 的菌丝进行代谢物鉴定。通过聚类和PCA 分析,将9 个样本分成3 组,共检测和鉴定出1 165 种代谢物(图4)。PCA 分析结果显示,在PC1×PC2 评分图上,Fo、Fp、Fs 三组之间表现出明显的分离,这表明3 种镰刀菌的代谢物存在较大差异,同时每个样本的3 个生物学重复紧密聚集在一起,表明所测代谢组数据具有较高的可重复性。在检测到的1 165 个代谢物中,可分为13 大类(图5-A),其中1 001种代谢物被分为12个已知类;其余164种未知的代谢物被分配到“其他”组。共鉴定出属于4 类的600 种初级代谢产物,主要的初级代谢产物是氨基酸及其衍生物、脂质,这些占总初级代谢产物的68%。共鉴定出401 种次生代谢产物,分为8 类,占总代谢物的34.4%。酚酸为主要次生代谢产物,其次为生物碱和黄酮。通过比较分析,发现3 种镰刀菌中代谢物的差异主要体现在占比较大的氨基酸及其衍生物和脂质上。

图4 基于主成分(PCA)和聚类热图的代谢产物差异分析Fig.4 Differential metabolite analysis on the basis of principal component (PCA) and clustering heat map

图5 3种镰刀菌中所有已鉴定的代谢产物和差异积累代谢产物Fig.5 All identified metabolites and DAMs in the three Fusarium species
为了比较3 种镰刀菌之间的代谢物组成的差异,用VIP≥1.0、fold change≥2 和fold change≤0.5 的参数分析代谢物,结果显示,在3 个可比较组中,共确定了963种差异代谢物(DAMs),通过Venn图和柱形图对筛选结果进行了说明(图5-B、C)。在Fs 和Fo 之间有519 种差异代谢物,其中分别有243 和276 个代谢物在Fo中上调和下调;共有728中差异代谢物在Fs和Fp中被鉴定,包括Fp 中上调331 个、下调397 个;在Fo 和Fp中共有716种差异代谢物,其中分别有354、362个代谢物在Fp中上调和下调。
为了研究每个样品的代谢特征,差异代谢物被分为相应的类别。结果如图6 所示,在Fs vs.Fo 比较组中,与Fs相比,Fo中大多数氨基酸及其衍生物、黄酮上调,而大多数脂质、核苷酸及其衍生物、酚酸类下调。在Fs vs.Fp 的比较中,初级代谢物和次级代谢物分别占差异代谢物的50.82%、36.40%,与Fs 相比,Fp 中的大多数初级代谢产物下调;而在Fo vs.Fp 比较组中,共有380 种初级代谢物和243 种次级代谢物被鉴定为差异代谢物。其中,与Fo相比,Fp中大多数脂质上调,而有机酸、核苷酸及其衍生物、氨基酸及其衍生物一类的初级代谢产物下调,黄酮类、酚酸类的大多数次生代谢产物同样下调。综上,Fo、Fp 与Fs 三者表现出不同的代谢组成;与另外两个菌相比,Fs 的初级代谢产物含量较高,特别是脂质和核苷酸及其衍生物;与Fs 相比,Fp 的初级代谢产物含量较低;与Fp、Fs 相比,Fo 含有较高的氨基酸及其衍生物,而脂质含量较低。

图6 差异代谢物的分类和数量Fig.6 Classification and number of differential metabolites
2.7 三种镰刀菌的转录组学分析
转录组分析结果表明,3 种镰刀菌的基因表达水平不同(图7-A)。为了检验转录组的差异,对3种镰刀菌转录组进行配对比较,在配对比较中确定的DEGs数量如图7-B、C 所示,在Fs 和Fo 比较组中,共检测到16 325个DEGs,其中在Fo中,8 394个DEGs的表达量高于Fs,7 931 个DEGs 的表达量低于Fs。同样,在Fs 和Fp的比较中共发现16 048个DEGs,其中8 482个DEGs的表达量高于Fs,7 566 低于Fs。在Fo 和Fp 的比较中共发现13 366 个DEGs,其中7 183 个在Fp 中的表达量高于Fo,6 183个DEGs在Fp中的表达量低于Fo。上述结果表明,不同镰刀菌种的基因表达谱存在较大差异。
对Fo vs.Fp、Fs vs.Fo、Fs vs.Fp 3 组DEGs 的GO富集情况进行比较,结果发现,在生物过程中,3 个比较组的DEGs 均显著富集在细胞和代谢过程中;在细胞成分中,细胞解剖学实体注释的基因相对较多;同时,结合、催化活性、转运活性是影响分子功能的最大因素。在KEGG 注释结果中,Fo vs.Fp、Fs vs.Fo 和Fs vs.Fp 共3 个比较组中所有的差异基因均注释到了代谢、细胞过程、遗传信息处理、环境信息处理和生物系统5 个相关通路。在KEGG 富集分析结果中显示,3 个比较组在代谢中的碳代谢、氧化磷酸化注释基因最多;遗传信息处理中核糖体、内质网中的蛋白质加工注释基因最多;细胞过程中减数分裂-酵母注释基因最多;环境信息处理中MAPK信号通路-酵母注释基因最多;生物系统只有在长寿调节途径-多物种被注释。
为了进一步了解这些差异基因的生物学功能,基于KEGG 数据库对差异基因进行通路富集分析,选取富集最显著的前20 条通路进行展示(图8)。Fs 与Fo之间的DEGs 主要富集在氧化磷酸化(上调165 个、下调111 个)、核糖体(上调175 个、下调131 个)、剪接体(上调134 个、下调108 个)、TCA 循环(上调63 个、下调62个)等途径(图8-A);Fs与Fp之间的DEGs主要富集在氧化磷酸化(上调145个、下调108个)、核糖体(上调179 个、下调124个)、剪接体(上调136个、下调107个)(图8-B);Fo与Fp之间的DEGs 主要富集在真核生物中的核糖体生物发生(上调73 个、下调89 个)、内质网中的蛋白质加工(上调121 个、下调104 个)(图8-C)。结果表明,与核糖体、氧化磷酸化相关的基因表达量在3种镰刀菌中的差异较大。

图8 差异表达基因KEGG富集前20条通路Fig.8 Top 20 pathways for KEGG enrichment analysis of DEGs
2.8 转录组和代谢组联合分析
为了解在转录水平上调控的代谢途径,对DAMs和DEGs 的富集途径进行了成对比较(图9)。在Fs 和Fo比较组中,α-亚麻酸代谢、碳代谢、不饱和脂肪酸的生物合成、花生四烯酸代谢都有重叠(图9-A);在Fs和Fp的比较中,亚油酸代谢、赖氨酸生物合成、精氨酸生物合成、α-亚麻酸代谢、半胱氨酸和蛋氨酸的代谢有重叠(图9-B);在Fo 和Fp 的比较中,不饱和脂肪酸的生物合成、精氨酸生物合成重叠(图9-C)。

图9 转录组和代谢组联合分析Fig.9 Transcriptome and metabolome combined analysis
结合转录组学和代谢组学分析的数据,发现氨基酸是3 个镰刀菌不同种占比最高的差异代谢物,而与生命体生长发育相关的氨基酸,是真菌菌丝营养生长的唯一氮源,因此重点关注氨基酸代谢相关通路,分析氨基酸在不同种镰刀菌间的差异表达情况。3 个镰刀菌氨基酸代谢物积累差异的图谱显示(图10),多数氨基酸如缬氨酸、亮氨酸、精氨酸、鸟氨酸、苏氨酸、赖氨酸、甲硫氨酸(蛋氨酸)、天冬酰胺在Fo 中的含量较为丰富;与其他两种镰刀菌相比,半胱氨酸、天冬氨酸、异亮氨酸在Fs中积累较多。

图10 3个不同种镰刀菌中氨基酸代谢的相关途径Fig.10 Pathways related to amino acid metabolism in three different Fusarium species
3 讨论
镰刀菌是最具破坏性的植物病原菌之一[15],能够利用菌丝定殖植株根部进行侵染,最终导致作物产量下降,带来严重的经济损失[16]。靶向和非靶向代谢组技术已用于鉴定不同生物体中的代谢物[17]。本研究采用广泛靶向代谢组学方法检测尖孢镰刀菌、层出镰刀菌和腐皮镰刀菌中的代谢物,共检测到1 165种代谢物,其中以氨基酸及其衍生物这一类别占比最高(图5)。
氨基酸是组成蛋白质的基本元素,与蛋白质合成和真菌分生孢子萌发紧密相关[18-19]。天冬酰胺作为真菌蛋白质合成的优质氮源,直接影响真菌分生孢子萌发和菌丝体的形成[20]。本研究中Fs 天冬酰胺的含量远低于Fo、Fp(图10),由此推测低含量的天冬酰胺可能是Fs 菌丝生长较Fo 与Fp 慢的因素之一。氨基酸种类同样是影响真菌菌丝生长快慢的因素之一,研究表明缬氨酸、精氨酸、甲硫氨酸、苏氨酸和亮氨酸可显著促进尖孢镰刀菌的菌丝生长,其中苏氨酸不利于尖孢镰刀菌的孢子萌发[21-24]。在本研究中,缬氨酸、精氨酸、亮氨酸、苏氨酸、甲硫氨酸、鸟氨酸等氨基酸在Fo 中的含量远高于Fs和Fp(图10)。相对丰富的缬氨酸、精氨酸、亮氨酸和甲硫氨酸可能是促进Fo 菌丝生长的物质,而苏氨酸可能抑制了Fo的孢子萌发。张俊英等[21]和王田涛等[25]研究发现天冬氨酸对腐皮镰刀菌的菌丝生长具有抑制作用。Qiu 等[26]研究发现天冬氨酸和半胱氨酸对尖孢镰刀菌的菌丝生长具有较强的抑制作用。张璐等[27]研究显示,L-半胱氨酸能显著抑制稻曲病菌的菌丝生长。本研究中,Fs 天冬氨酸和半胱氨酸的含量远高于Fo、Fp,结合前面的表型结果(图3)推测天冬氨酸和半胱氨酸抑制了Fs 的菌丝生长。上述研究结果之间存在差异,可能是由于致病菌种类的不同,但这也说明了不同种类氨基酸对病原菌的生长发育产生不同的影响。根据以上结果推测,苏氨酸和天冬氨酸有可能是Fo、Fp 和Fs 菌丝生长产生差异的相关代谢产物。
转录组常被用于分析代谢物积累的分子机制。在本研究中,分别在Fs vs.Fo、Fs vs.Fp、Fo vs.Fp 比较组中鉴定出16 325、16 048、13 366 个DEGs(图7),每次比较中均存在大量DEGs,表明不同种的镰刀菌基因表达谱存在较大差异。DEGs 的KEGG 富集分析结果表明(图8),大量的DEGs 与核糖体、氧化磷酸化有关,推测翻译的启动和能量代谢相关途径与3 种镰刀菌菌丝生长差异有关;剪接体途径在Fs与Fo和Fs与Fp的比较中显著富集。PRP4 是编码剪接体成分中唯一的激酶,Gao等[28]和董慧霞等[29]研究发现PRP4激酶基因的缺失或减少会使菌丝生长、分生孢子产生受到抑制。说明病原真菌的菌丝生长和分生孢子生成受到PRP4激酶基因的调控。本研究发现编码PRP4 激酶的基因表达在Fs 与Fo 和Fs 与Fp 的比较中显著上调,在Fo 与Fp 的比较中显著下调,因此推测,Fo 菌丝生长速率及孢子产量与另外两个菌相比显著增加是因为Fo 中积累了更多的PRP4 激酶。综合上述结果表明,镰刀菌的菌丝营养生长和分生孢子的产生可能在转录水平上受到调控。
4 结论
本研究在尖孢镰刀菌、层出镰刀菌及腐皮镰刀菌中检测到大量的代谢物,并对不同种镰刀菌的差异代谢物进行分类和功能分析,初步探究了氨基酸及其衍生物在不同种镰刀菌中的差异表达。结果表明,尖孢镰刀菌含有较高的氨基酸及其衍生物,腐皮镰刀菌次之,层出镰刀菌最少;发现氨基酸参与调控镰刀菌的生长发育,包括菌丝生长、孢子萌发及分生孢子的产生。后续将对本研究中涉及的相关氨基酸进行进一步分析,以期更全面深入探究不同种镰刀菌之间分子生物学差异的分子机制。
