水稻明恢826光身基因GL826的精细定位与候选基因分析
2024-02-23韦新宇张文静曾跃辉肖长春黄建鸿许旭明
韦新宇 张文静 曾跃辉 肖长春 张 锐 黄建鸿 许旭明,
(1三明市农业科学研究院生物技术研究所,福建 三明 365500;2福建省(山区)作物遗传改良与创新利用重点实验室,福建 三明 365500;3三明市农业科学研究院水稻研究所,福建 三明 365500)
光身稻(Oryzaglaberrima)因其茎秆、叶片和谷壳等组织表面光滑无毛而得名,又叫光叶稻或光壳稻。光身稻具有广亲和性、对强光适应能力强、抗倒伏性强、适合机械化操作和节省储运空间等优良特性[1-4],已作为杂交水稻育种重要的种质资源被加以研究和利用[5]。
植物表皮毛起源于表皮细胞,是一种表皮组织向外延伸的毛状突起,在植物体中普遍存在,可由单细胞或多细胞构成,形态结构多样[6-8]。水稻的表皮毛为双细胞毛状体,呈圆柱状分布[9]。目前,对水稻表皮毛性状的研究主要集中在叶片和颖壳[5]。光身稻的无表皮毛性状主要表现为叶片和颖壳表面毛状体的减少或缺失。已报道的与水稻茸毛生长发育相关的基因HL6[10]、HL1[11]和GL6[12],均已被定位在水稻第6 号染色体上,且叶片长毛表型均受细胞核单基因控制,属显性遗传。已报道的水稻光身基因wmg2[13]位于第3 号染色体上,wmg1[13]位于第4 号染色体上,GL5[10]、NUDA/GL-1[14]、dep[9]、gl-l[15]、GLAG5[16]位于第5 号染色体上,GLR3[17]、OsSPL10[18]、gl6[19]、GLL[20]位于第6 号染色体上。其中,GL5基因被精细定位在水稻第5号染色体33 kb 区间内,GL5基因的表达水平降低导致表皮毛的缺失[10];NUDA/GL-1基因座被精细定位在水稻第5 号染色体28.5 kb 区间内,通过RNAi 和互补分析,确认一个编码具有WUSCHEL结构域蛋白的同源基因(OsWOX3B)作为候选基因[14];dep基因被精细定位在水稻第5 号染色体22 kb 区间内,互补试验证实dep基因对无毛表型具有调节作用[9]。位于第6号染色体上的OsSPL10启动子区发生变异导致籼稻品种WD-17993出现无毛性状[18],也有研究表明OsSPL10是水稻茸毛发育的正向调控基因,其与OsWOX3B、OsPLT2基因间存在遗传互作,共同调控水稻表皮毛的起始发生和伸长[21]。
明恢826(MH826)是三明市农业科学研究院利用亲本IR249和NO3S2杂交配组,经多世代自交选择、抗病鉴定以及与大量不育系测配筛选育成的优良光身稻恢复系。该恢复系具有株型好、结实率高、米质优、配合力强等优点,所配杂交稻组合已陆续进入生产应用,其育种利用和研究价值较好。但目前对MH826 的光身性状及控制光身性状的基因尚不了解。因此,本研究对MH826的光身性状进行显微观察和遗传学分析,利用分离群体分析法(bulked segregation analysis,BSA)和隐性群体分析法(recessive class analysis,RCA),对其光身基因进行精细定位和候选基因分析,以期为进一步明确其基因功能和分子机制奠定基础,同时为光身稻品种及其光身基因在水稻育种上的应用提供理论依据。
1 材料与方法
1.1 试验材料
利用光身稻恢复系MH826 与具有明显表皮毛特性的水稻品种华占、明恢2155和9311杂交,获得F1代。F1代自交后获得F2代分离群体,用于光身基因的遗传学分析和精细定位。2020 年晚季在福建沙县三明市农业科学研究院水稻试验基地种植亲本、F1和F2代群体,常规田间管理。
1.2 表型鉴定与遗传分析
分别在苗期、分蘖期和抽穗期对亲本、F1和F2代分离群体单株进行表型鉴定和统计学分析。以手指自叶尖沿叶面和边缘向叶基部触摸无粗糙感作为光身表型鉴定依据。通过统计F2代分离群体中光身单株和有毛单株的分离比进行遗传学分析,并利用χ2进行适合性检验。
1.3 扫描电镜观察
选取水稻分蘖期的叶片和灌浆期的种子用2.5%戊二醛固定液于4 ℃冰箱内固定1 h 以上,然后用0.2 mol·L-1的磷酸缓冲液(pH 值7.2)漂洗3 次,每次20 min,再用1%锇酸固定1 h,然后用0.2 mol·L-1的磷酸缓冲液(pH 值7.2)漂洗3 次,每次20 min,再用梯度乙醇溶液进行脱水,每次20 min。之后在K850 CO2临界点干燥仪(Quorum,英国)内进行干燥处理,再将样品粘在样品台上用MC1000 离子溅射仪(HITACHI,日本)进行离子溅射镀膜处理,最后利用SU8100 扫描电子显微镜(HITACHI,日本)观察并拍照[22]。
1.4 基因的精细定位
采用改良的十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)法[23]提取水稻苗期叶片全基因组DNA。在F2分离群体中分别随机选择15 个光身单株和15个有毛单株提取基因组DNA,浓度统一稀释为50 ng·μL-1,等量混合从而构建光身基因池和有毛基因池[24]。通过水稻生物信息学网站(http://www.gramene.org/)搜索PCR 扩增产物大小在300 bp 以内,且均匀分布于水稻12条染色体上的356 对简单重复序列(simple sequence repeat,SSR)引物对亲本和基因池进行多态性检测并对F2隐性单株进行基因型分析,筛选与目标基因紧密连锁的分子标记。PCR扩增反应体系为10 μL:2×TaqPCR MasterMix(艾德莱,北京)5.0 μL,50 ng·μL-1DNA 模板0.8 μL,10 μmol·L-1正、反向引物各0.5 μL,ddH2O 3.2 μL。PCR 扩增反应程序:94 ℃预变性3 min;94 ℃变性10 s,55~60 ℃退火10 s,72 ℃延伸10 s,35 个循环;72 ℃终延伸5 min;4 ℃保存。PCR 扩增反应结束后,将PCR 扩增产物用8.0%的非变性聚丙烯酰胺凝胶进行电泳,通过GelDoc XR+凝胶成像系统(Bio-Rad,美国)进行拍照观察。另外,根据粳稻品种日本晴和籼稻品种9311 之间的基因组序列差异,利用Primer Premier 5.0 软件进一步设计和开发分布密度更高的插入缺失(insertion-deletion,InDel)标记,用于光身基因GL826的精细定位。PCR 反应及电泳程序方法和步骤同上。利用Mapmaker/Exp3.0 软件进行连锁分析,采用Kosambi 运算函数将重组率转换为遗传距离,结合MapDraw v2.1 软件绘制遗传连锁图谱。根据水稻生物信息学网站(http://www.gramene.org/)提供的水稻基因组序列信息并通过染色体步移的方法构建物理图谱。
1.5 候选基因分析
通过水稻基因组注释数据库(Rice Genome Annotation Project,RGAP,http://rice.plantbiology.msu.edu/)对精细定位区间内候选基因的功能进行预测,并结合实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)以及克隆和测序技术对候选基因进行表达和序列分析,具体方法参照文献[25]。
2 结果与分析
2.1 MH826表型鉴定和扫描电镜分析
本研究以手指触摸的方式对研究材料的表型进行初步鉴定。结果表明,具有表皮毛特性的水稻品种华占、明恢2155和9311的叶片和籽粒颖壳具有明显的粗糙感,手指在叶片和颖壳表面滑动时存在明显的阻滞感;而光身稻恢复系MH826 的叶片和籽粒颖壳触摸光滑,无粗糙感。进一步采用扫描电镜分析了具有表皮毛特性的水稻品种华占和光身稻恢复系MH826 分别在分蘖期叶片以及灌浆期籽粒的表皮毛发育情况。结果表明,华占和MH826 在叶片和籽粒表皮存在显著的表皮毛差异。在华占的叶片和籽粒表皮可观察到明显的尖刺状表皮毛,包括大刺毛和小刺毛,且在叶片表面分布相对密集(图1-A~D)。而在MH826 的叶片和籽粒表皮仅存在少量的腺毛,未观察到明显的尖刺状表皮毛,呈现表面光滑特性(图1-E~H),其与手指触感鉴定结果表现一致。

图1 华占和MH826的叶片、籽粒扫描电镜观察Fig.1 Observation of leaf and grain phenotypes of two parental lines (Huazhan and MH826) by scanning electron microscope
2.2 MH826光身性状的遗传学分析
为了对MH826 的光身性状进行遗传特性分析,本研究利用MH826 分别与具有表皮毛特性的水稻品种华占、明恢2155 和9311 配制杂交组合,获得F1代并构建了3 个独立的F2代分离群体。在分蘖盛期,分别对华占×MH826,明恢2155×MH826 和MH826×9311 获得的F1代植株以及F2代群体进行叶片表型鉴定和统计学分析。结果表明,杂交获得的所有F1代植株叶片均表现为明显的表皮毛性状,与具有表皮毛特性的亲本叶片表型表现一致,说明MH826 的光身性状属于隐性遗传。另外,在3 个独立的杂交F2代群体中,显性单株(有毛单株)和隐性单株(光身单株)表现出明显的分离,且均符合孟德尔单基因控制的3∶1分离比(χ2<χ20.05)(表1)。以上结果表明,MH826的光身性状由单个细胞核隐性基因控制。本研究将其命名为GL826( Glabrous Leaf 826)。
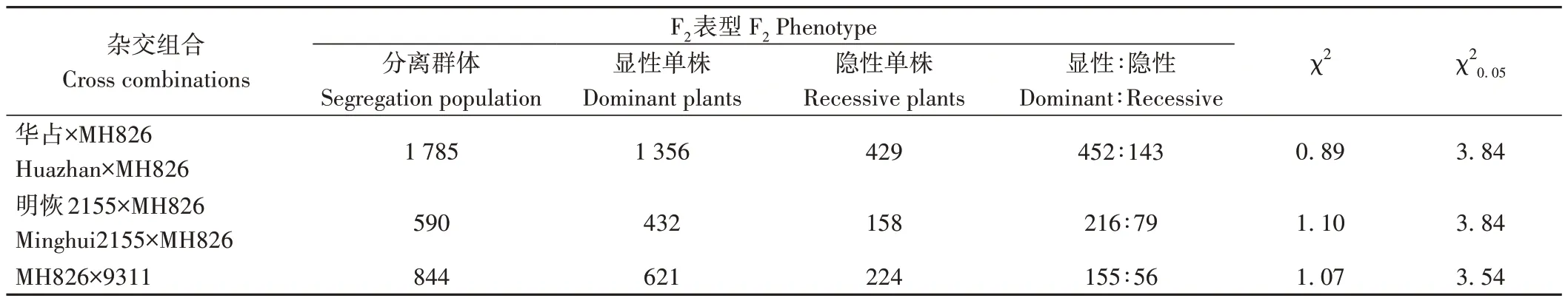
表1 MH826杂交组合的分离分析Table 1 Segregation analysis of MH826 crosses
2.3 GL826基因的精细定位
由表1 可知,华占×MH826、明恢2155×MH826 和MH826×9311 构建的3 个F2代分离群体植株数量分别是1 785、590 和844 个。综合考虑基因精细定位对大群体数量的要求,本研究优先选用群体植株数量较大的华占×MH826 获得的429 个F2隐性单株对光身基因GL826进行精细定位。首先利用平均分布于水稻12条染色体上的356 对SSR 引物对亲本以及两个极端基因池进行多态性筛选,通过对F2隐性单株进行基因型鉴定,并结合Mapmaker/Exp 3.0 进行连锁分析。获得一个位于水稻第5 号染色体上的SSR 标记Rm13 与GL826基因连锁。进一步在Rm13 附近筛选分布密度更高的SSR 标记对两亲本、基因池以及F2隐性单株进行多态性检测和基因型分析,获得与GL826连锁的SSR标记共7 对:Rm17731、Rm6300、Rm17787、Rm17812、Rm17819、Rm5579 和Rm405。并将GL826初步定位在Rm17787 和Rm17812 之间,相对遗传距离分别为1.6 和2.4 cM(图2-A)。通过比对粳稻品种日本晴和籼稻品种9311 基因组序列,在Rm17787 和Rm17812标记之间开发获得插入缺失InDel 标记95 对,进一步对亲本、基因池以及F2隐性单株进行多态性检测和基因型分析,获得与GL826紧密连锁的特异性InDel标记19 对:InDel-02、InDel-11、InDel-13、InDel-14、InDel-17、InDel-24、InDel-26、InDel-28、InDel-31、InDel-40、InDel-44、InDel-48、InDel-61、InDel-64、InDel-68、InDel-70、InDel-71、InDel-72 和InDel-76。最终将光身基因GL826精细定位在分子标记InDel-70 和InDel-11 之间,且相对遗传距离均为0.2 cM(图2-A)。结合RGAP 数据库,该精细定位区间对应粳稻品种日本晴的物理距离为141.03 kb(图2-B)。参考日本晴各细菌人工染色体(bacterial artificial chromosome,BAC)克隆序列,并通过染色体步移的方法将每个与光身基因GL826连锁的分子标记在染色体上的位置锚定在相应的BAC 克隆上,从而构建了覆盖GL826基因位点的物理图谱(图2-B)。本研究用于GL826精细定位的InDel标记序列及扩增片段大小如表2所示。

图2 光身基因GL826精细定位Fig.2 Fine mapping of glabrous leaf gene GL826
2.4 GL826候选基因分析
参考RGAP 水稻基因组注释数据库,发现在该精细定位区间共预测有23 个开放阅读框(ORFs)(表3)。其中候选基因LOC_Os05g02730为已报道的与水稻表皮毛发育相关的基因OsWOX3B,该基因编码一个WOX3B转录因子家族蛋白,参与植物特异性横向器官的发育调节,OsWOX3B基因突变将导致水稻叶片和籽粒颖壳表皮毛缺失,表现为植株整体光滑无毛的表型[9,14]。因此,本研究将LOC_Os05g02730作为GL826的重点候选基因并进行进一步的序列和表达分析。

表3 23个候选基因功能注释Table 3 Functional annotations of twenty-three candidate genes of GL826 based on the RGAP database
为了鉴定候选基因LOC_Os05g02730是否为GL826,本研究通过PCR 扩增和测序技术首先克隆和分析了光身稻恢复系MH826 和具有表皮毛特性的水稻品种华占、明恢2155 和9311 中LOC_Os05g02730基因的编码序列。结果表明,华占、明恢2155、9311和MH826在LOC_Os05g02730基因的编码区未检测到碱基差异,且序列和已报道的OsWOX3B[9,14]基因序列完全一致(图3-A)。即光身稻恢复系MH826 中含有LOC_Os05g02730(OsWOX3B)基因完整的编码序列(coding sequence,CDS)。另外,进一步选择LOC_Os05g02730基因起始密码子上游1.8 kb 启动子区域进行PCR 扩增和序列比对分析。结果表明,华占、明恢2155、9311和MH826 在该启动子区域同样未检测到碱基差异并且和OsWOX3B基因启动子序列表现一致(图3-B)。因此,LOC_Os05g02730基因在具有表皮毛特性的水稻品种华占、明恢2155、9311 和光身稻恢复系MH826 中未鉴定到DNA 水平差异,包括编码区和基因上游的启动子区域。本研究用于LOC_Os05g02730基因CDS 和启动子序列测序的特异性引物如表4所示。

表4 用于LOC_Os05g02730基因测序和表达分析的引物Table 4 Primers used for sequencing and expression analysis of LOC_Os05g02730 in this study
为了进一步确定候选基因LOC_Os05g02730即为光身基因GL826,本研究利用qRT-PCR 技术分析了LOC_Os05g02730基因在光身稻恢复系MH826 和具有表皮毛特性的水稻品种华占在不同时期以及不同组织部位中的表达差异,其中分别包括LOC_Os05g02730在苗期、分蘖期和抽穗期的根、茎、叶以及抽穗期幼穗组织中的表达。结果表明,LOC_Os05g02730基因在MH826 苗期、分蘖期和抽穗期的茎、叶片以及抽穗期的幼穗中的表达水平均极显著低于具有表皮毛特性的水稻品种华占,尤其在叶片中的表达下调最为明显(图4)。说明LOC_Os05g02730基因在光身稻恢复系MH826 中的表达受到了严重的抑制,其表达量在不同生长发育阶段不同组织中表现为不同程度的下调。因此,推测LOC_Os05g02730即为GL826基因。本研究用于LOC_Os05g02730基因表达分析的特异性引物如表4所示。

图4 LOC_Os05g02730在华占和MH826不同时期不同组织中的表达模式分析Fig.4 Expression patterns of LOC_Os05g02730 in various tissues of huazhan and MH826 during different growth stages,determined by qRT-PCR analysis
3 讨论
MH826 是三明市农业科学研究院经多世代自交选择、抗病鉴定以及大量不育系测配筛选育成的优良光身稻恢复系。本研究通过手指触感和扫描电镜观察进行光身表型鉴定,结果显示MH826 的叶片和颖壳表面手指触摸光滑,无粗糙感。扫描电镜同样未观察到明显的尖刺状表皮毛,呈现表面光滑表型,二者鉴定结果一致。在明确了MH826 光身表型的基础上,利用MH826 与具有表皮毛特性的水稻品种华占、明恢2155和9311 杂交,构建多个F2代分离群体对其光身性状进行遗传学分析。结果表明MH826 的光身性状由细胞核隐性单基因控制。目前已报道的调控水稻光身性状的基因NUDA/GL-1[14]、OsWOX3B[26]、dep[9]、GLR1[13]、GL5[27]、gl1[28]、OsSPL10[29]、GLR3[17]、glr2[30]、GLL[20]等也均受细胞核隐性单基因控制。
本研究利用MH826与华占杂交构建的429个F2代隐性(光身性状)单株对GL826基因进行精细定位。将GL826基因定位在水稻第5号染色体短臂端,位于分子标记InDel-70 和InDel-11 之间,相对遗传距离均为0.2 cM,区间物理距离为141.03 kb。参考RGAP 数据库,发现在该精细定位区间共注释有23 个完整的ORF。其中LOC_Os05g02730基因[9,14]为前人已报道的与水稻表皮毛性状发育相关的基因。因此,本研究重点将LOC_Os05g02730作为GL826的候选基因,并作进一步的序列比对和表达模式分析。结果发现LOC_Os05g02730基因在光身稻恢复系MH826 苗期、分蘖期叶片、茎以及抽穗期叶片、茎和幼穗组织中的表达表现出不同程度的下调,说明LOC_Os05g02730基因在光身稻恢复系MH826 中的表达受到了严重抑制。Zhang等[14]认为LOC_Os05g02730基因与WUSCHEL-like基因(OsWOX3B)同源。OsWOX3B属于WOX3家族中的一个亚族,其主要调控水稻叶片形态的发生以及表皮毛的生长和发育,同时影响水稻侧生器官的发育和形成。序列分析结果表明,LOC_Os05g02730与水稻的OsWOX3以及拟南芥的PRS、玉米的NS1和NS2具有高度相似性[9,30-31],其功能对于表皮细胞的分化至关重要。因此,综合以上表型鉴定、构建3个独立群体的遗传分析、精细定位、LOC_Os05g02730基因的表达模式分析及其功能注释等分析结果,本研究认为候选基因LOC_Os05g02730(OsWOX3B)即为GL826基因。然而本研究在进行基因序列比对时发现,LOC_Os05g02730基因在光身稻恢复系MH826 和具有表皮毛特性的水稻品种华占、明恢2155 和9311 之间均未检测到DNA水平上的差异,包括CDS 编码区和基因上游的启动子区域(图3)。这与NUDA/GL-1[14]、OsWOX3B[26]、dep[9]报道的研究结果一致,即LOC_Os05g02730基因在有毛水稻和光身水稻品种间不存在DNA 水平上的差异,因而推测其光身表型可能由表观遗传修饰引起。其中关于DNA 甲基化的研究较多,如水稻甲基化转移酶SDG714的功能缺失,会导致基因组甲基化水平明显降低,进而导致植株表现出光叶和光壳表型[32]。无毛非洲栽培稻的颖壳无毛性状是由于hAT转座子插入到控制毛状体发育基因GLAG5(GLABROUS GLUME 5)上,引发DNA 甲基化,进而抑制该基因的表达而产生无毛性状[16]。另外,组蛋白乙酰化也被发现参与调控植物表皮毛的发育,如GCN5(GENERAL CONTROL NON DEREPRESS-IBLE 5)通过组蛋白乙酰化作用于GL1、GL2和GL3的启动子,参与抑制拟南芥的表皮毛发育起始[33]。miRNA 作为一类进化上保守的小分子RNA,已有研究表明其参与了植物表皮毛的发育,如在拟南芥中,SPL(SQUAMOSA PROMOTER BINDING PROTEIN LIKE)是调控表皮毛发育的一类转录因子,miRNA156通过调控SPLs的表达来调控表皮毛发育,miRNA156的参与会导致SPLs的表达量增加,拟南芥主茎上表皮毛的数量相应减少[34]。另有研究报道,水稻光身突变体的光叶或光壳表型的形成可能由RNA 的折叠等二级结构变化导致[5,28]。由此可知,关于光身稻恢复系MH826 光身基因GL826的具体调控机理有待进一步研究。
前人对水稻光身基因的研究多采用光身突变体或远缘种质作为研究材料,而本研究则采用新育成的已在生产上应用的光身稻恢复系作为研究材料,这使得定位和克隆的基因更能与生产实际结合,能够直接在育种和生产实践中加以利用。近年来,光身稻品种的选育和种质资源的应用越来越多。张世辉等[35]利用光壳遗传背景材料AF6-82/R80 与三合占/农香16 杂交,经多代自交、回交,育成香型优质稻品种农香32。陈锦文等[36]以光身稻澳大利亚-112 与明恢77 杂交,经多世代选育,育成光身稻恢复系泉恢404,并配组育成杂交稻组合福农优404。本课题组利用光身稻恢复系MH826 配制的杂交稻新组合泸优826、广优826、明优826 均表现产量高、米质好、千粒重大、抗倒伏性强等优点,应用前景较好。
4 结论
光身稻恢复系MH826 的光身表型由单个细胞核隐性基因控制。利用MH826 与华占杂交构建的F2分离群体将GL826 基因精细定位在水稻第5 号染色体短臂端,位于InDel-70 和InDel-11 之间约141.03 kb 区域内。通过序列分析和表达模式分析,确定候选基因LOC_Os05g02730即为GL826基因。
