线粒体源性活性氧调控蛋白/酶在老年性耳聋中的研究进展
2024-02-22孙宗润孙一诺陈海军许子渊杨城龙尹海燕
孙宗润 孙一诺 陈海军 许子渊 杨城龙 尹海燕
(济宁医学院基础医学院,山东 济宁 272067)
老年性耳聋亦称年龄相关性聋(ARHL),是指随着年龄增长而逐渐出现双耳对称性、进行性的感音神经性听力损失,患者常出现对高频声音不敏感,语言分辨率下降,多数还伴有耳鸣等问题。随着人口老龄化的加剧,ARHL已成为一个严重的社会健康问题。资料预测,2025~2040年,中国老年人口将从2.84亿增加到4亿,其中约有11.04%会出现听力障碍,而ARHL约占其中66.78%〔1〕。ARHL患者认知能力下降、痴呆风险增加,不仅影响了患者的生活质量,而且带来巨大的社会经济负担。线粒体源性活性氧(ROS)积累与ARHL发病机制密切相关,成为国内外学者研究的焦点,调控线粒体ROS相关的酶和蛋白在ARHL的作用日益受到重视。本文通过论述调控线粒体ROS的酶和蛋白在ARHL的作用,为其预防和治疗提供帮助。
1 线粒体ROS与衰老
线粒体通过氧化磷酸化生成ATP参与能量供给,在此过程中产生ROS,是细胞内ROS产生的主要场所。一般情况下,ROS在细胞内信号传递过程中起到氧化还原信使的作用,线粒体抗氧化酶,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、过氧化氢酶等,可以清除代谢过程中产生的多余ROS,维持线粒体稳态,保护细胞活性。过多的ROS影响线粒体稳态加速细胞凋亡,造成不可逆损伤,导致细胞死亡。随着年龄增长,线粒体内膜损伤影响线粒体膜质子浓度梯度,使线粒体合成 ATP的功能受损,引起过量ROS产生,攻击靶点蛋白,造成生物膜结构蛋白和脂质过氧化,损伤生物膜通透性,加速细胞凋亡〔2〕。ROS介导的氧化应激引起耳蜗组织细胞损伤是导致ARHL的病理关键之一〔3〕。耳蜗毛细胞及螺旋神经元属不可再生的终末分化细胞,其损伤导致不可逆ARHL,研究证实调控耳蜗毛细胞和螺旋神经元线粒体ROS产生的蛋白和酶在ARHL发展中具有重要意义。
2 调控ROS的线粒体内膜蛋白(Mpv)与ARHL
2.1Mpv17 Mpv17是一种在人体中由Mpv17基因编码的蛋白质。Mpv17蛋白作为线粒体抗氧化因子在活性氧代谢中发挥着重要作用。Mpv17通过与HtrA2丝氨酸蛋白酶结合,通过稳定线粒体内膜电位抑制线粒体ROS的产生〔4〕。Mpv17蛋白可以减轻年龄引起的螺旋神经节细胞退化,Mpv17基因缺失(Mpv17-/-)小鼠在7月龄时螺旋神经节细胞严重退化,体积变小〔5〕。另有研究证实Mpv17基因缺失小鼠在出生2个月后即表现出严重的听力损伤,且伴有部分血管纹脱节,边缘细胞缺失或完全不发育,柯氏器退化,毛细胞丢失〔6,7〕。Meyerzum等〔8〕通过观察小鼠第18天到第9周的发育状况,发现Mpv17-/-小鼠柯蒂器成熟后内耳毛细胞快速的细胞变性,伴随着广泛的细胞质空泡形成、线粒体改变和溶解。
2.2解耦联蛋白(UCP)2 UCP2是线粒体内膜蛋白UCP家族的一员,通过稳定膜电位,消除线粒体内膜两侧的跨膜质子浓度差,减慢线粒体氧化磷酸化过程,减少ROS的生成。研究表明,UCP2间接参与细胞内ROS的生成从而对内耳的氧化损伤起到保护作用〔9〕。Sugiura等〔10〕研究发现在日本人群中UCP2基因外显子的多态性与年龄相关性听力损失显著相关。D-半乳糖诱导大鼠衰老,其内耳UCP2 mRNA和UCP2蛋白显著增加〔11〕。魏薇等〔12〕发现在老年鼠耳蜗中UCP2表达量明显增高,推测UCP2通过降低线粒体ATP合成从而影响耳蜗带状突触的正常功能。Gates等〔13〕证实衰老过程中线粒体突变引起UCP2减少,进而导致内耳耳蜗退化、听力损失。
3 调控线粒体ROS的酶与ARHL
3.1异柠檬酸脱氢酶(IDH)2 IDH2参与三羧酸循环,产生谷胱甘肽还原酶(GSR)辅助因子还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),通过维持线粒体氧化平衡左右细胞命运〔14,15〕。激活的IDH2通过增加线粒体中NADPH升高谷胱甘肽(GSH)/氧化谷胱甘肽(GSSG)比率,降低ROS水平,保护内耳细胞,预防哺乳动物年龄相关的听力损失〔14〕。IDH2 缺失降低NADPH和GSH水平,导致ROS过度积累,引起毛细胞和螺旋神经节神经元死亡,导致听力受损〔16〕。White等〔16〕发现24月龄的IDH2-/-雄性小鼠在8、32和48 kHz的听性脑干反应(ABR)阈值比年龄匹配的WT小鼠增加了27~35 dB,老年IDH2-/-雄性小鼠在8和48 kHz时Ⅰ波振幅下降了40%~46%,表明IDH2缺失加速雄性小鼠ARHL。
3.2柠檬酸合成酶(CS) CS参与三羧酸循环,产生高能还原形式的烟酰胺腺嘌呤二核苷酸和黄素腺嘌呤二核苷酸2用于氧化磷酸化〔17〕。CS活性降低减缓氧化磷酸化的速度或降低糖酵解的速度,减少ATP的产生,增加细胞中ROS积累,促进耳蜗毛细胞的衰老〔18,19〕。Cai等〔20〕证明CS基因敲除导致过量的超氧化物歧化,线粒体中与ROS产生相关的调节因子UCP2表达水平降低,ROS生成增多,ATP合成减少,最终导致毛细胞凋亡。此外,Johnson等〔21〕证实A/J小鼠(一种表现出AHL的近交小鼠品系)体内CS合成减少,ROS增多,通过激活应激反应或信号转导途径导致细胞死亡。
3.3Sirtuins(Sirt)家族 Sirts是烟酰胺腺嘌呤二核苷酸依赖性蛋白脱乙酰酶家族,共有7个同源物(Sirt1~7)。Sirt1、Sirt6和Sirt7在细胞核中,Sirt2在细胞质中,Sirt3、Sirt4 和Sirt5在线粒体中,与线粒体氧化应激密切相关〔22〕。其中Sirt1、Sirt6在毛细胞或螺旋神经节中高表达,与ARHL关系也较为密切。降低Sirt1表达减少耳蜗外毛细胞和螺旋神经元与年龄相关的氧化损伤,延迟ARHL的早期发作〔23〕。增加Sirt1活性对ARHL中枢通路的恢复有重要作用〔24〕。Sirt6基因在衰老耳蜗外毛细胞和螺旋神经元表达上调〔25〕。Sirt3可以直接结合线粒体复合物Ⅰ和Ⅱ使其去乙酰化来调控ROS的生成,通过改变SOD2的乙酰化水平调节ROS的清除〔26~28〕。抑制 Sirt3 降低线粒体膜电位、升高 ROS 水平导致耳蜗基底膜毛细胞损伤和带状突触丢失〔29〕。在衰老大鼠研究中发现,Sirt3存在于大鼠中枢听觉皮质中,Sirt3表达降低,SOD2活性降低,ROS生成增加,导致线粒体超微结构退行性变化,最终导致ARHL〔30〕。
3.4葡萄糖-6-磷酸脱氢酶(G6PD) G6PD催化6-磷酸葡萄糖脱氢,产生NADPH。参与细胞抗氧化。Bermúdez-Muoz等〔31〕发现随着年龄的增长,与正常小鼠相比,高表达G6PD转基因小鼠NADPH水平升高,ROS生成减少,维持了耳蜗科蒂器、螺旋神经节和侧壁器官的正常结构,保护外毛细胞免受氧化损伤。提示过多的G6PD是通过对抗与年龄相关的氧化还原失衡和氧化诱导的损伤起到延迟ARHL的作用。
3.5细胞色素C氧化酶(COX) COX复合体由13个亚基组成,其中,COX1、COX2和COX3参与线粒体膜上氧化呼吸链的组成及氧自由基的产生,COX复合物是氧自由基产生的一个重要场所〔32〕。随着年龄增长,呼吸链中的COX会发生明显变化,测序结果显示老年人耳蜗神经元中大量的COX基因突变,编码COX1、COX2和COX3的线粒体DNA分别减少了15%、43%和75%〔33〕。Markaryan等〔34〕检测到老年性耳聋患者螺旋神经节细胞中COX3表达降低。在听皮层中COX3 mRNA 表达随着年龄的增加而逐渐降低〔35〕。综上,COX在ARHL发生过程中的作用不容忽视。
3.6NADPH氧化酶(NOX) NOXs是产生ROS的主要部位之一,在哺乳动物,NOX家族由七种亚型(NOX1~5、DUOX1、2)组成,其中NOX3与ARHL关系最为密切。由于NOX3只在内耳表达,使其在减缓ROS产生和参与内耳细胞氧化损伤方面起重要作用。随着年龄的增长,小鼠耳蜗内毛细胞和螺旋神经节中NOX3表达增加〔36〕。衰老大鼠外周听觉系统中ROS的主要来源是NOX3,慢性注射D-Gal会加重外周听觉系统中NOX3介导的氧化应激,导致线粒体损伤和细胞凋亡〔37,38〕。Rousset等〔39〕研究表明,NOX酶介导的兴奋性毒性的增强是导致年龄相关性听力损失的主要原因,为ARHL的发病机制和未来的治疗靶点提供了新的见解。
综上,线粒体源性ROS积累与ARHL发病机制密切相关,通过调控线粒体ROS相关的关键酶和蛋白影响内耳ROS水平,延缓ARHL的发病进程(图1)。
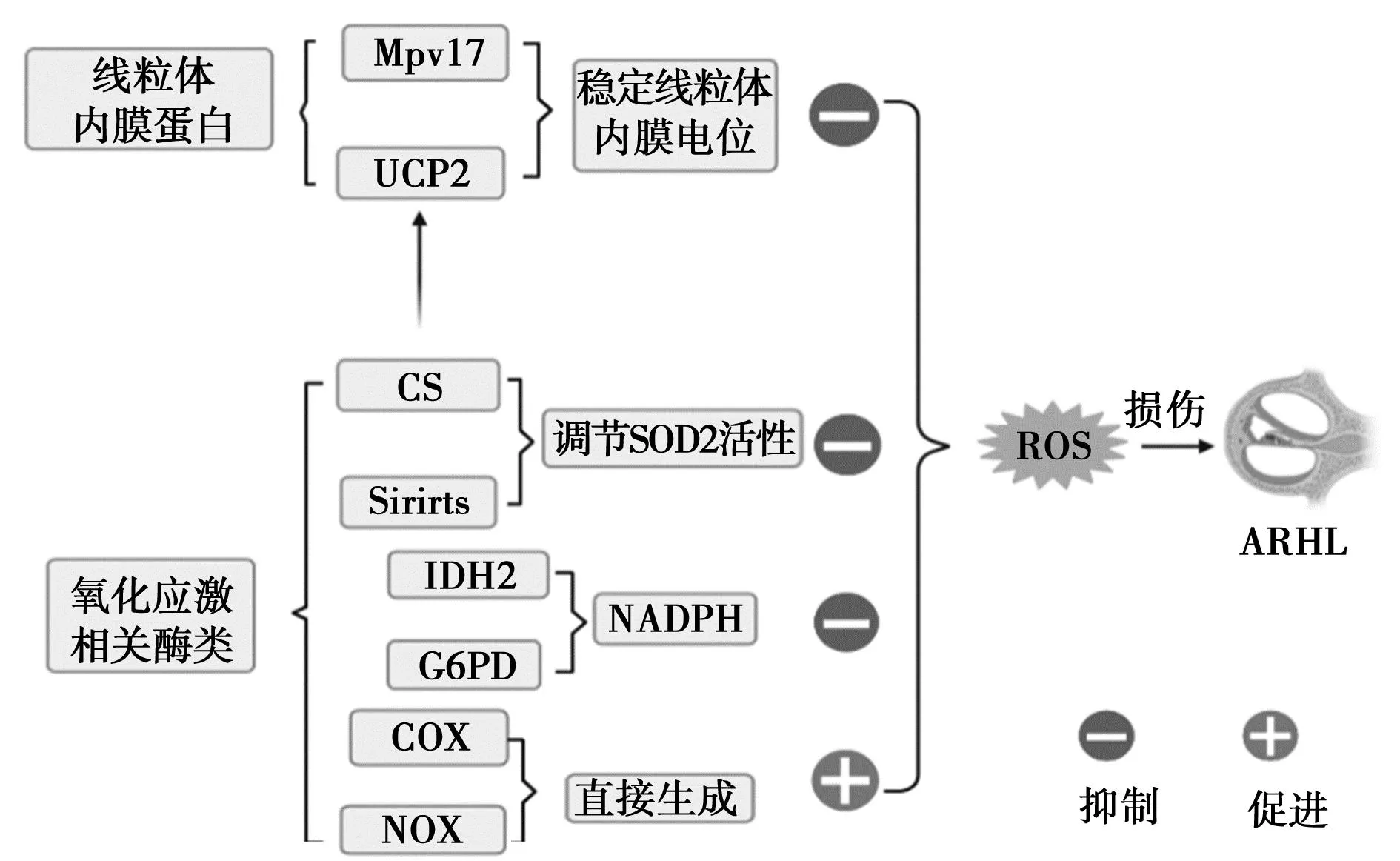
图1 线粒体源性ROS调控蛋白和酶
