miR-26a在血管钙化中的作用机制
2024-02-22吴伟尚玉强程龙王杰杨传蕾
吴伟 尚玉强 程龙 王杰 杨传蕾
(华中科技大学同济医学院附属武汉中心医院心脏大血管外科,湖北 武汉 430000)
血管钙化虽然被认为是正常衰老过程的一部分,但某些病理过程,如糖尿病、高血压、慢性肾病(CKD)和罕见的遗传性疾病,也可能促成这种情况〔1〕,严重威胁着人类的健康。已有研究发现,骨形态发生蛋白(BMP)、骨桥蛋白(OPN)、骨保护素(OPG)及细胞核因子κB受体活化因子配体(RANKL) 等骨相关蛋白,在血管钙化的过程中有重要作用,其中OPG和RANKL的作用最为重要〔2,3〕。RANKL通过调控巨噬细胞生成促钙化细胞因子,以调节血管平滑肌细胞(VSMCs)钙化,而OPG则相当于整个RANKL系统的制动器,其与核因子κB受体激活剂(RANK)竞争性结合,抑制了RANKL/RANK系统的作用,从而抑制VSMCs钙化〔3〕。miRNAs可指导VSMCs的基因重新编码,并且在其他细胞中也有与血管钙化相关的有效应答〔4〕,miRNAs被认为是调节血管钙化的关键因素,其中miR-26a能够促进VSMCs增殖,同时抑制细胞分化和凋亡,并改变TGF-β途径的信号传导。并且其代表着异常平滑肌细胞(SMC)生物学的重要新调节剂和某些疾病的潜在治疗靶标〔5〕。而miR-26a在血管钙化中的具体作用机制尚不清楚。因此,本研究通过文献资料及生物信息学数据库等筛选出miR-26a探讨其在血管钙化中的表达差异及其作用机制。
1 材料与方法
1.1主要试剂 DMEM购自Gibco(C11995500BT),胎牛血清购自TBD(TBD11HT),PBS和0.25%胰蛋白酶购自雷根(R00088,CC0130),β-甘油磷酸盐(BGP)、CaCl2均购自Sigma(G9422、C1016),甲醛购自麦克林(F864792),茜素红法钙质染色试剂盒购自上海歌凡(M040),碱性磷酸酶(ALP)购自南京建成(A059-1-1)。
1.2主要仪器 超净工作台购自博科(型号BBS-DDC),生物安全柜购自安泰(型号BSC-1800IIB2),CO2恒温培养箱购自LabServTM(型号LBS#111112100),移液器购自(型号LH-745021),倒置荧光显微镜购自析域(型号BM-38XD),酶标仪购自杭州奥盛仪器有限公司(型号AMR-100),微量高速离心机购自长沙平凡(TG16W),微量移液枪购自美国Rainin PiPet-Lite,水浴锅购自Leica(HI1210),UPT 优普特实验室超纯水器购自法国MilliPORE(ULUPURE,优普)。
1.3细胞培养 将大鼠胸大动脉平滑肌细胞A7r5从液氮中取出后立即置于37 ℃水浴锅中,不断摇晃,使其在1 min之内溶解,然后迅速置于超净台中,将溶解后的细胞悬液加入含有5 ml 10%胎牛血清(FBS)DMEM培养基的培养瓶中,轻轻吹打均匀后,放入37 ℃、5%CO2恒温培养箱中培养。每日观察细胞贴壁情况并换液,取生长状态良好,形态正常的VSMCs细胞进行实验。
1.4主动脉SMC钙化模型构建 收集细胞,调整细胞悬液浓度,分于12孔板,1×105个细胞/孔,每孔1 ml,置 37 ℃、5%CO2培养箱中培养过夜,使细胞贴壁。钙化培养基(CM;DMEM中补充10 mmol/L BGP和3 mmol/L CaCl2)诱导A7r5钙化,诱导0、12、24、48、72 h。取出细胞培养板备用。
1.5模型鉴定 取各组细胞用PBS洗3遍后,用4%多聚甲醛固定30 min。吸去4%多聚甲醛溶液。加入2 ml茜素红染色液,室温染色30 min蒸馏水速洗。在倒置显微镜下观察染色效果,拍照。
1.6实时荧光定量聚合酶链反应(qRT-PCR) Trizol提取细胞总RNA,反转录为cDNA,以cDNA为模板进行PCR扩增。PCR程序:95 ℃预变性3 min;95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,共40个循环。采用2-ΔΔCt法计算miR-26a相对表达水平,引物序列(5′-3′)为:miR-26a正向:GGGGTTCAAGTAATCCAGGA,反向:CTGGTGTCGTGGAGTCGG,骨保护素(OPG)正向:CGAGTGATGAATGCGTGTA,反向:CAGGAGGCCAAGTGAGC,骨桥蛋白(OPN)正向:ACAGTATCCCGATGCCACA,正向:GCTGGTCTTCCCGTTGC,骨形态发生蛋白(BMP)-2正向:TCTGTCCCTACTGATGAGTTTCT,反向:GGCTGTGGCAGGCTTTAT,胶原蛋白(Collagen)Ⅱ正向:GCCTAGCAACATGCCAATC,反向:GCAGCAAAGTTCCCAGTAAGA,GAPDH正向:CAAGTTCAACGGCACAG,反向:CCAGTAGACTCCACGACAT,U6正向:CTCGCTTCGGCAGCACATATACT,反向:ACGCTTCACGAATTTGCGTGTC。
1.7细胞转染 实验分为对照(control)组、miR-26a-5p mimics组、miR-26a-5p mimics NC组、miR-26a-5p inhibitor组、miR-26a-5p inhibitor NC组。进行贴壁和悬浮细胞,对于每个转染样品,按下面的方法准备:①取100 pmol miRNA稀释于250 μl Opti-MEM中,轻轻吹吸5次混匀。②取5 μl Lipofectamine®RNAiMAX稀释于250 μl Opti-MEM中,轻轻吹吸5次混匀,室温下静置 5 min。③将①中液体缓慢加入②液体中,轻轻吹吸5次混匀,室温孵育20 min。④将500 μl复合物加到含有细胞和换有1.5 ml新鲜培养基的培养板孔中,来回轻柔摇晃细胞培养板。⑤将细胞板置于37 ℃、5% CO2培养箱中,转染 4 h后换新鲜培养基,培养 24 h。⑥检测转入基因表达情况。
1.8细胞钙化沉积检测 将实验进行分组,除正常对照组不进行任何处理,其余组构建血管钙化模型(VSMC细胞诱导钙化),分为模型组、miR-26a mimic组(miR-26a mimic转染)、mimic NC组(mimic NC转染)、miR-26a inhibitor组(miR-26a inhibitor转染)、inhibitor NC组(inhibitor NC转染)。模型诱导:钙化培养基被用来诱导VSMC钙化,诱导48 h。取各组细胞用磷酸盐缓冲液(PBS)洗3遍后,用4%多聚甲醛固定30 min,吸去4%多聚甲醛溶液;加入2 ml茜素红染色液,室温染色30 min,蒸馏水速洗,在倒置显微镜下观察染色效果,拍照。
1.9细胞ALP检测 采用南京建成试剂盒检测细胞ALP活性,操作步骤严格按照说明书进行。
1.10统计学处理 采用SPSS22.0软件进行方差分析、LSD检验。
2 结 果
2.1VSMC钙化模型的构建及miR-26a表达量 与0 h比较,随着诱导时间延长,细胞钙化加剧,在48 h和72 h细胞钙化明显。见图1。与0 h(0.96±0.04)比较,钙化12、24、48、72 h VSMC细胞miR-26a表达水平(0.61±0.28、0.19±0.00、0.07±0.01、0.07±0.00)显著下降(均P<0.05),且在48 h时miR-26a表达水平达到最低。因此,细胞钙化最佳诱导时间为48 h。
2.2miR-26a-5p模拟剂、抑制剂转染细胞效率鉴定 与miR-26a-5p mimics NC组(0.92±0.13)相比,转染miR-26a-5p mimics后miR-26a-5p的表达量(9.24±0.26)显著升高(P<0.05)。与miR-26a-5p inhibitor NC组(1.02±0.07)相比,转染miR-26a-5p inhibitor 后miR-26a-5p表达量(0.19±0.01)显著降低(P<0.05),而miR-26a-5p inhibitor NC组和miR-26a-5p mimics组miR-26a-5p水平无明显变化(P>0.05)。说明miR-26a-5p mimics和miR-26a-5p inhibitor可以用于后续实验。
2.3miR-26a对细胞钙化的影响 与mimic NC组比较,miR-26a mimic组钙化程度明显改善;与模型组和inhibitor NC组比较,miR-26a inhibitor组的钙化程度明显严重;而mimic NC组和inhibitor NC与模型组相比无明显变化。见图2。
2.4miR-26a对钙化细胞ALP活性的影响 与mimic NC组相比较,miR-26a mimic组ALP活性显著降低(P<0.05)。而inhibitor NC组和miR-26a inhibitor组ALP活性无显著差异(P>0.05)。见表1。
2.5miR-26a对OPG、OPN、BMP-2和CollagenⅡ基因表达影响 与正常对照组比较,模型组OPG、miR-26a表达水平显著降低(P<0.05),OPN、BMP-2和CollagenⅡ表达水平显著升高(P<0.05);与mimic NC组比较,miR-26a mimic组miR-26a、OPG表达水平显著升高(P<0.05),OPN、BMP-2和CollagenⅡ表达水平显著降低(P<0.05)。与inhibitor NC组比较,miR-26a inhibitor组的miR-26a、OPG、OPN、BMP-2和CollagenⅡ表达水平无显著差异(P>0.05)。见表1。

图1 VSMC钙化模型鉴定(茜素红染色,×200)
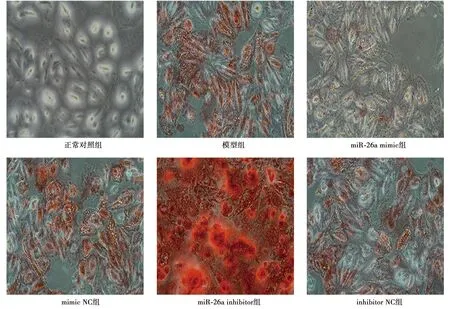
图2 各组细胞钙化沉积(茜素红染色,×200)

表1 miR-26a对钙化细胞ALP活性和OPG、OPN、BMP-2和CollagenⅡ蛋白表达的影响
3 讨 论
血管钙化被定义为矿物质沉积在血管系统中,以钙-磷酸复合物形式存在,是主动脉粥样硬化、高血压、糖尿病血管病变等普遍存在的病理表现,易致心室肥大、心力衰竭、主动脉夹层形成,是心脑血管病高死亡率的重要因素〔6〕。其钙化的过程被认为源自凋亡SMC或这些细胞在内部弹性层附近释放的基质囊泡(外泌体),这发生在钙化调节蛋白〔如骨钙素(OC)和BMP2〕的内膜含量发生变化之前,但与未羧化基质gla蛋白(MGP)的表达增强〔7〕。
微小RNA(miRNAs)是一类由20~22个核苷酸组成的小片段非编码RNA,通过靶向结合基因mRNA的3′非翻译区(3′-UTR)调控其表达〔8〕。通常来说,一种miRNA可以靶向结合调控多个mRNAs,一个mRNA也可能由多种miRNAs调控的。miRNAs是由含有环状结构的miRNAs的初级转录产物在细胞核内由Drosha加工成60~90 nt miRNAs前体,然后pre-miRNAs通过核输出蛋白5途径转运至细胞质,在细胞质中由核糖核酸酶Ⅲ剪切为成熟miRNAs,目前已发现的miRNA有28,600多种,其中人源性miRNA有4 500多种,研究显示,很多miRNA在机体生命活动过程中发挥重要作用〔9〕。有研究证明,microRNAs在骨代谢中发挥重要作用,包括血管钙化〔10,11〕。而miR-26a能够促进VSMC增殖,同时抑制细胞分化和凋亡,并改变转化生长因子(TGF)-β途径的信号传导。ALP是骨形成和 VC 的表型标志物〔12,13〕。在软骨内骨化过程中,ALP 活性对于羟基磷灰石的形成很重要,并且在异位钙化中观察到在脉管系统中的类似作用。本研究发现,在过表达miRNA-26a后显著降低了ALP的活性。
而OPG/RANKL/RANK系统是骨代谢中的一个重要的信号通路,OPG是肿瘤坏死因子(TNF)受体超家族的成员,是一种成骨细胞分泌的诱饵受体,是骨吸收的负调节因子。RANKL通过调控巨噬细胞生成促钙化细胞因子以调节VSMC钙化,而OPG则相当于整个RANKL系统的制动器,其与RANK竞争性结合,抑制了RANKL/RANK系统的作用,从而抑制VSMC钙化〔14〕。Bennett等〔15〕研究发现,在小鼠敲除OPG基因后动脉粥样硬化、VC和骨质疏松加剧严重,同时RANKL表达水平升高。本研究结果与前人研究结果一致,进一步解释了在细胞钙化时,miR-26a通过靶向结合某个基因调控了OPG/RANKL/RANK的信号通路。
综上,在细胞钙化模型中,过表达miR-26a后,可使OPG的表达量上调,使OPN、BMP-2、CollagenⅡ表达水平下调,其作用机制可能与miR-26a结合某个基因后,调控了OPG/RANKL/RANK信号通路有关。
