LRG1在乳腺癌组织中表达及临床意义
2024-02-22张彦收刘学良张庚曹淼刘运江
张彦收 刘学良 张庚 曹淼 刘运江
(1河北医科大学第四医院乳腺中心,河北 石家庄 050011;2沧州市人民医院甲乳外科)
中国国家癌症中心发布的全国癌症统计数据显示:乳腺癌是国内女性发病首位的恶性肿瘤,每年发病人数约为30.4万〔1〕。当前,随着精准化治疗模式的推进和新型药物的不断涌现,乳腺癌的治疗效果已取得了巨大提升。然而,乳腺癌发病机制复杂,探寻乳腺癌发病、增殖和转移关键基因,建立新的治疗途径和靶点对提高乳腺癌的生存率至关重要。富亮氨酸α-2糖蛋白(LRG)1是富亮氨酸重复序列(LRR)超家族蛋白成员之一,LRG1在多种恶性肿瘤中表达上调,并在细胞增殖、凋亡、侵袭转移及血管生成方面扮演着重要角色。目前国内、外关于LRG1在乳腺癌中表达的研究报道较少。本研究通过检测原发性乳腺癌组织中LRG1的表达,探讨其与临床病理参数的关系。
1 资料与方法
1.1临床资料 收集2019年1~6月河北医科大学第四医院乳腺中心收治的125例原发性乳腺癌患者石蜡包埋组织标本及临床病理资料,均为女性,中位年龄50岁;组织切片包括乳腺癌组织及癌旁组织。纳入标准:(1)经病理诊断确诊为浸润性乳腺癌;(2)均接受手术治疗(保乳或乳房切除术),腋窝接受前哨淋巴结活检或淋巴结清扫。(3)术前未接受过放、化疗及内分泌治疗。排除标准:(1)合并其他恶性肿瘤;(2)初诊有远处转移;(3)复发转移性乳腺癌。(4)病理检查结果为乳腺导管上皮重度不典型增生和导管原位癌。本研究经河北医科大学第四医院伦理委员会批准,患者均已知情同意。
1.2免疫组织化学染色方法 所有组织标本中LRG1蛋白的表达均由医院病理科医师采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(SP)法进行检测,具体操作步骤如下:石蜡切片脱蜡、乙醇脱水;加3% H2O237 ℃下孵育10 min,以阻断内源性过氧化物酶的活性;磷酸盐缓冲液(PBS)冲洗3次×5 min;行抗原修复,山羊血清孵育,加LRG1抗体(1∶200)、4 ℃下孵育过夜;PBS冲洗3次×5 min;加生物素标记,37 ℃下孵育20 min;PBS冲洗3次×5 min;加辣根过氧化物酶标记,37 ℃下孵育30 min;PBS冲洗3次×5 min;加新配制的DAB 显色,苏木素复染10 s,PBS反蓝,脱水、透明、封片。PBS 替代一抗作为阴性对照。
1.3结果判读 两位经验丰富的病理医师,采用双盲法对免疫组化结果进行判读。LRG1着色部位主要为胞膜和胞质,阳性信号表现为褐色颗粒状外观。在病灶处随机选取10个高倍视野,每个视野计数100个细胞。半定量分析LRG1呈阳性的癌细胞在所观察细胞中的百分比和染色强度。染色百分比为:阳性细胞数<5%=0分,5%~25%=1分,26%~50%=2分,≥51%=3分。染色强度分为:无染色=0分,轻度染色=1分,中度染色=2分,重度染色=3分。然后,根据染色强度与阳性细胞比率评分的乘积,确定每个标本的染色评分:≥3分为阳性,<3分为阴性。
1.4统计学方法 采用SPSS21.0软件行χ2检验。
2 结 果
2.1LRG1在肿瘤组织及正常乳腺组织中的表达情况 在125例原发性乳腺癌患者中,59.2%(74/125例)患者LRG1呈阳性表达。LRG1着色部位主要位于胞膜和胞质,阳性信号表现为褐色颗粒状外观,见图1。乳腺癌组织中LRG1表达高于癌旁组织〔36.7%(46/125)〕,差异有统计学意义(χ2=4.96,P=0.04)。

图1 LRG1 在乳腺癌组织中表达(×200)
2.2LRG1表达与临床病理参数的关系 不同淋巴结转移、TNM分期患者LRG1阳性表达差异显著(P<0.01,P<0.05)。未发现乳腺癌组织中LRG1蛋白阳性表达与患者年龄、月经状态、肿瘤直径、组织学分级、乳腺癌分型的相关性(P>0.05)。见表1。
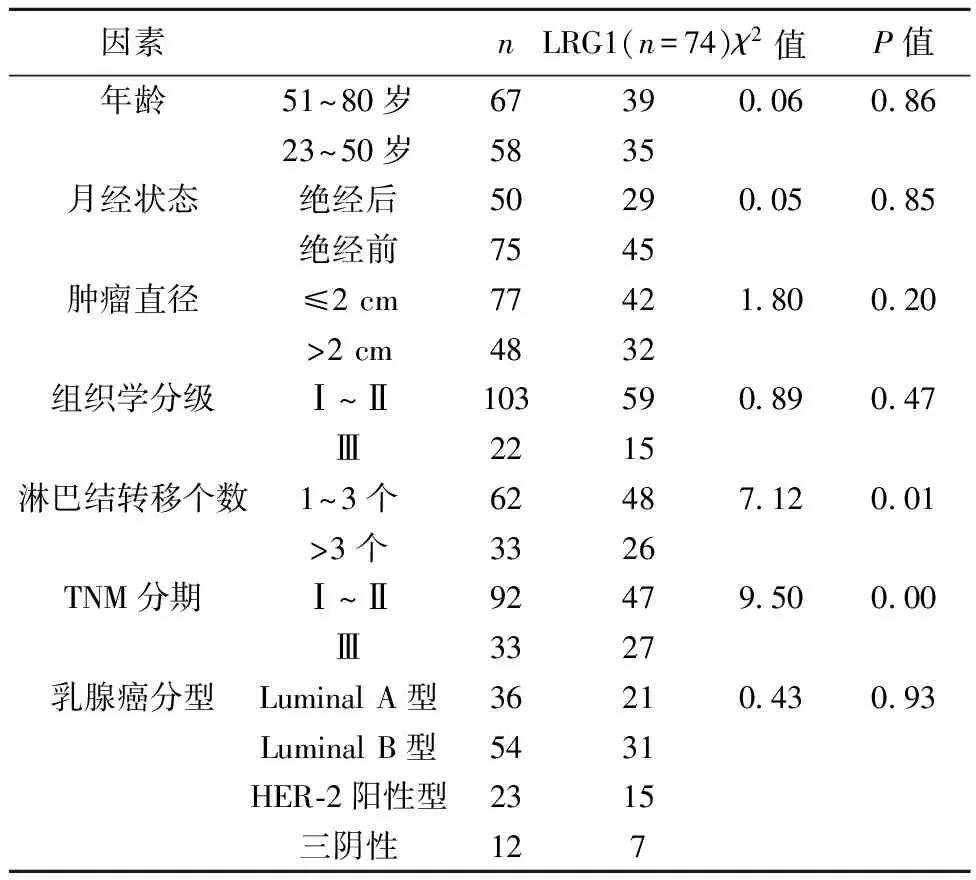
表1 乳腺癌组织中LRG1阳性表达与临床病理参数的关系(n)
3 讨 论
LRG1是最早被发现的含有LRR结构的蛋白。早期研究认为LRG1可能是中性粒细胞早期分化的一种标志物〔2〕。近些年研究显示LRG1在人类多种恶性肿瘤组织、血液、脑脊液、外泌体中异常表达,并且可以作为部分肿瘤早期诊断和预后判断的生物标记物。LRG1可能在肿瘤的发生、发展、侵袭转移、上皮间质转化(EMT)和异常血管生成过程中扮演重要角色。
LRG1在健康人视网膜新生血管中表达水平较高,在其他正常组织如乳房、皮肤和胃肠道组织中呈现弱的不完全表达〔3〕。目前多项报道LRG1在恶性肿瘤组织中呈现表达上调。在239例胃癌患者中,44%的患者LRG1呈现高表达〔4〕;在肝癌患者中,LRG1的表达水平为85.8%(667/777)〔5〕。此外,在胰腺癌和非小细胞肺癌中,同样发现LRG1表达水平的升高〔6,7〕。基于癌症基因组图谱(TCGA)数据库中转录组测序技术(RNA-seq)测序结果,使用基因表达谱数据动态分析(GEPIA)数据库(http://gepia.cancer-pku.cn/index.html)〔8〕分析TCGA中1 085例乳腺浸润性癌和112例正常乳腺组织的数据,结果显示LRG1 mRNA在乳腺癌组织中表达明显高于正常乳腺组织。分析Breast Cancer Gene-Expression Miner数据库〔9〕中乳腺癌资料,LRG1 mRNA表达在不同激素受体状态和HER-2表达中存在显著差异,雌激素受体(ER)、孕激素受体(PR)均阳性患者LRG1 mRNA表达显著高于ER、PR均阴性组;HER-2阴性组LRG1 mRNA表达高于HER-2过表达组。本研究结果证明,LRG1蛋白在浸润性乳腺癌组织的表达与LRG1 mRNA表达情况一致。但在不同分子亚型中未发现LRG1蛋白表达差异性,可能与本研究中纳入HER-2阳性型和三阴性乳腺癌标本例数较少有关,可进一步扩大样本量进行验证。
目前研究显示,LRG1不仅在恶性肿瘤组织中异常表达,且与恶性肿瘤的进展相关。于菁等〔10〕发现,乳酸脱氢酶(LDH)、LRG1及β2-微球蛋白(MG)在肿瘤分期晚、存在淋巴结结外侵犯及骨髓受累的弥漫大B细胞淋巴瘤患者血清中表达水平异常升高,血清中LRG1水平是影响弥漫大B胞淋巴瘤复发的独立危险因素。先前的研究也证实,LRG1蛋白的表达是影响乳腺癌无疾病生存期(DFS)、总生存期(OS)的独立危险因素,LRG1表达水平与DFS、OS呈负相关〔11〕。梁栋等〔12〕研究显示,LRG1 mRNA表达还与子宫内膜癌淋巴结的转移和临床分期有关。Sun等〔13〕研究了结直肠癌组织中LRG1的表达与临床病理相关指标的关系,结果显示,LRG1蛋白的表达与血管微密度、肿瘤分期、组织分化和脉管浸润等病理参数显著相关。在胃癌研究中,有学者发现LRG1在胃癌组织中的表达与组织学类型、脉管浸润、肿瘤直径、淋巴结转移及疾病分期显著相关,抑制LRG1的表达可以降低体外胃癌细胞的迁移和侵袭〔14〕。进一步分析Breast Cancer Gene-Expression Miner数据库〔9〕中乳腺癌资料发现,LRG1在1 525例淋巴结阳性患者中的表达高于2 345例淋巴结阴性组。本研究同样发现乳腺癌组织中LRG1蛋白的表达与淋巴结转移个数、病理TNM分期显著相关,LRG1表达可能反映了疾病的进展。
LRG1主要通过转化生长因子(TGF)-β信号通路作用于血管生成、EMT和细胞凋亡的调控机制,影响肿瘤的发生和发展〔15,16〕。Wang等〔17〕在小鼠视网膜疾病模型的研究中发现LRG1可能通过TGF-β1信号途径发挥促肿瘤血管生成作用。在TGF-β1存在时,LRG1可以与内皮糖蛋白相互作用,激活TGF-β1/活化素受体样激酶(ALK)1信号通路引起致病性血管生成。在非小细胞肺癌研究中发现细胞外泌体中富含LRG1蛋白,来自患者样品或癌细胞外泌体可以显著增加人脐静脉内皮细胞(HUVEC)中血管生成标记物血管内皮生长因子(VEGF)A和血管生成素(Ang)1的表达,并增强HUVEC的成管能力〔18〕。其他研究还表明LRG1参与了诱导EMT过程,并可促进结直肠癌细胞中VEGFA表达,促进肿瘤血管生成。此外,LRG1还可以通过以浓度和时间依赖性方式诱导缺氧诱导因子(HIF)-1促进血管生成〔19〕。证据表明通过调节 LRG1抑制肿瘤迁移、侵袭具有很高的潜在临床价值〔20,21〕。而针对LRG1作为新的抗体药物耦联物(ADC)靶点药物,已证实在细胞外与标准化疗相比具有相似的抗肿瘤活性〔22〕,LRG1在未来抗肿瘤领域可能作为新的治疗靶点。
综上,LRG1在浸润性乳腺癌组织表达上调,并与淋巴结转移个数、病理TNM分期相关。LRG1可能在乳腺癌发生、发展过程中发挥关键作用,通过进一步机制的进一步探索,可能为将来乳腺癌的诊断和治疗提供新的思路。
