湿生扁蕾呫吨酮联合益生菌调控TGF-β1/Smads通路及炎性因子干预大鼠结肠炎癌转化
2024-02-18卢年华靳展洪叶张茜张萌李俊珂赵慧巧张永鹏
卢年华 靳展洪叶 张茜 张萌 李俊珂 赵慧巧 张永鹏

摘要:目的 基于TGF-β1/Smads通路及炎性因子探讨湿生扁蕾呫吨酮(GPX)联合益生菌干预结肠炎癌转化的机制。方法 将90只大鼠采用随机数字表法分为正常组、模型组[饮用右旋糖酐硫酸钠(DSS)3 d]和给药组。其中,模型组又分为炎症期组、炎癌前期组[注射二甲基肼(DMH)4周]、炎癌中期组(注射DMH 13周)、炎癌末期組(注射DMH 21周);给药组是在炎癌末期组的基础上边建模边给药且根据所给药物再分组,即饮用DSS 3 d,在饮用DSS的第1天就开始灌胃各组药物,每日1次,持续8周,分别为GPX 69.3 mg/kg(GPX组)、益生菌400 mg/kg(益生菌组)、GPX 69.3 mg/kg+益生菌400 mg/kg(联合组)、沙利度胺13.5 mg/kg(沙利度胺组)。对各组疾病活动指数(DAI)、结肠长度和湿质量指数进行比较;观察大鼠结肠瘤体特征;HE染色观察结肠病理变化;Western blot和酶联免疫吸附试验分别检测转化生长因子(TGF)-β1,Smad4,Smad7和白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α表达。结果 与炎癌末期组比较,各给药组结肠长度增加,结肠壁厚、湿质量指数与瘤体最大直径降低,TGF-β1和Smad4蛋白表达水平升高,Smad7、IL-6、TNF-α水平降低,GPX组与联合组DAI得分降低(P<0.05),GPX组、益生菌组和联合组的肠黏膜层结构和形态改善,结肠隐窝结构与杯状细胞数量增加;与益生菌组和GPX组比较,联合组结肠壁厚、结肠湿质量指数、瘤体数量降低,TGF-β1和Smad4蛋白表达水平升高,IL-6、TNF-α水平降低(P<0.05)。结论 GPX和益生菌联用可抑制结肠炎癌转化,其作用机制可能与调控TGF-β1/Smads通路和抑制IL-6、TNF-α表达有关。
关键词:结直肠肿瘤;结肠炎;生物转化;湿生扁蕾呫吨酮;益生菌;TGF-β1/Smads通路
中图分类号:R735.35文献标志码:ADOI:10.11958/20230462
Gentianopsis paludosa xanthone combined with probiotics inhibits colon inflammation-tumor transformation in rats by regulating TGF-β1/Smads pathway and inflammatory factors
Abstract: Objective To investigate the mechanism of Gentianopsis paludosa xanthone (GPX) combined with probiotics in the intervention of colon inflammation-tumor transformation in rats by regulating TGF-β1/Smads pathway and inflammatory factors. Methods Ninety rats were divided into the normal group, the model group [drinking sodium dextran sulfate (DSS) for 3 days] and the intervention group by random number table method. The model group was subdivided into the inflammatory stage group, the pre-inflammatory cancer group (DMH injection for 4 weeks), the intermediate inflammatory cancer group (DMH injection for 13 weeks) and the advanced inflammatory cancer group (DMH injection for 21 weeks). The administration group was subdivided into the groups (after the first day of drinking DSS, drugs for each group were given by gavage once a day for 8 weeks) on the basis of the advanced inflammatory cancer group, including the GPX group (GPX 69.3 mg/kg), the probiotic group, the combined group (GPX+probiotics 400 mg/kg) and the thalidomide group (thalidomide 13.5 mg/kg). The disease activity index (DAI), colon length and wet mass index were compared between all groups. Characteristics of colon tumors were observed, and pathological changes of colon were observed by HE staining. The expression levels of transforming growth factor (TGF) -β1, Smad4, Smad7, interleukin (IL)-6 and tumor necrosis factor (TNF) -α were detected by Western blot assay and enzyme-linked immunosorbent assay, respectively. Results Compared with the advanced inflammatory cancer group, the administration groups showed an increase in colon length, the expression levels of TGF-β1 and Smad4 protein, a decrease in colon wall thickness, wet mass index, maximum tumor diameter, the levels of Smad7, IL-6, TNF-α, and DAI score decreased in the GPX group and the combined group (P<0.05). The structure and morphology of intestinal mucosa were improved in the GPX group, the probiotic group and the combination group, and the structure of colonic crypt and goblet cell number were increased. Compared with the probiotic group and the GPX group, the colon wall thickness, colon wet mass index and tumor number were decreased, the protein expression levels of TGF-β1 and Smad4 were increased, and levels of IL-6 and TNF-α were decreased in the combination group (P<0.05). Conclusion GPX combined with probiotics could inhibit the transformation of colon inflammation-tumor, and the mechanism may be related to the regulation of TGF-β1/Smads pathway and the inhibition of pro-inflammatory factors of IL-6 and TNF-α.
Key words: colorectal neoplasms; colitis; biotransformation; Gentianopsis paludosa xanthone; probiotics; TGF-β1/Smads pathway
潰疡性结肠炎(UC)是一种炎症性肠病,主要伴腹痛、腹泻、便血等症状[1]。炎症是一种正常的生理反应,在组织损伤愈合过程中发挥重要作用。然而对于炎症性肠病而言,炎症反应会导致正常细胞突变和表观遗传变化,结肠炎相关性结肠癌(CAC)的发病风险升高[2]。目前,关于结肠炎癌转化发生的确切分子机制尚不清楚。研究发现,转化生长因子(TGF)-β1/Smads信号通路、白细胞介素(IL)-6和肿瘤坏死因子(TNF)-α在结肠炎癌转化中扮演重要角色,TGF-β1与Smad4的条件性缺失可刺激细胞因子分泌,加剧炎症反应,导致炎症驱动的癌症发生[3-4];IL-6和TNF-α能够通过抑制免疫反应、聚集炎症细胞,加重炎症反应,在慢性炎症介导的结肠癌发生中起关键作用[5]。湿生扁蕾呫吨酮(Gentianopsis paludosa xanthone,GPX)是从龙胆科植物湿生扁蕾中分离得到的活性成分。湿生扁蕾提取物可抑制UC纤维化,抑制人结肠腺癌细胞SW480增殖,改善肿瘤微环境[6-7]。目前,关于GPX对结肠炎癌转化的作用研究较少。本研究通过建立大鼠结肠炎癌转化模型,探究GPX联合益生菌抑制结肠炎癌转化的作用及与TGF-β1/Smads信号通路和炎性因子IL-6、TNF-α的关联机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 90只SPF级Wistar雄性大鼠,体质量(180±5)g,购自斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010],饲养于河北北方学院生命科学中心[SYXK(冀)2019-004],普通维持饲料(0205SH0305A,斯贝福生物技术有限公司),自然光照、温度10~26 ℃、湿度18%~50%。实验经河北北方学院实验动物福利伦理审查委员会审批(2020-2-013-S)。
1.1.2 试剂与仪器 右旋糖酐硫酸钠(DSS,分子质量35~50 ku)、二甲基肼(DMH)均购自湖北万得化工有限公司;RIPA裂解液、SDS-PAGE凝胶制备试剂盒、ECL Plus超敏发光液、蛋白上样缓冲液、兔抗鼠Smad7抗体,TNF-α、IL-6酶联免疫吸附试验(ELISA)检测试剂盒均购自北京索莱宝生物科技有限公司;兔抗鼠TGF-β1抗体、Smad4抗体、羊抗兔二抗均购自博士德生物工程有限公司;Marker购自碧云天生物技术有限公司;益生菌(每克含1 012.5亿活菌,VSL#3)购自Alfasigma公司;沙利度胺购自常州制药厂有限公司;ChampChemi 610蛋白凝胶成像系统购自北京赛智创业科技有限公司;电泳仪购自美国Bio-rad公司;HMR-1手持组织研磨仪购自上海沪析实业有限公司;KD-BM生物组织包埋机、KD-BL冷冻台、KD-T组织摊烤片机、KD2258切片机均购自科迪仪器设备有限公司;ECLIPSE显微镜购自日本Nikon公司;JC-MB68酶标仪购自华业分析仪器有限公司。
1.1.3 GPX制备 湿生扁蕾全草采集于张家口市崇礼区,经河北北方学院中药方剂教研室鉴定为Gentianopsis paludosa(Hook.f.)Ma.,经自然阴干,按照既往提取和分离GPX工艺[6,8],称取湿生扁蕾全草500 g,加4 L 95%乙醇,加热回流提取2次,每次1.5 h,减压回收乙醇,得到的流浸膏加适量双蒸水混悬,DM130型大孔吸附树脂纯化后干燥,得到含量为51.0%的GPX粉末,4 ℃储存备用。
1.2 方法
1.2.1 分组与模型建立 将90只大鼠采用随机数字表法分为9组,每组10只。包括1个正常组、4个模型组和4个给药组。4个模型组包括炎症期组(饮用DSS 3 d)、炎癌前期组(饮用DSS 3 d+注射DMH 4周)、炎癌中期组(饮用DSS 3 d+注射DMH 13周)、炎癌末期组(饮用DSS 3 d+注射DMH 21周)。4个给药组是在炎癌末期组的基础上边建模边给药,即在饮用DSS第1天开始灌胃药物,每日1次,持续8周;剂量分别为GPX 69.3 mg/kg(GPX组)、益生菌400 mg/kg(益生菌组)、GPX 69.3 mg/kg+益生菌400 mg/kg(联合组)、沙利度胺13.5 mg/kg(沙利度胺组);以上各组别药物均参考成人剂量,采用体表面积换算。DSS质量分数为5%,大鼠每日饮用30 mL,DMH采用颈部皮下注射,25 mg/kg,1次/周。建模结束时,各给药组禁食不禁水1 d,采用戊巴比妥钠(40 mg/kg)麻醉后,结肠取材进行观察和检测。正常组和各模型组同期给予同体积的生理盐水自由饮用和颈部皮下注射。此外,各组大鼠每日均给予15 g普通饲料喂养和自由饮水。
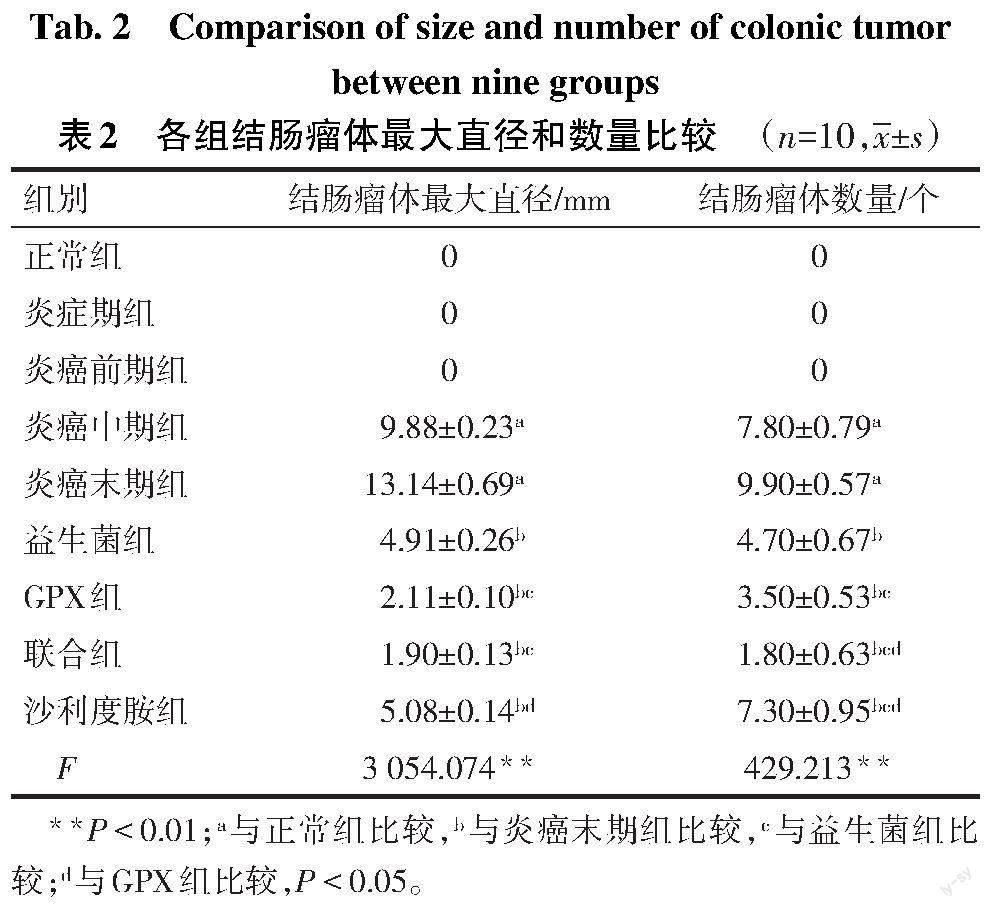
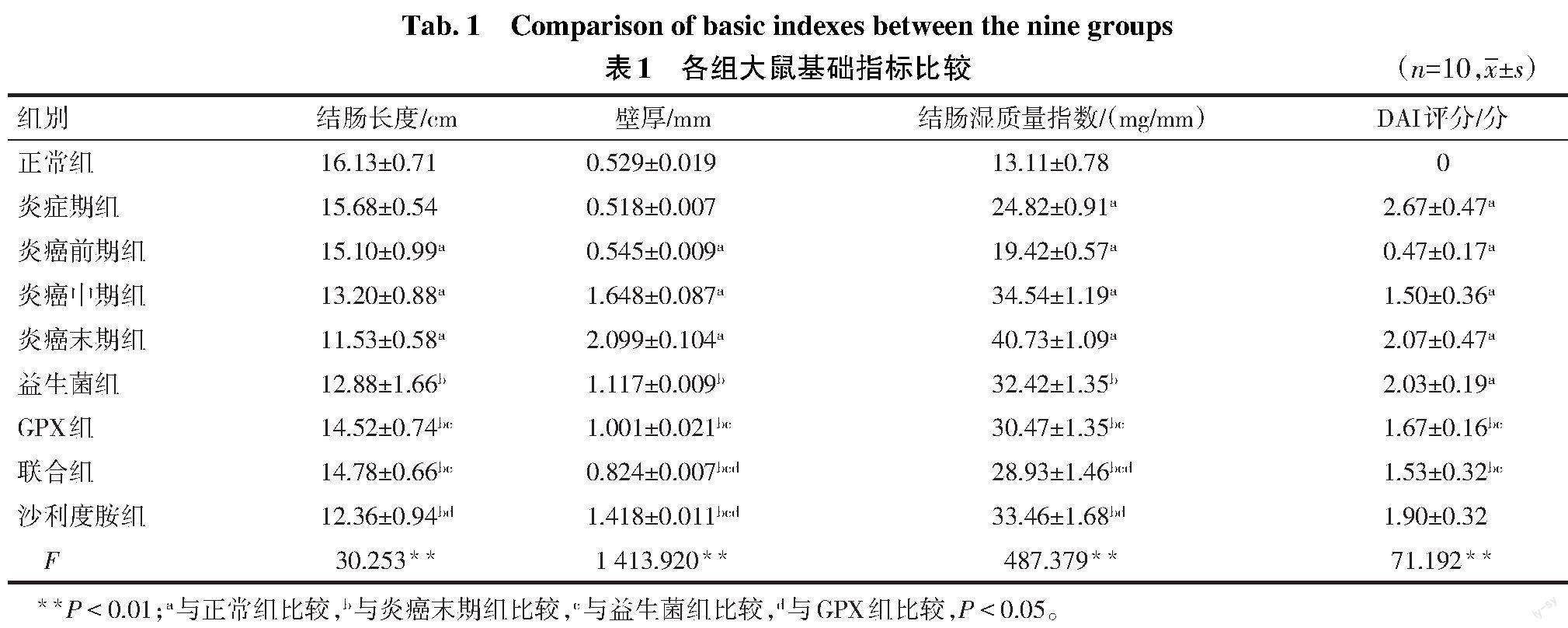
1.2.2 大鼠基础指标观察 参照文献[9],通过观察大鼠体质量、大便性状及便血情况,对各组大鼠进行疾病活动指数(DAI)评分,评估大鼠结肠炎癌转化中疾病活动情况;剪取大鼠全结肠,测量结肠长度;每只剪取近端、中端和远端结肠3个非瘤部位,石蜡包埋切片后采用光学显微镜比例尺量取结肠黏膜上皮至浆膜层厚度,计算平均值为结肠壁厚;沿肠系膜剪开结肠,除去内容物后称取全结肠质量,结肠湿质量指数(mg/mm)=全结肠湿质量(mg)/结肠全长(mm);观察大鼠结肠瘤体特征,比较各组瘤体大小(最大瘤体直径)和数量。
1.2.3 结肠组织HE染色 采集各组大鼠结肠组织(除正常组外,其余各组选取结肠瘤体明显处)。4%多聚甲醛固定,乙醇脱水,二甲苯透明,石蜡包埋切片4 μm,二甲苯和梯度乙醇脱蜡,蒸馏水漂洗,自制Weigert氏铁苏木素染液染色,1%盐酸乙醇分化,0.5%氨水返蓝,伊红染色,脱水后,中性树胶固定封片,观察各组结肠组织病理形态。
1.2.4 Western blot检测TGF-β1、Smad4和Smad7蛋白表达 取各组大鼠结肠组织,生理盐水漂净污物,正常组取中段结肠,炎症期组大鼠取溃疡充血明显处,荷瘤大鼠结肠取瘤体,研磨仪粉碎组织,经RIPA试剂裂解,12 000 r/min离心5 min,取上清液置于EP管,100 ℃水浴加热,加入上样缓冲液得到蛋白上样液。每孔加样15 μL,采用SDS-PAGE制备凝胶和电泳。电泳条件:150 V 2 h,转膜条件:100 V 1 h,5%脱脂奶粉室温封闭2.5 h,兔抗鼠TGF-β1抗体(1∶1 500)、Smad4抗体(1∶2 000)和Smad7抗体(1∶1 000)室温各孵育2 h,TBST洗膜,羊抗兔二抗(1∶10 000)室温孵育2 h,ECL化学发光显影,Image J对各组条带灰度值进行定量分析。
1.2.5 ELISA检测血清TNF-α和IL-6水平 取腹主动脉血1.5 mL,室温自然凝固30 min,4 ℃、1 000 r/min离心15 min,吸取血清,置于EP管,-20 ℃保存。根据ELISA试剂盒说明检测TNF-α和IL-6水平。
1.3 统计学方法 采用SPSS 25.0进行数据分析,计量资料以[[x] ±s
]表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠基础指标比较 与正常组比较,炎症期组的结肠湿质量指数和DAI评分升高,炎癌前期组、炎癌中期和炎癌末期组的结肠长度缩短,壁厚增加,结肠湿质量指数和DAI评分升高(P<0.05);与炎癌末期组比较,各给药组结肠长度增加、结肠壁厚与湿质量指数降低,且GPX组与联合组DAI得分降低(P<0.05);与益生菌组和GPX组比较,联合组结肠壁变薄,结肠湿质量指数降低(P<0.05);与GPX组比较,联合组结肠长度和DAI评分差异无统计学意义,见表1。
2.2 各组大鼠结肠瘤体比较 见图1,表2。炎症期组结肠组织透明柔软,为炎性水肿,结肠溃疡面出血显著;炎癌前期组结肠局部增厚,呈硬斑状,未见瘤体;炎癌中期组可见结肠瘤体,提示结肠炎癌转化建模成功;炎癌末期组结肠瘤体紧贴肠壁,泛白,呈不规则菜花状,局部密集,彼此嵌套生长,触感较硬;GPX组、益生菌组和联合组结肠瘤体呈肉芽状,分布稀疏,触感软、有弹性。与正常组比较,炎癌中、末期组瘤体最大直径与数量升高(P<0.05);与炎癌末期组比较,各给药组瘤体最大直径均降低(P<0.05);与益生菌组和GPX组比较,联合组瘤体数量减少(P<0.05);联合组与GPX组,沙利度胺与益生菌组分别比较,瘤体最大直径差异无统计学意义。
2.3 各组结肠炎癌转化病理学变化 正常组结肠黏膜结构形态清晰,无炎性浸润;炎症期结肠黏膜破溃明显,大量炎性细胞充斥于黏膜层且向下侵入黏膜下层,局部穿过固有肌层,柱状细胞和肠腺消失;炎癌前期、炎癌中期和沙利度胺组肠黏膜固有层空泡化明显,且伴炎性细胞浸润;炎癌末期组瘤体形态显著,可见强异型腺管增生,隐窝分支扭曲,表现为管状中高度分化腺瘤。与炎癌末期组比较,GPX组、益生菌组和联合组的肠黏膜层结构和形态显著改善,结肠隐窝结构与杯状细胞数量增加,肠腺、单层柱状上皮细胞恢复,隐窝异型分支减少,见图2。
2.4 各组结肠组织TGF-β1、Smad4和Smad7蛋白水平 与正常组比较,TGF-β1和Smad4蛋白表达在炎癌前期、炎癌中期、炎癌末期组逐渐降低(P<0.05),而Smad7蛋白表达逐渐升高(P<0.05);与炎癌末期组比较,各给药组TGF-β1和Smad4蛋白表达升高,Smad7蛋白表达降低(P<0.05);与益生菌组和GPX组比较,联合组TGF-β1和Smad4蛋白表达升高(P<0.05),见表3、图3。
2.5 各组大鼠血清中IL-6与TNF-α水平比较 与正常组比较,炎症期组IL-6与TNF-α水平升高;与炎症期组比较,炎癌前期组IL-6与TNF-α水平降低(P<0.05);与炎癌前期组比较,炎癌中期和炎癌末期组IL-6与TNF-α水平升高(P<0.05);与炎癌末期组比较,各给药组IL-6、TNF-α水平降低(P<0.05);与益生菌组和GPX组比较,联合组IL-6、TNF-α水平降低(P<0.05),见表4。
3 讨论
湿生扁蕾传统上属于藏药,在藏语或藏医药本草著作中常被称为“机合滴”“甲蒂”“松几斗”等,民间常用于治疗“赤巴”“小儿腹泻”“时疫热”等症[10]。目前对该药在抗UC肠纤维化和抑制结肠上皮间质转化方面开展了相应探索[11-12],但尚缺少对结肠炎癌转化的研究。本研究结果显示,经DSS联合DMH建模后,结肠瘤体从炎癌中期即开始出现,表明结肠炎癌转化建模成功;同时GPX与益生菌单独和联合用药均可增加炎癌转化末期结肠长度,降低结肠壁厚和结肠湿质量指数。通过观察各组结肠瘤体和结肠病理学变化,GPX与益生菌可有效抑制结肠炎癌转化中瘤体的大小与数量,恢复结肠隐窝和增加杯状细胞数量,减少结肠隐窝分支扭曲,尤其是联合组干预结肠炎癌转化作用显著,可能是GPX与益生菌发挥了潜在的協同效应有关。
TGF-β1是一种多效性细胞因子,几乎靶向所有肠黏膜细胞。Means等[4]研究发现,TGF-β受体传导下游经典信号依赖于Smad4,通常单个抑癌因子缺失很少导致癌症发生,但仅Smad4的缺失足以促使炎症驱动的结肠癌发生。Troncone等[13]研究发现,Smad7可负性调节TGF-β1/Smads通路而参与结肠癌的发生,药物抑制Smad7可恢复TGF-β1功能,减轻UC患者和小鼠炎症。本研究结果显示,GPX与益生菌单一或联合用药可以升高TGF-β1与Smad4的表达,同时降低Smad7水平,表明GPX与益生菌可能作用于TGF-β1/Smads通路而干预结肠炎癌转化。
IL-6和TNF-α为常见炎性因子,TGF-β1具有的抗炎效应可以降低二者水平[14]。抑制炎症性肠病患者IL-6和TNF-α水平不仅可减轻肠道炎症,还可降低结肠癌的发生风险[15-16]。本研究结果显示,GPX与益生菌可抑制结肠炎癌转化进程中炎性因子IL-6、TNF-α的表达,表明GPX与益生菌可能通过抑制IL-6、TNF-α的释放以延缓结肠炎癌转化。
综上所述,GPX与益生菌联合可能通过调控TGF-β1/Smads通路和抑制IL-6、TNF-α炎性因子表达进而抑制结肠炎癌转化。但由于结肠炎癌转化机制复杂,GPX与益生菌对结肠炎癌转化的作用仍需进一步探索。
参考文献
[1] 张聪伟,刘金响,吕小龙,等. 白头翁汤灌肠辅助治疗溃疡性结肠炎的有效性及安全性的Meta分析[J]. 中国中西医结合外科杂志,2023,29(6):758-765. ZHANG C W,LIU J X,LV X L,et al. Baitouweng decoction enema for ulcerative colitis:Meta-analysis[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2023,29(6):758-765. doi:10.3969/j.issn.1007-6948.2023.05.007.
[2] ZHANG W,FU X,XIE J,et al. miR-26a attenuates colitis and colitis-associated cancer by targeting the multiple intestinal inflammatory pathways[J]. Mol Ther Nucleic Acids,2021,24:264-273. doi:10.1016/j.omtn.2021.02.029.
[3] CHAURIO R A,ANADON C M,LEE COSTICH T,et al. TGF-β-mediated silencing of genomic organizer SATB1 promotes Tfh cell differentiation and formation of intra-tumoral tertiary lymphoid structures[J]. Immunity,2022,55(1):115-128.e9. doi:10.1016/j.immuni.2021.12.007.
[4] MEANS A L,FREEMAN T J,ZHU J,et al. Epithelial Smad4 deletion up-regulates inflammation and promotes inflammation-associated cancer[J]. Cell Mol Gastroenterol Hepatol,2018,6(3):257-276. doi:10.1016/j.jcmgh.2018.05.006.
[5] KHATTAB A E,DARWISH A M,OTHMAN S I,et al. Anti-inflammatory and immunomodulatory potency of selenium-enriched probiotic mutants in mice with induced ulcerative colitis[J]. Biol Trace Elem Res,2023,201(1):353-367. doi:10.1007/s12011-022-03154-1.
[6] LU N H,ZHAO H Q,JING M,et al. The pharmacodynamic active components study of Tibetan medicine Gentianopsis paludosa on ulcerative colitis fibrosis[J]. Int Immunopharmacol,2017,46:163-169. doi:10.1016/j.intimp.2017.01.001.
[7] 高娜,景明,張艳霞,等. 藏药湿生扁蕾对人结肠癌SW480细胞凋亡调控因子Bcl-2及Bax的mRNA表达的影响[J]. 中国民族医药杂志,2014,20(9):51-53. GAO N,JING M,ZHANG Y X,et al. The effect of Tibetan Medicine Gentianopsis Paludosa about colon cancer SW480 cell apoptosis regulatory factors mRNA expression of Bcl-2 and Bax[J]. Journal of Medicine & Pharmacy of Chinese Minorities,2014,20(9):51-53. doi:10.16041/j.cnki.cn15-1175.2014.09.033.
[8] 寇亮,刘越敏,柳娜,等. 大孔吸附树脂分离纯化湿生扁蕾总 酮[J]. 中药新药与临床药理,2022,33(4):522-530. KOU L,LIU Y M,LIU N,et al. Separation and purification of total xanthones from Gentianopsis paludosa using macroporous adsorption resin[J]. Tradit Chin Drug Res Clin Pharmacol,2022,33(4):522-530. doi:10.19378/j.issn.1003-9783.2022.04.014.
[9] KLITGAARD M,KRISTENSEN M N,VENKATASUBRAMANIAN R,et al. Assessing acute colitis induced by dextran sulfate sodium in rats and its impact on gastrointestinal fluids[J]. Drug Deliv Transl Res,2023,13(5):1484-1499. doi:10.1007/s13346-023-01313-y.
[10] 盧年华,芦彦兆,赵慧巧,等. 藏药湿生扁蕾与獐牙菜的相关本草考证[J].中国药房,2016,27(19):2647-2649. LU N H,LU Y Z,ZHAO H Q,et al. Related herbal textual research on Tibetan herb Shi Sheng Bian Lei and Zhang Ya Cai[J]. China Pharm,2016,27(19):2647-2649. doi:10.6039/j.issn.1001-0408.2016.19.18.
[11] 寇亮. 湿生扁蕾总 酮抗UC肠纤维化机制研究及其结肠定位微丸的制备[D]. 兰州:甘肃中医药大学,2022. KOU L. Study on the mechanism of anti-UC intestinal fibrosis by total xanthones from Gentianopsis paludosa and preparation of colon-specific[D]. Lanzhou:Gansu University of Traditional Chinese Medicine,2022. doi:10.27026/d.cnki.ggszc.2022.000003.
[12] 柳娜,刘越敏,薄双琴,等. 湿生扁蕾总 酮对NCM460细胞间质转化的影响[J]. 中国细胞生物学学报,2022,44(9):1735-1743. LIU N,LIU Y M,BO S Q,et al. Effect of xanthones from Gentianopsis paludosa on mesenchymal transformation of NCM460 cells[J]. Chinese Journal of Cell Biology,2022,44(9):1735-1743. doi:10.11844/cjcb.2022.09.0005.
[13] TRONCONE E,MARAFINI I,STOLFI C,et al. Involvement of Smad7 in inflammatory diseases of the gut and colon cancer[J]. Int J Mol Sci,2021,22(8):3922. doi:10.3390/ijms22083922.
[14] TAGLIARI E,CAMPOS L F,CASAGRANDE T,et al. Effects of oral probiotics administration on the expression of transforming growth factor β and the proinflammatory cytokines interleukin 6, interleukin 17, and tumor necrosis factor α in skin wounds in rats[J]. JPEN J Parenter Enteral Nutr,2022,46(3):721-729. doi:10.1002/jpen.2216.
[15] J?SA V,F?DERER K,ZRUBKA Z,et al. Investigation of IL6 expression in patients with colorectal adenocarcinoma[J]. Orv Hetil,2021,162(37):1502-1507. doi:10.1556/650.2021.32206.
[16] BAKSHI H A,QUINN G A,NASEF M M,et al. Crocin inhibits angiogenesis and metastasis in colon cancer via TNF-α/NF-kB/VEGF pathways[J]. Cells,2022,11(9):1502. doi:10.3390/cells11091502.
