麝香酮调节SHH介导的自噬对卵巢癌细胞恶性进展的影响
2024-02-18汪爱华张飞忠王红英
汪爱华 张飞忠 王红英


摘要:目的 探究麝香酮调节超音刺猬蛋白(SHH)介导的自噬对卵巢癌细胞恶性进展的影响。方法 检测0、2、4、8、16、24 μmol/L的麝香酮处理后的人卵巢癌细胞SKOV3存活率,筛选出麝香酮最佳细胞作用浓度。体外培养SKOV3细胞并构建其移植瘤小鼠模型,随机均分为对照组,麝香酮组,麝香酮+自噬抑制剂氯喹(CQ)组,麝香酮+空载组,麝香酮+SHH过表达组,按照分组分别以麝香酮、CQ、空载质粒及SHH过表达质粒处理后,检测各组移植瘤小鼠肿瘤体积和质量;分別以EdU染色、TUNEL染色、细胞划痕、Transwell侵袭实验、免疫印迹法、实时荧光定量PCR检测SKOV3细胞增殖、凋亡、迁移、侵袭、SKOV3细胞及其移植瘤小鼠肿瘤组织自噬相关蛋白(LC3Ⅱ/LC3Ⅰ、Beclin-1)与SHH表达。结果 与对照组相比,麝香酮组细胞增殖率、迁移率、侵袭数目、肿瘤体积和质量、肿瘤组织SHH mRNA及蛋白表达水平均降低(P<0.05),细胞凋亡率、细胞及肿瘤组织LC3Ⅱ/LC3Ⅰ和Beclin-1蛋白表达水平均升高(P<0.05)。与麝香酮组相比,麝香酮+CQ组和麝香酮+SHH过表达组细胞增殖率、迁移率、侵袭数目、肿瘤体积和质量升高(P<0.05),细胞凋亡率、细胞及肿瘤组织LC3Ⅱ/LC3Ⅰ和Beclin-1蛋白表达水平均降低(P<0.05);麝香酮+SHH过表达组细胞及肿瘤组织SHH mRNA及蛋白表达水平升高(P<0.05);麝香酮+空载组细胞各指标变化差异无统计学意义(P>0.05)。结论 麝香酮可通过下调SHH而促进卵巢癌细胞自噬,进而抑制其增殖、体内生长、迁移及侵袭,促进其凋亡,最终抑制其恶性进展。
关键词:卵巢肿瘤;麝香酮;超音刺猬蛋白;自噬;恶性进展
中图分类号:R737.31文献标志码:ADOI:10.11958/20230541
Impacts of muscone on malignant progression of ovarian cancer cells by regulating SHH mediated autophagy
Abstract: Objective To investigate the effect of muscone on malignant progression of ovarian cancer cells mediated by regulating sonic hedgehog (SHH) mediated autophagy. Methods Survival rates of human ovarian cancer cell line SKOV3 treated with 0, 2, 4, 8, 16, and 24 μmol/L muscone were detected, and the optimal cell action concentration of muscone was selected. SKOV3 cells were cultured in vitro, and their transplanted tumor mouse models were constructed. Cells were randomly grouped into the control group, the muskone group, the muskone+chloroquine (CQ,an autophagy inhibitor) group, the muskone+empty group and the muskone+SHH overexpression group. After grouping and treatment with musconeand, CQ, empty plasmid and SHH overexpression plasmid, the tumor volume and weight in transplanted tumor mice were detected. EdU staining, TUNEL staining, cell scratch, Transwell invasion assay, immunoblotting and real-time fluorescence quantitative PCR were used to detect proliferation, apoptosis, migration and invasion of SKOV3 cells, the expression of autophagy related proteins (LC3Ⅱ/LC3Ⅰ, Beclin-1) and SHH in SKOV3 cells and transplanted tumor mice in each. Results Compared with the control group, the cell proliferation rate, cell migration rate, number of invasions, tumor volume and weight, and the expression of SHH mRNA and protein in tumor tissue were decreased in the muskone group (P<0.05), and the apoptosis rate, LC3Ⅱ/LC3Ⅰ, Beclin-1 protein in cells and tumor tissue were increased (P<0.05). Compared with the muscone group, the cell proliferation rate, cell migration rate, number of invasion, tumor volume and weight were increased in the muscone+CQ group and the muskone+SHH overexpression group (P<0.05), and the apoptosis rate, LC3Ⅱ/LC3Ⅰ and the expression of Beclin-1 protein in cells and tumor tissue were decreased (P<0.05). There were no significant differences in the above indicators in the muscone+empty group (P>0.05). Conclusion Muscone can promote autophagy of ovarian cancer cells by down-regulating SHH, thereby inhibiting their proliferation, in vivo growth, migration and invasion, promoting their apoptosis, and ultimately inhibiting their malignant progression.
Key words: ovarian neoplasms; muscone; sonic hedgehog; autophagy; malignant progression
卵巢癌是全球范围内常见的恶性肿瘤,因其发病早期不易察觉,患者就诊时病情大多已进入晚期,病死率很高,已成为女性癌症死亡的主要原因之一[1-2]。自噬是一种细胞自我降解过程,在包括卵巢癌在内的癌症发生发展中起重要作用,触发并增强自噬可对抗促炎细胞因子促进的卵巢癌过量糖酵解及转移扩散,进而抑制其恶性进展[3-4]。麝香酮是麝香的主要活性成分,可用于抗癌、抗炎、抗肿瘤多药耐药等,且疗效显著[5]。有研究显示,麝香酮可通过结合雄激素受体、孕激素受体等多个靶标对乳腺癌发挥潜在治疗作用[6];其可显著抑制肺癌A549细胞的顺铂耐药性,并抑制小鼠皮下移植瘤的生长[7]。超音刺猬蛋白(sonic hedgehog,SHH)在大肠癌、卵巢癌等恶性肿瘤的发生及恶性进展中发挥至关重要的作用。研究显示,SHH在癌症干细胞中过表达,下调其表达可明显抑制大肠癌的体内生长[8]。SHH与卵巢癌总生存期短有关,并与卵巢型子宫内膜异位症恶变相关,其高表达提示子宫内膜异位症相关卵巢癌患者预后不良[9-10]。另有研究显示,SHH介导癌细胞自噬过程,抑制SHH信号可通过诱导细胞凋亡、细胞周期停滞和自噬来抑制前列腺癌的体内外生长,并减轻其骨转移[11]。由此推测SHH可能通过调控自噬介导卵巢癌的恶性进展。本研究通过体外培养人卵巢癌细胞系SKOV3,探究麝香酮调节SHH介导的自噬对卵巢癌细胞恶性进展的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞 BALB/c小鼠购自山东博安生物技术股份有限公司,生产许可证号:SCXK(鲁)2020-0006,SPF级,6周龄左右,雌性,体质量18~22 g,饲养在25~27 ℃、湿度40%~55%的动物房内,维持明暗各12 h循环照明;人卵巢癌细胞系SKOV3购自上海盖宁生物科技有限公司。
1.1.2 主要试剂及仪器 麝香酮(批号110719-201716)购自天津西玛科技有限公司;氯喹(chloroquine,CQ,批号200-191-2)购自北京谨明生物科技有限公司;SHH过表达质粒及空载质粒购自吉满生物科技(上海)有限公司;McCoys 5A培养基购自美国Gibco公司;一步法荧光定量PCR试剂盒、总RNA提取试剂盒购自翌圣生物科技(上海)股份有限公司;EdU染色增殖试剂盒、CCK-8试剂盒、TUNEL检测试剂盒、结晶紫溶液、兔源抗人Anti-LC3、Beclin1、SHH、GAPDH一抗,HRP偶联山羊抗兔二抗购自英国Abcam公司等。
LD-96A小型酶标仪购自山东莱恩德智能科技有限公司;MF53-M倒置荧光显微镜购自山东千司科學仪器有限公司;TE62全湿蛋白电转印系统、SE400垂直蛋白电泳系统购自美国Amersham公司等。
1.2 方法
1.2.1 麝香酮最佳细胞作用浓度筛选 快速取出冻存的SKOV3细胞,于39.5 ℃水浴内冻融,1 000 r/min离心5 min,洗涤细胞沉淀,加入McCoys 5A培养基(含1%青-链霉素双抗及10%胎牛血清)进行复苏培养。传代后接种于96孔板,接种密度为1×104个/孔,培养24 h后,以终浓度0、2、4、8、16、24 μmol/L的麝香酮处理[7],0 μmol/L麝香酮处理的细胞为对照组,同时设空白对照组(不接种细胞只加入培养基)。48 h后每孔加入20 μL CCK-8试剂继续培养1.5 h,采用酶标仪于450 nm波长处测定细胞光密度(OD)值,计算细胞存活率。细胞存活率=(麝香酮处理组OD值-空白对照组OD值)/(对照组OD值-空白对照组OD值)×100%,筛选出麝香酮最佳细胞作用浓度进行后续实验。
1.2.2 SKOV3移植瘤小鼠模型构建及分组 参照文献[12]构建SKOV3移植瘤小鼠模型。SKOV3细胞传代后计数并配制1×107个/mL的细胞悬液,将其接种至BALB/c小鼠右腋皮下,每只接种0.1 mL,1周后观察到小鼠右腋下长出米粒大小肿块即表示移植瘤模型构建成功。按照随机数字表法将小鼠分为对照组、麝香酮组、麝香酮+CQ组、麝香酮+空载组、麝香酮+SHH过表达组,每组10只。除对照组外,其余各组于肿瘤部位皮下注射16 mg/kg麝香酮(1.6 g/L麝香酮溶液注射10 mL/kg,1次/d)[7]。同时麝香酮组小鼠腹腔注射10 mL/kg生理盐水;麝香酮+CQ组小鼠腹腔注射50 mg/kg CQ(5 g/L CQ溶液注射10 mL/kg)[12];麝香酮+空载组小鼠于肿瘤部位皮下注射空载质粒(注射剂量参考说明书),并腹腔注射10 mL/kg生理盐水;麝香酮+SHH过表达组小鼠于肿瘤部位皮下注射SHH过表达质粒(注射剂量参考说明书),并腹腔注射10 mL/kg生理盐水;对照组小鼠分别于肿瘤部位皮下、腹腔注射与麝香酮+SHH过表达组等剂量的生理盐水,各组小鼠均每隔1 d注射1次,连续处理28 d。
1.2.3 移植瘤小鼠肿瘤体积和质量检测及标本采集 各组处理完成24 h后,颈椎脱臼处死小鼠,剪开右腋下皮肤剥离出肿瘤组织块,测量其肿瘤长径a及短径b,计算肿瘤体积=(a×b2)/2;用手术剪取下约0.4 g肿瘤组织置于适量RAPI缓冲液内,研碎并匀浆,3 000 r/min离心20 min,收集上清液得到总蛋白样品液,以BCA法检测其总蛋白浓度并调至各组相同,分组标记后存在-80 ℃备用;再次剪下约0.4 g肿瘤组织存于液氮备用。
1.2.4 SKOV3细胞分组处理及标本收集 SKOV3传代后接种于24孔板,接种密度为1×105个/孔,培养24 h后根据随机数字表法分为对照组、麝香酮组、麝香酮+CQ组、麝香酮+空载组、麝香酮+SHH过表达组。对照组细胞不进行处理,麝香酮组细胞以终浓度16 μmol/L的麝香酮处理,麝香酮+CQ组细胞以终浓度16 μmol/L的麝香酮和5 μmol/L的CQ[12]联合处理,麝香酮+空载组以终浓度16 μmol/L的麝香酮处理的同时转染空载质粒,麝香酮+SHH过表达组以终浓度16 μmol/L的麝香酮处理的同时转染SHH过表达质粒,转染步骤按照脂质体2000说明进行。处理48 h后收集细胞沉淀,以RAPI缓冲液于冰水浴内裂解2 h,3 000 r/min离心20 min,收集上清液,得到总蛋白样品液,以BCA法检测其总蛋白浓度并调至各组相同,分组标记后存于-80 ℃备用;重复上述实验操作后再次收集各组细胞沉淀存于液氮备用。
1.2.5 EdU及TUNEL染色法分别检测各组SKOV3细胞增殖、凋亡 (1)EdU染色。SKOV3传代后接种于24孔板,接种密度为1×105个/孔,培养24 h后分组处理48 h(方法同1.2.4),每组添加适量EdU溶液继续培养3 h,PBS洗涤、10%甲醛固定细胞,然后按照EdU细胞增殖试剂盒说明进行EdU染色,PBS洗涤、DAPI染色、PBS洗涤后,于荧光显微镜下采集细胞图像,用Image J软件定量各组细胞(核呈现红色的EdU阳性细胞与呈蓝色的总细胞)数目,计算其增殖率,增殖率=EdU阳性细胞数目/总细胞数目×100%。(2)TUNEL染色。SKOV3传代后接种于24孔板,接种密度为1×105个/孔,培养24 h后分组处理48 h(方法同1.2.4),PBS洗涤、10%甲醛固定细胞后行TUNEL染色,具体染色按照TUNEL检测试剂盒说明书进行,PBS洗涤、DAPI染色液孵育10 min、PBS洗涤后,于荧光显微镜下采集细胞图像,用Image J软件定量各组细胞(核呈现红色的凋亡细胞与呈蓝色的总细胞)数目,计算其凋亡率。凋亡率=凋亡细胞数目/总细胞数目×100%。
1.2.6 细胞划痕及Transwell侵袭实验分别检测各组SKOV3细胞迁移、侵袭 (1)细胞划痕实验。SKOV3传代后接种于12孔板,接种密度为2×105个/孔,培养24 h后,用1 mL枪头在每孔中央划出1条直线,将划痕中细胞冲洗掉后,于显微镜下采集细胞图像,用Image J软件定量各组划痕面积并记为S1,然后分组处理细胞48 h(方法同1.2.4),再次测量各组划痕面积并记为S2,计算各组细胞迁移率。迁移率=(S1-S2)/S1×100%。(2)Transwell侵袭实验。SKOV3传代后接种于24孔板,接种密度为1×105个/孔,培养24 h后分组处理48 h(方法同1.2.4),收集细胞计数后每组取出2.5×105个细胞,以不含胎牛血清的McCoys 5A培养基重悬后混匀,接种在24孔Transwell板上室并同时在其下室加入适量含10%胎牛血清的McCoys 5A培养基,培养24 h后以PBS洗涤、10%甲醛固定下室内细胞,结晶紫染色液孵育10 min、PBS洗涤、DAPI染色液孵育10 min、PBS洗涤后,于显微镜下采集细胞图像,用Image J软件定量各组细胞数目即为侵袭数。
1.2.7 实时荧光定量PCR检测各组SKOV3细胞及其移植瘤小鼠肿瘤组织SHH表达 取出1.2.2中的肿瘤组织和1.2.4中的细胞沉淀,用总RNA提取试剂盒并按照其说明指导分别提取两者中总RNA,然后取适量总RNA采用一步法进行实时荧光定量PCR扩增,具体步骤按照一步法荧光定量PCR试剂盒说明书进行。反应条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,42个循环。以GAPDH为内参,采用2-ΔΔCt法计算SHH基因相对表达量,引物序列见表1。
1.2.8 免疫印迹法检测各组SKOV3细胞及其移植瘤小鼠肿瘤组织自噬相关蛋白及SHH蛋白表达 取出1.2.2中的肿瘤组织和1.2.4中的细胞蛋白样品液,于4 ℃冰箱内放置2 h解冻后,加入适量上样缓冲液煮沸变性,每组取含20 mg总蛋白的样品液,于SDS-PAGE浓缩胶内上样。100 V恒压下电泳80 min,使蛋白于SDS-PAGE分离胶内按分子质量大小分开,40 mA稳流下湿转1.5 h,将分离胶内蛋白全部移到PVDF膜上。以5%脱脂奶粉封闭非特异性抗原后将LC3、GAPDH、Beclin-1、SHH蛋白条带裁下,分别浸入均稀释2 000倍的兔源LC3、GAPDH、Beclin-1、SHH一抗溶液,4 ℃孵育12 h后以TBST缓冲液洗膜(3次,5 min/次),孵育稀释1 000倍的HRP偶联山羊抗兔二抗溶液2 h,TBST缓冲液洗膜(3次,5 min/次),以化学发光试剂孵育显色,摄制各组检测蛋白图像后用Image J软件定量其灰度,算出其与内参GAPDH的灰度比值后统计分析其相对表达量。
1.3 统计学方法 采用GraphPad Prism 8.0软件进行数据分析。计量资料以均数±标准差([[x] ±s
])表示,多组间差异比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 麝香酮对SKOV3细胞存活率的影响 2、4、8、16、24 μmol/L的麝香酮均可降低SKOV3细胞存活率(P<0.05),见图1。半数抑制浓度为15.30 μmol/L,选择16 μmol/L的麝香酮进行后续实验。
2.2 麝香酮对SKOV3移植瘤小鼠肿瘤体积与质量的影响 与对照组相比,麝香酮组小鼠肿瘤体积和质量降低(P<0.05)。与麝香酮组相比,麝香酮+CQ组、麝香酮+SHH过表达组小鼠肿瘤体积和质量升高(P<0.05);麝香酮+空载组小鼠肿瘤体积和质量差异无统计學意义(P>0.05)。见表2。
2.3 麝香酮对SKOV3细胞增殖与凋亡的影响 与对照组相比,麝香酮组细胞增殖率降低,凋亡率升高(P<0.05)。与麝香酮组相比,麝香酮+CQ组、麝香酮+SHH过表达组细胞增殖率升高,凋亡率降低(P<0.05);麝香酮+空载组细胞凋亡率、增殖率差异无统计学意义(P>0.05)。见图2、3,表3。
2.4 麝香酮对SKOV3细胞迁移与侵袭的影响 与对照组相比,麝香酮组细胞迁移率与侵袭数目降低(P<0.05)。与麝香酮组相比,麝香酮+CQ组、麝香酮+SHH过表达组细胞迁移率与侵袭数目升高(P<0.05);麝香酮+空载组细胞迁移率与侵袭数目差异无统计学意义(P>0.05)。见图4、5,表4。
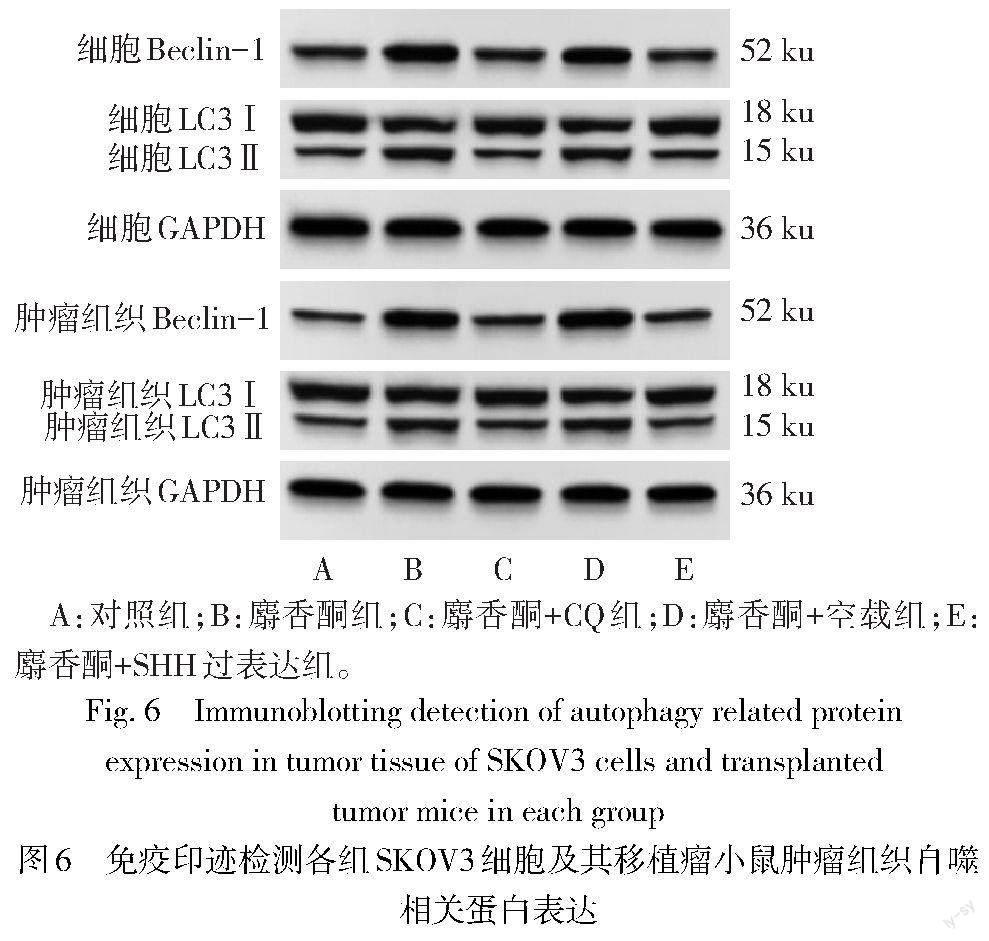
2.5 麝香酮对SKOV3细胞及其移植瘤小鼠肿瘤组织自噬的影响 与对照组相比,麝香酮组细胞及小鼠肿瘤组织LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达水平升高(P<0.05)。与麝香酮组相比,麝香酮+CQ组、麝香酮+SHH过表达组细胞及小鼠肿瘤组织LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达水平降低(P<0.05);麝香酮+空载组细胞及小鼠肿瘤组织LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达水平差异无统计学意义(P>0.05)。见图6、表5。
2.6 麝香酮对SKOV3细胞及其移植瘤小鼠肿瘤组织SHH表达的影响 与对照组相比,麝香酮组细胞及小鼠肿瘤组织SHH mRNA、蛋白表达水平降低(P<0.05)。与麝香酮组相比,麝香酮+SHH过表达组细胞及小鼠肿瘤组织SHH mRNA、蛋白表达水平升高(P<0.05);麝香酮+CQ组、麝香酮+空载组细胞及小鼠肿瘤组织SHH mRNA、蛋白表达水平差异无统计学意义(P>0.05)。见图7、表6。
3 讨论
卵巢癌在我国的发病率较高,目前主要依靠手术切除后辅以放化疗进行综合治疗,但因耐药性、扩散转移、复发等原因易导致治疗失败,因而迫切需要探寻更有效的新型治疗手段[13-14]。麝香酮是提取自珍贵中药麝香的一种3-甲基十五酮化合物,具有显著的抗肿瘤、逆转多药耐药性等药理作用,可通过减弱肺癌细胞顺铂耐药性发挥显著的抗癌功效[5-7,15]。本研究结果显示,以麝香酮处理SKOV3细胞及其移植瘤小鼠,细胞增殖率、迁移率、侵袭数目以及小鼠肿瘤体积和质量降低,细胞凋亡率升高。既往研究亦发现,麝香酮作为恶性肿瘤治疗药西黄丸的主要起效成分之一,能通过改善肿瘤微环境而起到抗癌作用[16]。本研究证实麝香酮可降低卵巢癌细胞增殖、迁移及侵袭活性,促使其凋亡,抑制其在小鼠体内生长,最终延缓卵巢癌恶性进展,提示麝香酮在卵巢癌临床治疗中极具开发价值。
自噬可通过降解受损细胞器以修复恶变细胞,并促进肿瘤细胞凋亡,进而发挥肿瘤抑制作用[3-4]。本研究结果显示,以麝香酮处理SKOV3细胞及其移植瘤小鼠的肿瘤组织自噬相关蛋白LC3Ⅱ/LC3Ⅰ及Beclin-1蛋白表达水平升高。既往研究发现,激活自噬可抑制卵巢癌细胞耐药性、增殖和迁移,发挥明显抗癌作用[17-18]。本研究表明自噬参与麝香酮对卵巢癌恶性进展的抑制过程,且麝香酮可增强自噬;以自噬抑制剂CQ和麝香酮联合处理SKOV3细胞及其移植瘤小鼠,与麝香酮单独处理相比,可减弱麝香酮对卵巢癌细胞增殖、体内生长、迁移及侵袭的抵抗作用,消除其对卵巢癌细胞凋亡的促进作用,最终逆转麝香酮对卵巢癌恶性进展的抑制作用,提示麝香酮是通过诱导自噬抑制卵巢癌恶性进展的。
SHH可通过调控细胞增殖、凋亡、迁移及自噬介导肿瘤发生及恶性进展,抑制其表达可显著降低高级别浆液性卵巢癌细胞的运动性、迁移性,并抑制其肿瘤干细胞在裸鼠体内生长[19],还可提高髓母细胞瘤小鼠的存活率[20]。本研究结果显示,麝香酮处理后SKOV3细胞及小鼠肿瘤组织SHH mRNA及蛋白表达水平降低。既往研究发现,抑制SHH信号可诱导自噬,并抑制卵巢癌细胞增殖、迁移及体内生长[12]。而本研究证实麝香酮亦可抑制SHH信号,提示SHH参与麝香酮对卵巢癌恶性进展的抑制过程;以麝香酮处理SKOV3细胞及其移植瘤小鼠的同时过表达SHH,可减弱麝香酮对卵巢癌细胞增殖、体内生长、迁移及侵袭的抵抗作用,消除其对卵巢癌细胞自噬与凋亡的增强作用,最终逆转麝香酮对卵巢癌恶性进展的抑制作用,提示麝香酮诱导自噬来抑制卵巢癌恶性进展是通过下调SHH实现的。
综上所述,麝香酮可通过下调SHH而诱导卵巢癌细胞自噬,进而降低其增殖、体内生长、迁移及侵袭活性,促进其凋亡,抑制其恶性进展,对卵巢癌发挥抗肿瘤作用,通过抑制SHH信号诱导自噬是其药理机制之一。本研究揭示了麝香酮在卵巢癌临床治疗中具有开发应用潜力,对于改进卵巢癌治疗技术具有积极价值。
参考文献
[1] PORTER R,MATULONIS U A. Immunotherapy for ovarian cancer[J]. Clin Adv Hematol Oncol,2022,20(4):240-253.
[2] KHANLARKHANI N,AZIZI E,AMIDI F,et al. Metabolic risk factors of ovarian cancer:a review[J]. JBRA Assist Reprod,2022,26(2):335-347. doi:10.5935/1518-0557.20210067.
[3] FENG C,YUAN X X. Role of autophagy and its regulation by noncoding RNAs in ovarian cancer[J]. Exp Biol Med,2023:15353702231151958. doi:10.1177/15353702231151958.
[4] VIDONI C,FERRARESI A,VALLINO L,et al. Glycolysis inhibition of autophagy drives malignancy in ovarian cancer:exacerbation by IL-6 and attenuation by resveratrol[J]. Int J Mol Sci,2023,24(2):1723. doi:10.3390/ijms24021723.
[5] 齊娜,段文娟,李雅婧,等. 麝香酮药理作用的研究进展[J]. 世界科学技术-中医药现代化,2020,22(8):3042-3047. QI N,DUAN W J,LI Y J,et al. Research Progress on the Pharmacological Action of Muscone[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2020,22(8):3042-3047. doi:10.11842/wst.20181223004.
[6] ZHAO Y R,TAO S X,WANG Q,et al. A network-based pharmacological study on the mechanism of action of muscone in breast cancer[J]. Transl Cancer Res,2022,11(5):1195-1206. doi:10.21037/tcr-22-667.
[7] 盧鹏,樊晶晶,罗旭,等. 麝香酮对肺癌细胞的顺铂耐药和小鼠体内的肿瘤生长的作用[J]. 广西医科大学学报,2020,37(11):1948-1953. LU P,FAN J J,LUO X,et al. The effect of Muscone on lung cancer cells resistance to cisplatin and tumor growth in mice[J]. J Guangxi Med Univ,2020,37(11):1948-1953. doi:10.16190/j.cnki.45-1211/r.2020.11.003.
[8] ZHANG M,TAO Z Y,GAO L J,et al. Toosendanin inhibits colorectal cancer cell growth through the Hedgehog pathway by targeting Shh[J]. Drug Dev Res,2022,83(5):1201-1211. doi:10.1002/ddr.21951.
[9] LONDERO A P,ORSARIA M,VIOLA L,et al. Survivin,sonic hedgehog,krüppel-like factors,and p53 pathway in serous ovarian cancer:an immunohistochemical study[J]. Hum Pathol,2022,127:92-101. doi:10.1016/j.humpath.2022.06.023.
[10] 赵飞,于新平,赵涵,等. GLI1及Shh在卵巢型子宫内膜异位症恶变过程中的表达及其意义[J]. 中华妇产科杂志,2022,57(2):125-132. ZHAO F,YU X P,ZHAO H,et al. Expression and significance of GLI1 and Shh in the malignant transformation of ovarian endometriosis[J]. Chin J Obstet Gynecol,2022,57(2):125-132. doi:10.3760/cma.j.cn112141-20211219-00736.
[11] ZHANG X Y,LIU Q B,ZHANG T T,et al. Bone-targeted nanoplatform enables efficient modulation of bone tumor microenvironment for prostate cancer bone metastasis treatment[J]. Drug Deliv,2022,29(1):889-905. doi:10.1080/10717544.2022.2050845.
[12] PAN Y B,ZHOU J N,ZHANG W D,et al. The Sonic Hedgehog signaling pathway regulates autophagy and migration in ovarian cancer[J]. Cancer Med,2021,10(13):4510-4521. doi:10.1002/cam4.4018.
[13] NAKAI H,MATSUMURA N. The roles and limitations of bevacizumab in the treatment of ovarian cancer[J]. Int J Clin Oncol,2022,27(7):1120-1126. doi:10.1007/s10147-022-02169-x.
[14] BOSE S,SAHA P,CHATTERJEE B,et al. Chemokines driven ovarian cancer progression,metastasis and chemoresistance:potential pharmacological targets for cancer therapy[J]. Semin Cancer Biol,2022,86(Pt 2):568-579. doi:10.1016/j.semcancer.2022.03.028.
[15] 王志,谢建絮,李婉斯,等. 麝香及西黄方中麝香酮在正常、乳腺癌癌前病变大鼠体内药动学的比较[J]. 中成药,2020,42(10):2545-2550. WANG Z,XIE J X,LI W S,et al. Comparison of in vivo pharmacokinetics of muscone from Moschus and Xihuang Decoction in normal rats and rats with precancerous lesions of breast cancer[J]. Chin Tradit Pat Med,2020,42(10):2545-2550. doi:10.3969/j.issn.1001-1528.2020.10.001.
[16] 任瑶,江一鸣,项蓉蓉,等. 西黄丸组分中药调节肿瘤微环境中Treg细胞PI3K/AKT通路的抗肿瘤作用机制研究[J]. 药物评价研究,2019,42(3):437-443. REN Y,JIANG Y M,XIANG R R,et al. Antitumor mechanism of Xihuang Pills component-based Chinese medicine by regulating Treg cells PI3K/AKT pathway in tumor microenvironment[J]. Drug Eval Res,2019,42(3):437-443. doi:CNKI:SUN:YWPJ.0.2019-03-010.
[17] CHEN S,GAO Y,ZHU P,et al. Anti-cancer drug anlotinib promotes autophagy and apoptosis in breast cancer[J]. Front Biosci (Landmark Ed),2022,27(4):125. doi:10.31083/j.fbl2704125.
[18] ZHANG M J,YUE H D,HUANG X,et al. Novel platinum nanoclusters activate PI3K/AKT/mTOR signaling pathway-mediated autophagy for cisplatin-resistant ovarian cancer therapy[J]. ACS Appl Mater Interfaces,2022,14(43):48502-48514. doi:10.1021/acsami.2c15143.
[19] SNEHA S,NAGARE R P,SIDHANTH C,et al. The hedgehog pathway regulates cancer stem cells in serous adenocarcinoma of the ovary[J]. Cell Oncol,2020,43(4):601-616. doi:10.1007/s13402-020-00504-w.
[20] CHEN L P,LI Y,SONG Z H,et al. O-GlcNAcylation promotes cerebellum development and medulloblastoma oncogenesis via SHH signaling[J]. Proc Natl Acad Sci USA,2022,119(34):e2202821119. doi:10.1073/pnas.2202821119.
