BMAL1减轻H2O2诱导的心肌细胞损伤机制研究
2024-02-18易娜肖雯田源袁李礼
易娜 肖雯 田源 袁李礼

摘要:目的 探討脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(BMAL1)通过核因子E2相关因子2(NRF2)调节活性氧(ROS)/NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体通路对过氧化氢(H2O2)诱导的心肌细胞损伤的影响。方法 体外培养H9c2细胞和BMAL1稳定过表达的H9c2细胞,建立H2O2诱导的H9c2细胞损伤模型,并将细胞分为对照(Control)组、H2O2组、BMAL1过表达(BMAL1-OE)组、BMAL1过表达+H2O2(BMAL1-OE+H2O2)组、BMAL1过表达+NRF2抑制剂(BMAL1-OE+ML385)组、BMAL1过表达+NRF2抑制剂+H2O2(BMAL1-OE+ML385+H2O2)组。采用CCK-8法检测细胞活力,荧光探针2',7'-二氯荧光素二乙酸酯检测ROS生成,Western blot检测BMAL1、NRF2和NLRP3蛋白表达,酶联免疫吸附试验法检测白细胞介素(IL)-1β释放。结果 与Control组相比,H2O2组H9c2心肌细胞活力减弱,ROS生成增多,BMAL1和NRF2蛋白表达水平降低,NLRP3蛋白表达水平升高,IL-1β释放增多(P<0.05);与H2O2组相比,BMAL1-OE+H2O2组H9c2心肌细胞活力升高,ROS生成减少,BMAL1和NRF2蛋白表达水平升高,NLRP3蛋白表达水平降低,IL-1β释放减少(P<0.05)。与BMAL1-OE+H2O2组相比,BMAL1-OE+ML385+H2O2组H9c2心肌细胞活力减弱,ROS生成增多,NLRP3蛋白表达水平升高,IL-1β释放增多(P<0.05)。结论 BMAL1可减轻H2O2诱导的H9c2心肌细胞损伤,其机制可能与NRF2调节ROS/NLRP3炎症小体通路有关。
关键词:ARNTL转录因子类;NF-E2相关因子2;活性氧;NLR家族,热蛋白结构域包含蛋白3;脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1;炎症小体
中图分类号:R542.2文献标志码:ADOI:10.11958/20231027
Mechanism of BMAL1 attenuating H2O2-induced cardiomyocyte injury
Abstract: Objective To investigate the effect of BMAL1 on H2O2-induced cardiomyocyte injury through NRF2-regulated ROS/NLRP3 inflammasome pathway. Methods H9c2 cells and H9c2 cells with stable over-expressed BMAL1 were cultured and divided into the control group, the H2O2 group, the BMAL1-OE group, the BMAL1-OE+H2O2 group, the BMAL1-OE+ML385 group and the BMAL1-OE+ML385+H2O2 group. All groups were pre-intervened with corresponding inhibitors, and then treated with 0.2 mmol/L H2O2, except for the control group and the BMAL1-OE group. After the intervention, CCK-8 assay was used to measure cell viability, fluorescent probe DCFH-DA was used to measure ROS generation and Western blot assay was used to detect BMAL1, NRF2 and NLRP3 protein expressions. ELISA was used to determine IL-1β release. Results Compared with the control group, the cell viability was decreased, ROS generation was increased, BMAL1 and NRF2 protein expressions were decreased, NLRP3 expression and IL-1β release were increased in the H2O2 group (P<0.05). Compared with the H2O2 group, the cell viability was increased, ROS generation was decreased, BMAL1-OE and NRF2 protein expressions were increased, NLRP3 expression and IL-1β release were decreased in the BMAL1-OE+H2O2 group (P<0.05). Compared with the BMAL1-OE+H2O2 group, the cell viability was decreased, ROS generation was increased, NLRP3 expression and IL-1β release were increased in the BMAL1-OE+ML385+H2O2 group (P<0.05). Conclusion BMAL1 attenuates H2O2-induced H9c2 cardiomyocyte injury, and its mechanism may be related to the regulation of ROS/NLRP3 inflammasome pathway through NRF2.
Key words: ARNTL transcription factors; NF-E2-related factor 2; reactive oxygen species; NLR family, pyrin domain-containing 3 protein; BMAL1; inflammasome
心血管疾病的发病率和死亡率较高,为我国重要的公共卫生问题[1]。炎症免疫因素在心血管疾病中发挥重要作用[2],NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体在心血管疾病中的作用受到广泛关注[3]。多种心血管疾病的危险因素均能激活NLRP3炎症小体[4]。因此,探讨NLRP3炎症小体通路对心血管疾病的调控有助于寻找新的心肌细胞保护策略和靶点。心血管疾病的发作有昼夜变化的特点。生物钟相关基因参与心血管疾病的病理生理学过程[5]。本课题组前期研究证实,作为生物钟昼夜节律调控重要元件之一的脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(BMAL1)可通过核因子E2相关因子2(NRF2)减轻过氧化氢(H2O2)诱导的大鼠心肌细胞氧化应激损伤[6],但具体机制尚未明确。BMAL1是否通过调控NLRP3炎症小体通路而减轻心血管疾病时的细胞损伤尚不清楚。本文在前期研究基础上,选用H2O2诱导的H9c2心肌细胞氧化应激损伤模型,探讨BMAL1通过NRF2调节活性氧(ROS)/NLRP3炎症小体的分子机制。
1 材料与方法
1.1 主要试剂和仪器 H9c2心肌细胞和BMAL1稳定过表达的H9c2心肌细胞为本室保存;DMEM培养液、胎牛血清、磷酸盐缓冲液(PBS)、胰蛋白酶、100×青霉素/链霉素购自美国Gibco公司;H2O2购自Sigma公司;细胞计数试剂-8(CCK-8)购自东仁化学公司;ROS检测试剂盒购自碧云天生物技术有限公司;白细胞介素(IL)-1β酶联免疫吸附试验(ELISA)检测试剂盒购自美国Thermo Scientific公司;兔抗大鼠BMAL1、NRF2、NLRP3和GAPDH抗体以及辣根过氧化物酶标记的羊抗兔IgG二抗购自Abcam公司;NRF2特异性抑制剂ML385购自MCE公司;全波长多功能酶标仪购自Biotek公司,蛋白电泳分离、转膜和化学发光成像系统购自Bio-rad公司。
1.2 方法
1.2.1 细胞培养和模型构建 采用含10%胎牛血清的DMEM培养基培养H9c2细胞。BMAL1稳定过表达的H9c2心肌细胞培养时另添加1 mg/L的嘌呤霉素。采用终浓度为0.2 mmol/L的H2O2诱导H9c2细胞损伤模型,处理24 h后用于后续实验。
1.2.2 实验分组 细胞分为对照(H9c2心肌细胞,Control)组、H2O2(0.2 mmol/L H2O2处理H9c2心肌细胞24 h)组、BMAL1过表达(BMAL1稳定过表达的H9c2心肌细胞,BMAL1-OE)组、BMAL1过表达+H2O2(0.2 mmol/L H2O2处理BMAL1稳定过表达的H9c2心肌细胞24 h,BMAL1-OE+H2O2)组、BMAL1过表达+NRF2抑制剂(2 μmol/L ML385预处理BMAL1稳定过表达的H9c2心肌细胞12 h,BMAL1-OE+ML385)组、BMAL1过表达+NRF2抑制剂+H2O2(2 μmol/L ML385预处理BMAL1稳定过表达的H9c2心肌细胞12 h后再予以0.2 mmol/L H2O2继续处理24 h,BMAL1-OE+ML385+H2O2)组。
实验分为2个部分:实验1分组设置为Control组、H2O2组、BMAL1-OE组、BMAL1-OE+H2O2组,研究BMAL1对心肌细胞氧化应激损伤的影响;实验2分组设置为BMAL1-OE组、BMAL1-OE+H2O2组、BMAL1-OE+ML385组、BMAL1-OE+ML385+H2O2组,研究NRF2在BMAL1参与心肌细胞氧化应激损伤过程中的作用。
1.2.3 CCK-8法检测细胞活力 细胞按1×104个/孔接种于96孔板,分组干预后,每孔更换为含10 μL CCK-8试剂的PBS溶液,37 ℃培养1 h后,采用酶标仪测定450 nm波长处吸光度(A450)值。
1.2.4 荧光探针2',7'-二氯荧光素二乙酸酯(DCFH-DA)检测细胞ROS 细胞按1×104个/孔接种于96孔板,分组干预后,每孔更换含终浓度为10 μmol/L DCFH-DA的无血清DMEM培养基,37 ℃培养20 min,采用无血清DMEM培养基清洗细胞3次以去除未进入细胞的DCFH-DA,通过全波长多功能酶标仪488 nm波长激发,测定525 nm发射波长的吸光度值(A525),并计算各组的相对ROS比率(各实验组A525/对照组A525×100%)。
1.2.5 Western blot檢测细胞BMAL1、NRF2和NLRP3蛋白表达 细胞按1×106个/孔接种于6孔板,分组干预后收集细胞,RIPA裂解液提取总蛋白,BCA定量蛋白后变性。通过10% SDS-PAGE对蛋白进行电泳分离后转移至PVDF膜上,5%脱脂奶粉室温下封闭1 h,加入BMAL1(1∶1 000)、NRF2(1∶1 000)、NLRP3(1∶1 000)和GAPDH抗体(1∶2 000),4 ℃孵育12 h,TBST清洗后用辣根过氧化物酶标记的羊抗兔IgG二抗(1∶2 000)室温孵育1 h,TBST清洗后加入ECL液后化学发光,应用成像系统采集,Image Lab分析灰度值,以GAPDH为内参,计算各目的蛋白的相对表达量。实验重复3次。
1.2.6 ELISA法检测细胞IL-1β释放 细胞按1×104个/孔接种于96孔板,分组干预后收集细胞上清液,1 000 r/min离心5 min,去除细胞残留,采用ELISA法检测IL-1β含量,按照试剂盒说明书进行操作。
1.3 统计学方法 采用GraphPad Prism 8软件进行数据分析。计量资料以[[x] ±s
]表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t法。P<0.05为差异有统计学意义。
2 结果
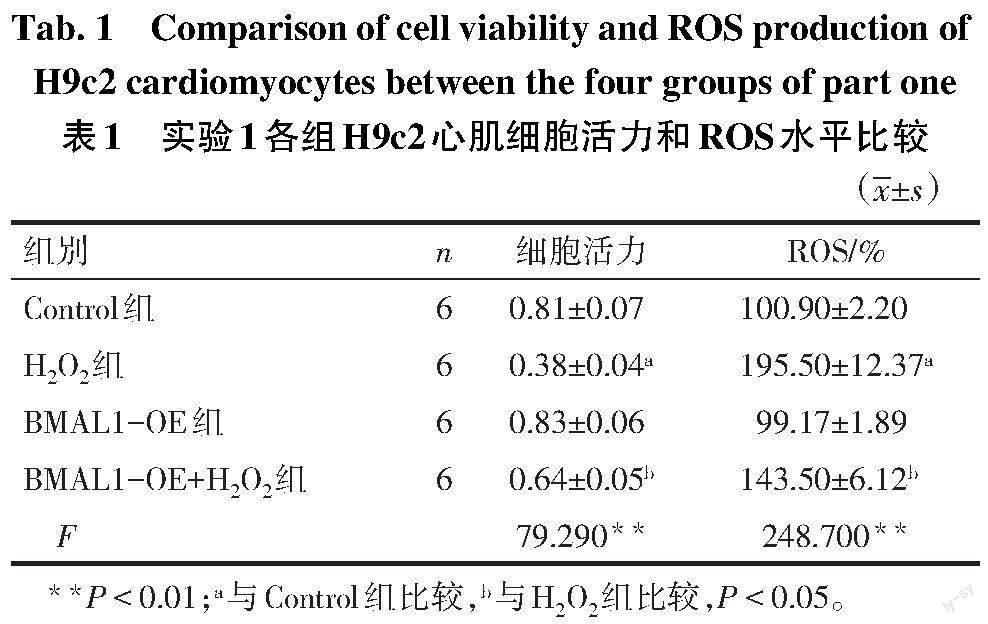
2.1 BMAL1对H2O2诱导H9c2心肌细胞损伤和ROS生成的影响 与Control组相比,H2O2组H9c2心肌细胞活力减弱,ROS水平增高(P<0.05),BMAL1-OE组H9c2心肌细胞活力和ROS水平无明显变化(P>0.05);与H2O2组相比,BMAL1-OE+H2O2组H9c2心肌细胞活力升高,ROS水平降低(P<0.05),见表1。
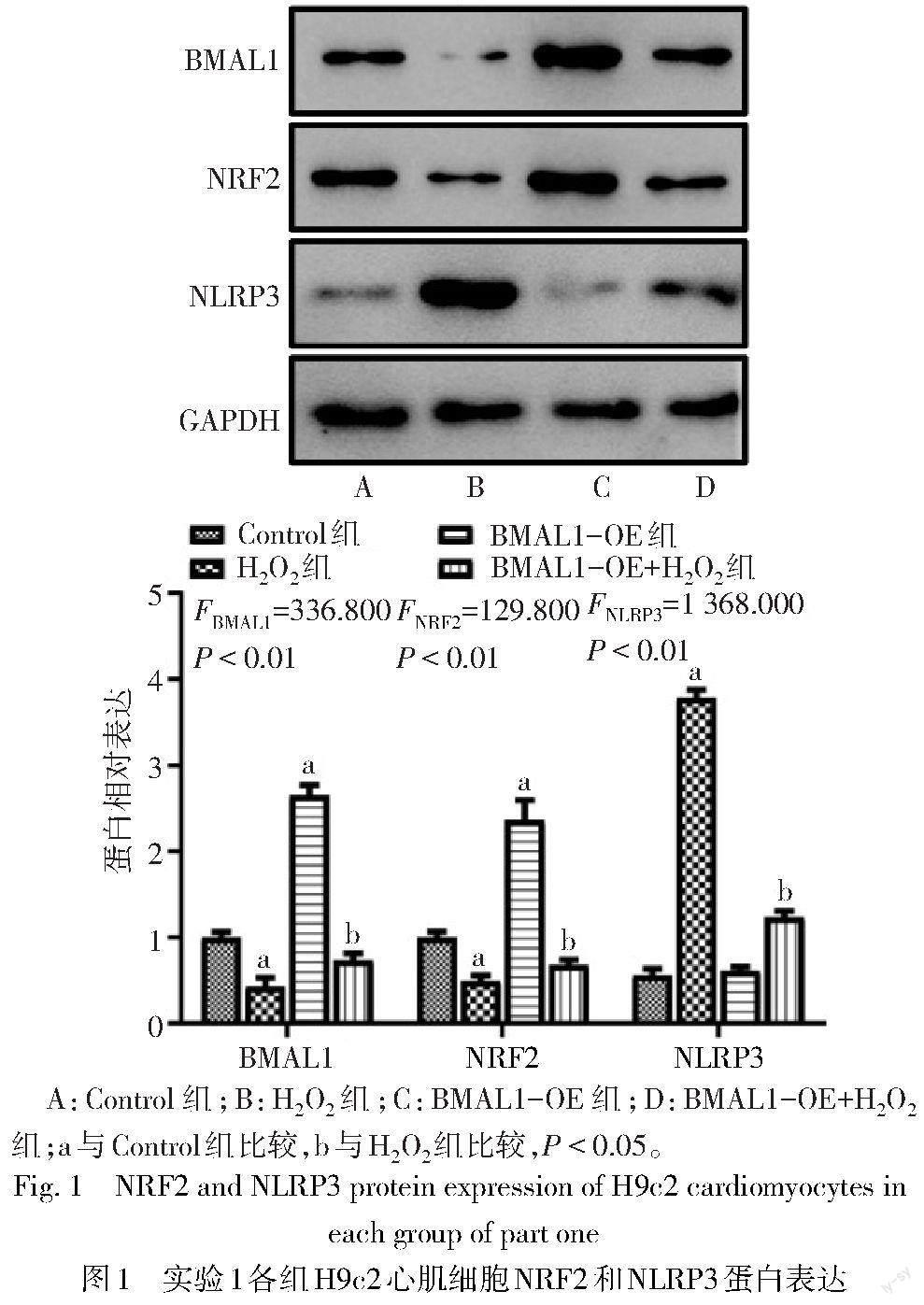
2.2 BMAL1对H2O2诱导心肌细胞NRF2和NLRP3蛋白表达的影响 与Control组相比,H2O2组H9c2心肌细胞BMAL1和NRF2蛋白表达水平降低,NLRP3蛋白表达水平升高(P<0.05),BMAL1-OE组H9c2心肌细胞BMAL1和NRF2蛋白表达水平升高(P<0.05),NLRP3蛋白表達水平无明显变化(P>0.05);与H2O2组相比,BMAL1-OE+H2O2组H9c2心肌细胞BMAL1和NRF2蛋白表达水平升高,NLRP3蛋白表达水平降低(P<0.05),见图1。
2.3 BMAL1对H2O2诱导心肌细胞IL-1β释放的影响 与Control组相比,H2O2组H9c2心肌细胞IL-1β释放增多(P<0.05),BMAL1-OE组H9c2心肌细胞IL-1β释放无明显变化(P>0.05);与H2O2组相比,BMAL1-OE+H2O2组H9c2心肌细胞IL-1β释放减少(P<0.05),见图2。
2.4 BMAL1通过NRF2影响H2O2诱导H9c2心肌细胞损伤和ROS生成 与BMAL1-OE组相比,BMAL1-OE+ML385组H9c2心肌细胞活力和ROS水平无明显变化(P>0.05);与BMAL1-OE+H2O2组相比,BMAL1-OE+ML385+H2O2组H9c2心肌细胞活力减弱,ROS水平增高(P<0.05),见表2。
2.5 BMAL1通过NRF2影响H2O2诱导H9c2心肌细胞NLRP3蛋白表达 与BMAL1-OE组相比,BMAL1-OE+ML385组H9c2心肌细胞NLRP3表达无明显差异(P>0.05);与BMAL1-OE+H2O2组相比,BMAL1-OE+ML385+H2O2组H9c2心肌细胞NLRP3表达升高(P<0.05),见图3。
2.6 BMAL1通过NRF2影响H2O2诱导H9c2心肌细胞IL-1β释放 与BMAL1-OE组相比,BMAL1-OE+ML385组H9c2心肌细胞IL-1β释放无明显变化(P>0.05);与BMAL1-OE+H2O2组相比,BMAL1-OE+ML385+H2O2组H9c2-心肌细胞IL-1β释放增多(P<0.05),见图4。
3 讨论
心血管疾病受到生物钟节律因素的影响[7]。本课题组前期研究表明生物钟节律调控的核心基因之一的BMAL1能减轻H2O2诱导H9c2心肌细胞损伤,并成功构建BMAL1稳定过表达H9c2细胞[6]。本研究采用经典的H2O2诱导H9c2心肌细胞氧化应激损伤模型[8],结果显示,H9c2细胞经H2O2诱导后,细胞活力降低、ROS生成增多,H9c2细胞发生损伤,模型建立成功。BMAL1稳定过表达能抑制H2O2诱导的细胞活力降低和ROS产生,提示BMAL1可减轻H2O2诱导的H9c2心肌细胞损伤,具有潜在的保护作用。
NLRP3炎症小体与多种心血管疾病的发生发展密切相关,其在心肌细胞损伤中的作用也日益受到重视[9]。NLRP3炎症小体的活化包含启动和激活两个方面,其中ROS的生成是NLRP3炎症小体激活最主要的机制[10],而ROS生成增多引起的氧化应激亦是心肌损伤的核心机制之一[11]。针对ROS/NLRP3炎症小体激活的调控能影响细胞的病理生理进程[12-13],但BMAL1的心肌细胞保护作用是否与NLRP3炎症小体有关尚不明确。Hong等[14]研究表明BMAL1能调控巨噬细胞NLRP3介导的IL-1β释放。本研究结果显示,BMAL1稳定过表达能抑制H2O2诱导的H9c2细胞NLRP3蛋白高表达和IL-1β释放,提示BMAL1能减轻心肌细胞ROS/NLRP3炎症小体通路活化,这也可能是其减轻H2O2诱导的H9c2细胞损伤的机制之一。
生物体内有着复杂的抗氧化还原体系,用于控制ROS水平并防止其过量积累[15],NRF2则是其中的一种重要的氧化还原敏感性转录因子,能激活下游一系列抗氧化基因,降低ROS水平,从而维持细胞稳态[16-17]。有研究报道BMAL1可通过调节NRF2来影响氧化还原稳态[18-19]。本研究结果亦显示,BMAL1高表达能促进NRF2表达。为探究NRF2在其中的作用,采用抑制剂ML385处理H9c2细胞,结果显示ML385减少BMAL1对H2O2诱导的H9c2心肌细胞活力和ROS生成的抑制作用,提示NRF2参与BMAL1对心肌细胞的保护作用。而Early等[20]研究发现巨噬细胞BMAL1通过NRF2调控IL-1β释放。本研究结果显示,ML385增加BMAL1对H2O2诱导的H9c2细胞NLRP3和IL-1β的蛋白表达释放,提示BMAL1通过NRF2调节ROS/NLRP3炎症小体通路及H2O2诱导的心肌细胞损伤。
综上所述,BMAL1能减轻H2O2诱导的H9c2心肌细胞损伤,其机制可能与NRF2调节ROS/NLRP3炎症小体通路有关。本研究为BMAL1在心血管疾病中发挥氧化和炎症反应的负调节作用提供了理论基础和实验依据。但本研究仅通过体外细胞实验证实了BMAL1对H2O2诱导的H9c2心肌细胞氧化应激损伤的影响机制,在体内的作用机制还需继续探索。
参考文献
[1] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2020概要[J]. 中國循环杂志,2021,36(6):521-545. The Writing Committee of the Report on Cardiovascular Health and Diseases in China. Report on cardiovascular health and diseases burden in china:an updated summary of 2020[J]. Chin Circ J,2021,36(6):521-545. doi:10.3969/j.issn.1000-3614.2021.06.001.
[2] 赵冬. 心血管疾病危险因素的研究:过去、现在和未来[J]. 中国循环杂志,2021,36(1):1-3. ZHAO D. Research on cardiovascular disease risk factors:past,present and future[J]. Chin Circ J,2021,36(1):1-3. doi:10.3969/j.issn.1000-3614.2021.01.001.
[3] PELLEGRINI C,MARTELLI A,ANTONIOLI L,et al. NLRP3 inflammasome in cardiovascular diseases:Pathophysiological and pharmacological implications[J]. Med Res Rev,2021,41(4):1890-1926. doi:10.1002/med.21781.
[4] 谭红梅. NLRP3炎症小体与心血管疾病[J]. 中山大学学报(医学科学版),2017,38(2):215-221. TAN H M. Role of NLRP3 inflammasome in cardiovascular diseases[J]. J Sun Yat-sen Univ (Med Sci),2017,38(2):215-221. doi:10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).2017.0035.
[5] THOSAR S S,BUTLER M P,SHEA S A. Role of the circadian system in cardiovascular disease[J]. J Clin Invest,2018,128(6):2157-2167. doi:10.1172/JCI80590.
[6] 易娜,袁李礼. BMAL1对H2O2诱导的H9c2心肌细胞损伤的影响及机制探讨[J]. 天津医药,2021,49(8):791-795. YI N,YUAN L L. Effects and mechanism of BMAL1 on H2O2-induced H9C2 cardiomyocyte injury[J]. Tianjin Med J,2021,49(8):791-795. doi:10.11958/20210463.
[7] 杨瑾,徐志峰,苏嘉,等. 生物钟基因与心血管疾病的研究进展[J]. 中华心血管病杂志,2020,48(7):610-615. YANG J,XU Z F,SU J,et al. Research progress on the circadian clock regulation in cardiovascular system and associationbetween circadian clock regulation and cardiovascular diseases[J]. Chin J Cardiol,2020,48(7):610-615. doi:10.3760/cma.j.cn112148-20190725-00430.
[8] 易娜,李贺,游三丽,等. 丹参酮ⅡA通过AK003290减轻H2O2诱导的原代小鼠心肌细胞焦亡[J]. 中国病理生理杂志,2021,37(6):1035-1041. YI N,LI H,YOU S L,et al. Tanshinone IIA attenuates H2O2-induced primary mouse cardiomyocyte pyroptosis via AK003290[J]. Chin J Pathophysiol,2021,37(6):1035-1041. doi:10.11958/20210463.
[9] ABBATE A,TOLDO S,MARCHETTI C,et al. Interleukin-1 and the inflammasome as therapeutic targets in cardiovascular disease[J]. Circ Res,2020,126(9):1260-1280.
[10] PANDEY A,SHEN C,FENG S,et al. Cell biology of inflammasome activation[J]. Trends Cell Biol,2021,31(11):924-939. doi:10.1016/j.tcb.2021.06.010.
[11] ZHAO T,WU W,SUI L,et al. Reactive oxygen species-based nanomaterials for the treatment of myocardial ischemia reperfusion injuries[J]. Bioact Mater,2021,7:47-72. doi:10.1016/j.bioactmat.2021.06.006.
[12] 王佳慧,梁欢,方典,等. 抑制线粒体活性氧自由基可减轻高糖诱导的心肌细胞焦亡和鐵死亡[J]. 南方医科大学学报,2021,41(7):980-987. WANG J H,LIANG H,FANG D,et al. Inhibition of mitochondrial reactive oxygen species reduces high glucose-induced pyroptosis and ferroptosis in H9C2 cardiac myocytes[J]. J South Med Univ,2021,41(7):980-987. doi:10.12122/j.issn.1673-4254.2021.07.03.
[13] WEI Z,NIE G,YANG F,et al. Inhibition of ROS/NLRP3/Caspase-1 mediated pyroptosis attenuates cadmium-induced apoptosis in duck renal tubular epithelial cells[J]. Environ Pollut,2020,273:115919. doi:10.1016/j.envpol.2020.115919.
[14] HONG H,CHEUNG Y M,CAO X,et al. REV-ERBα agonist SR9009 suppresses IL-1β production in macrophages through BMAL1-dependent inhibition of inflammasome[J]. Biochem Pharmacol,2021,192:114701. doi:10.1016/j.bcp.2021.114701.
[15] SIES H,JONES D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents[J]. Nat Rev Mol Cell Biol,2020,21(7):363-383. doi:10.1038/s41580-020-0230-3.
[16] KASAI S,SHIMIZU S,TATARA Y,et al. Regulation of Nrf2 by mitochondrial reactive oxygen species in physiology and pathology[J]. Biomolecules,2020,10(2):320. doi:10.3390/biom10020320.
[17] 陈芳,邹联洪,刘协红,等. NRF2减轻阿霉素诱导的心肌H9c2细胞氧化应激和溶酶体功能障碍[J]. 中国病理生理杂志,2019,35(8):1359-1364. CHEN F,ZOU L H,LIU X H,et al.NRF2 attenuates oxidative stress and lysosomal dysfunction in doxorubicin-induced H9C2 cells[J]. Chin J Pathophysiol,2019,35(8):1359-1364. doi:10.3969/j.issn.1000-4718.2019.08.003.
[18] CHHUNCHHA B,KUBO E,SINGH D P. Clock protein BMAL1 and Nrf2 cooperatively control aging or oxidative response and redox homeostasis by regulating rhythmic expression of prdx6[J]. Cells,2020,9(8):1861. doi:10.3390/cells9081861.
[19] LIU X H,XIAO W,JIANG Y,et al. BMAL1 regulates the redox rhythm of HSPB1,and homooxidized HSPB1 attenuates the oxidative stress injury of cardiomyocytes[J]. Oxid Med Cell Longev,2021,2021:5542815. doi:10.1155/2021/5542815.
[20] EARLY J O,MENON D,WYSE C A,et al. Circadian clock protein BMAL1 regulates IL-1β in macrophages via NRF2[J]. Proc Natl Acad Sci USA,2018,115(36):E8460-E8468. doi:10.1073/pnas.1800431115.
