非小细胞肺癌临床病理特征与脑转移的关系
2024-02-08吴萌王思伟李梅

[摘" "要]" "目的:通过对非小细胞肺癌(non-small cell lung cancer, NSCLC)患者临床病理特征及驱动基因分析,分析脑转移的危险因素并建立预测模型。方法:收集2019年12月—2022年12月收治于南通大学附属医院诊治的142例NSCLC患者的临床资料及基因检测等结果,分析突变率较高的3种驱动基因,探究发生脑转移的危险因素,并建立及验证预测模型。结果:(1)142例NSCLC患者中,腺癌占81.7%,脑转移发生率为31.7%。(2)表皮生长因子受体(epidermal growth factor receptor, EGFR)(29.6%)、肿瘤蛋白p53(tumor protein p53, TP53)(23.8%)和鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene, KRAS)(12.2%)突变率较高。66.9%患者发生突变,EGFR与TP53共突变率为16.9%。(3)EGFR突变在女性、腺癌、不吸烟者、淋巴结转移N2~3、有颅外器官转移及癌胚抗原增高的患者中常见;TP53突变与颅外器官转移相关;KRAS突变则常见于淋巴结转移N0~1患者。(4)单因素分析显示,年龄≤66岁、肿瘤直径gt;3 cm、腺癌类型、淋巴结转移状态、骨转移及多个基因突变均与脑转移相关。(5)通过Logistic多因素分析,年龄≤66岁、肿瘤直径gt;3 cm、腺癌类型及多个基因突变可有效预测脑转移风险,构建的模型ROC曲线AUC为0.839,具有良好的诊断价值。结论:EGFR、TP53和KRAS基因突变与脑转移风险相关,构建的模型可为脑转移风险评估和早期预防提供依据。
[关键词]" "非小细胞肺癌;临床病理特征;驱动基因;脑转移;危险因素
[中图分类号]" "R734.2" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)06-0503-05
The relationship between clinicopathological characteristics of non-small cell lung cancer and brain metastasis*
WU Meng1**, WANG Siwei2, LI Mei1***" " " " (1Department of Tumor Chemotherapy, Affiliated Hospital of Nantong University, Jiangsu 226001; 2Department of Endocrinlolgy, the First People?蒺s Hospital of Shuyang County)
[Abstract]" "Objective: To investigate the risk factors for brain metastasis in non-small cell lung cancer(NSCLC) patients through the analysis of clinicopathological characteristics and driver genes, and to establish a predictive model. Methods: Clinical data and genetic testing results from 142 NSCLC patients treated at the Affiliated Hospital of Nantong University from December 2019 to December 2022 were collected. The mutation rates of three frequently mutated driver genes were analyzed to explore the risk factors for brain metastasis. A predictive model was then developed and validated. Results: (1)Among the 142 NSCLC patients, adenocarcinoma accounted for 81.7%, and the incidence of brain metastasis was 31.7%. (2)The mutation rates were high for epidermal growth factor receptor(EGFR, 29.6%), tumor protein p53(TP53, 23.8%), and kirsten rat sarcoma viral oncogene(KRAS, 12.2%). Mutations were present in 66.9% of patients, with co-mutations of EGFR and TP53 in 16.9%. (3)EGFR mutations were more common in females, adenocarcinoma patients, non-smokers, patients with N2-3 lymph node metastases, extracranial organ metastases, or elevated carcinoembryonic antigen levels. TP53 mutations were associated with extracranial organ metastases, while KRAS mutations were more frequent in patients with N0-1 lymph node metastases. (4)Univariate analysis indicated that age≤66 years, tumor diametergt;3 cm, adenocarcinoma type, lymph node metastasis status, bone metastasis, and multiple gene mutations were significantly associated with brain metastasis. (5)Logistic multivariate analysis revealed that age≤66 years, tumor diametergt;3 cm, adenocarcinoma type, and multiple gene mutations were effective predictors of brain metastasis risk. The predictive model showed AUC of 0.839, indicating good diagnostic performance. Conclusion: EGFR, TP53, and KRAS gene mutations are associated with the risk of brain metastasis. The predictive model provides a useful tool for assessing brain metastasis risk and aiding in early prevention.
[Key words]" "non-small cell lung cancer; clinicopathological characteristic; driver gene; brain metastasis; risk factor
肺癌在全球恶性肿瘤中死亡率最高[1],其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占大多数,约50%的肺癌患者发生脑转移[2]。血脑屏障的存在使化疗难以有效控制病情发展,导致肺癌患者预后差、生存期缩短。近年来,靶向治疗和放射治疗在控制NSCLC脑转移方面取得了一定进展,尤其是针对驱动基因突变患者的靶向治疗显著延长了其生存期[3]。
现有的治疗方案多针对已确诊的脑转移患者,若无症状患者未能及时诊断,可能错过最佳放疗时机。预防性颅脑放疗(prophylactic cranial irradiation, PCI)已被证实能有效预防脑转移,特别是对高风险无症状患者有帮助[4]。识别脑转移的高危因素可为NSCLC患者争取更多控制疾病的时间并延长生存期。
研究[5]表明,年龄、癌胚抗原(carcinoembryonic antigen, CEA)水平和基因突变状态等多因素模型可预测脑转移的发生。表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变也是脑转移的危险因素之一[6]。此外,一些分子标志物,如细胞角蛋白19片段(cytokeratin fragment 19, CYFRA21-1)、糖类抗原19-9、癌症抗原125、神经元特异性烯醇化酶和D-二聚体等也与脑转移的发生相关[7]。本文将通过扩展基因研究,分析多种驱动基因与脑转移的相关性,建立预测模型,为NSCLC患者的脑转移预防及诊治提供依据。
1" "资料与方法
1.1" "一般资料" "收集2019年12月—2022年12月南通大学附属医院142例NSCLC患者的临床病理及基因检测等结果。纳入标准:(1)病理确诊为NSCLC;(2)行头颅增强CT、MRI或PET/CT确认有无脑转移;(3)具备完整的临床基本信息及基因检测结果。排除标准:(1)临床资料不全;(2)合并其他恶性肿瘤。基因检测采用Illumina hiseq 4000进行二代测序。病理类型依据2015版WHO肺肿瘤分类[8],TNM分期参照WHO第8版标准[9]。本研究经南通大学附属医院伦理委员会审核批准(批号:2018-L100)。
1.2" "研究方法" "采用回顾性分析,探讨NSCLC患者临床病理特征与驱动基因的相关性及脑转移危险因素。观察指标包括患者年龄、性别、吸烟史、血液肿瘤指标、肿瘤直径、病理类型、淋巴结及远处转移情况、驱动基因、程序化死亡受体-配体1(programmed cell death-ligand 1, PD-L1)、肿瘤增殖抗原Ki-67、甲状腺转录因子-1(thyroid transcription factor-1, TTF-1)、CEA、CYFRA21-1和肿瘤突变负荷等。
1.3" "统计学方法" "数据分析使用SPSS 26.0统计软件,各类数值以频数和百分比表示,采用χ2检验和Fisher精确检验分析组间差异,利用Logistic回归模型筛选脑转移高危因素,通过ROC曲线验证其预测价值,当AUCgt;0.5时结果具有统计学意义,确定截断值。Plt;0.05为差异有统计学意义。
2" "结" " " 果
2.1" "NSCLC患者的临床病理特征及驱动基因突变
2.1.1" "临床病理特征" "本研究纳入142例NSCLC患者,其中男90例(63.4%),女52例(36.6%);平均年龄(63.81±9.63)岁,中位年龄66岁,其中≤66岁92例(64.8%),gt;66岁50例(35.2%)。吸烟者较少,共55例(38.7%);腺癌116例(81.7%),鳞癌20例(14.1%);N分期为N2~3者88例(62.0%),N0~1者54例(38.0%);脑转移45例(31.7%),颅外器官转移73例(51.4%),其中骨转移占比较大,共46例(63.0%)。一线治疗方式:手术68例(47.9%),化疗59例(41.5%),靶向治疗13例(9.2%),放疗2例(1.4%)。
2.1.2" "基因突变
2.1.2.1" "189个基因位点情况" "纳入的142例患者均接受基因检测,包括EGFR、肿瘤蛋白p53(tumor protein p53, TP53)、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene, KRAS)等,共检测到189个突变基因位点。突变率最高的3种基因为EGFR(29.6%)、TP53(23.8%)和KRAS(12.2%)。其余基因突变率依次为:磷脂酰肌醇3激酶催化亚基α(phosphoinositide 3-kinase catalytic subunit alpha, PIK3CA)(6.9%)、SMAD家族成员4(SMAD family member 4, SMAD4)(4.8%)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)(4.2%)、共济失调毛细血管扩张突变基因(ataxia telangiectasia, ATM)(3.7%)、视网膜母细胞瘤1(retinoblastoma 1, RB1)(3.2%)、腺瘤性息肉病基因(adenomatous polyposis coli, APC)(3.2%)、Erb-B2受体酪氨酸激酶2(Erb-B2 receptor tyrosine kinase 2, ERBB2)(3.2%)、转染重排因子(rearranged during transfection, RET)(3.2%)、鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1, BRAF)(1.6%)、c-ros癌基因1(c-ros oncogene 1, ROS-1)(1.1%)和细胞间质上皮转换因子(cellular-mesenchymal epithelial transition factor, c-MET)(0.5%)。
2.1.2.2" "患者基因突变情况" "142例患者中,驱动基因突变95例(66.9%),其中单基因突变31例(21.8%),包括EGFR(14.8%)、KRAS(3.5%)、ERBB2(1.4%)和ALK(2.1%)。携带两个及以上基因突变64例(45.1%)。总体上EGFR突变概率最高(39.4%),其次为TP53(31.7%)、KRAS(16.2%)、PIK3CA(9.2%)、SMAD4(6.3%)、ALK(5.6%)、ATM(4.9%)、RB1(4.2%)、APC(4.2%)、ERBB2(3.5%)、RET(3.5%)、BRAF(2.1%)、ROS-1(1.4%)和c-MET(0.7%)。
2.1.2.3" "EGFR基因突变情况" "在56例EGFR基因突变的NSCLC患者中,单个外显子突变46例(32.4%),其中18号外显子2例(1.4%),19号外显子21例(14.8%),20号外显子3例(2.1%),21号外显子20例(14.1%);同时突变2个外显子的有10例(7.0%),其中20/21号外显子4例(2.8%),18/19号外显子1例(0.7%),19/20号外显子4例(2.8%),19/21号外显子1例(0.7%)。另外,EGFR突变患者中合并其他基因突变35例(62.5%),占所有NSCLC患者的24.6%,合并1个共突变17例(12.0%),其中与TP53共突变最常见,有13例(9.2%)。合并2个共突变15例(10.5%),合并3个共突变3例(2.1%)。
2.1.2.4" "其他基因共突变情况" "除EGFR基因突变外,本研究统计了69例NSCLC患者其他13种基因共突变情况,频率较高的有TP53、KRAS、PIK3CA、SMAD4等。其中,TP53与EGFR共突变的频率最高,见表1。
2.2" "NSCLC 患者驱动基因与临床病理特征" "本研究中,NSCLC患者基因突变率最高的3种基因为EGFR、TP53和KRAS。为探讨这3种基因与临床病理特征的相关性,分析了性别、年龄、病理类型、吸烟史、淋巴结转移情况、颅外器官转移、CEA和CYFRA21-1。结果表明,EGFR基因突变与性别(女性P=0.001)、腺癌(P=0.001)、不吸烟(P=0.045)、N2~3淋巴结转移(P=0.003)、颅外器官转移(P=0.002)及CEA增高相关。TP53基因突变主要见于有颅外器官转移的患者(Plt;0.001)。KRAS基因突变则常见于N0~1淋巴结转移的患者(P=0.046)。
2.3" "NSCLC患者临床病理特征与脑转移的相关性" "在142例NSCLC患者中,发生脑转移45例(31.7%),其中初次诊断时发现19例(13.4%),治疗过程中发现26例(18.3%)。分析性别、年龄、吸烟史、肿瘤直径、病理类型、淋巴结转移、颅外器官转移、基因突变等因素对脑转移的影响。结果显示,年龄≤66岁(P=0.027)、肿瘤直径gt;3 cm(P=0.003)、腺癌(Plt;0.001)、N2~3淋巴结转移(P=0.001)、有颅外器官转移(Plt;0.001)及基因突变(Plt;0.001)是发生脑转移的危险因素,而性别、吸烟史、肿瘤突变负荷、PD-L1、Ki-67、TTF-1、CEA及CYFRA21-1水平与脑转移无相关性。
2.4" "驱动基因突变与NSCLC患者脑转移的相关性
2.4.1" "各驱动基因突变与NSCLC患者脑转移" "收集NSCLC患者的14种突变基因,结果显示EGFR(Plt;0.001)、TP53(Plt;0.001)、PIK3CA(Plt;0.001)、BRAF(P=0.048)、ERBB2(P=0.022)、RET(P=0.002)、SMAD4(P=0.006)、RB1(P=0.038)基因突变与发生脑转移有相关性(均Plt;0.05),是NSCLC患者发生脑转移的危险因素。
2.4.2" "EGFR基因突变与NSCLC患者脑转移" "在142例NSCLC患者中,存在EGFR基因突变56例(39.4%),包括仅携带1个EGFR突变位点46例(32.4%)和双突变位点10例(7.0%)。脑转移45例患者中,存在EGFR基因突变29例,其中仅携带1个突变位点25例(17.2%),携带两个突变位点4例(2.8%)。
2.4.2.1" "EGFR基因突变位点与脑转移" "142例NSCLC患者EGFR基因突变位点情况如下:18号(1.4%)、19号(14.8%)、20号(2.1%)、21号(14.1%)、20/21号(2.8%)、18/19号(0.7%)、19/20号(2.8%)、19/21号(0.7%)。在发生脑转移的患者中,19号外显子突变的发生率最高,占NSCLC患者的9.9%,其脑转移概率为66.7%。结果显示,各类EGFR基因突变位点与NSCLC患者发生脑转移无相关性(P=0.299)。
2.4.2.2" "EGFR基因共突变与脑转移" "142例NSCLC患者中,出现EGFR与其他基因共突变35例(24.6%),其中脑转移患者也出现EGFR与其他基因的共突变,有20例(44.4%)。结果显示,EGFR合并1种、2种或3种基因突变与NSCLC患者发生脑转移无相关性(P=0.352)。
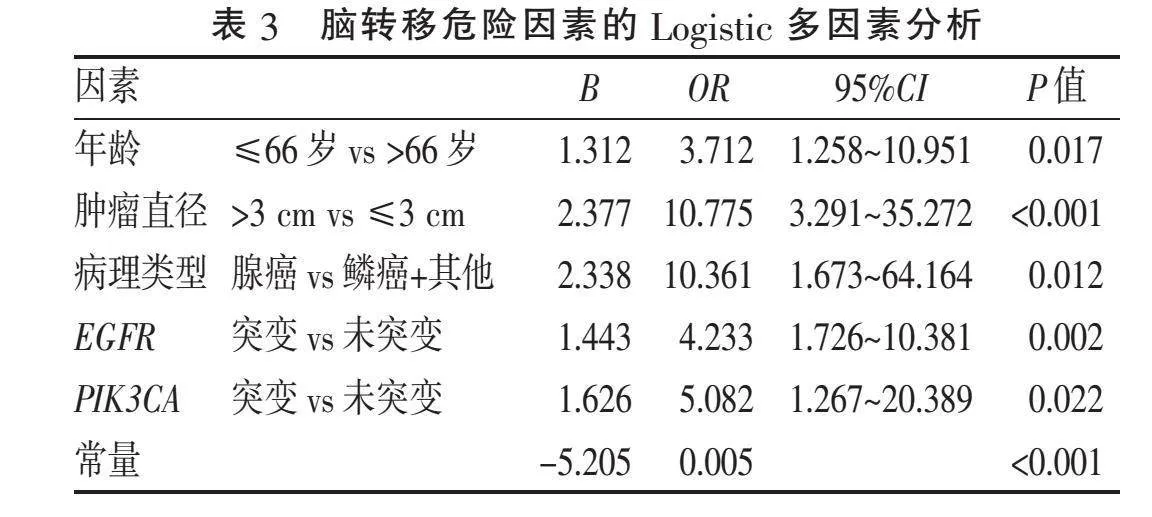
2.5" "NSCLC患者发生脑转移的多因素分析" "将上述研究中有意义的单因素(年龄、肿瘤直径、病理类型、淋巴结转移、骨转移及EGFR、TP53、PIK3CA、BRAF、ERBB2、RET、SMAD4、RB1基因突变状态,均Plt;0.05)纳入Logistic多因素分析,结果显示,年龄≤66岁(P=0.033)、肿瘤直径gt;3 cm(P=0.001)、腺癌病理类型(P=0.022)、EGFR基因突变(P=0.012)和PIK3CA基因突变(P=0.048)是NSCLC患者发生脑转移的独立危险因素,见表2。
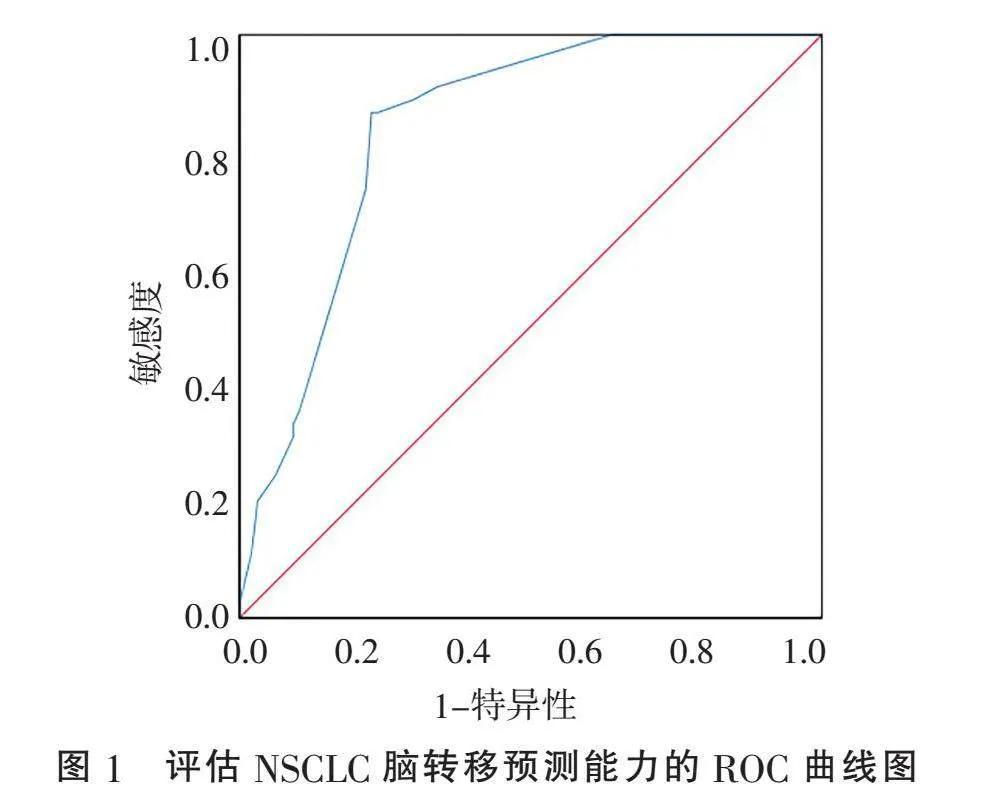
2.6" "NSCLC患者脑转移预测能力分析" "为验证Logistic多因素回归分析结果对预测NSCLC患者发生脑转移的价值,将具有统计学意义的因素(年龄、肿瘤直径、病理类型、EGFR和PIK3CA基因状态)进行分析,得出脑转移概率预测模型公式:Logit(P)=-5.205+1.312×年龄+2.377×肿瘤直径+2.338×腺癌+1.443×EGFR基因突变+1.626×PIK3CA基因突变,通过此模型可得到每例患者发生脑转移的预测概率,AUC为0.839(Plt;0.001,标准误=0.033,95%CI为0.774~0.903),表明该模型具有较好的诊断价值。当截断值(P值)≥0.302,其敏感度和特异度最大(分别为86.7%和77.3%)。因此,Logit(P)值≥0.302表示发生脑转移风险较高,见表3,图1。
3" "讨" " " 论
3.1" "NSCLC驱动基因特点及与临床病理特征相关性" "本研究中,142例NSCLC患者的脑转移率为31.7%,骨转移率为32.4%,与既往研究[10]一致。EGFR基因突变率为39.4%,符合30%~60%的范围[11],19号和21号外显子突变占73.2%。TP53基因突变率为31.7%,可能因鳞癌患者比例较少而与国外研究[12]不同。KRAS基因突变率为16.2%,与亚洲人群的研究相近。本文45.1%的患者出现基因共突变,其中EGFR与TP53共突变率高达71.4%。
研究[13]表明,EGFR、TP53和KRAS基因突变频率位列前三。EGFR突变更常见于女性、腺癌和不吸烟患者。EGFR突变与年龄无显著关联,淋巴结转移和颅外器官转移状态与EGFR突变相关。CEA增高也与EGFR突变相关。TP53突变与颅外器官转移相关,突变患者存活时间较短。KRAS突变在淋巴结N0~1患者中较常见,原发灶与转移灶的突变率存在差异[14],但均对辅助诊断具有重要价值。
3.2" "临床病理特征与脑转移" "本研究对性别、年龄、吸烟史、肿瘤直径等因素进行单因素分析,结果显示,年龄、肿瘤直径、病理类型、淋巴结和骨转移及驱动基因突变与NSCLC患者发生脑转移相关(Plt;0.05)。年龄≤66岁、肿瘤直径gt;3 cm及腺癌患者更易发生脑转移,且颅外器官转移和淋巴结N2~3状态也增加脑转移风险。此外,骨转移患者发生脑转移的风险更大,可能与肿瘤细胞的转移机制有关,涉及平行进展和线性级联[15]。本研究发现性别和吸烟史与脑转移无显著关联,血清CEA水平与脑转移的相关性尚不明确,尽管其他研究[16]提出了相关性。总体而言,本研究的临床病理特征及相关基因的突变分析对NSCLC患者脑转移的预测具有重要意义,未来需进一步深入研究相关影响因素。
3.3" "驱动基因与脑转移" "既往研究[17-18]表明驱动基因在NSCLC的诊断、治疗及预后的评估等方面发挥重要作用,本研究亦发现相关驱动基因突变可能作为NSCLC脑转移重要预测因素之一。结果显示EGFR、TP53、PIK3CA、BRAF、ERBB2、RET、SMAD4和RB1基因突变与NSCLC患者脑转移相关(Plt;0.005)。EGFR突变是脑转移的重要预测因素,尽管EGFR合并其他基因共突变与脑转移无明显关联[19]。TP53突变可能与脑转移风险有关,PIK3CA突变被视为高危因素,BRAF和ERBB2突变在脑转移患者中较为常见[20]。SMAD4和RB1突变也与脑转移相关[21]。虽然未发现ALK基因突变与脑转移的关联,但有其重要性。因此,NSCLC脑转移与多种基因突变相关,为未来临床研究提供了方向,建议增加样本量以深化研究并优化治疗方案。
综上所述,年龄、肿瘤直径、病理类型、淋巴结转移、骨转移及多种基因突变(如EGFR、PIK3CA、BRAF等)均为脑转移的高危因素;构建了预测脑转移的模型,并通过ROC曲线验证了其诊断价值,该模型可用于评估NSCLC患者发生脑转移的概率,为早期预防和治疗提供依据。
[参考文献]
[1]" "GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017: a systematic analysis for the global burden of disease study 2017[J]. Lancet, 2018, 392(10159):1736-1788.
[2]" "DAWE D E, GREENSPOON J N, ELLIS P M. Brain metastases in non-small-cell lung cancer[J]. Clin Lung Cancer, 2014, 15(4):249-257.
[3]" "TSAKONAS G, DE PETRIS L, EKMAN S. Management of brain metastasized non-small cell lung cancer(NSCLC)-from local treatment to new systemic therapies[J]. Cancer Treat Rev, 2017, 54:122-131.
[4]" "CHALUBINSKA-FENDLER J, KEPKA L. Prophylactic cranial irradiation in non-small cell lung cancer: evidence and future development[J]. J Thorac Dis, 2021, 13(5):3279-3288.
[5]" "CACHO-D?魱AZ B, CUAPAT?魪NCATL L D, RODR?魱GUEZ J A, et al. Identification of a high-risk group for brain metastases in non-small cell lung cancer patients[J]. J Neurooncol, 2021, 155(1):101-106.
[6]" "TAN L, WU Y Y, MA X W, et al. A comprehensive meta-analysis of association between EGFR mutation status and brain metastases in NSCLC[J]. Pathol Oncol Res, 2019, 25(2):791-799.
[7]" "文登虎, 刘杰, 章宏峰. 非小细胞肺癌脑转移分子诊断标志物的研究进展[J]. 临床与实验病理学杂志, 2021, 37(5):582-584.
[8]" "TRAVIS W D, BRAMBILLA E, BURKE A P, et al. Introduction to the 2015 World Health Organization classification of tumors of the lung, pleura, thymus, and heart[J]. J Thorac Oncol, 2015, 10(9):1240-1242.
[9]" "DETTERBECK F C, BOFFA D J, KIM A W, et al. The eighth edition lung cancer stage classification[J]. Chest, 2017, 151(1):193-203.
[10]" "SANTINI D, BARNI S, INTAGLIATA S, et al. Natural history of non-small-cell lung cancer with bone metastases[J]. Sci Rep, 2015, 5:18670.
[11]" "GIRARD N, SIMA C S, JACKMAN D M, et al. Nomogram to predict the presence of EGFR activating mutation in lung adenocarcinoma[J]. Eur Respir J, 2012, 39(2):366-372.
[12]" "Cancer Genome Atlas Research Network. Comprehensive genomic characterization of squamous cell lung cancers[J]. Nature, 2012, 489(7417):519-525.
[13]" "DIBARDINO D M, RAWSON D W, SAQI A, et al. Next-generation sequencing of non-small cell lung cancer using a customized, targeted sequencing panel: emphasis on small biopsy and cytology[J]. Cytojournal, 2017, 14:7.
[14]" "KOSAKA T, YATABE Y, ONOZATO R, et al. Prognostic implication of EGFR KRAS and TP53 gene mutations in a large cohort of Japanese patients with surgically treated lung adenocarcinoma[J]. J Thorac Oncol, 2009, 4(1):22-29.
[15]" "KLEIN C A. Parallel progression of primary tumours and metastases[J]. Nat Rev Cancer, 2009, 9(4):302-312.
[16]" "卢春青, 王盼, 韩晓蓓, 等. 非小细胞肺癌脑转移危险因素评估及意义[J]. 临床检验杂志, 2022, 40(2):141-146.
[17]" "孙百尔, 钱佳燕. MiR-124-3p调控的LAD1作为肺腺癌潜在治疗靶点的生物信息学分析[J]. 南通大学学报(医学版), 2023, 43(5):406-411.
[18]" "王立鹏, 李义慧, 李唯源, 等. 整合多芯片数据的肺癌诊断关键基因的发现与初步验证[J]. 南通大学学报(医学版), 2024, 44(4):307-312.
[19]" "JIANG T, SU C X, LI X F, et al. EGFR TKIs plus WBRT demonstrated no survival benefit other than that of TKIs alone in patients with NSCLC and EGFR mutation and brain metastases[J]. J Thorac Oncol, 2016, 11(10):1718-1728.
[20]" "李向玉. HER2基因突变非小细胞肺癌患者的临床病理特征及预后分析[D]. 郑州: 郑州大学, 2019.
[21]" "HUANG R S P, HARRIES L, DECKER B, et al. Clinicopathologic and genomic landscape of non-small cell lung cancer brain metastases[J]. Oncologist, 2022, 27(10):839-848.
[收稿日期] 2024-10-08
