低氧预处理hUCMSC-Exos通过抑制肺血管EndMT缓解低氧性肺动脉高压*
2024-01-17王玉香刘川川张晴晴马有刚王小波王亚婷
王玉香,刘川川,张晴晴,黄 攀,刘 红,马有刚,王小波,王亚婷,马 兰△
(1青海大学医学部,青海 西宁 810016;2青海大学附属医院包虫病实验室,青海 西宁 810001;3青海大学高原医学研究中心,青海 西宁 810001)
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是由于肺血管收缩和血管重构所致的肺动脉压力持续增高,导致右心肥厚甚至衰竭[1]。肺血管重构是HPH 发生发展的关键环节,表现为肺动脉平滑肌细胞过度增殖、肺动脉内皮细胞功能障碍和肺血管纤维化[2]。内皮细胞功能障碍是肺血管重构的关键因素[3]。内皮细胞发生不可逆增殖,失去其内皮表型转化为间充质样表型,即发生内皮-间充质转化(endothelial-mesenchymal transition,EndMT)。EndMT 可导致细胞外基质合成增多、降解减少,引起血管纤维化,促进HPH 的形成。阻断HPH 病理改变的多个环节,才能有效阻止或逆转疾病的进展,因此调节EndMT可能是一项新的治疗方式。
随着再生医学的发展,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)具有免疫原性低和多向分化能力等优势,展示出良好的治疗潜力。然而,有研究表明移植后的间充质干细胞(mesenchymal stem cells,MSCs)主要通过旁分泌起作用,其分泌的外泌体(exosomes,Exos)具有源细胞的生物学活性且易于存储[4],成为无细胞疗法的研究热点。Exos 是由MSCs 分泌的直径为30~200 nm 的具有双层脂质膜包裹的囊泡,可携带源细胞的蛋白质、DNA 和RNA 等而进行物质交换和信息传递[5]。hUCMSC-Exos 在组织修复、抗炎和免疫调节中发挥重要作用[6]。
有研究报道,经低氧预处理后hUCMSCs 活力增强,促进其Exos 的释放[7];且低氧预处理MSCs 释放的Exos 比常氧Exos 更能减少炎症细胞浸润[8]。目前,低氧预处理hUCMSC-Exos 对HPH 肺血管EndMT的作用尚不清楚。因此,本研究旨在探讨低氧预处理hUCMSC-Exos对HPH肺血管EndMT的影响。
材 料 和 方 法
1 实验动物与细胞
人脐带组织均来源于青海大学附属医院产科健康产妇的新生儿,经产妇和家属签订知情同意书后采集。本课题已通过青海大学医学院伦理委员会的批准(No. Y2022-99)。4~5 周龄SPF 级雄性Sprague-Dawley(SD)大鼠24 只,体质量125~150 g,购自北京维通利华实验动物技术有限公司(合格证号为No.110011230104604254)。人肺小动脉内皮细胞(human pulmonary arteriole endothelial cells,HPAECs)购自武汉普诺赛生命科技有限公司。
2 主要试剂和仪器
DMEM/F12 培养液和胎牛血清(fetal bovine serum,FBS)购自武汉普诺赛生命科技有限公司;ECM培养液和内皮细胞生长添加剂(endothelial cell growth supplement,ECGS)购自ScienCell;Matrix-GelTM基质胶购自碧云天生物技术有限公司;BCA 蛋白定量试剂盒和VE-cadherin 抗体购自Thermo Scientific;β-actin 抗体购自Abclonal;CD31、vimentin 和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体购自Abcam。JEM-1400FLASH 透射电镜购自JEOL;LSM880共聚焦显微镜和AxioVert. A1 倒置生物显微镜购自Zeiss;Amersham Imager 600 超灵敏多功能成像仪购自GE。
3 实验方法
3.1 hUCMSCs 的分离和培养 无菌状态下收集长约6~8 cm 的脐带组织。在超净台中用无菌PBS溶液冲洗脐带残留血液4~5 次,并剔除脐动脉、静脉。分离华通胶并剪成3 mm×3 mm×3 mm 大小的块状,用组织块贴壁法将组织块贴在洁净的培养皿上,37 ℃培养箱中静置30 min 后加入含20% FBS 的DMEM/F12 培养液。每5 d 更换1 次培养液,待组织块周围爬出细胞且融合度达90%时,用0.125%胰蛋白酶消化成单个细胞并加入DMEM/F12 培养液重悬细胞于培养瓶中,取第2~6代细胞用于后续实验。
3.2 hUCMSCs 免疫表型及分化能力的鉴定 将第2 代hUCMSCs 用0.125%胰蛋白酶消化离心后加入CD34、CD45、CD29、CD90 和CD44 抗体孵育,用流式细胞仪检测以上表面标志物的表达。参考文献方法[7],成脂成骨诱导分化液培养21 d后用油红O和茜素红S染液检测hUCMSCs成脂和成骨分化能力。
3.3 hUCMSC-Exos 的提取、鉴定与共培养 待hUCMSCs 融合度达到80%时更换为无血清DMEM/F12 培养液,置于CO2培养箱(5% CO2+21% O2+74% N2)或三气培养箱(5% CO2+1% O2+94% N2)培养48 h后,收集常氧或低氧培养液。参考文献方法[9]用超滤法提取hUCMSC-Exos。取10 μL hUCMSC-Exos 滴加于2 mm 的铜网上,室温孵育1 min 后用3%醋酸双氧铀孵染3 min,室温晾干后在透射电镜下观察并拍照。采用纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)技术检测hUCMSC-Exos 粒径;采用Western blot法检测hUCMSC-Exos表面标志蛋白CD9、Alix 和Tsg101 表达水平。用PKH26 标记hUCMSCExos,与HPAECs 在37 ℃、5% CO2培养箱中共培养24 h,激光共聚焦显微镜下观察HPAECs对hUCMSCExos的摄取情况并拍照。
3.4 动物分组及模型的建立 用随机数字法将SD大鼠随机分为常氧(normaxia,N)组、低氧(hypoxia,H)组、低氧+常氧hUCMSC-Exos(H-NExo)组和低氧+低氧预处理hUCMSC-Exos(H-HExo)组,每组6 只。将N组大鼠置于常氧环境(21% O2),后3组大鼠置于模拟海拔5 000 m 的低压氧舱(10% O2),每组大鼠均可自由进食水。后3组大鼠在低氧第3、5、7、10和14天时经尾静脉分别注射200 μg 常氧hUCMSC-Exos、低氧预处理hUCMSC-Exos 或等体积PBS。21 d 后检测各组大鼠相关指标的变化。
3.5 实验动物相关指标检测
3.5.1 右心室收缩压(right ventricular systolic pressure,RVSP)检测 各组大鼠经3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后仰卧位固定,参考文献方法[10]分离大鼠右侧颈外静脉,将PE-50 导管经右侧颈外静脉缓慢插入大鼠右心室后得到稳定的波形,记录RVSP。
3.5.2 右心室肥厚指数(right ventricular hypertrophy index,RVHI)检测与肺动脉分离 大鼠颈椎脱臼后剪开胸腔取出心肺组织,分离心脏去除左右心耳,沿室间隔剪下右心室,吸干水分后分别称量右心室(right ventricle,RV)及左心室加室间隔(left ventricular plus septum,LV+S)的重量(weight,W),计算RVHI,RVHI=WRV/WLV+S。将新鲜肺组织取出用PBS冲洗残留血液,固定在泡沫板上并浸泡在预冷的PBS中,沿肺动脉主干向下逐级分离肺动脉。PBS洗净肺动脉残留血液后保存在-80 ℃用于后续实验。
3.5.3 肺组织病理学检测 取各组大鼠右下肺叶固定于4%多聚甲醛中,经梯度乙醇脱水、二甲苯透明、石蜡包埋后制成4 μm 切片。切片经HE 染色后在光学显微镜下观察肺血管病理改变,用Image-Pro Plus 6.0 软件计算分析血管壁面积占血管总面积的百分率(percentage of vascular wall area,WA%)和血管壁厚度占血管外径的百分率(percentage of vascular wall thickness,WT%)。
3.6 HPAECs 培养及分组 HPAECs 用含5% FBS和1% ECGS 的ECM 培养液,于37 ℃、5% CO2培养箱中培养。取第2~4 代细胞用于后续实验。HPAECs长至60%时,用无血清ECM 培养液饥饿处理12 h 后随机分为常氧对照(N-Con)组、低氧模型(H-Con)组、低氧+常氧hUCMSC-Exos(Hy-NExo)组和低氧+低氧预处理hUCMSC-Exos(Hy-HExo)组。N-Con 组细胞置于CO2培养箱(5% CO2+21% O2+74% N2),其余3组细胞置于三气培养箱(5% CO2+1% O2+94% N2)并加100 mg/L(此浓度源于之前的研究[12])常氧hUCMSCExos、低氧预处理hUCMSC-Exos 或等体积PBS,培养48 h进行后续实验[11]。
3.7 细胞相关指标检测
3.7.1 免疫荧光染色 用0.125%胰蛋白酶消化对数生长期HPAECs,接种2×104个细胞于共聚焦培养皿中。将各组干预后的细胞用4%多聚甲醛固定20 min,0.1% Triton X-100 室 温 通 透10 min 后 加 入CD31、VE-cadherin和α-SMA抗体(1:100)4 ℃孵育过夜。次日PBS 洗涤后加入Cy3 标记的山羊抗兔及FITC 标记的山羊抗小鼠荧光Ⅱ抗(1∶300)室温避光孵育1 h。PBS 洗涤后加入DAPI 室温避光染细胞核10 min。在激光共聚焦显微镜下观察并拍照,并用ImageJ软件计算荧光强度。
3.7.2 Transwell 实验 将各组HPAECs 消化离心后用无血清ECM培养液重悬,将1×104个细胞接种于Transwell 上室,下室中加入600 μL ECM 培养液。培养12 h后弃去上室和下室培养液,加入4%多聚甲醛室温固定20 min。用1%结晶紫室温染色20 min,PBS 洗涤后在显微镜下观察并拍照,用ImageJ 软件分析细胞迁移数。
3.7.3 小管形成实验 基质胶用ECM 培养液按1∶3 稀释后取100 μL 加入48 孔板将各组HPAECs 消化离心后用无血清ECM培养液重悬,按每孔1×104个细胞接种于铺有基质胶的48 孔板,置于37 ℃、5% CO2培养箱孵育6 h。显微镜下拍照,用ImageJ 软件分析小管总分支长度。
3.8 Western blot 实验 将各组大鼠肺动脉和消化离心后的HPAECs 中加入RIPA 裂解液,研磨后于冰上静置15 min,4 ℃、13 200×g离心10 min 后取上清。BCA 蛋白定量法测定蛋白浓度,加入5× Loading Buffer 并调整为等浓度等体积的蛋白样品后99 ℃煮10 min;将蛋白样品在10% SDS-PAGE 凝胶上电泳;再将凝胶上的蛋白转移至PVDF 膜;5%脱脂奶粉室温封闭1 h;加入CD31、VE-cadherin、α-SMA 和vimentin抗体(1∶1 000)4 ℃孵育过夜;TBST 洗涤后加入辣根过氧化物酶标记的Ⅱ抗(1∶5 000)孵育1 h;用ECL超敏发光液在超灵敏多功能成像仪下对蛋白条带显影;用ImageJ软件分析条带灰度值。
4 统计学处理
采用GraphPad Prism 7.0 软件进行分析。数据均以均数±标准差(mean±SD)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 hUCMSCs形态及鉴定
组织块贴壁法培养脐带组织14~21 d后,镜下观察到组织块周围有大量成纤维细胞样细胞爬出(图1A);经传代后细胞呈长梭形,旋涡状生长(图1B)。茜素红S和油红O染色结果显示,成骨和成脂诱导分化21 d后出现钙化和脂肪滴(图1C)。流式细胞术检测结果显示,hUCMSCs 高表达CD29、CD44 和CD90,不表达CD34和CD45(图1D)。
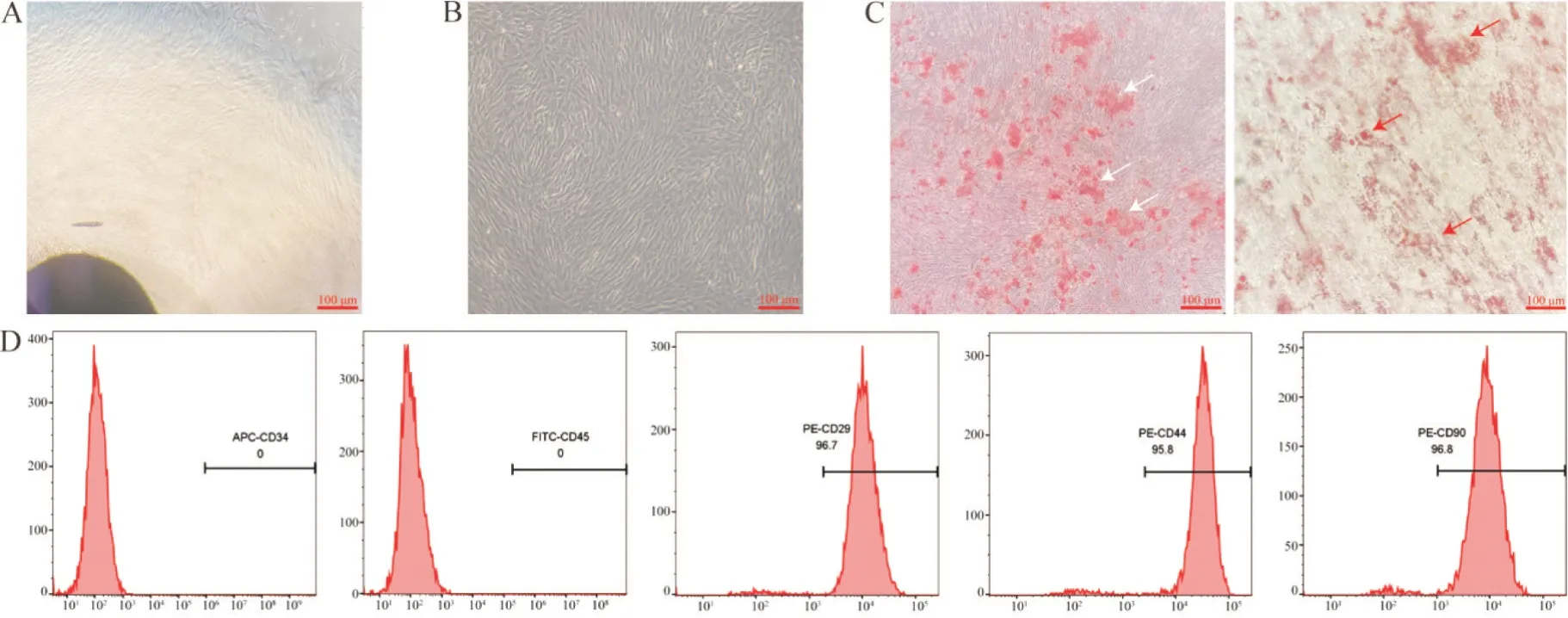
Figure 1. Morphology and characterization of hUCMSCs. A: spindle-shaped of cells growing from the tissue mass after 21 d of culture(scale bar=100 μm); B: representative image showing the fibroblast-like morphology of cultured hUCMSCs (scale bar=100 μm); C: differentiation potential of hUCMSCs observed by alizarin red S and oil red O staining (white arrows indicate the calcium mineralization,while red arrows indicate the fat drops; scale bar=100 μm); D: surface markers of hUCMSCs analyazed by flow cytometry (positive for CD29,CD44 and CD90,but negative for CD34 and CD45).图1 hUCMSCs形态及鉴定
2 hUCMSC-Exos形态及鉴定
透射电镜观察到hUCMSC-Exos 呈杯状、圆形囊泡状,外周可见双层膜结构,中央含低密度成分(图2A)。NTA 结果显示,hUCMSC-Exos 直径在30~200 nm 之间(图2B)。Western blot 结果显示,hUCMSCExos 表达CD9、Alix 和Tsg101,而hUCMSCs 不表达以上蛋白(图2C)。
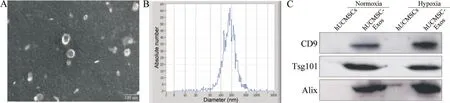
Figure 2. Morphology and characterization of hUCMSC-Exos. A: morphology of hUCMSC-Exos was assessed by transmission electron microscopy (scale bar=100 nm); B: particle size of hUCMSC-Exos was assessed by nanoparticle tracking analysis; C: the expression of CD9,Tsg101 and Alix was detected by Western blot.图2 hUCMSC-Exos形态及鉴定
3 HPAECs摄取hUCMSC-Exos情况
经激光共聚焦显微镜观察hUCMSC-Exos 在HPAECs 中的归巢现象,结果显示PKH26 标记的hUCMSC-Exos可以被HPAECs成功摄取(图3)。
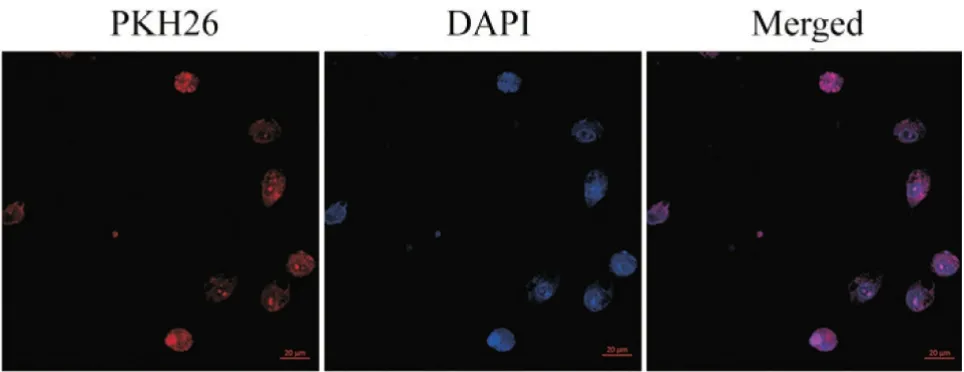
Figure 3. Uptake of hUCMSC-Exos by HPAECs was observed by immunofluorescence staining (scale bar=20 μm).图3 HPAECs摄取hUCMSC-Exos
4 低氧预处理hUCMSC-Exos 对大鼠RVSP 和RVHI的影响
与N 组相比,H 组大鼠RVSP 和RVHI 均显著升高(P<0.01);与H 组相比,H-NExo 组和H-HExo 组大鼠RVSP 均下降(P<0.01),且H-HExo 组比H-NExo组大鼠RVSP 下降更显著(P<0.01),常氧或低氧预处理hUCMSC-Exos 干预后大鼠RVHI 显著降低(P<0.05),但H-HExo 组与H-NExo 组间相比RVHI 无显著差异(P>0.05),见图4。
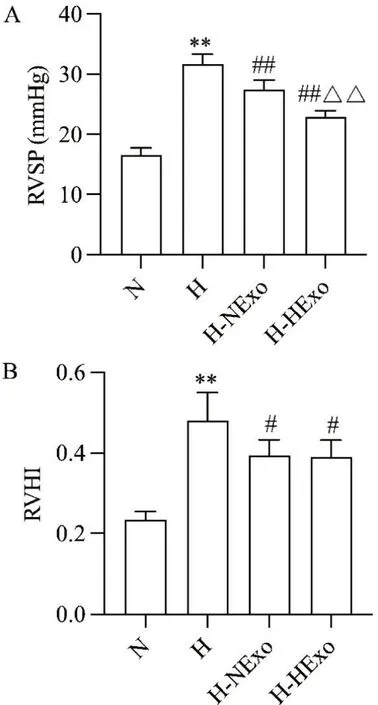
Figure 4. Effects of hypoxia-preconditioned hUCMSC-Exos (HExo)on right ventricular systolic pressure (RVSP; A) and right ventricular hypertrophy index (RVHI; B) of the rats. Mean±SD. n=6. **P<0.01 vs normoxia (N) group;#P<0.05,##P<0.01 vs hypoxia (H) group; △△P<0.01 vs hypoxia+normoxic hUCMSC-Exos (H-NExo) group.图4 低氧预处理hUCMSC-Exos 对大鼠RVSP 和RVHI 的影响
5 低氧预处理hUCMSC-Exos 对大鼠肺血管重构的影响
HE染色结果显示,与N组相比,H组大鼠肺血管管壁显著增厚,WA%和WT%显著升高(P<0.01);与H 组相比,加入常氧或低氧预处理hUCMSC-Exos 后WA%和WT%显著降低(P<0.01);与H-NExo 组相比,H-HExo 组WA%和WT%显著降低(P<0.01),见图5。

Figure 5. Effect of hypoxia-preconditioned hUCMSCs-Exos (HExo) on pulmonary vascular remodeling in rats. A: representative histopathological images of rat pulmonary vessels with HE staining (the upper scale bar=40 μm; the lower scale bar=20 μm);B: comparsion of percentage of vascular wall area (WA%) in each group; C: comparsion of percentage of vascular wall thickness (WT%) in each group. Mean±SD. n=6. **P<0.01 vs normoxia (N) group; ##P<0.01 vs hypoxia (H) group; △△P<0.01 vs hypoxia+normoxic hUCMSC-Exos (H-NExo) group.图5 低氧预处理hUCMSC-Exos对大鼠肺血管重构的影响
6 低氧预处理hUCMSC-Exos 对大鼠肺血管End-MT蛋白水平的影响
Western blot 结果显示,与N 组相比,H 组α-SMA和vimentin 表达水平显著升高,CD31 和VE-cadherin表达水平显著降低(P<0.05 或P<0.01);与H 组相比,H-NExo 组EndMT 相关蛋白水平无显著差异(P>0.05);与H-NExo 组相比,H-HExo 组CD31 和VEcadherin 表达水平显著升高,α-SMA 和vimentin 表达水平显著降低(P<0.05),见图6。
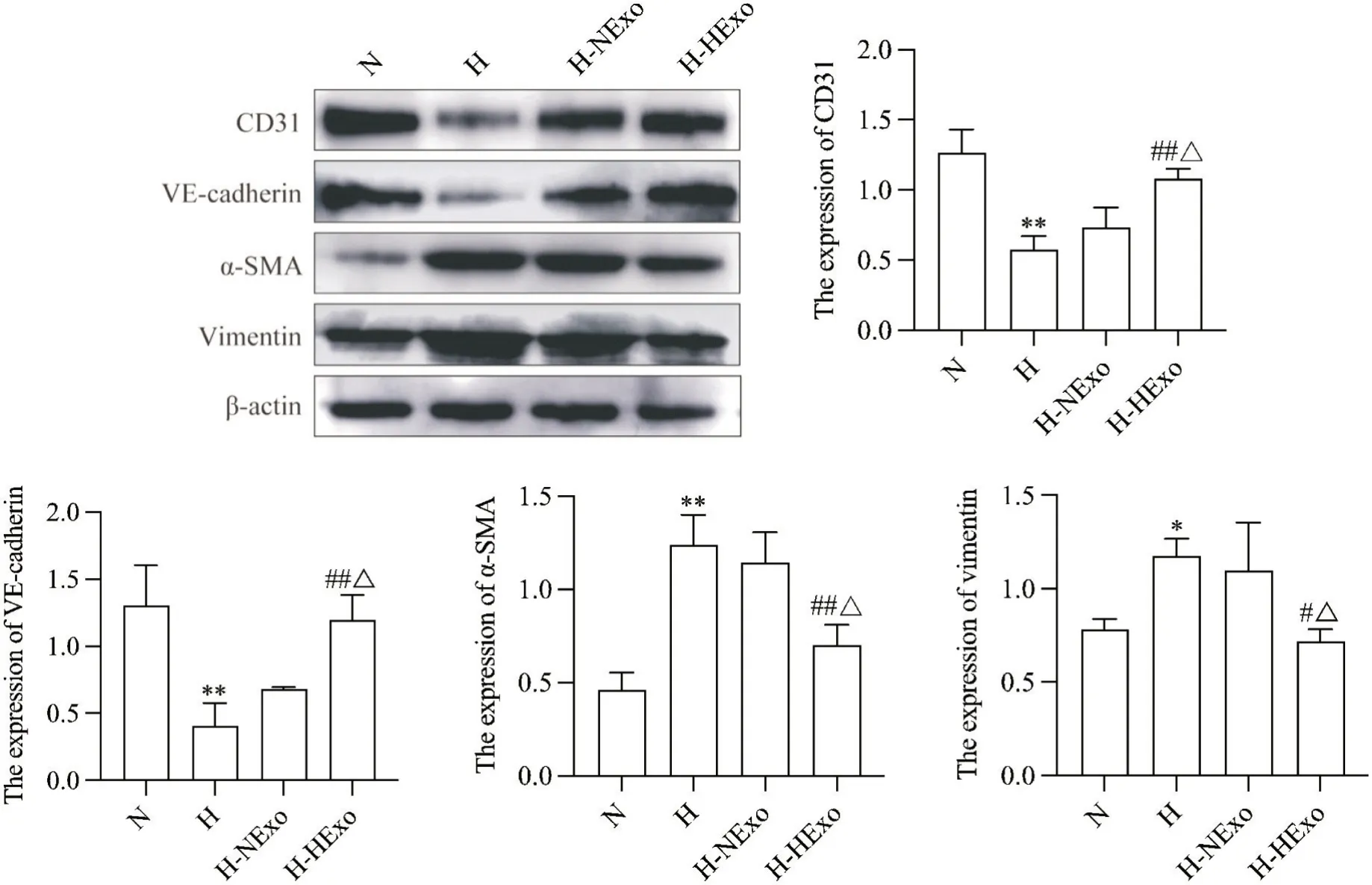
Figure 6. Effects of hypoxia-preconditioned hUCMSCs-Exos (HExo) on the protein expression levels of CD31,VE-cadherin,α-smooth muscle actin (α-SMA) and vimentin in rat pulmonary vessels were detected by Western blot. Mean±SD. n=3. *P<0.05,**P<0.01 vs normoxia (N) group; #P<0.05,##P<0.01 vs hypoxia (H) group; △P<0.05 vs hypoxia+normoxic hUCMSCExos (H-NExo) group.图6 低氧预处理hUCMSC-Exos对大鼠肺血管中CD31、VE-cadherin、α-SMA和vimentin蛋白表达水平的影响
7 HPAECs形态及鉴定
倒置显微镜下观察,HPAECs呈鹅卵石样生长,分布规则,见图7A。免疫荧光染色结果显示,HPAECs高表达CD31 和VE-cadherin,几乎不表达α-SMA,见图7B。
8 低氧预处理hUCMSC-Exos 对HPAECs 迁移的影响
Transwell 实验结果显示,与N-Con 组相比,HCon 组HPAECs 发生迁移,且迁移数显著增多(P<0.01);常氧或低氧预处理hUCMSC-Exos可显著抑制HPAECs 迁移(P<0.01);与Hy-NExo 组相比,Hy-HExo组细胞迁移数显著减少(P<0.05),见图8。
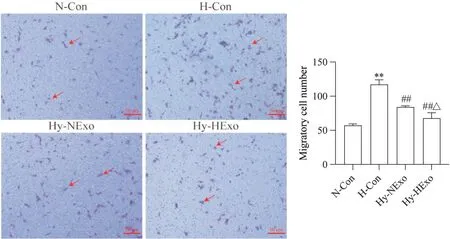
Figure 8. Effect of hypoxia-preconditioned hUCMSC-Exos (HExo) on migration ability of human pulmonary arteriole endothelial cells(HPAECs) was detected by Transwell assay (crystal violet staining,scale bar=50 μm). Red arrows indicate migratory cells. Mean±SD. n=3. **P<0.01 vs normoxic control(N-Con) group; ##P<0.01 vs hypoxic control(H-Con) group; △P<0.05 vs hypoxia+normoxic hUCMSC-Exos (Hy-NExo) group.图8 低氧预处理hUCMSC-Exos对HPAECs迁移能力的影响
9 低氧预处理hUCMSC-Exos 对HPAECs 小管形成的影响
小管形成实验结果显示,与N-Con 组相比,HCon 组HPAECs 小管形成能力增强,总分支长度显著增加(P<0.01);与H-Con 组相比,加入常氧或低氧预处理hUCMSC-Exos 后HPAECs 小管形成减少,总分支长度显著缩短(P<0.01),且Hy-HExo 组比Hy-NExo 组小管总分支长度显著缩短(P<0.05),见图9。
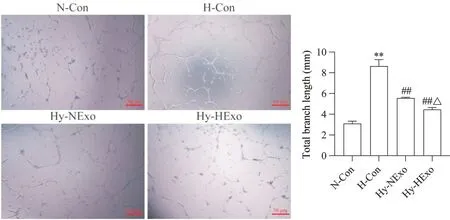
Figure 9. Effect of hypoxia-preconditioned hUCMSC-Exos(HExo) on tube formation of human pulmonary arteriole endothelial cells(HPAECs) was observed by Matrigel tube formation assay (scale bar=50 μm). Mean±SD. n=3. **P<0.01 vs normoxic control (N-Con) group; ##P<0.01 vs hypoxic control (H-Con) group; △P<0.05 vs hypoxia+normoxic hUCMSC-Exos (Hy-NExo) group.图9 低氧预处理hUCMSC-Exos对HPAECs小管形成的影响
10 低氧预处理hUCMSC-Exos对HPAECs中End-MT的影响
免疫荧光双染(图10)和Western blot(图11)结果显示,与N-Con 组相比,H-Con 组内皮细胞标志物CD31荧光强度显著减弱,间充质标志物α-SMA 荧光强度显著增强(P<0.01),内皮细胞标志物CD31 和VE-cadherin 蛋白表达水平显著降低(P<0.01),间充质标志物α-SMA 和vimentin 蛋白表达水平显著升高(P<0.01);与H-Con 组相比,Hy-NExo 组CD31 荧光强度显著增强,α-SMA荧光强度显著减弱(P<0.01),CD31 蛋白表达水平显著升高(P<0.01),VE-cadherin、α-SMA 和vimentin 蛋白表达水平无显著差异(P>0.05);与Hy-NExo 组相比,Hy-HExo 组CD31 荧光强度显著增强(P<0.05),α-SMA 荧光强度显著减弱(P<0.01),α-SMA(P<0.05)和vimentin(P<0.01)蛋白表达水平显著降低,CD31和VE-cadherin蛋白表达水平显著升高(P<0.05)。
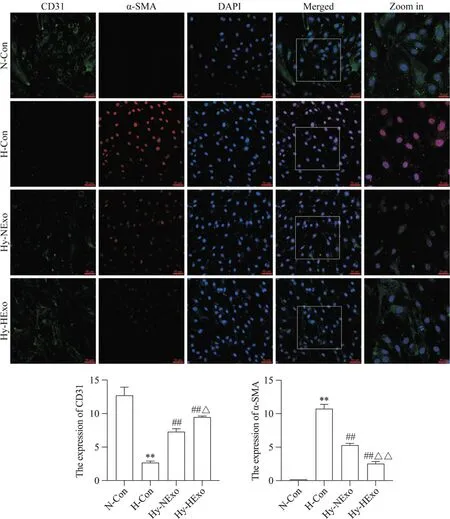
Figure 10. Effect of hypoxia-preconditioned hUCMSC-Exos (HExo) on endothelial-mesenchymal transition in human pulmonary arteriole endothelial cells (HPAECs). The expression of CD31 and α-smooth muscle actin (α-SMA) in HPAECs was observed by double immunofluorescence staining (green: CD31; red: α-SMA; blue: DAPI; scale bar=50 μm; zoom in:the Merged local magnification,scale bar=20 μm). Mean±SD. n=3. **P<0.01 vs normoxic control (N-Con) group; ##P<0.01 vs hypoxic control (H-Con) group; △P<0.05,△△P<0.01 vs hypoxia+normoxic hUCMSC-Exos (Hy-NExo) group.图10 低氧预处理hUCMSC-Exos对HPAECs内皮-间充质转化的影响
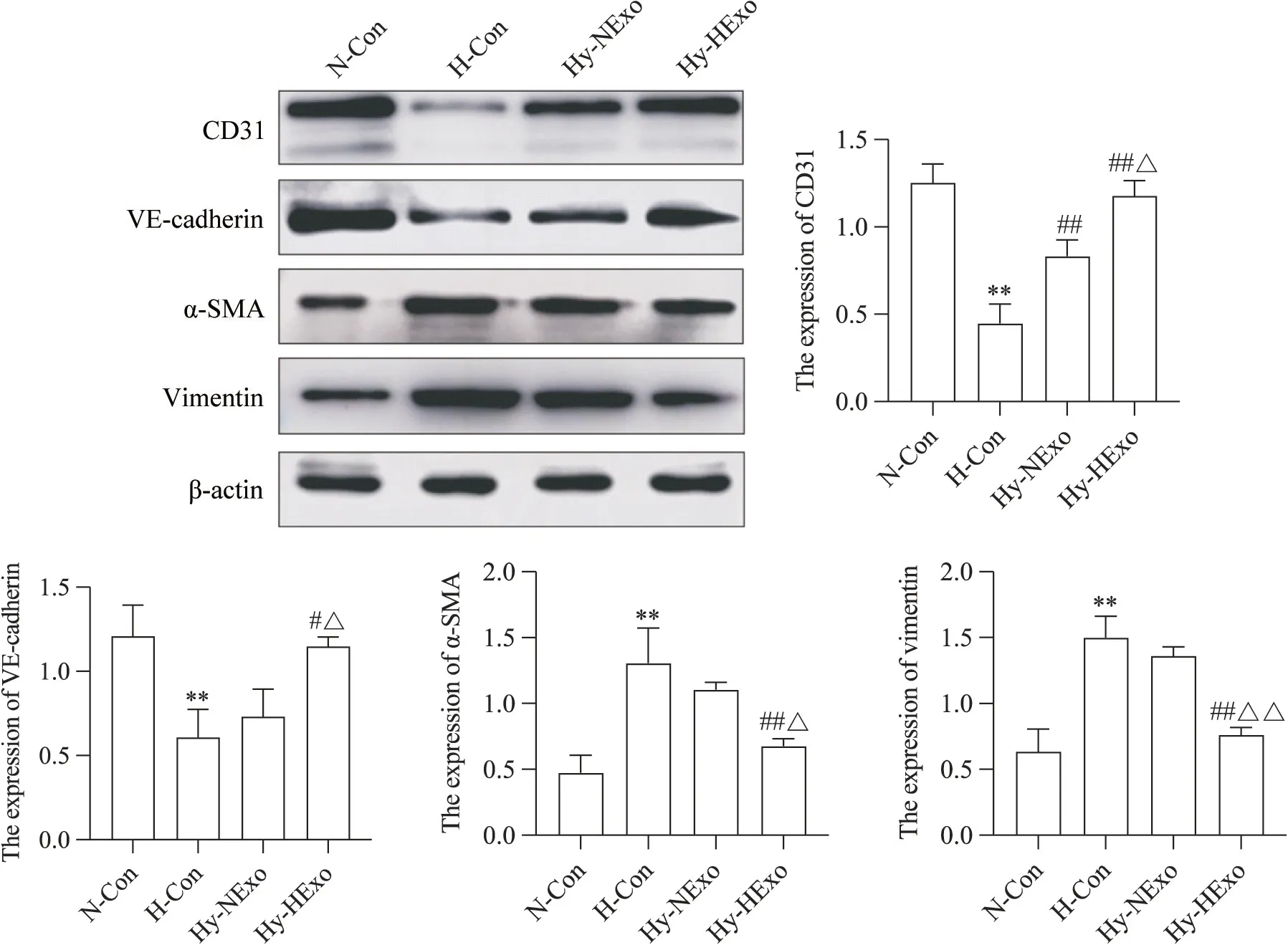
Figure 11. Effects of hypoxia-preconditioned hUCMSC-Exos (HExo) on the protein expression levels of CD31,VE-cadherin,α-smooth muscle actin (α-SMA) and vimentin in human pulmonary arteriole endothelial cells (HPAECs) were detected by Western blot. Mean±SD. n=3. **P<0.01 vs normoxic control (N-Con) group; #P<0.05,##P<0.01 vs hypoxic control (H-Con)group; △P<0.05,△△P<0.01 vs hypoxia+normoxic hUCMSC-Exos (Hy-NExo) group.图11 低氧预处理hUCMSC-Exos对HPAECs中CD31、VE-cadherin、α-SMA和vimentin蛋白表达水平的影响
讨 论
HPH 是一种以持续的肺血管阻力升高和肺血管重构为特征的进行性疾病[13]。脉血管阻力升高是肺动脉高压的特征,肺血管重构是肺动脉高压的病理标志[14]。尽管越来越多的证据表明药物治疗可以提高HPH 患者的生存率,但仍无法治愈。因此,迫切需要真正逆转HPH血管重塑的新策略。
hUCMSCs 由于具有易获取、较快的自我更新能力和较高的增殖能力等优点[15],被认为是再生医学中最具潜力的种子细胞之一。研究表明,移植后的MSCs 存在存活率及分化归巢率低等问题,而其可能是通过旁分泌Exos 来发挥作用[16]。Exos 是由MSCs通过胞吐作用释放的细胞外囊泡,具有与源细胞相似的功能,是细胞间通信、代谢和免疫调节的重要载体[17]。氧浓度在MSCs的自我更新、分化和旁分泌功能中发挥重要作用。细胞在体外培养时相对氧含量为21%,而大多数MSCs 存在于体内氧含量2%~8%的环境中[18],且低氧预处理MSCs来源的Exos更能减少炎症因子的表达,抑制炎症免疫反应[19]。因此,低氧预处理hUCMSC-Exos 可能是治疗HPH 的更好选择。
本研究中,首先成功分离出原代hUCMSCs,用流式细胞术鉴定hUCMSCs 免疫表型,通过成脂成骨诱导分化验证hUCMSCs 具有多向分化能力。通过超滤法成功提取hUCMSC-Exos,分别从动物和细胞水平验证低氧预处理hUCMSC-Exos对低氧诱导的肺血管和HPAECs 中EndMT 的影响。将大鼠于模拟海拔5 000 m的低压氧舱(10% O2)中饲养21 d,RVSP显著升高,右心室肥厚,肺动脉内侧壁增厚及管腔狭窄闭塞,提示HPH 大鼠模型建立成功;经低氧预处理hUCMSC-Exos 干预后可显著降低大鼠RVSP,缓解右心室肥厚程度,逆转肺血管重塑。以上结果提示低氧预处理hUCMSC-Exos 可缓解HPH,抑制肺血管重塑。
在HPH 发展过程中,HPAECs 发生EndMT 是肺血管重塑中关键的一个环节[20]。低氧可诱导多种细胞因子表达激活内皮细胞,通过EndMT 过程将其转化为间充质样细胞,导致内皮细胞功能障碍[21]。内皮细胞发生EndMT 时,内皮细胞标志物如CD31 和VE-cadherin 丢失,间充质样细胞标志物如α-SMA 和vimentin 表达增加,导致细胞连接松散向内膜下迁移,获得增殖和迁移的能力[22]。动物水平研究结果显示,HPH 大鼠模型中肺血管CD31 和VE-cadherin表达下降,α-SMA 和vimentin 表达增多,提示肺血管发生EndMT。在细胞水平上验证低氧(1% O2)可诱导HPAECs发生EndMT,同时HPAECs迁移和小管形成增加。低氧预处理hUCMSC-Exos干预后可部分上调肺血管和HPAECs中CD31和VE-cadherin 的表达,下调α-SMA 和vimentin 的表达,抑制内皮细胞发生EndMT,进而抑制肺血管重塑。
本研究结果表明,低氧预处理hUCMSC-Exos 可抑制肺血管发生EndMT,但其作用机制尚未证实,其可能与miRNA 调控有关。有研究表明低氧预处理hUCMSC-Exos 富集miR-126,可识别并结合HIF-1α启动子序列中的缺氧反应元件,调控HIF-1α 的表达[23]。也有文献报道,miR-146a-5p 在低氧预处理的MSCs的细胞外囊泡中含量相对丰富[24]。
综上所述,低氧预处理hUCMSC-Exos 可以通过抑制EndMT过程,保持肺血管内皮细胞的功能,进而减轻肺血管重塑。因此,低氧预处理hUCMSC-Exos可能是一种潜在治疗HPH 的方式,然而其作用机制还需进一步探索。
