褪黑素对小鼠抑郁样行为和BDNF-ERK-CREB信号通路的作用*
2024-01-17丁佳萌张冬先
严 赫,李 雄,丁佳萌,张冬先△
(1昆明医科大学法医学院,云南 昆明 650500;2国家卫健委毒品依赖和戒治重点实验室,云南 昆明 650500)
抑郁症是以持续心境低落为特征的精神障碍性疾病,患者常伴认知功能下降和生理功能紊乱,严重者会出现自杀倾向[1]。据2018 年世界卫生组织报道,抑郁症是最常见的致残原因之一,全球有超过3亿的患者[2]。在我国,抑郁症患者达到9 500 万人以上,且终生患病率为6.8%[3]。由于COVID-19的大流行,也导致世界范围内的抑郁症病例增加了25%以上[4]。因此迫切需要有效的临床治疗干预靶点,但抑郁症的发病机理尚不明确。
近年来研究认为,脑源性神经营养因子(brainderived neurotrophic factor,BDNF)在抑郁症的发病机制中发挥着重要作用[5]。BDNF 通过与其特异性受体——原肌球蛋白相关激酶B(tropomyosin-related kinase B,TrkB)结合,可启动下游的细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路,包括ERK1 和ERK2 两个部分[6]。磷酸化ERK1/2(phosphorylated ERK1/2,p-ERK1/2)参与信号传导并激活相关基因的转录,涉及调节神经元生长发育、突触可塑性和神经再生,并参与学习记忆和认知行为[7]。研究报道,抑郁患者前额叶皮层及海马中ERK 表达水平较低[8]。在小鼠抑郁症模型中,氟西汀(fluoxetine,FLX)和帕罗西汀等抗抑郁药可提高大脑p-ERK水平,并激活cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB)来缓解小鼠抑郁样行为[9]。在慢性应激中,大鼠海马和额叶组织中亦观察到CREB 表达降低[10],而脑区内降低p-CREB 水平可导致动物出现抑郁样行为[11]。因此,BDNF-ERK-CREB信号通路极有可能参与抑郁症的形成,但目前其作用尚未明确。
褪黑素(melatonin,MEL)是一种神经内分泌激素,因其具有强烈的抗炎、抗氧化作用而受到了诸多研究的关注[12]。据报道,MEL可以促进BDNF 表达[13],可能具有缓解抑郁的功效[14]。然而,目前尚无MEL 是否通过作用于BDNF-ERK-CREB 信号通路来缓解抑郁样行为的研究。
本研究拟采用慢性束缚应激(chronic restraint stress,CRS)来构建小鼠抑郁症模型,以FLX 作为阳性对照,MEL 作为干预药物,探讨MEL 对小鼠抑郁样行为的影响以及BDNF-ERK-CREB 信号通路在此过程中发挥的作用。
材 料 和 方 法
1 实验动物和试剂
本实验采用10~12 周龄SPF 级雄性C57BL/6J 小鼠(22~25 g)共48 只,购自湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2019-0004],饲养于昆明医科大学实验动物学部。饲养条件为昼夜12 h节律,室温(22±2) ℃,湿度(50±5)%,自由摄水摄食。实验经昆明医科大学动物实验伦理审查委员会审查批准(No. kmmu20221288)。
MEL(HY-B0075)和FLX(HY-B0102)均购自MedChemExpress;分析纯蔗糖(10021418)购自国药集团化学试剂有限公司;PCR 逆转录试剂盒(AG11705)和SYBR Green kit(AG11701)购自湖南艾科瑞生物工程有限公司;目的引物购自湖南擎科生物技术有限公司;尼氏染色试剂(G1430)购自北京索莱宝生物科技有限公司;c-Fos 抗体(ab222699)购自Abcam;BDNF 抗体(28205-1-AP)、p-ERK1/2 抗体(28733-1-AP)、CREB 抗体(12208-1-AP)和β-tubulin抗体(10068-1-AP)购自武汉三鹰生物技术有限公司。
2 主要方法
2.1 动物模型建立 根据以往研究报道[15],采用经典的CRS 法建立小鼠抑郁症模型。将48 只小鼠随机分为对照组(n=12)和CRS 组(n=36),再将CRS 组小鼠分为CRS+vehicle、CRS+FLX 和CRS+MEL 三个亚组(n=12)。CRS 组小鼠给予每天5 h、连续14 d 的CRS,即将小鼠置于圆形桶状透明聚乙烯器内限制自由活动,不影响正常呼吸。于第15 天进行行为学实验来确定模型构建是否成功。CRS组小鼠第16天至第29天继续进行CRS,参照预实验及文献结果[16],在每次刺激前30 min进行一次腹腔注射FLX(10 mg/kg)或MEL(10 mg/kg),CRS+vehicle 组小鼠则给予等体积的溶剂。14 d后再次进行行为学检测。随后24 h内处死小鼠,各组半数脑组织进行多聚甲醛固定用于尼氏染色和免疫荧光观察,其余半数脑组织用于RT-qPCR 和Western blot 等检测。行为学及药物干预流程见图1。
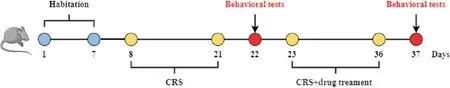
Figure 1. Chronic restraint stress (CRS) model construction and drug intervention process.图1 建立CRS抑郁症模型及药物干预时间轴
2.2 强迫游泳实验(forced swimming test,FST) 在长宽高各为40 cm的塑料容器内加入适量水,将小鼠放入水中,软件记录5 min内每只小鼠不动时间[1,5]。
2.3 悬尾实验(tail suspension test,TST) 将小鼠固定在悬尾箱内,头部正对摄像头,软件分析5 min中内小鼠不动时间[1,5,9]。
2.4 糖水偏好实验(sucrose preference test,SPT)实验第1 天给予每只小鼠1%蔗糖溶液,第2 天换为自来水,后禁水1 d,在第4天同时放置蔗糖溶液和自来水,第2 天后计算蔗糖溶液和自来水的消耗体积。糖水消耗率=蔗糖溶液消耗体积(mL)/蔗糖溶液消耗体积(mL)+自来水消耗体积(mL)[10]。
2.5 旷场实验(open-field test,OFT) 在第22 天和第37 天进行OFT。反应箱大小为40 cm×40 cm×35 cm,将小鼠置入旷场后,通过软件计算中央运动时间和距离[5,10-11]。
2.6 体重测量 适应性饲养7 d 后记录小鼠初次体重(g);经14 d 的CRS 后再次测量体重(g),计算体重增幅;在药物干预14 d后第3次测量小鼠体重(g),再次计算体重增幅。
2.7 RT-qPCR 根据试剂盒说明进行提取总RNA,逆转录及qPCR 实验。内参照为GAPDH,mRNA 相对表达水平用2-ΔΔCt法计算。引物序列见表1。
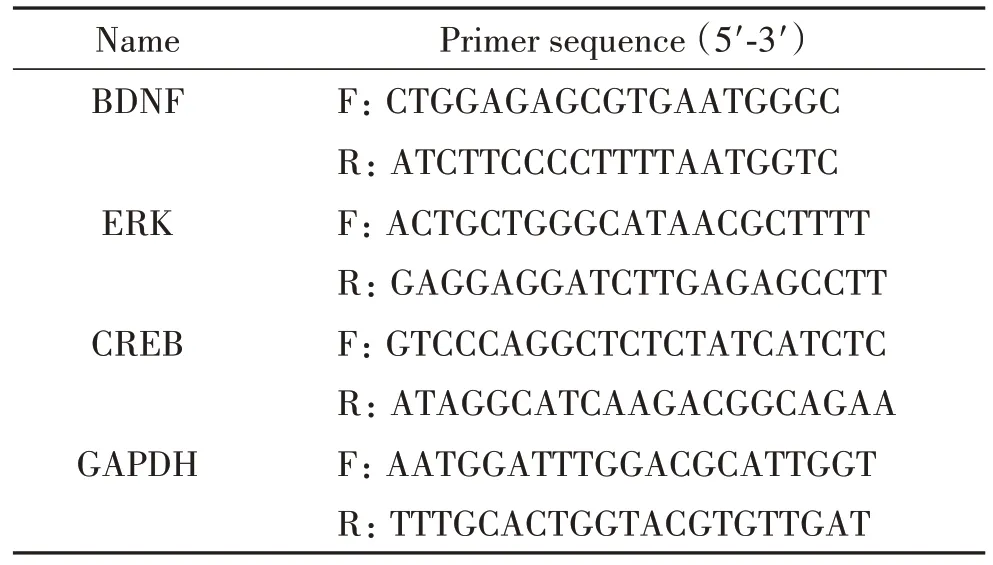
表1 引物序列Table 1. Primer sequence
2.8 Western blot 取小鼠额叶皮层和海马组织。提取定量蛋白后,4%~20% MOPS 凝胶电泳。将蛋白转至PVDF 膜。5%牛血清白蛋白于37 ℃封闭1 h。TBST 洗膜。加入BDNF 抗体(1∶1 000)、p-ERK 抗体(1∶1 000)、CREB 抗体(1∶1 000)和β-tubulin抗体(1∶5 000),4 ℃孵育过夜。TBST洗膜。加入相应的Ⅱ抗(1∶5 000)37 ℃孵育1 h 后显影。使用ImageJ 软件计算灰度值。
2.9 尼氏染色 根据试剂盒说明,将脑组织样本用4%多聚甲醛固定后脱水、石蜡包埋并切片,脱蜡、水化后使用尼氏染料染色;洗色、分化;中性树胶封片,显微镜下观察。
2.10 免疫荧光染色 制备脑组织冰冻切片,穿孔液穿孔30 分钟,PBS 漂洗。封闭液室温封闭2 h。c-Fos 抗体(1∶200)4 ℃孵育过夜。PBS 漂洗,加入相应的Ⅱ抗(1∶200)室温避光孵育1 h,PBS漂洗。抗荧光衰减封片剂封片,荧光显微镜观察。
3 统计学处理
用SPSS 26.0 统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。两组样本组间比较采用独立样本t检验,多组间比较采用单因素方差分析或两因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 CRS对小鼠体重增长和行为学的影响
经过14 d 的CRS 刺激,与对照组相比,CRS 组小鼠的体重增长显著降低(P<0.01),FST 和TST 的不动时间均显著延长(P<0.01),糖水消耗率显著降低(P<0.01),OFT 的中央停留时间和运动距离均显著缩短(P<0.01),见图2。
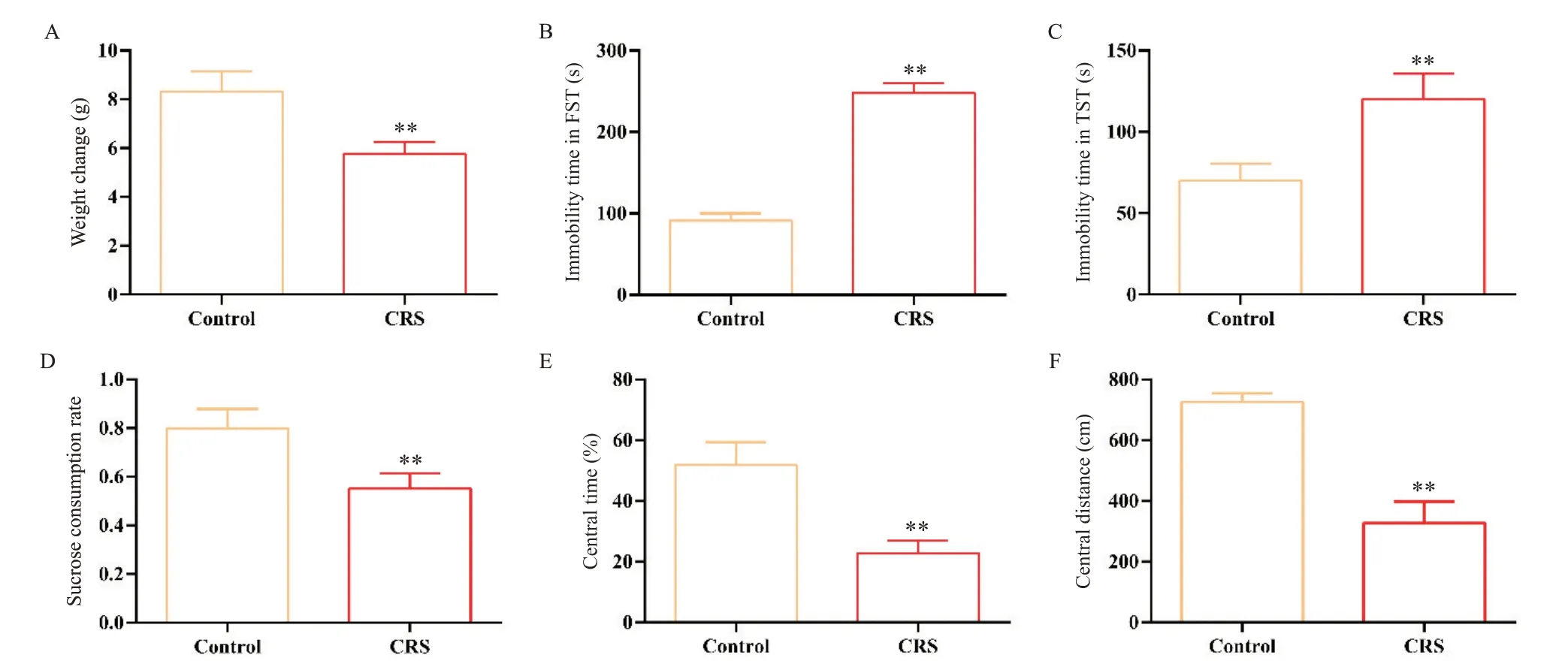
Figure 2. Effects of chronic restraint stress (CRS) on body weight and depression-like behaviors of the mice. A: the weight change;B: the immobility time in forced swimming test(FST); C: the immobility time in tail suspension test(TST); D: the sucrose consumption rate in sucrose preference test; E: the central time in open-field test (OFT); F: the central distance in OFT. Mean±SD. n=12. **P<0.01 vs control group.图2 CRS对小鼠体重及抑郁样行为的影响
2 MEL 和FLX 治疗对CRS 诱导的抑郁症小鼠体重和行为学的影响
CRS+vehicle 组小鼠的体重变化与对照组比较无显著差异;与CRS+vehicle 组比较,CRS+FLX 组和CRS+MEL 组小鼠的体重增长速率均显著增加(P<0.01);CRS+FLX 组 与CRS+MEL 组之间 无显著差异,见图3A。在FST 和TST 中,与对照组相比,CRS+vehicle组小鼠的不动时间均显著延长(P<0.01);经2周药物治疗后,与CRS+vehicle 组比较,CRS+FLX 组和CRS+MEL 组小鼠的不动时间均显著缩短(P<0.01);CRS+FLX 组 与CRS+MEL 组之间 无显著差异,见图3B、C。在SPT 中,与对照组相比,CRS+vehicle 组小鼠的糖水消耗率显著降低(P<0.01);经2周药物治疗后,与CRS+vehicle 组比较,CRS+FLX 组和CRS+MEL 组小鼠的糖水消耗率均显著增加(P<0.01);CRS+FLX 组 与CRS+MEL 组之间 无显著差异,见图3D。在OFT 中,与对照组相比,CRS+vehicle组小鼠的中央运动时间和距离均显著缩短(P<0.01);经2 周药物治疗后,与CRS+vehicle 组比较,CRS+FLX 组和CRS+MEL 组小鼠的中央运动时间和距离均显著增加(P<0.01);CRS+FLX 组与CRS+MEL组小鼠无显著差异,见图3E、F。

Figure 3. Effects of melatonin (MEL) and fluoxetine (FLX) on body weight and depression-like behaviors in chronic restraint stress(CRS) mice. A: the weight change; B: the immobility time in forced swimming test (FST); C: the immobility time in tail suspension test (TST); D: the sucrose consumption rate in sucrose preference test; E: the central time in open-field test(OFT); F: the central distance in OFT. Mean±SD. n=12. **P<0.01 vs control group; ##P<0.01 vs CRS+vehicle group.图3 褪黑素与氟西汀治疗对CRS小鼠体重及抑郁样行为的作用
3 MEL 和FLX 对CRS 小鼠额叶皮层和海马中BDNF-ERK-CREB信号通路的影响
RT-qPCR 结果显示,CRS+vehicle 组小鼠额叶皮层和海马中BDNF、ERK 和CREB 的mRNA 水平均显著下降(P<0.01);与CRS+vehicle 组比较,经2 周的药物治疗后,CRS+FLX 组和CRS+MEL 组小鼠额叶皮层和海马中BDNF、ERK 和CREB 的mRNA 水平均显著上升(P<0.01);CRS+FLX 组与CRS+MEL 组之间无显著差异,见图4。

Figure 4. Effects of melatonin (MEL) and fluoxetine (FLX) on the mRNA levels of brain-derived neurotrophic factor (BDNF),extracellular signal-regulated kinase (ERK) and cAMP response element-binding protein (CREB) in the frontal cortex (A) and hippocampus (B) of chronic restraint stress (CRS) mice. Mean±SD. n=6. **P<0.01 vs control group; ##P<0.01 vs CRS+vehicle group.图4 褪黑素和氟西汀对CRS小鼠额叶皮层和海马BDNF、ERK和CREB mRNA水平的影响
Western blot 结果显示,与对照组相比,CRS+vehicle 组小鼠额叶皮层和海马中BDNF、p-ERK1/2 和CREB 蛋白水平均显著下降(P<0.01);经2 周的药物治疗后,与CRS+vehicle 组对比,CRS+FLX 组和CRS+MEL 组小鼠额叶皮层和海马中BDNF、p-ERK1/2 和CREB 蛋白水平均显著上升(P<0.01);CRS+FLX 组与CRS+MEL组之间无显著差异,见图5。

Figure 5. Effects of melatonin (MEL) and fluoxetine (FLX) on the protein levels of brain-derived neurotrophic factor (BDNF),phosphorylated extracellular signal-regulated kinase 1/2 (p-ERK1/2) and cAMP response element-binding protein(CREB) in the frontal cortex (A) and hippocampus (B) of chronic restraint stress (CRS) mice. Mean±SD. n=6. **P<0.01 vs control group; ##P<0.01 vs CRS+vehicle group.图5 褪黑素与氟西汀对CRS小鼠额叶皮层和海马BDNF、p-ERK1/2和CREB蛋白水平的影响
4 MEL 和FLX 对CRS 小鼠额叶皮层和海马中神经元的影响
尼氏染色结果显示,对照组小鼠额叶皮层和海马CA1区神经元排列规则,尼氏小体数量丰富;与对照组相比,CRS+vehicle 组小鼠额叶皮层和海马CA1区部分神经元排列不规则,尼氏小体数量减少(P<0.01);与CRS+vehicle 组相比,CRS+FLX 组和CRS+MEL组小鼠额叶皮层和海马CA1区神经元形态显著改善,接近对照组正常神经元的形态(P<0.01);小鼠神经元形态在CRS+FLX 组与CRS+MEL 组之间无显著差异,见图6。
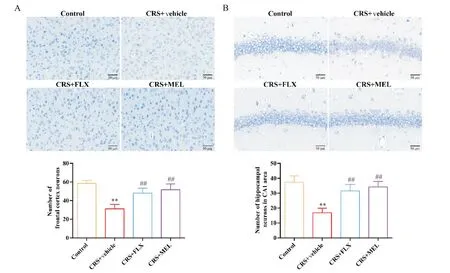
Figure 6. Effects of melatonin(MEL) and fluoxetine(FLX) on the morphological changes of neurons in the frontal cortex (A) and hippocampal CA1 region (B) of chronic restraint stress (CRS) mice (Nissl staining,scale bar=50 μm). Mean±SD. n=6.**P<0.01 vs control group; ##P<0.01 vs CRS+vehicle group.图6 褪黑素与氟西汀对CRS小鼠额叶皮层和海马神经元形态的影响
5 MEL 和FLX 对CRS 小鼠额叶皮层和海马中c-Fos表达的影响
免疫荧光染色结果显示,与对照组相比,CRS+vehicle 组小鼠额叶皮层和海马CA1 区中的c-Fos 阳性细胞数量均显著增加(P<0.01);经2 周的药物治疗后,与CRS+vehicle 组对比,CRS+FLX 组和CRS+MEL 组小鼠额叶皮层和海马CA1 区中的c-Fos 阳性细胞数量均显著下降(P<0.01);CRS+FLX 组与CRS+MEL组小鼠之间无显著差异,见图7。
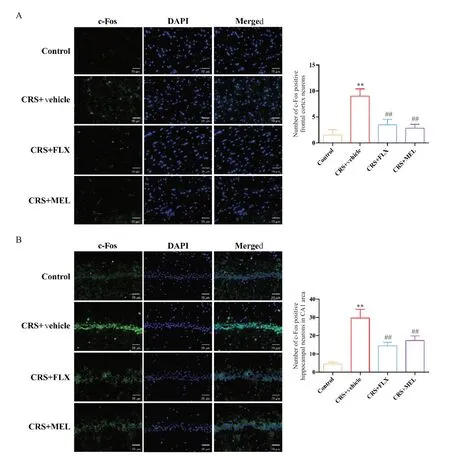
Figure 7. Effects of melatonin (MEL) and fluoxetine (FLX) on c-Fos expression in the frontal cortex (A) and hippocampal CA1 region (B) of chronic restraint stress (CRS) mice were detected by immunofluorescence staining (scale bar=50 μm). Mean±SD. n=6. **P<0.01 vs control group; ##P<0.01 vs CRS+vehicle group.图7 褪黑素与氟西汀对CRS小鼠额叶皮层和海马c-Fos表达的影响
讨 论
抑郁症目前缺乏有效的治疗手段,探究其发病机理并寻找特异性的药物干预靶点是亟待解决的重要公共卫生问题[17]。动物模型是进行发病机制探索和药物开发的重要辅助工具,而稳定的抑郁症模型构建是本研究的基础。在本实验中,采用对机体无损伤性刺激,且与人类身心性疾病的致病过程有形似性的CRS模型[18]。通过FST、TST、OFT和SPT等行为学检测证实成功诱导小鼠抑郁症模型。有研究表明,MEL 能够缓解药物脂多糖诱导的大鼠抑郁样行为[19]。而本研究证实,MEL 治疗增加了CRS 小鼠在FST和TST中的不动时间、在OFT中的中央运动时间和距离,以及糖水消耗率,表明MEL显著缓解了CRS小鼠的抑郁样行为。
BDNF 缺乏是抑郁发病的重要机制[16]。研究显示,BDNF 具有维持神经突触生长、分化和存活的神经生物功能[20]。在胞内BDNF 可与TrkB 结合并激活下游ERK 分子,从而促进CREB 磷酸化,CREB 作为细胞内与抑郁症相关信号通路中的一个交汇点,可进一步调节BDNF 的活性,并发挥神经保护作用[21]。在啮齿动物抑郁模型中,大脑海马和前额叶皮层中BDNF 水平显著降低[22]。有研究显示,长期外周BDNF给药可以促进小鼠海马中p-ERK和p-CREB的表达,并缓解小鼠的焦虑及抑郁症状[23]。在本研究中,CRS 小鼠的大脑海马和前额叶皮层中BDNF、ERK 和CREB 表达也均受到抑制,与已报道的慢性不可预见温和应激诱导的抑郁样小鼠模型具有一致的表现[22],而这种抑制同样可被MEL 治疗所逆转。因此,我们认为MEL 显著缓解抑郁样行为的机制可能涉及BDNF-ERK-CREB信号通路。
FLX 作为经典的抗抑郁药,可通过抑制5-羟色胺(5-hydroxytryptamine,5-HT)再摄取,增加大脑5-HT 的供给来缓解抑郁症状。研究认为,BDNF 是FLX发挥抗抑郁作用的重要靶点,通过增强BDNF的表达,其与TrkB 结合后,激活细胞内下游信号通路关键因子,如ERK、CREB等,可修复神经元损伤从而发挥抗抑郁作用[24]。而敲减小鼠海马BDNF表达可抑制FLX、阿戈美拉汀等抗抑郁药的药理作用[25];有报道称齐墩果酸也可依赖BDNF-ERK-CREB 信号通路来发挥抗抑郁作用[26]。本实验中使用FLX 作为阳性对照,结果显示FLX 治疗显著缓解了小鼠抑郁样行为,且BDNF-ERK-CREB 的分子表达也出现同MEL 一致的改变。该结果提示此信号通路可能是抑郁症发病以及抗抑郁药作用的共同分子机制,可为未来开发药物提供重要干预靶点。
海马和前额叶皮层具有调节情绪认知和工作记忆的功能,是抑郁症发病相关的重要脑区。影像学证据表明,抑郁症患者额叶皮层、海马等脑区萎缩显著,且伴有神经元变性[27]。此外,抑郁小鼠的额叶及海马脑区神经元排列紊乱,数量减少,细胞结构破坏[28]。我们的结果显示,CRS 小鼠额叶皮层和海马CA1 区的神经元排列欠规则,尼氏小体数量减少,而FLX 和MEL干预均减轻了CRS小鼠上述脑区的神经元损伤。c-Fos 是胞内信号通路传导的第三信使,生理性c-Fos 的表达可以促进神经细胞的再生与修复,而过度表达则会加重神经元的损伤,继而导致神经元死亡或凋亡发生[29]。研究显示,抑郁症动物模型中c-Fos 过度表达在与情感活动关系密切的额叶皮层及海马区[30]。已证实,FLX 可以通过激活单胺类神经递质的释放来下调c-Fos 蛋白的表达,从而减轻抑郁样行为[31]。本实验观察到,CRS 小鼠的c-Fos 阳性细胞表达显著增多,经MEL 治疗后,降低了c-Fos阳性细胞表达,提示MEL 的抗抑郁机制可能与降低额叶皮层及海马中神经元c-Fos 的表达有关,但具体的分子机制以及与BDNF-ERK-CREB 信号通路的关系有待进一步研究。
综上所述,MEL 通过激活额叶皮层和海马中的BDNF-ERK-CREB 信号通路,减轻神经元损伤,减少神经元内c-Fos 蛋白表达,从而缓解小鼠抑郁样行为(图8)。
本研究观察到MEL 抗抑郁样行为的作用,并提出了可能与BDNF-ERK-CREB 信号通路相关的机制,这一基础研究可能对揭示抑郁症的发病机制和促进有效临床药物靶点的开发具有重要意义。
