飞龙掌血通过调控大鼠M1/M2型小胶质细胞极化减轻脑缺血再灌注损伤*
2024-01-17高建红赵方毓何一多陈显兵
高建红,王 刚,杨 丹,赵方毓,何一多,陈显兵
(风湿性疾病发生与干预湖北省重点实验室,湖北省肾脏病临床医学研究中心,湖北民族大学医学部,湖北 恩施 445000)
缺血性脑卒中是一种急性脑血管疾病,其特征是大脑局部血流突然中断。现阶段,治疗缺血性脑卒中的方法主要包括溶栓和血栓清除,但治疗窗口较狭窄,脑血液循环的恢复会进一步导致脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI),加重神经功能的缺损[1-3]。小胶质细胞(microglia)是脑内巨噬细胞类型之一,是免疫系统的第一道防线,维持脑神经细胞的内环境稳态。机体损伤后,小胶质细胞被激活,M1 型小胶质细胞释放炎症因子,介导神经炎症的发生;而M2型小胶质细胞释放抑炎因子,减轻炎症反应。通过抑制M1型小胶质细胞和促进M2型小胶质细胞的极化,可以减轻炎症[4-5]。因此调控M1/M2型小胶质细胞的极化平衡对于减轻CIRI具有重要意义。
飞龙掌血(Toddaliaasiatica,TA)又名三百棒,为芸香科植物的根,是一种天然药物,也是具有地区的民族特色药。现代药理表明,TA 具有重要的拮抗炎症作用[6-7]。但是,TA 能否通过调控M1/M2型极化来减轻炎症反应,尚未得到系统的研究。因此,本研究通过制备大鼠CIRI模型,探究TA对小胶质细胞中M1/M2 表型极化的影响,深入探讨Toll 样受体介导的神经炎症,以期为TA 减轻CIRI 的作用机理提供依据。
材 料 和 方 法
1 实验动物
80 只2 月龄(体重约200~250 g)的SPF 级雄性SD 大鼠,饲养于清洁级动物房,保持相对湿度在55%、温度在24 ℃,由辽宁省实验动物中心提供,合格证号为SCXK(辽)2020-0001。
2 主要试剂与仪器
主要试剂:尼氏染色液、SDS-PAGE 快速配制试剂盒购自上海碧云天生物技术有限公司;免疫组化试剂盒购自福州迈新生物技术开发有限公司;TUNEL 细胞凋亡试剂盒购自武汉伊莱瑞特生物技术有限公司;Toll 样受体4(Toll-like receptor 4,TLR4)抗体、髓样分化因子88(myeloid differentiation factor 88,MyD88)抗体、核因子κB(nuclear factor-κB,NFκB) p65 抗体、p-NF-κB p65 抗体、NF-κB 抑制因子(NF-κB inhibitory factor,IκB)抗体、p-IκB 抗体、离子钙结合衔接分子1(ionized calcium-binding adapter molecule 1,Iba1)抗体、精氨酸酶1(arginase 1,Arg1)抗体和白细胞介素6(interleukin-6,IL-6)抗体购自上海Abmart 医药科技有限公司;IL-4 和IL-10 抗体购自武汉爱博泰克生物科技有限公司;β-actin 抗体购自武汉三鹰生物技术有限公司。
主要仪器:Tanon-5200 全自动化学发光成像系统购自上海天能科技有限公司、Western blot 电泳装置购自Bio-Rad。
3 主要方法
3.1 药物配制 TA 购自湖北民族大学附属民大医院中药房,经中药实验室专家鉴定为芸香科植物TA的干燥根茎。取飞龙掌血适量,打粉,70%乙醇超声提取,旋转蒸发仪浓缩药液并真空干燥,得TA 醇提物,称重计算收得率为15%,使用时配制成所需浓度。据记载TA 生药成人内服的剂量为:9~15 g/d,取剂量12 g/d。根据实验动物与人体体表面积比例进行计量换算,最终换算为TA 1.08 g·kg-1·d-1。盐酸多奈哌齐片的成人用量为5 mg/d,换算得大鼠剂量为0.45 mg·kg-1·d-1。
3.2 动物分组及造模 基于课题组前期研究[8]造模组选用线栓法行大脑中动脉栓塞术制备CIRI大鼠模型。具体操作:手术前所有大鼠禁食不禁水,麻醉,颈部备皮、消毒,逐层分离左侧皮肤、皮下组织、颈总动脉、颈外动脉和颈内动脉,结扎翼腭动脉。将鱼线栓(长为5 cm、直径为0.4 mm)插入颈总动脉,后经颈内动脉到达大脑中动脉前端。从颈内动脉、颈外动脉Y 型交叉口计算,保证插入18.5 mm。2 h后将线栓拔出,线栓头部到颈内动脉为宜。行为学评分1~3 分表明大鼠造模成功,随机分为模型(model)组、飞龙掌血(TA)组和盐酸多奈哌齐(donepezil,DON)组,并增设假手术(sham)组(仅分离血管),每组16 只。再灌注24 h 后,各组予以对应药物灌胃,分为两个时间段取材:(1)给药7 d,每组6 只大鼠,3只用于病理学观察,3只用于免疫组化检测;(2)给药14 d,每组10 只大鼠,3 只用于病理学观察,3 只用于免疫组化检测,4只用于蛋白含量测定。
3.3 动物一般情况观察 术后观察各组大鼠的基本情况。
3.4 大鼠神经功能评分 造模后,对1、3、7 和14 d的大鼠进行神经功能缺损评分。
3.5 HE、Nissl 和TUNEL 染色 分别给药7 和14 d后,各组随机取3 只大鼠。麻醉,依次进行生理盐水灌注、多聚甲醛灌注,取材后脑组织进行多聚甲醛24 h固定、脱水、石蜡包埋、4 μm 切片,分别进行HE、Nissl和TUNEL染色。
3.6 免疫组织化学法检测Iba1、Arg1 和TLR4 阳性细胞表达情况 分别给药7、14 d 后,各组随机取3只大鼠。麻醉,依次进行生理盐水灌注、多聚甲醛灌注,取材后脑组织进行多聚甲醛24 h 固定、脱水、包埋、4 μm 切片,烤片过夜,二甲苯、无水乙醇梯度脱蜡、水化。柠檬酸抗原修复20 min,PBS 清洗3 min、3次。根据试剂盒说明书,滴加试剂1 和试剂2,滴加I抗Iba1抗体、Arg1抗体、TLR4抗体(比例均为1∶300)静置1.5 h,PBS 清洗3 min、3 次,然后滴加试剂3 静置15 min,PBS 清洗3 min 3 次,滴加试剂4 静置20 min,滴加DAB 显色液避光静置3 min,纯水洗涤后苏木精复染1 min,纯水洗涤1 min,醋酸15 s,纯水洗涤1 min,碳酸锂15 s,纯水洗涤1 min,无水乙醇2 min,二甲苯透明化处理2 min,中性树胶固定。
3.7 Western blot 检测相关蛋白含量的表达 给药14 d 后,每组取4 只大鼠。麻醉,取海马置于-80 ℃冰箱备用;称取20 mg组织放入EP管中,加入200 μL裂解混合液,裂解液与PMSF 比例100∶1,依次进行剪碎、研磨、超声、裂解、离心、取上清液、配平每组蛋白,再依次配制凝胶、电泳、转膜、封闭,随后加入抗体TLR4、MyD88、p-NF-κB p65、IκB、p-IκB、IL-6、Arg1(比例均为1∶1 000),IL-4、IL-10、Iba1(比例均为1∶750),NF-κB p65(比例为1∶7 500),孵育Ⅰ抗过夜,孵育Ⅱ抗1 h,显影并计算灰度值。
4 统计学处理
利用SPSS 26.0 软件进行统计分析。正态性分布数据用均值±标准差(mean±SD)表示。组间均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 TA对CIRI大鼠一般情况的影响
术后大鼠左侧眼睑呈半张开状态,眼睑瘀血结痂,严重者左眼不睁,并伴有不同程度的肢体运动障碍,活动量减少,部分大鼠尾尖出现瘀血青紫甚至枯萎。
2 TA对CIRI大鼠神经功能评分影响
CIRI 术后1 d、3 d、 7 d 及14 d 的大鼠神经功能评分均较sham 组升高(P<0.01);与model组相比,给药后3 d、7 d、14 d TA 组及DON 组评分显著降低(P<0.01),见图1。
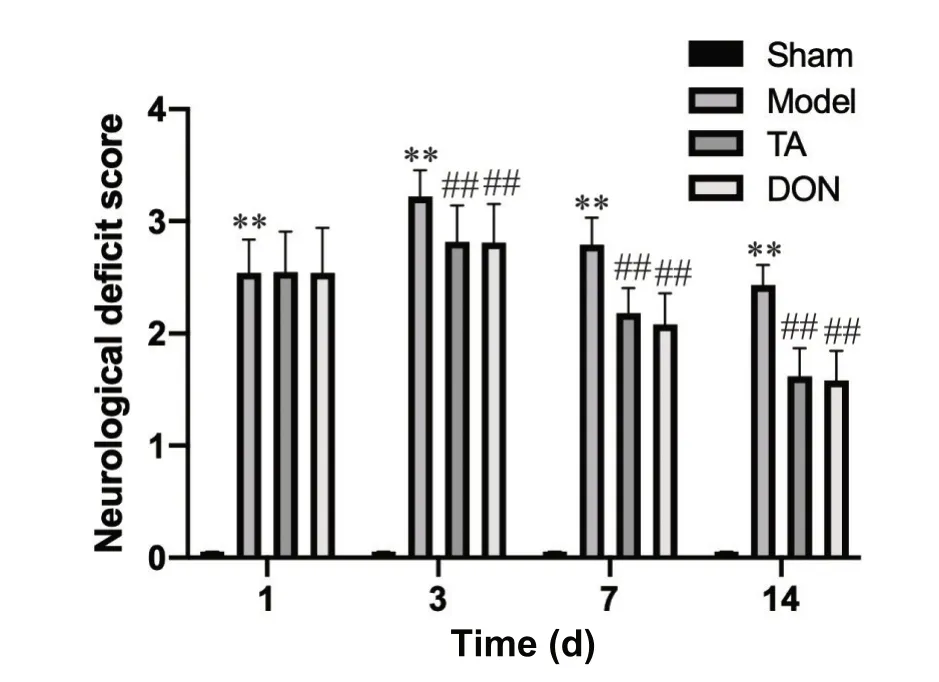
Figure 1. Comparison of neurological function scores of the rats in each group. Mean±SD. n=10. **P<0.01 vs sham group; ##P<0.01 vs model group.图1 各组大鼠神经功能评分
3 TA对CIRI大鼠形态学影响
分别给药7、14 d,与sham 组大鼠相比,model 组海马CA1 区和皮质区神经元数量显著减少,神经元和尼氏小体排列较松散紊乱,尼氏小体减少甚至溶解,细胞出现严重的核固缩、空泡化现象;与model组相比,TA 组及DON 组大鼠神经元增多,细胞排列的相对整齐紧密,空泡化及核固缩现象减轻,尼氏小体较多,见图2、3。
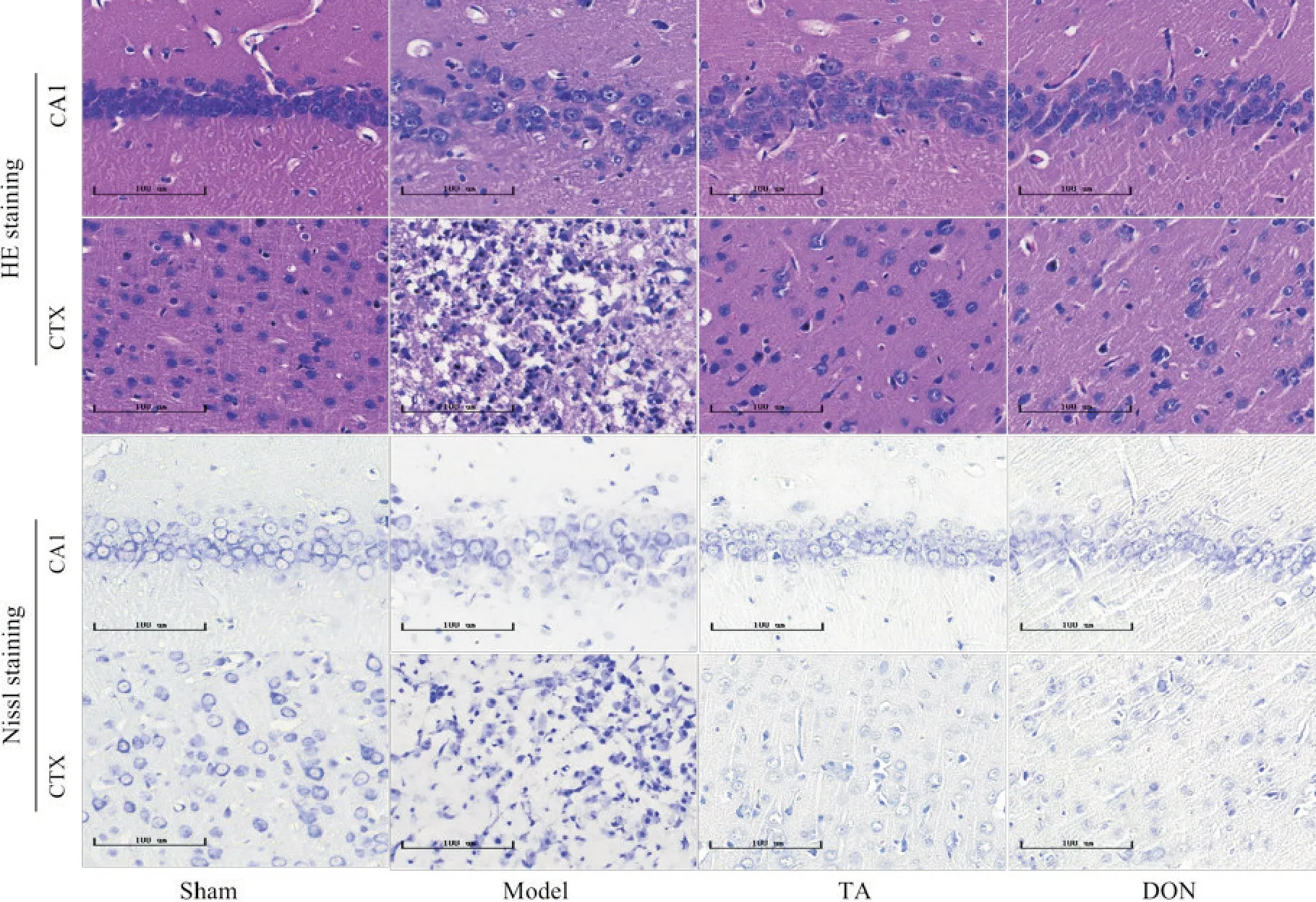
Figure 2. Pathological changes of the brain tissue of rats in each group at 7 d after CIRI (HE and Nissl staining,scale bar=100 μm).CA1: hippocampal CA1 region; CTX: cortex.图2 各组大鼠术后7 d脑组织病理变化
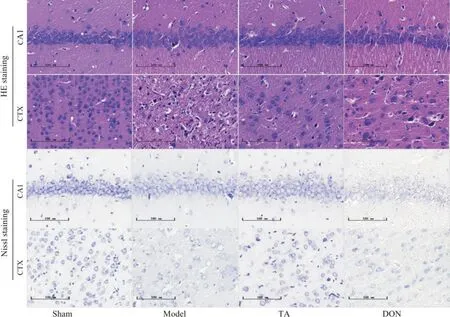
Figure 3. Pathological changes of the brain tissue of rats in each group at 14 d after CIRI (HE and Nissl staining,scale bar=100 μm). CA1: hippocampal CA1 region; CTX: cortex.图3 各组大鼠术后14 d脑组织病理变化
4 TA对CIRI大鼠神经元凋亡的影响
给药14 d,与sham 组大鼠相比,model 组的神经元凋亡增多(P<0.01);与model 组相比,TA 组及DON组大鼠神经元凋亡降低(P<0.05),见图4。
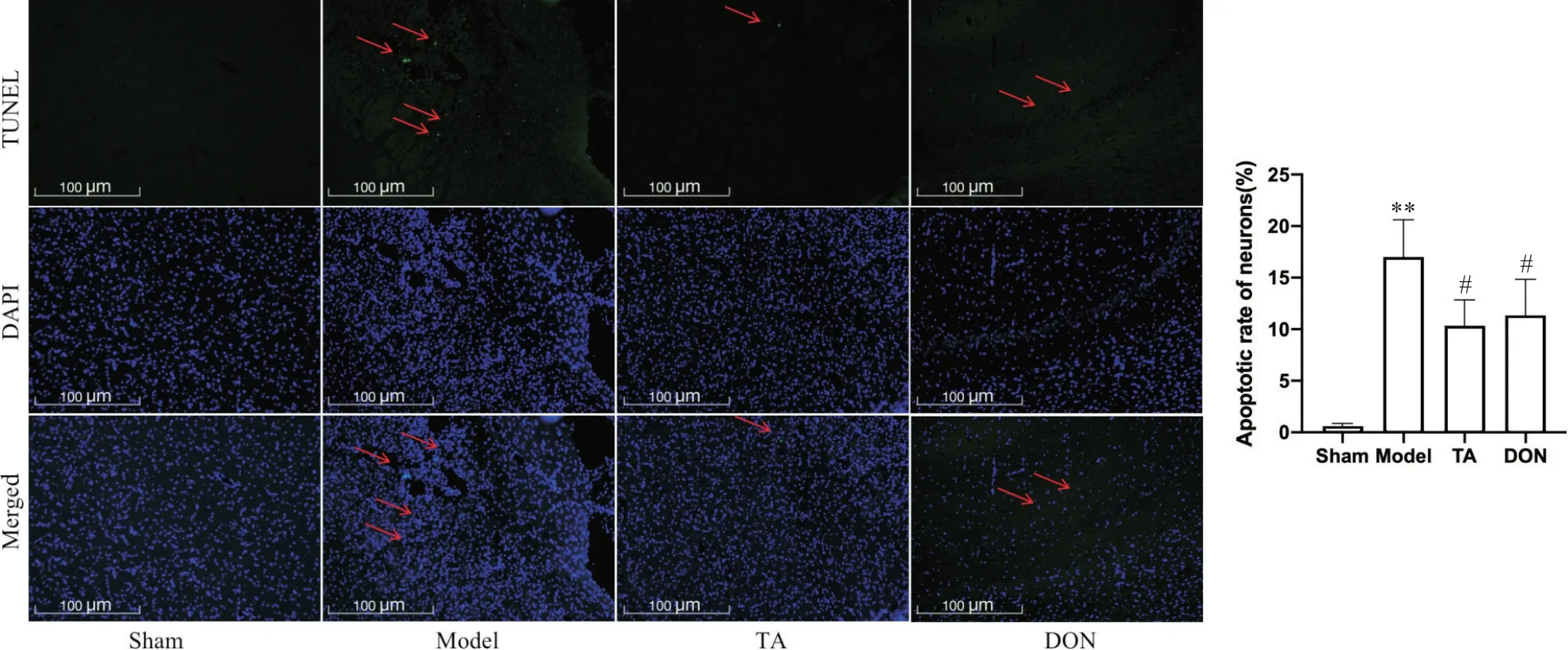
Figure 4. Neuronal apoptosis in rats of each group (TUNEL staining,scale bar=100 μm). Mean±SD. n=3. **P<0.01 vs sham group;#P<0.05 vs model group.图4 各组大鼠神经元凋亡情况
5 TA 对CIRI大鼠Iba1、Arg1和TLR4阳性表达的影响
5.1 TA 对M1 型小胶质细胞标志物Iba1 和M2 型小胶质细胞标志物Arg1 的影响 给药7、14 d,与sham组相比,model组大鼠Iba1阳性细胞在皮质区表达较为显著,胞体明显增大,突起回缩,呈现出阿米巴样;Arg1 阳性表达细胞数量增加。与model 组相比,TA组及DON 组大鼠Iba1 表达减少,胞体较小,突起较长;Arg1阳性细胞表达有所增加,见图5、6。
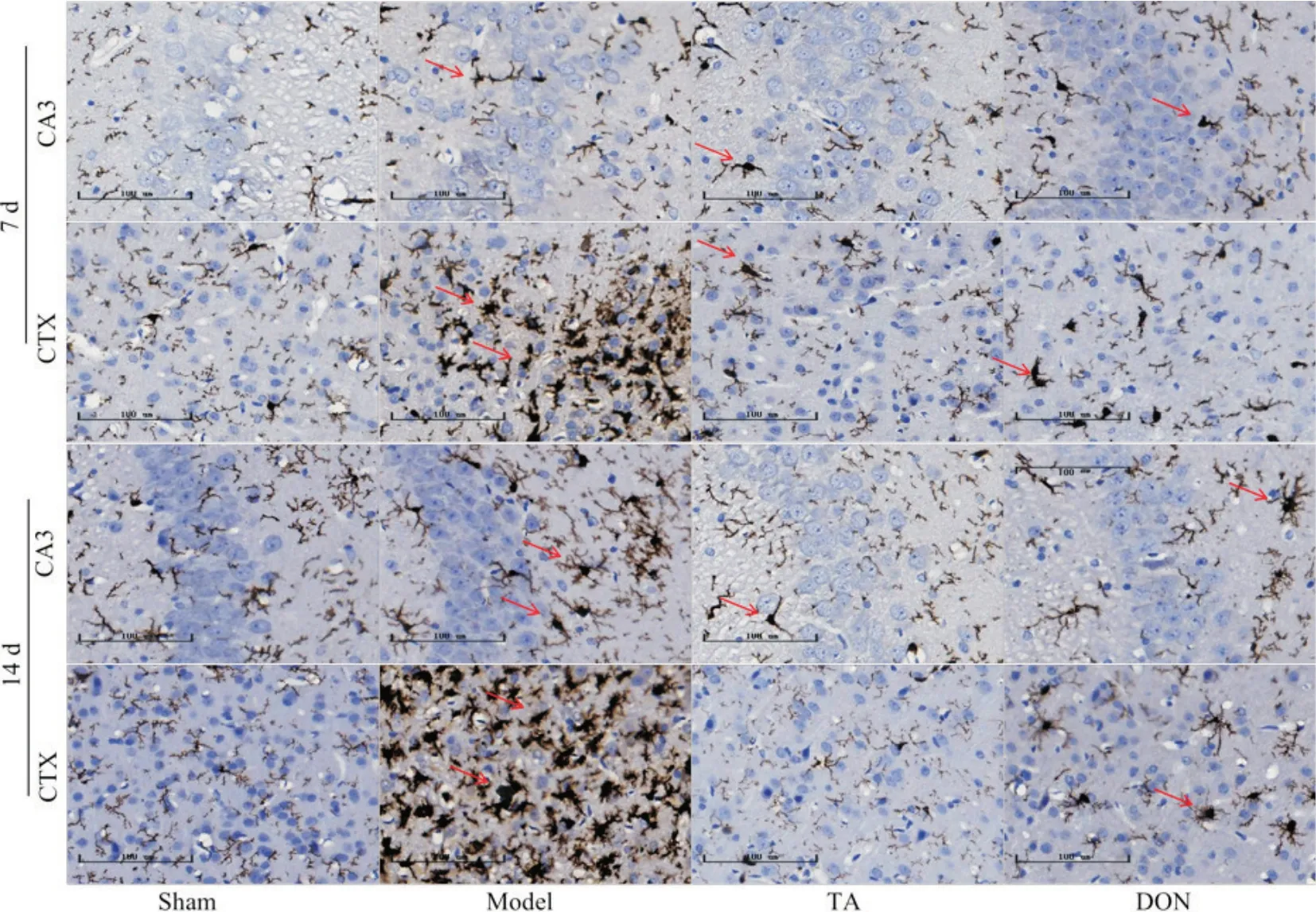
Figure 5. Localization and expression of Iba1 protein in the brain tissue of rats at 7 and 14 d after CIRI in each group (scale bar=100 μm). CA3: hippocampal CA3 region; CTX: cortex.图5 各组大鼠7、14 d脑组织Iba1蛋白定位表达
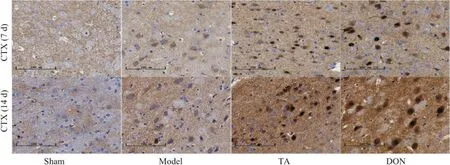
Figure 6. Localization and expression of Arg1 protein in the brain tissue of rats at 7 and 14 d after CIRI in each group (scale bar=100 μm). CTX: cortex.图6 各组大鼠脑组织Arg1蛋白定位表达
5.2 TA 对TLR4/MyD88/NF-κB 通路中TLR4 的阳性表达的影响 给药14 d,与sham 组相比,model 组大鼠TLR4 阳性细胞表达增加;与model 组相比,TA 组及DON组大鼠TLR4表达有所降低,见图7。
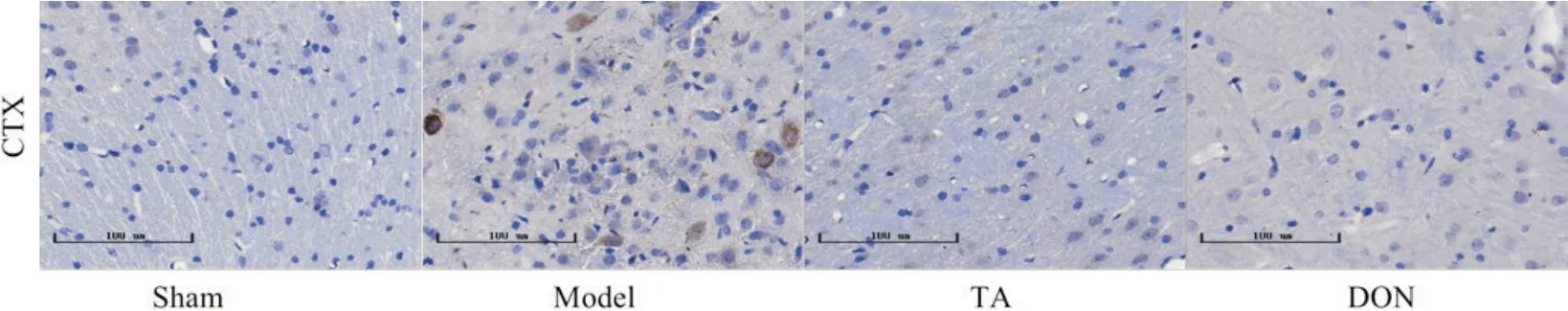
Figure 7. Localization and expression of TLR4 protein in the brain tissue of rats at 14 d after CIRI in each group (scale bar=100 μm). CTX: cortex.图7 各组大鼠14 d脑组织TLR4蛋白定位表达
6 Western blot法测定结果
6.1 TA 对CIRI 大鼠Iba1、Arg1、IL-6、IL-4 和IL-10蛋白表达的影响 与sham 组相比,model 组大鼠海马Iba1、IL-6 和Arg1 表达量升高(P<0.01),IL-4 和IL-10 表达量降低(P<0.05);与model 组相比,TA 组和DON 组Iba1 和IL-6 表达显著降低(P<0.01),Arg1、IL-4和IL-10蛋白表达升高(P<0.05),见图8。
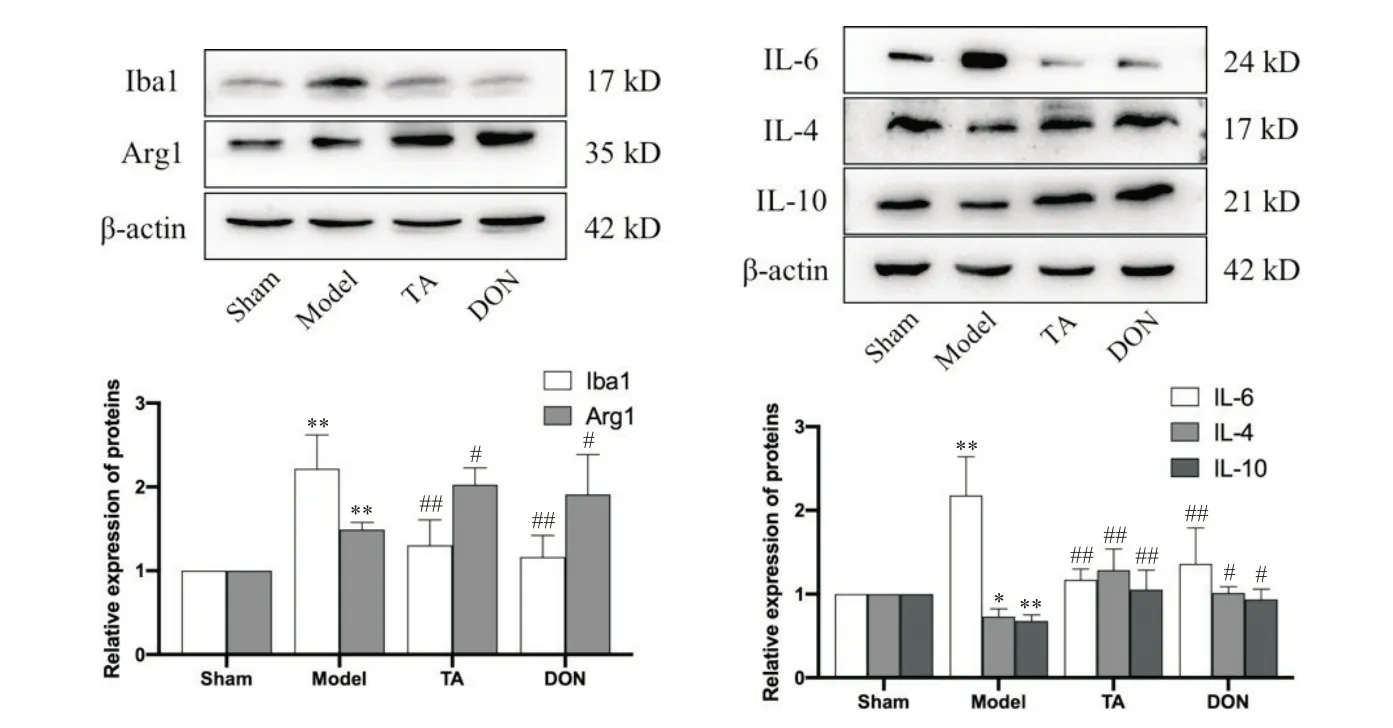
Figure 8. Protein expression in hippocampal tissue of rats in each group. Mean±SD. n=4. *P<0.05,**P<0.01 vs sham group; #P<0.05,##P<0.01 vs model group.图8 各组大鼠海马组织相关蛋白的表达
6.2 TA 对CIRI 大鼠TLR4/MyD88/NF-κB 通路相关蛋白表达的影响 与sham 组相比,model 组大鼠海马的TLR4、MyD88、NF-κB p65、p-NF-κB p65和p-IκB表达量增多(P<0.05);与model 组相比,TA 组和DON组各指标表达量降低(P<0.05),见图9。
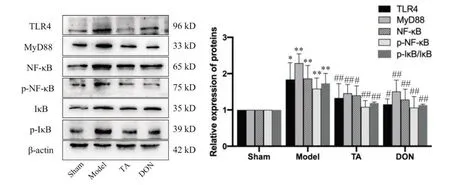
Figure 9. The levels of TLR4/MyD88/NF-κB pathway-related proteins in the hippocampal tissue of rats in each group. Mean±SD. n=4. *P<0.05,**P<0.01 vs sham group; #P<0.05,##P<0.01 vs model group.图9 各组大鼠海马组织TLR4/MyD88/NF-κB通路相关蛋白的表达
讨 论
小胶质细胞是中枢神经系统重要的免疫细胞,通常处于静态。小胶质细胞具有三个基本功能,参与并不断监测内环境变化,促进神经元的修复,以及必要的防御功能,从而为神经提供保护作用[9]。当有神经元损伤或其他损伤时,小胶质细胞将被激活,激活的小胶质细胞会成为一把双刃剑,具有鲜明表型变化的神经损害型M1 和神经保护型M2。M1 型将损害周围的健康神经组织,并且通过死亡或正在死亡的神经元反过来加剧M1型小胶质细胞的活化,引起神经元的渐进性丧失[10-11]。而M2型可以减少局部组织的损伤,并促进损伤区域的修复和再生。因此,促进M1型小胶质细胞到M2型的极化形式,已然成为一种新的治疗策略。研究表明调控小胶质细胞极化对于减轻脑缺血后神经元凋亡,促进神经发育和功能恢复至关重要[12]。本研究中CIRI大鼠细胞凋亡数量增多,神经功能评分降低,病理损伤严重,TA可有效缓解这一状态,说明TA 有明确的保护脑神经功能作用,具有抗凋亡功能。
为明确TA 对M1/M2型小胶质细胞极化的影响,我们进行了相关指标的检测。机体损伤后,M1 型小胶质细胞被激活,胞体变大,出现不规则突起,呈阿米巴状,并且释放TNF-α、IL-6等促炎细胞因子,参与神经炎症的发生发展,导致病情加重。Iba1 作为小胶质细胞的特异性标志物,可判断小胶质细胞的激活情况[13-15]。小胶质细胞的另一种状态M2 型,以Arg1 为标志物,产生IL-4 和IL-10 等抑炎因子,可促进组织的修复及再生,具有神经保护作用[16-17]。本研究中,CIRI 大鼠M1 型小胶质细胞被激活,炎症因子IL-6 表达升高,抑炎因子IL-4 和IL-10 表达降低;TA降低了炎症因子分泌,促进了抑炎因子释放,同时,抑制了M1型小胶质细胞,激活了M2型小胶质细胞。这提示TA对CIRI炎症损伤具有一定的治疗作用,可能是通过抑制促炎M1型,促进抗炎M2型极化,从而发挥抗炎作用。
在中枢神经系统中,Toll样受体是一类模式识别受体的重要成员,小胶质细胞是中枢神经系统中Toll样受体表达最丰富的细胞类型,其中TLR4具有特异性识别病原体分子的作用。TLR4 的激活可以通过MyD88 依赖和非依赖途径,磷酸化并降解IκB 蛋白,继而激活NF-κB 通路,增加炎症因子的表达,引起炎症反应,导致细胞凋亡[15,18-19]。有研究表明,降低小胶质细胞中TLR4 和MyD88 的表达可以有效抑制NF-κB 的激活,减轻炎症反应,并减少神经功能损伤[18]。本研究指标中,CIRI 大鼠TLR4、MyD88、NFκB p65、p-NF-κB p65 等蛋白含量显著升高,TA 显著降低了各项指标的表达。这提示TA 可能通过抑制TLR4/MyD88/NF-κB通路发挥抗炎作用。
综上所述,TA 对脑缺血再灌注大鼠具有神经保护作用,减少神经元的凋亡,降低炎症因子IL-6 的分泌,增强抑炎因子IL-4、IL-10 释放,其机制可能与调控M1/M2 型小胶质细胞、抑制TLR4/MyD88/NF-κB介导的炎性通路有关。
