紫云英苷诱导炎性痛小鼠前扣带回皮质星形胶质细胞自噬*
2024-01-17林佳泓王姝涵张润恒杨翠珠杨雅琪马宇昕
林佳泓,王姝涵,张润恒,杨翠珠,杨雅琪,周 畅,唐 佩,刘 靖,马宇昕
(广东药科大学基础医学院人体解剖与组织胚胎学系,广东 广州 510006)
炎症性疼痛是临床中常见的慢性疼痛类型,主要是由创伤、细菌或病毒感染及外科手术引起组织损伤所导致[1]。当组织发生炎症时,炎症介质和细胞因子的释放会刺激痛觉神经末梢,将疼痛信号通过背根神经传入脑干和大脑皮层[2]。前扣带回皮质(anterior cingulate cortex)作为大脑皮层的一部分,是胼胝体吻部周围高度连接的皮质区域[3],参与疼痛以及痛情绪信息的传导与调控,对痛觉处理至关重要[4]。
神经炎症激活是中枢敏化的一个重要特征,包括炎性介质产生增多和胶质细胞的活化[5]。活化的星形胶质细胞可以调节神经营养因子,炎性介质,趋化因子和神经递质的释放,介导疼痛的发生[6]。研究表明,自噬可通过调节炎症反应、抑制胶质细胞活化和调节细胞代谢等方式,从而对炎症性疼痛的产生和发展起调控作用[7-8]。因此,通过药物治疗增强自噬,抑制星形胶质细胞活化可能是疼痛治疗的有效措施。
紫云英苷(astragalin,AST),化学名为3,5,7,4'-四羟基黄酮-3-葡萄糖(kaempferol-3-O-β-D-glucoside),是多种传统中药的生物活性成分,具有抗炎、抗肿瘤、抗氧化、神经保护等药理特性,并具有修复受损DNA、营养心肌等作用[9]。
已有研究证实,AST 可下调P2X4 受体并抑制胶质细胞活化,进而缓解小鼠神经病理性疼痛[10],但对炎症性疼痛的影响及作用机制仍不清楚。因此,我们通过向小鼠踝关节腔内注射完全弗氏佐剂(complete Freund's adjuvant,CFA)构建经典的炎症性疼痛动物模型,借以观察AST 对CFA 小鼠前扣带回皮质自噬相关因子表达及对星形胶质细胞活化的影响,为进一步探讨AST 对炎症性疼痛的作用机制提供实验依据。
材 料 和 方 法
1 实验材料
1.1 实验动物 SPF 级雄性C57BL/6 小鼠,6 月龄,20~23 g,共24 只,均购自广州中医药大学实验动物中心,许可证号为SCXK(粤)2021-0059。所有动物均饲养于广东药科大学实验动物中心SPF 级屏障环境:12 h光照循环,饮水进食自由,室温(22±2) ℃,相对湿度(55±5)%。本实验所有动物实验操作经广东药科大学动物伦理委员会批准(批准使用号为:SPF2017591)。
1.2 主要试剂与仪器 紫云英苷(99.02%,wkq20032506)购于四川省维克奇生物科技有限公司;CFA 购于Sigma;GFAP 抗体(16825-1-AP)购于Proteintech;LC3 抗 体(ab51520)、p62 抗 体(ab91526)、beclin-1 抗体(ab217179)、ATG12 抗体(ab155589)、GAPDH 抗体(ab9485)、荧光兔Ⅱ抗(ab150077)、荧光小鼠Ⅱ抗(ab150116)和辣根过氧化物酶标记的兔Ⅱ抗(ab205718)均购于Abcam。von Frey 纤维丝套件购于Aesthesio;化学发光成像与分析系统Tanon-5200 购于上海天能科技有限公司;光学显微镜及成像系统AX-10购于ZEISS。
2 实验方法
2.1 构建炎症性疼痛模型 根据参考文献方法[11],小鼠经2%异氟烷麻醉,定位右侧腓骨外踝窝位置,用22 号针头插至胫腓骨与跗骨间的关节腔内,当有明显突破感时,注入10 μL CFA 构建炎症性疼痛模型。生理盐水(saline)组小鼠给予注射等量生理盐水。
2.2 实验分组及给药处理 将炎性痛模型小鼠随机分为CFA 模型组及60 mg/kg AST 给药组,并设置对照(control)组及saline组,每组各6只小鼠。
给药处理:根据已有研究[12]及本研究预实验结果,选取60 mg/kg AST 作为给药剂量,将AST 溶于10 ml/L DMSO溶液中制成60 mg/kg混悬液,给药组小鼠按体重给予腹腔注射60 mg/kg AST。确定炎性痛模型小鼠构建成功后进行给药,每日1 次,连续腹腔注射给药21 d,于给药结束后取材。
2.3 机械痛阈值测定实验 根据参考文献方法[13],安静环境里,将小鼠置于透明正方体玻璃箱中,底为1 cm × 1 cm 孔径的铁丝网,适应环境30 min 后,用von Frey 纤维触丝垂直剌激小鼠右侧后肢足底正中,持续时间≤6 s,小鼠出现舔足或者抬足等行为视为阳性反应。每次测试重复3 次,计算平均值。于造模前后及AST给药后1、3、5、7、14和21 d测定各组小鼠痛阈值。
2.4 免疫荧光多重染色 每组随机选取3 只小鼠进行免疫荧光染色。参考课题组前期实验方法[14],采用50 ml/L 戊巴比妥钠麻醉小鼠,断头取出大脑,置于多聚甲醛溶液固定48 h 后进行流水冲洗,梯度脱水、包埋、切片。选取完整的组织蜡块切片,常规脱水脱蜡后,将组织切片浸于0.1 mol/L 的柠檬酸盐缓冲液中进行抗原修复20 min,采用快速免疫封闭液37 ℃封闭20 min,去除封闭液后,分别滴加鼠抗GFAP(1∶500)和 兔抗LC3(1∶500)、兔抗p62(1∶200)、兔抗beclin-1(1∶200)、兔抗ATG12(1∶200),于4 ℃孵育过夜,复温20 min后用PBST溶液冲洗,每次5 min,冲洗3次,于组织上滴加山羊抗小鼠荧光Ⅱ抗(1∶300)和山羊抗兔荧光Ⅱ抗(1∶300),置于37 ℃烘箱中孵育2 h。PBST 冲洗后用DAPI 染液进行核染色,随后滴加防荧光淬灭剂,封片,最后用光学显微镜进行拍照并观察。
2.5 Western blot 每组随机选取3 只小鼠进行Western blot 检测。参考课题组前期实验方法[14],采用50 ml/L 戊巴比妥钠麻醉小鼠,断头取脑,于冰上快速分离大脑前扣带回皮质组织。根据组织质量,按照100∶1 加入RIPA 和PMSF 进行组织裂解,冰上研磨皮质组织,4 ℃离心取上清液,BCA 蛋白定量试剂盒进行各组蛋白浓度测定,制备蛋白样品。随后进行电泳、转膜、50 g/L 脱脂奶粉封闭2 h,封闭完成后分别孵育下述Ⅰ抗:兔抗LC3(1∶5 000)、兔抗p62(1∶3 000)、兔抗beclin-1(1∶3 000)、兔抗ATG12(1∶5 000),置于4 ℃孵育过夜。TBST清洗3次后再滴加山羊抗兔Ⅱ抗(1∶10 000)于摇床孵育2 h,TBST 冲洗。ECL 超敏发光液显影,ImageJ 软件进行蛋白灰度值测定。
3 统计学处理
所有数据均用GraphPad Prism 8.0 进行统计学分析。本实验结果均以均数±标准差(mean ±SD)表示,所有定量资料满足正态分布,且通过方差齐性检验后采用单因素方差分析(one way-ANOVA)。组间两两进行比较采用Turkey 法进行分析。P<0.05 认为差异具有统计学意义。
结 果
1 紫云英苷缓解CFA小鼠的炎症性疼痛
由机械痛阈值测定实验结果可知,各组小鼠基线疼痛阈值无显著性差异(P>0.05)。经CFA注射后1 d,与control 组和saline 组相比,CFA 小鼠患侧后爪机械痛阈值显著降低(P<0.01),证明炎性痛模型小鼠构建成功。确定模型构建成功后进行AST 给药,结果表明经60 mg/kg AST 给药处理后,CFA 小鼠机械痛阈值显著增加(P<0.05),见图1。
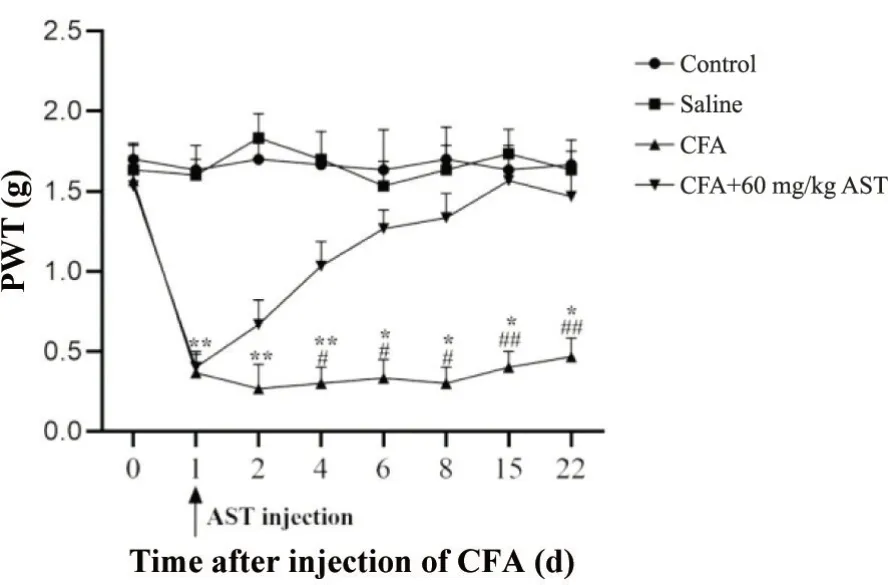
Figure 1. Astragalin (AST) increased the ipsilateral hind paw withdrawal threshold (PWT) of complete Freund's adjuvant (CFA)-treated mice. Mean±SD. n=6. *P<0.05,**P<0.01 vs control group; #P<0.05,##P<0.01 vs CFA+60 mg/kg AST group.图1 紫云英苷增加CFA小鼠患侧后爪机械缩足阈值
2 紫云英苷对CFA 小鼠前扣带回皮质内自噬相关因子表达及星形胶质细胞活化的影响
由免疫荧光染色结果可知,与control 组和saline组相比,CFA 组小鼠前扣带回皮质内LC3(P<0.01)、ATG12(P<0.01)和beclin-1(P<0.05)的平均荧光强度显著减弱,p62(P<0.01)平均荧光强度显著增强;而经60 mg/kg AST 给药处理后,CFA 小鼠前扣带回皮质内LC3(P<0.01)、ATG12(P<0.01)和beclin-1(P<0.05)的平均荧光强度显著增强,p62(P<0.05)平均荧光强度显著减弱。
此外,与control 组和saline 组相比,CFA 组小鼠前扣带回皮质内星形胶质细胞活化明显,平均荧光强度均显著增强(P<0.01),活化的星形胶质细胞胞体变大,突起增粗。经60 mg/kg AST 给药处理后,CFA 小鼠前扣带回皮质内星形胶质细胞平均荧光强度均显著减弱(P<0.05),且胞体变小,突起较细,激活的星形胶质细胞与自噬相关因子表达存在共定位,见图2~5。
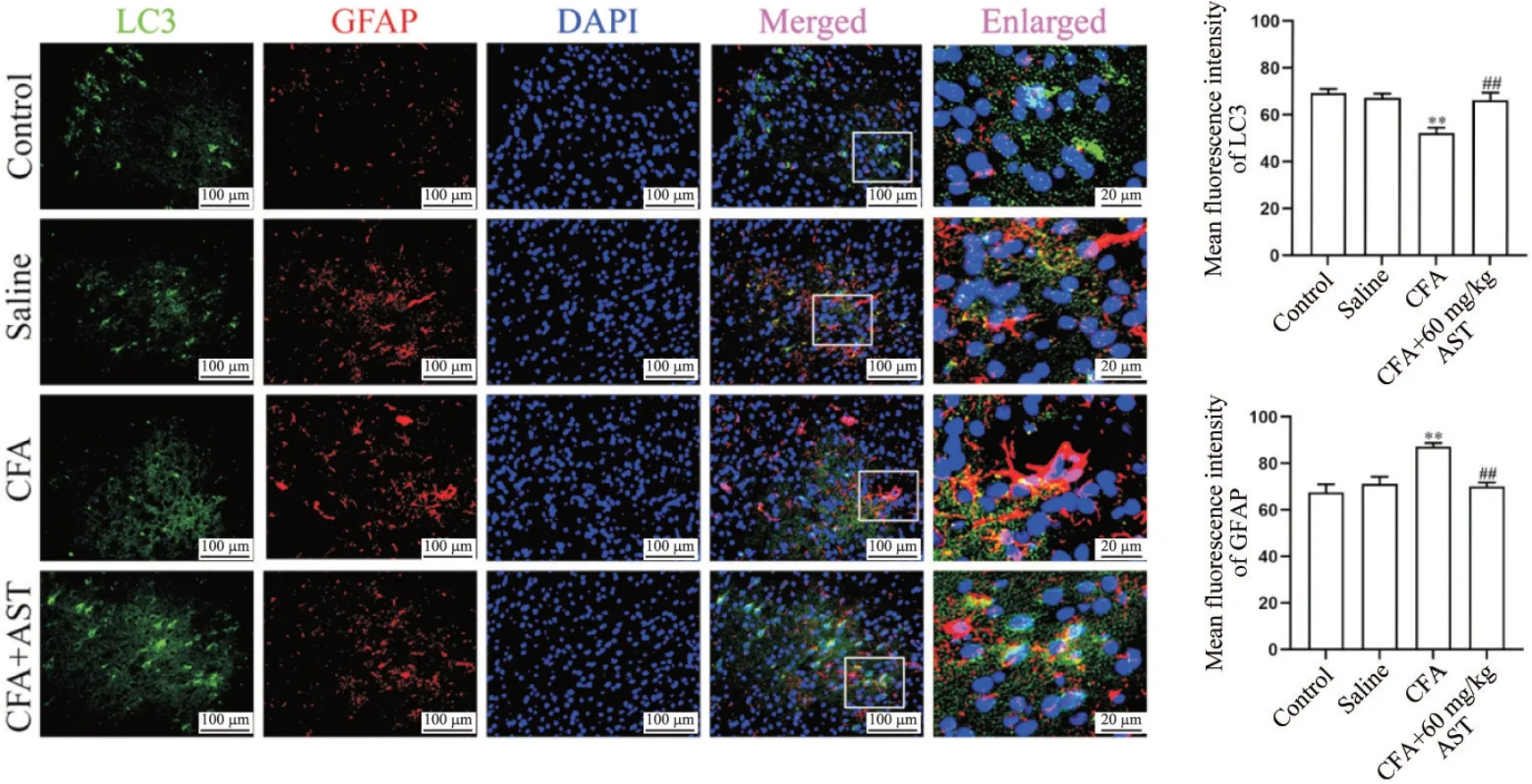
Figure 2. Multiple immunofluorescence staining was used to detect the effect of astragalin (AST) on mean fluorescence intensity of LC3 and GFAP in the anterior cingulate cortex of complete Freund's adjuvant (CFA)-treated mice(scale bar=100 or 20 μm). Mean±SD. n=3. **P<0.01 vs control group; ##P<0.01 vs CFA group.图2 免疫荧光染色检测紫云英苷对CFA小鼠脑前扣带回皮质内LC3与GFAP平均荧光强度的影响

Figure 3. Multiple immunofluorescence staining was used to detect the effect of astragalin (AST) on mean fluorescence intensity of p62 and GFAP in the anterior cingulate cortex of complete Freund's adjuvant (CFA)-treated mice (scale bar=100 or 20 μm). Mean±SD. n=3. **P<0.01 vs control group; #P<0.05 vs CFA group.图3 免疫荧光染色检测紫云英苷对CFA小鼠脑前扣带回皮质内p62与GFAP平均荧光强度的影响
3 紫云英苷激活CFA小鼠前扣带回皮质自噬
Western blot 实验结果显示,与control 组相比,CFA 组小鼠前扣带回皮质内自噬相关蛋白LC3(P<0.01)、ATG12(P<0.01)和beclin-1(P<0.01)表达水平显著下降,p62(P<0.05)表达水平显著上升;与CFA 组相比,经60 mg/kg AST 给药处理后,CFA 小鼠前扣带回皮质内自噬相关蛋白LC3(P<0.01)、ATG12(P<0.01)和beclin-1(P<0.01)的表达量均显著上升;而p62(P<0.05)表达量显著下降,且control组和saline组之间无显著差异,见图6。
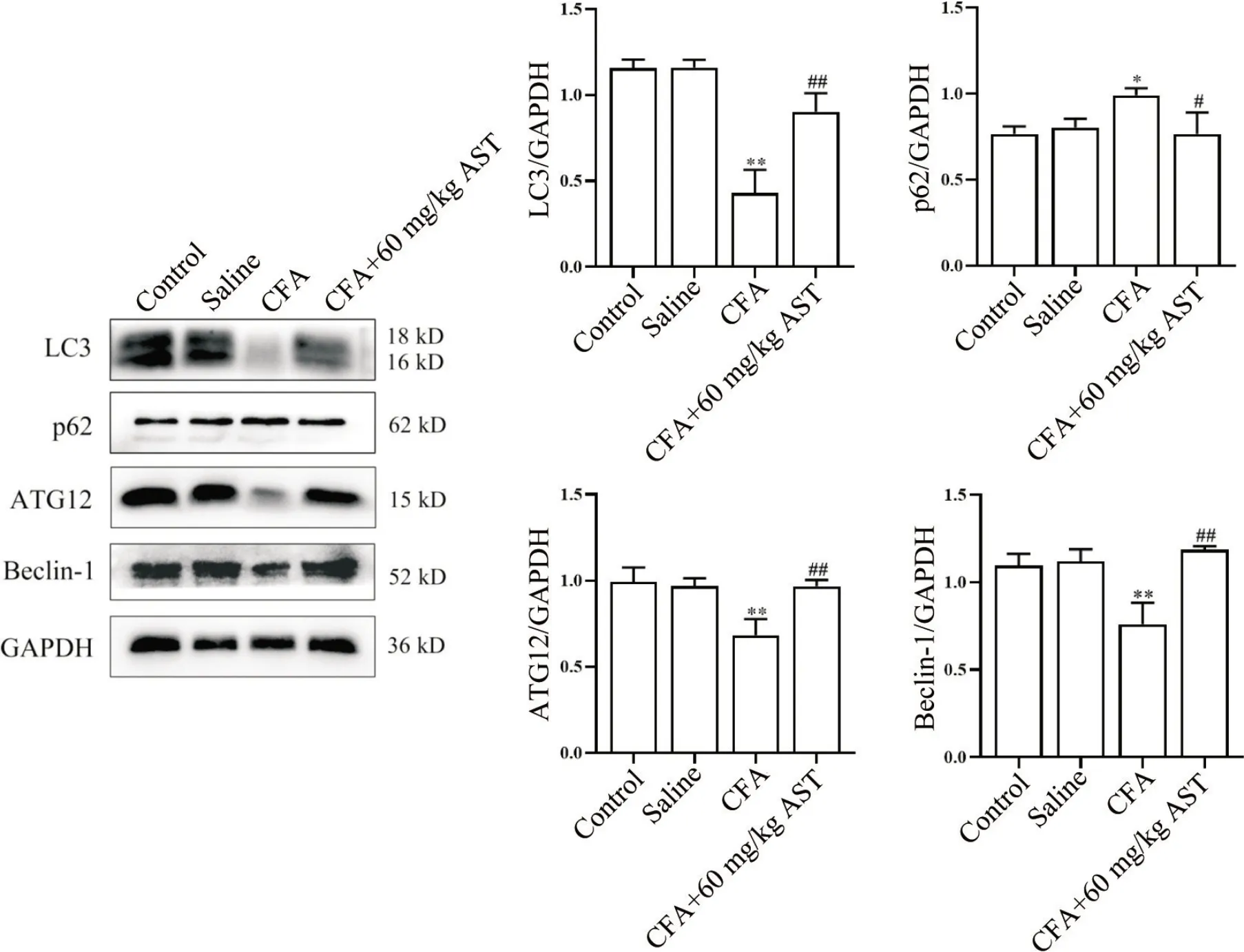
Figure 6. Astragalin (AST) increased the protein expression levels of LC3,ATG12 and beclin-1,and decreased the protein expression of p62 in the anterior cingulate cortex of complete Freund's adjuvant (CFA)-treated mice. Mean±SD. n=3. *P<0.05,**P<0.01 vs control group; #P<0.05,##P<0.01 vs CFA group.图6 紫云英苷上调CFA小鼠脑前扣带回皮质内LC3、ATG12和beclin-1蛋白表达水平,下调p62蛋白表达水平
讨 论
疼痛是影响人类健康的严重疾病之一,近年来众多研究都在寻找有效且安全的药物来改善炎症性疼痛,但至今仍未有好的解决手段。因此,亟需研究治疗炎症性疼痛的新途径[15]。
炎症性疼痛的发病机制主要包括炎症介质释放刺激周围神经和免疫细胞。因此,抑制炎症介质释放可作为缓解疼痛的有效治疗靶点[5,16]。AST 作为天然黄酮类化合物,具有抗炎、抗肿瘤、抗氧化等广泛的药理特性,且尚未显示其存在细胞毒性。相关研究证实,AST 可抑制促炎细胞因子的表达,进而减轻钩端螺旋体感染引起的炎症反应[12]。
钩吻素子通过激活星形胶质细胞自噬,抑制星形胶质细胞活化及促炎因子(IL-1β 和TNF-α)释放,进而缓解大鼠慢性压迫性损伤引起的神经性疼痛[17];3,5 DCQA 通过增强胶质细胞自噬改善CFA 小鼠炎症性疼痛[18];AST能够抑制NF-κB通路,降低IL-6、IL-8 和TNF-α 的产生,进而改善小鼠结肠炎[19]。但AST 对炎症性疼痛的作用及其机制仍不清晰,基于炎症、自噬及星形胶质细胞之间的密切关系,本研究选用CFA 构建最经典的炎性痛小鼠模型,旨在探讨AST 能否促进CFA 小鼠前扣带回皮质自噬,抑制星形胶质细胞的活化,进而缓解CFA 小鼠炎症性疼痛。
本研究通过机械痛阈值测定实验表明AST 可显著上调CFA 小鼠痛阈值,缓解炎症性疼痛。免疫荧光染色证实了AST 能够促进CFA 小鼠前扣带回皮质星形胶质细胞自噬,并抑制其活化,且星形胶质细胞与自噬相关因子表达存在共定位,表明AST 诱发的自噬相关机制与星形胶质细胞有关。并通过Western blot法进一步证明AST显著降低CFA小鼠前扣带回皮质中p62 蛋白表达,上调LC3、ATG12、beclin-1蛋白表达。总之,AST 可缓解CFA 小鼠的炎症性疼痛,其作用机制可能与AST 抑制CFA 小鼠前扣带回皮质星形胶质细胞活化,并促进其发生自噬有关。
自噬可通过调节星形胶质细胞的活性和功能,影响疼痛的进展过程,阻断星形胶质细胞活化可以有效预防或逆转慢性疼痛[20]。因此本研究通过AST 抑制CFA 小鼠前扣带回皮质星形胶质细胞活化,并促进其发生自噬的分子作用机制进行初步探讨,有望为AST 作为抗炎镇痛药物提供潜在的治疗靶点,但具体的自噬相关作用机制仍待深入研究。
