低氧诱导大鼠垂体腺瘤GH3细胞增殖、侵袭和上皮-间质转化的机制研究
2021-12-08张欢石文健刘永亮李景武张于董桂兰董伟
张欢,石文健,刘永亮,李景武,张于,董桂兰,董伟
垂体腺瘤是最常见的颅内肿瘤之一,占原发性中枢神经系统肿瘤的14%,约35%的垂体腺瘤呈侵袭性生长[1],与非侵袭性垂体腺瘤相比,侵袭性垂体腺瘤不仅手术全切率低,而且术后复发率高。上皮-间质转化(epithelial-mesenchymal transformation,EMT)是上皮细胞转化为间质细胞的生物学过程,与肿瘤的发生发展、远处转移、转移定植、癌症干性和化学抗性有关[2-3]。缺氧是组织中氧分压低的一种情况,已成为肿瘤病理生理学的一个关键因素。低氧会在多种肿瘤中诱导EMT[4-6],但在垂体腺瘤中尚不清楚。低氧诱导因子(hypoxia-inducible factors,HIF)是一类介导细胞适应低氧应激反应的调控因子,是细胞适应缺氧的主要驱动力。研究显示,HIF-1α与垂体腺瘤的侵袭性行为有关[7]。在生长激素腺瘤中,HIF-1α可通过促进蛋白激酶A活性增加而导致生长激素过度合成[8]。本研究旨在分析低氧诱导大鼠垂体腺瘤GH3细胞增殖、侵袭和EMT的机制,以期为垂体腺瘤的临床诊疗提供新的理论支持。
1 材料与方法
1.1 实验时间 本实验时间为2020年9月至2021年6月。
1.2 主要仪器与试剂 HIF-1α干扰片段(HIF-1αsiRNA)购自北京傲锐东源生物科技有限公司,GH3细胞购自美国ATCC公司,[3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑(金翁),内盐;MTS]购自北京泽平科技有限责任公司,RNA提取试剂盒购自天根生化科技(北京)有限公司,反转录试剂盒和实时荧光定量试剂盒购自美国Thermo公司,HIF-1α、N-钙黏蛋白(N-cadherin,N-Cad)、波形蛋白(Vimentin,Vim)、GAPDH一抗购自英国Abcam公司,小室实验用Transwell板购自美国Corning公司。
1.3 细胞分组 将GH3细胞分为常氧组(不转染HIF-1α-siRNA,氧浓度为19.5%)、低氧组(不转染HIF-1α-siRNA,氧浓度为2.5%)、常氧+siRNA组(转染HIF-1α-siRNA,氧浓度为19.5%)、低氧+siRNA组(转染HIF-1α-siRNA,氧浓度为2.5%)。将GH3细胞置于2.5%胎牛血清+15%马血清中,在37 ℃、5% CO2培养箱中培养。将处于对数生长期的GH3细胞先接种于6孔板中,常规培养至融合度为80%,更换新鲜培养液;将3 μg HIF-1α-siRNA稀释于5 μl Lipofectamine 3000TM中,加入含5 μl P3000TM的减血清培养基,补充总体系至250 μl,混匀后室温孵育5 min;将DNA-脂质体复合物加入6孔板中,分别将细胞置于不同氧浓度(常氧:19.5% O2;低氧:2.5% O2)的恒温恒湿培养箱中培养。
1.4 细胞增殖能力检测 取各组对数生长期的GH3细胞置于96孔板中,每孔种1×104个细胞,待细胞贴壁后,瞬时干扰HIF-1α表达,继续培养24、48、72 h后分别加入20 μl[3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑(金翁),内盐;MTS],继续培养4 h,检测490 nm波长处吸光度值,即细胞增殖能力。实验独立重复3次。
1.5 细胞侵袭能力检测 取各组对数生长期的GH3细胞,干扰HIF-1α表达24 h后,吸弃培养基,采用4 ℃磷酸盐缓冲液洗2次,胰酶消化后,4 ℃下1 000 r/min离心5 min(离心半径60 mm),收集各组细胞,调整细胞密度为2×105/ml,在Transwell板小室内种200 μl细胞,继续培养24 h后取出,采用4%甲醛固定,擦去小室内的细胞,苏木素染色后随机取5个高倍视野(×400),计算细胞数目,取均值,即细胞侵袭能力。实验独立重复3次。
1.6 GH3细胞中 HIF-1α、N-Cad、Vim mRNA表达水平检测 取各组对数生长期的GH3细胞,胰酶消化后利用一步法提取细胞总RNA,反转录合成cDNA。以cDNA为模板进行实时荧光定量PCR。PCR扩增条件为:50 ℃ 20 min,95 ℃ 10 min,95 ℃ 10 s,60 ℃ 1 min,共 40个循环。HIF-1α的正向引物为5'-TGCTCATCAGTTGCCACTTC-3',反向引物为5'-CCATCCAGGGCTTTCAGATA-3';N-Cad的正向引物为5'-ACGGGCAGATCACCACTATC-3',反向引物为5'-TTTCACAAGTCTCGGCCTCT-3';Vim的正向引物为5'-CCCAGATTCAGGAACAGCAT-3',反向引物为5'-CACCTGTCTCCGGTATTCGT-3';内参基因GAPDH的正向引物为5'-AACGACCCCTTCATTGACCT-3',反向引物为5'-CCCCATTTGATGTTAGCGGG-3'。采用 2-ΔΔCt法计算 GH3细胞中 HIF-1α、N-Cad、Vim mRNA表达水平。实验独立重复3次。
1.7 GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平检测 取各组对数生长期的GH3细胞,4 ℃下1 000 r/min离心5 min(离心半径60 mm),收集各组细胞,采用磷酸盐缓冲液洗3次,加入非变性裂解液,冰上孵育2 h,4 ℃下12 000 r/min离心15 min(离心半径60 mm),取上清液,采用BCA法检测样品总蛋白浓度。电泳,采用湿转法将蛋白转移至聚偏氟乙烯膜,采用5%脱脂牛奶封闭1 h,分别加入HIF-1α一抗(1∶2 000)、E-Cad一抗(1∶1 000)、Vim一抗(1∶2 000)、GAPDH一抗(1∶10 000),4 ℃下过夜。采用TBST洗膜3次,加入相应的二抗孵育1 h,采用等渗Tris-HCl-Tween缓冲盐溶液洗膜3次。加入ECL化学发光液,分析条带灰度值,即HIF-1α、N-Cad、Vim蛋白表达水平。实验独立重复3次。
1.8 统计学方法 采用SPSS 22.0统计学软件进行数据分析。服从正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较 常氧组、低氧组、常氧+siRNA组、低氧+siRNA组干扰后24、48、72 h细胞增殖能力比较,差异有统计学意义(P<0.05)。低氧组干扰后24、48、72 h细胞增殖能力高于常氧组,差异有统计学意义(P<0.05);常氧+siRNA组干扰后72 h细胞增殖能力低于常氧组,干扰后24、48、72 h细胞增殖能力低于低氧组,差异有统计学意义(P<0.05);低氧+siRNA组干扰后24 h细胞增殖能力高于常氧组,干扰后24、48、72 h细胞增殖能力低于低氧组、高于常氧+siRNA组,差异有统计学意义(P<0.05)。常氧组、低氧组、常氧+siRNA组、低氧+siRNA组干扰后48、72 h细胞增殖能力分别高于本组干扰后24 h,差异有统计学意义(P<0.05);常氧组、低氧组、常氧+siRNA组、低氧+siRNA组干扰后72 h细胞增殖能力分别高于本组干扰后48 h,差异有统计学意义(P<0.05),见表1。
表1 各组细胞增殖能力比较(±s,%,n=3)Table 1 Comparison of cell proliferation in each group

表1 各组细胞增殖能力比较(±s,%,n=3)Table 1 Comparison of cell proliferation in each group
注:a表示与常氧组比较,P<0.05;b表示与低氧组比较,P<0.05;c表示与常氧+siRNA组比较,P<0.05;d表示与本组干扰后24 h比较,P<0.05;e表示与本组干扰后48 h比较,P<0.05
组别 干扰后24 h 干扰后48 h 干扰后72 h常氧组 0.42±0.01 0.57±0.03d 0.82±0.02de低氧组 0.59±0.02a 0.89±0.03ad 1.54±0.07ade常氧+siRNA组 0.38±0.01b 0.47±0.03bd 0.60±0.06abde低氧+siRNA组 0.48±0.02abc 0.61±0.02bcd 0.91±0.04bcde F值 37.71 41.26 68.56 P值 <0.001 <0.001 <0.001
2.2 各组细胞侵袭能力比较 常氧组、低氧组、常氧+siRNA组、低氧+siRNA组细胞侵袭能力分别为(301.3±6.4)%、(477.3±20.2)%、(188.7±19.4)%、(321.0±17.9)%。常氧组、低氧组、常氧+siRNA组、低氧+siRNA组细胞侵袭能力比较,差异有统计学意义(F=49.30,P<0.001)。低氧组细胞侵袭能力高于常氧组,差异有统计学意义(P<0.05);常氧+siRNA组细胞侵袭能力低于常氧组、低氧组,差异有统计学意义(P<0.05);低氧+siRNA组细胞侵袭能力低于低氧组,高于常氧+siRNA组,差异有统计学意义(P<0.05)。
2.3 各组GH3细胞中 HIF-1α、N-Cad、Vim mRNA表达水平比较 常氧组、低氧组、常氧+siRNA组、低氧+siRNA组 GH3细胞中HIF-1α、N-Cad、Vim mRNA表达水平比较,差异有统计学意义(P<0.05)。低氧组GH3细胞中HIF-1α、N-Cad、Vim mRNA表达水平高于常氧组,差异有统计学意义(P<0.05);常氧+siRNA组GH3细胞中HIF-1α、Vim mRNA表达水平低于常氧组,HIF-1α、N-Cad、Vim mRNA表达水平低于低氧组,差异有统计学意义(P<0.05);低氧+siRNA组GH3细胞中HIF-1α、N-Cad、Vim mRNA表达水平低于低氧组,HIF-1α、Vim mRNA表达水平高于常氧+siRNA组,差异有统计学意义(P<0.05),见表2。
表2 各组GH3细胞中HIF-1α、N-Cad、Vim mRNA表达水平比较(±s,n=3)Table 2 Comparison of HIF-1α,N-Cad and Vim mRNA expression levels in GH3 cells of each group
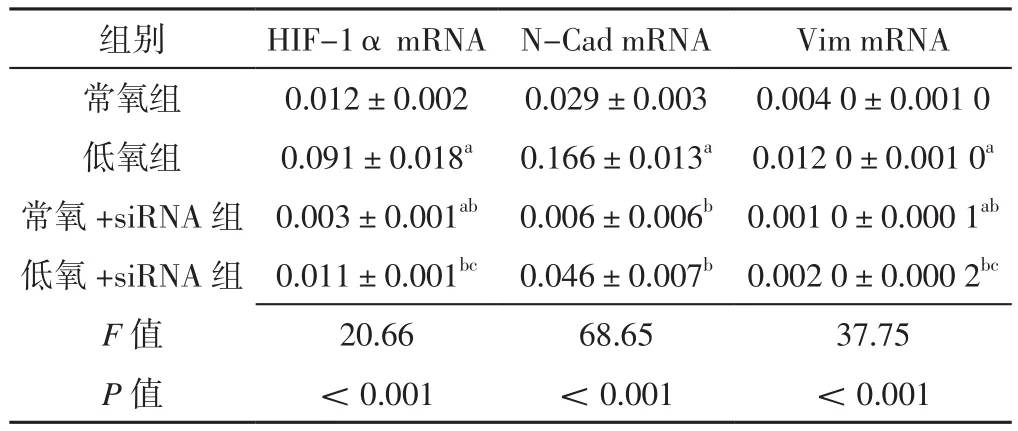
表2 各组GH3细胞中HIF-1α、N-Cad、Vim mRNA表达水平比较(±s,n=3)Table 2 Comparison of HIF-1α,N-Cad and Vim mRNA expression levels in GH3 cells of each group
注:HIF=低氧诱导因子,N-Cad=N-钙黏蛋白,Vim=波形蛋白;a表示与常氧组比较,P<0.05;b表示与低氧组比较,P<0.05;c表示与常氧+siRNA组比较,P<0.05
组别 HIF-1α mRNA N-Cad mRNA Vim mRNA常氧组 0.012±0.002 0.029±0.003 0.004 0±0.001 0低氧组 0.091±0.018a 0.166±0.013a 0.012 0±0.001 0a常氧+siRNA组 0.003±0.001ab 0.006±0.006b 0.001 0±0.000 1ab低氧+siRNA组 0.011±0.001bc 0.046±0.007b 0.002 0±0.000 2bc F值 20.66 68.65 37.75 P值 <0.001 <0.001 <0.001
2.4 各组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平比较 常氧组、低氧组、常氧+siRNA组、低氧+siRNA组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平比较,差异有统计学意义(P<0.05)。低氧组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平高于常氧组,差异有统计学意义(P<0.05);常氧+siRNA组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平低于常氧组、低氧组,差异有统计学意义(P<0.05);低氧+siRNA组GH3细胞中Vim蛋白表达水平高于常氧组,HIF-1α、N-Cad、Vim蛋白表达水平低于低氧组、高于常氧+siRNA组,差异有统计学意义(P<0.05),见表3、图1。

图1 BCA法检测各组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平的电泳图Figure 1 The electrophoretic patterns of HIF-1α,N-Cad and Vim protein expression levels in GH3 cells of each group detected by BCA method
表3 各组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平比较(±s,n=3)Table 3 Comparison of HIF-1α,N-Cad and Vim protein expression levels in GH3 cells of each group

表3 各组GH3细胞中HIF-1α、N-Cad、Vim蛋白表达水平比较(±s,n=3)Table 3 Comparison of HIF-1α,N-Cad and Vim protein expression levels in GH3 cells of each group
注:a表示与常氧组比较,P<0.05;b表示与低氧组比较,P<0.05;c表示与常氧+siRNA组比较,P<0.05
组别 HIF-1α蛋白 N-Cad蛋白 Vim蛋白常氧组 0.323±0.052 0.430±0.021 0.660±0.032低氧组 0.910±0.035a 1.110±0.055a 1.260±0.095a常氧+siRNA组 0.140±0.026ab 0.203±0.024ab 0.340±0.052ab低氧+siRNA组 0.283±0.038bc 0.493±0.012bc 0.983±0.044abc F值 76.27 143.60 42.94 P值 <0.001 <0.001 <0.001
3 讨论
肿瘤微环境是由肿瘤细胞和肿瘤周围浸润的免疫细胞、新生血管及其内皮细胞、肿瘤相关成纤维细胞和细胞外基质共同构成的[9],在实体肿瘤的发生发展及转移中起重要作用。作为肿瘤微环境的特征之一,低氧与多种肿瘤侵袭性和预后不良相关[10-11]。HIF-1α是细胞对缺氧做出反应的关键转录因子之一,与肿瘤EMT[7]、血管生成[12]、药物抗性[13]密切相关。本研究旨在分析低氧诱导大鼠垂体腺瘤GH3细胞增殖和EMT的机制。
国际癌症基因组联盟发起的“全基因组泛癌分析”计划显示,在27类1 188种癌症中肿瘤组织内低氧程度与基因突变频率增加有关,低氧在基因组重构和肿瘤恶性进展中起关键作用[11]。肿瘤组织内低氧环境有助于肿瘤的可塑性和异质性[14]。国内有报道称,低氧促进小鼠垂体腺瘤GT1-1细胞增殖,在12 h达到峰值,随后呈下降趋势[15]。本研究结果显示,低氧组干扰后24、48、72 h细胞增殖能力高于常氧组;常氧+siRNA组干扰后72 h细胞增殖能力低于常氧组,干扰后24、48、72 h细胞增殖能力低于低氧组;低氧+siRNA组干扰后24 h细胞增殖能力高于常氧组,干扰后24、48、72 h细胞增殖能力低于低氧组、高于常氧+siRNA组;常氧组、低氧组、常氧+siRNA组、低氧+siRNA组干扰后48、72 h细胞增殖能力分别高于本组干扰后24 h;常氧组、低氧组、常氧+siRNA组、低氧+siRNA组干扰后72 h细胞增殖能力分别高于本组干扰后48 h;提示低氧可促进垂体腺瘤细胞增殖,而干扰HIF-1α未能完全阻断低氧的促肿瘤细胞增殖作用。低氧组细胞侵袭能力高于常氧组;常氧+siRNA组细胞侵袭能力低于常氧组、低氧组;低氧+siRNA组细胞侵袭能力低于低氧组,高于常氧+siRNA组;提示低氧可促进垂体腺瘤细胞侵袭,而干扰HIF-1α未能完全阻断低氧的促肿瘤细胞侵袭作用。推测在垂体腺瘤中除了HIF-1α外,还有其他的调控机制,如2-酮戊二酸依赖性[16]、低氧诱导的内质网应激反应[17],但这需要进一步研究验证。
HIF-1是由HIF-1α和HIF-1β组成的异源二聚体,其中HIF-1α可反映机体缺氧程度,通过代谢、增殖和血管生成等多个生理过程参与癌症的发生发展[8]。HIF-1α能增强内皮细胞向低氧组织的迁移,即促进EMT,进而促进新生血管形成[18]。垂体腺瘤中EMT与腺瘤的侵袭性密切相关,诱导EMT可促进GH3细胞的侵袭和增殖,相反则抑制GH3细胞的侵袭和增殖,并引起GH3细胞阻滞于G1期[19]。大部分垂体腺瘤均有HIF-1α表达并且其水平与垂体腺瘤的侵袭性密切相关[20]。与血管丰富的正常脑垂体相比,垂体腺瘤具有较低的血管密度,但肿瘤内的缺氧条件仍可激活一些诱导途径,导致血管密度增加或形成更有序的微血管几何形状以维持肿瘤生长[21]。本研究结果显示,低氧组GH3细胞中HIF-1α mRNA及其蛋白表达水平高于常氧组;常氧+siRNA组GH3细胞中HIF-1α mRNA及其蛋白表达水平低于常氧组、低氧组;低氧+siRNA组GH3细胞中HIF-1α mRNA及其蛋白表达水平低于低氧组、高于常氧+siRNA组;提示低氧状态下GH3细胞的HIF-1α表达水平明显升高,本研究采用的siRNA技术未能完全阻断HIF-1α的表达。E-钙黏蛋白(E-cadherin,E-Cad)通常在上皮细胞中表达,其表达下调破坏细胞内连接使上皮细胞获得迁移能力。当E-Cad转变为N-Cad时,导致肿瘤细胞侵袭和扩散[22-23]。本研究结果显示,低氧组GH3细胞中N-Cad mRNA表达水平高于常氧组;常氧+siRNA组GH3细胞中N-Cad mRNA表达水平低于低氧组;低氧+siRNA组GH3细胞中N-Cad mRNA表达水平低于低氧组;低氧组GH3细胞中N-Cad蛋白表达水平高于常氧组;常氧+siRNA组GH3细胞中N-Cad蛋白表达水平低于常氧组、低氧组;低氧+siRNA组GH3细胞中N-Cad蛋白表达水平低于低氧组、高于常氧+siRNA组;提示E-Cad转化为N-Cad是低氧诱导GH3细胞发生EMT的主要机制。这一表现和既往应用细胞周期抑制剂帕博西尼影响GH3细胞侵袭的机制相同[24],即影响E-Cad向N-Cad的转化。Vim作为EMT的正调节因子,其上调被认为是EMT的先决条件[25]。本研究结果显示,低氧组GH3细胞中Vim mRNA表达水平高于常氧组;常氧+siRNA组GH3细胞中Vim mRNA表达水平低于常氧组、低氧组;低氧+siRNA组GH3细胞中Vim mRNA表达水平低于低氧组、高于常氧+siRNA组;低氧组GH3细胞中Vim蛋白表达水平高于常氧组;常氧+siRNA组GH3细胞中Vim蛋白表达水平低于常氧组、低氧组;低氧+siRNA组GH3细胞中Vim蛋白表达水平高于常氧组、常氧+siRNA组,低于低氧组;提示在低氧促进GH3细胞发生EMT的过程中,Vim也发挥重要作用。
综上所述,低氧通过上调HIF-1α表达而促进GH3细胞增殖和细胞侵袭,低氧通过上调N-Cad、Vim表达而促进EMT的发生,干扰HIF-1α表达可部分阻断这些作用。深入了解HIF-1α通路参与垂体腺瘤发生发展的分子调控机制可为垂体腺瘤的药物治疗提供新思路和理论依据。然而,本研究并未构建过表达HIF-1α模型,从过表达HIF-1α和干扰HIF-1α表达两方面证实HIF-1α与EMT的关系。在未来的研究中,本研究组计划构建稳定高表达HIF-1α和干扰HIF-1α表达的动物模型,比较两者的动物表型,为垂体腺瘤中靶向HIF-1α治疗提供新的证据。
作者贡献:张欢撰写论文,进行结果分析与解释;石文健、刘永亮、李景武进行数据收集;张于、董桂兰进行数据整理、分析;董伟进行文章的构思与设计,负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
