亚慢性铝暴露致大鼠认知障碍的Sirt1-Keap1/Nrf2信号通路机制*
2024-01-17刘建华萧非凡王彬鸿陈薪茹
刘 衍,刘建华,萧非凡,王彬鸿,陈薪茹,姜 斌,陈 欢,林 立,张 璟△,李 欢△
(1滨州医学院公共卫生与管理学院,山东 滨州 256600;2济宁医学院公共卫生学院,山东 济宁 272000)
铝是地壳中仅次于氧和硅的第三大化学元素,也是含量最多的金属元素[1],其可通过多种不同形式进入人体,对机体各组织都会造成伤害[2],神经系统对铝最为敏感[3]。铝的神经毒性是神经退行性疾病潜在的危险因素,认知障碍是神经系统疾病中常见的症状,主要表现为学习记忆功能减退[4]。
微小RNA(microRNA,miRNA,miR)是一种内源性、高度保守的非编码RNA,可参与多种病理生理过程[5]。研究表明miR-128-3p 是一种多功能的miRNA,可以参与调控神经炎症性疾病和氧化应激,与多种神经退行性疾病的发生有关[6]。沉默信息调节因子1(silent information regulator1,Sirt1)是一种Ⅲ类组蛋白脱乙酰酶,主要用来检测氧化底物的缺乏[7],Sirt1 是miR-128-3p 的一个重要靶点,miR-128-3p 可以调节Sirt1 的表达水平[8]。核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)是一种关键的转录因子,可以调节抗氧化防御系统[9],是Sirt1的关键下游靶点[10]。氧化应激在许多慢性疾病中有着重要的作用,如糖尿病、肿瘤和神经退行性疾病[11]。Kelch 样环氧氯丙烷相关蛋白(Kelch-like ECH-associated protein-1,Keap1)-Nrf2应激反应通路在对抗氧化应激中发挥重要作用[12]。基于miR-128-3p 和Sirt1-Keap1/Nrf2 通路对氧化应激的调节作用,为探究铝暴露神经毒性的Sirt1-Keap1/Nrf2 通路机制,本项工作应用铝暴露动物模型,观察铝暴露对大鼠海马组织中miR-128-3p 和Sirt1、Keap1 和Nrf2 蛋白表达水平的影响,探讨miR-128-3p 是否可以通过调控Sirt1-Keap1/Nrf2通路调节大鼠神经系统的氧化应激,进而影响大鼠的认知状况。
材 料 和 方 法
1 主要试剂与仪器
三氯化铝(分子式: AlCl3·6H2O,结晶型)(天津市风船化学试剂科技有限公司);麦芽酚(分析纯,纯度99.0%,Sigma-Aldrich);兔 抗GAPDH 抗 体(ET1601-4,华安生物科技有限公司);鼠抗Sirt1抗体(60303-1-Ig)、兔抗Nrf2 抗体(16396-1-AP)和辣根过氧化物酶标记的山羊抗鼠Ⅱ抗(SA00001-1)(三鹰生物科技有限公司);兔抗Keap1 抗体(bs-4900R,北京博奥森生物技术有限公司)。Morris 水迷宫及视频轨迹跟踪分析系统(江苏赛昂斯生物科技有限公司)。
2 实验方案
2.1 麦芽酚铝的暴露剂量设计与制备 2011 年世界卫生组织和联合国粮农组织(WHO/FAO)将铝的每周可容许摄入量暂修订为2.0 mg/kg[13]。对于 1个体质量 60 kg 的成人,铝的每天摄入量不超过17 mg,即成人铝的每日摄入量不超过 0. 283 mg/kg。根据人和动物体表面积折算的等效剂量比值计算,大鼠的铝口服剂量为1.785 mg/kg;根据不同给药途径的剂量换算,大鼠的铝腹腔注射剂量为 0.535 mg/kg。铝摩尔质量为26. 98 g/mol,故铝离子浓度约为19.85 μmol/kg;根据前期实验的经验[14],将染毒剂量定为对照组、低、中、高剂量组:0 μmol/kg、10 μmol/kg、20 μmol/kg 和40 μmol/kg。溶液配制方法参照前期实验[15],用灭菌的蒸馏水来溶解三氯化铝,配制成80、40 和20 mmol/L 的氯化铝溶液;用PBS 溶解麦芽酚,配制成240、120 和60 mmol/L 的麦芽酚溶液,然后将等体积的80 mmol/L 的氯化铝溶液和240 mmol/L 的麦芽酚溶液混合,得到浓度为40 mmol/L 的麦芽酚铝溶液,将等体积的40 和20 mmol/L 的氯化铝溶液分别与120 和60 mmol/L 的麦芽酚溶液相混合,得到20 mmol/L和10 mmol/L的麦芽酚铝溶液。
2.2 分组和干预方案 32只6周龄SPF级健康雄性SD 大鼠购自维通利华实验动物技术有限公司[许可证号为SCXK(京)2016-0002],体重(190±20) g。将大鼠喂养在济宁医学院动物房内,室内温度22~26 ℃,湿度50%左右。大鼠12 h 黑暗/光照(8:00~20:00),普通饲料喂养,自由摄食和饮水。大鼠在动物房适应一周后,开始分组,按照体质量随机分为4组:对照(control,CG)组、低剂量(low-dose,LG)组、中剂量(medium-dose,MG)组、高剂量(high-dose,HG)组,每组8 只,本实验采用腹腔注射麦芽酚铝进行大鼠染毒模型建立。具体方案:4 组大鼠按照1 mL/kg体质量给药,对照组给予生理盐水溶液(相当于麦芽酚铝暴露剂量为0 μmol/kg),低、中、高组分别给予浓度为10、20和40 μmol/kg 体质量的麦芽酚铝溶液,每周染毒5 d,停2 d,连续染毒3个月。在染毒期间,每天观察大鼠摄食及饮水情况、精神和生长发育等整体状况。每周对大鼠进行体重测量并记录。
3 主要实验方法
3.1 Morris水迷宫训练与测试 实验步骤:(1)定位巡航实验[16]:将Morris 水迷宫水池等分为4 个象限,将平台固定于其中的一个象限内,进行实验,水温保持在(20~24) ℃之间,周围环境恒定。在正式开始实验的前1 d,将大鼠放入水迷宫中自由活动2 min,并暴露平台,让大鼠熟悉迷宫的环境。正式开始实验时,将平台高度放于水面下2 cm 左右,在前5 d 的实验中,每天将大鼠面向池壁放入水中。记录大鼠从入水到找到平台的时间和游过的路线,计算4 个象限内找到平台时间的平均值作为逃避潜伏期,如果大鼠在120 s 内没有找到平台,将其引导至平台并让其在平台上停留10 s,逃避潜伏期记录为120 s。(2)空间探索实验:在第6 天,撤去水下平台,将大鼠从固定象限放入水中,记录120 s 内大鼠穿越平台位置和平台象限的次数。
3.2 冰冻切片检测活性氧(reactive oxygen species,ROS) 用冰冻机将大脑皮层进行切片,冰冻切片用纯水洗涤后稍甩干,用组化笔在组织周围画圈以用来防止抗体的流走,在圈内滴入ROS 染液,在37 ℃恒温箱中避光孵育30 min。置于PBS 中洗涤3次,切片稍甩干后在圈内滴加DAPI 染液,室温避光孵育10 min。PBS 洗涤3 次。切片稍甩干后用抗荧光淬灭封片剂封片,切片于荧光显微镜下观察并采集图像(DAPI 紫外激发波长330~380 nm,发射波长420 nm,发蓝光;CY3 激发波长510~560 nm,发射波长590 nm,发红光)。
3.3 谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测 取冻存的大鼠海马,称重后加入一定量预冷的PBS,并在冰上充分研磨,1 000×g离心20 min,离心后取上清。按照试剂盒说明书检测大脑皮层GSH-Px活力;采用多功能酶标仪在450 nm波长处检测样品吸光度(A),计算海马GSH-Px的含量。
3.4 RT-qPCR 检测海马miR-128-3p 表达 用1 mL Trizol 提取海马组织总RNA,测量RNA 浓度与纯度,设计miR-128-3p的上游引物(序列见表1),下游引物由试剂盒提供。扩增条件:95 ℃预变性15 min;95 ℃变形34 s,60 ℃退火34 s,共40 个循环。以U6 为内参照(引物序列见表1),用2-ΔΔCt法计算miR-128-3p相对表达量。
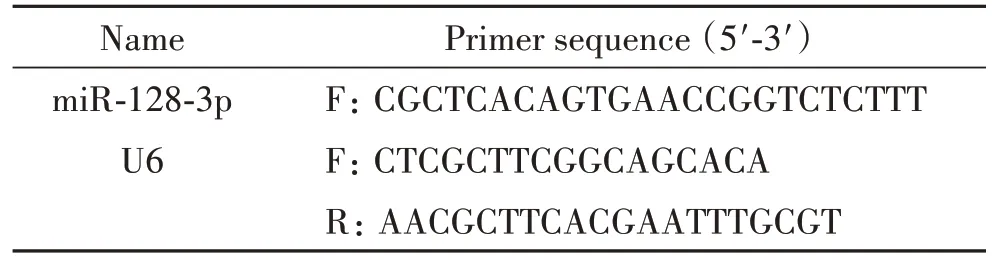
表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
3.5 Western blot检测海马组织中Srit1、Nrf2和Keap1蛋白的表达 称取一定量的海马组织并加入裂解液、研磨,离心取上清,测蛋白浓度。经SDS-PAGE,电泳条件:80 V 电泳至条带跑出浓缩胶,升高至120 V,电泳停止后将分离的蛋白转到PVDF 膜上,转膜完成后将PVDF 膜浸泡在5%的脱脂奶粉封闭液中室温封闭2 h,结束后用TBST 漂洗。然后分别加入Ⅰ抗(Srit1和Nrf2抗体稀释比为1∶5 000;Keap1抗体稀释比为1∶500),4 ℃孵育过夜,分别加入辣根过氧化酶标记的山羊抗鼠抗体和山羊抗兔抗体(稀释比为1∶5 000)。洗膜后ECL 显色,于暗室中曝光显影,以目的蛋白与内参照GAPDH 的灰度值比值代表目的蛋白的表达量,用Gelpro32软件进行统计分析。
4 统计学处理
采用SPSS 22.0统计软件对数据进行统计分析。经正态性检验,计量资料符合正态分布,采用均数±标准差(mean±SD)表示,各组间差异采用单因素方差分析(one-way ANOVA),方差齐采用LSD 法检验,方差不齐采用Dunnett T3 检验。P<0.05 为差异有统计学意义。
结 果
1 Morris 水迷宫检测各组大鼠的空间学习和记忆能力
结果显示,第 1、2 天各组大鼠的平均逃避潜伏期较接近,并无显著差异(P>0.05)。在第3、4和5天的实验中,麦芽酚铝暴露的三个组的逃避潜伏期均显著高于对照组(P<0.05)。在第4、5 天的实验中高剂量组大鼠的逃避潜伏期显著高于低剂量组(P<0.01)。组内比较:各组大鼠逃避潜伏期与前一天比较,时间均显著缩短(P<0.05),见图1A。数据显示,在第6 天的空间探索实验中,与对照组和低剂量组相比,高剂量组穿越平台和平台象限的次数显著减少(P<0.01),见图1。
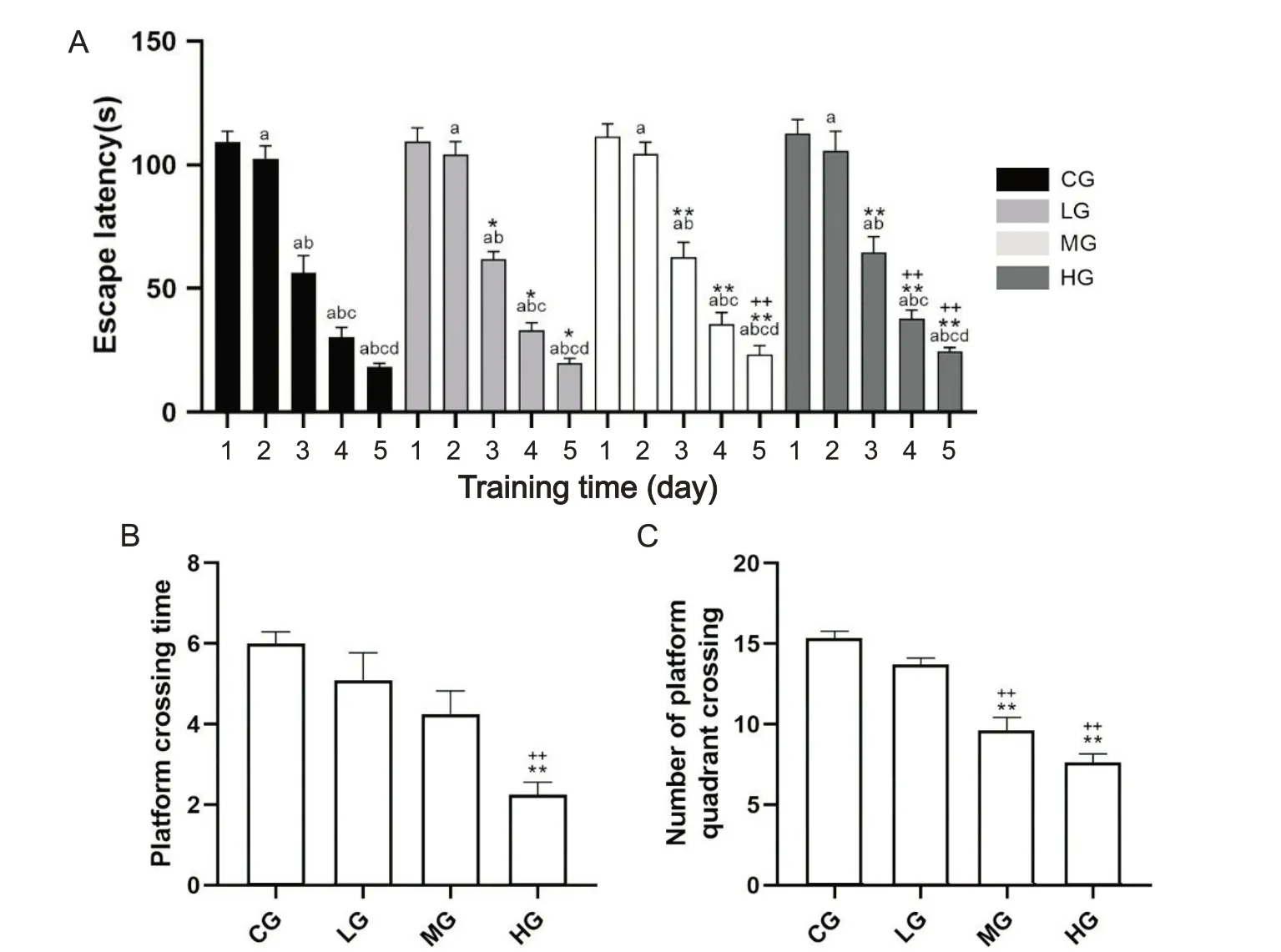
Figure 1. Morris water maze was used to detect learning and memory function in rats. A: the escape latency of rats in all four groups gradually decreased over time; B: as the exposure dose of maltol aluminum increased,the number of crossing the platform gradually decreased; C: with the increase of maltol aluminum exposure dose,the number of crossing the platform quadrant gradually decreased. Mean±SD. n=8. aP<0.05 vs the same group on day 1; bP<0.05 vs the same group on day 2; cP<0.05 vs the same group on day 3; dP<0.05 vs the same group on day 4; *P<0.05,**P<0.01 vs CG group; ++P<0.01 vs LG group.图1 各组大鼠Morris水迷宫实验结果
2 ROS表达升高和GSH-Px表达下降
随着染毒剂量的增加,大鼠海马组织中GSH-Px的含量逐渐减少,其中与对照组和低剂量组相比,高剂量组大鼠海马中的GSH-Px 含量显著减少(P<0.05,P<0.01);ROS检测结果显示,随着染毒剂量的增加,大鼠大脑皮层组织中红色荧光强度显著增强,表明ROS水平逐渐升高,对照组相比,中剂量组和高剂量组大鼠海马中的ROS 显著升高(P<0.05,P<0.01),见图2。

Figure 2. Relative expression levels of ROS and GSH-Px. A: ROS immunofluorescence staining was performed using DAPI (diamine phenylindole). The comparison of ROS expression characteristics in the cerebral cortex of rats was observed. After DAPI staining,the nuclei of neurons in the cerebral cortex appeared blue,and there was no statistically significant difference.However,after ROS staining,the cells exhibited a uniform red color,and the intensity of red fluorescence increased with the increasing dose of maltol aluminum exposure. B: as the maltol aluminum exposure dose gradually increased,there was a gradual increase in the relative expression of ROS. C: conversely,as the maltol aluminum exposure dose gradually increased,the relative expression of GSH-Px showed a gradual decrease. The scale bar=200 μm. Mean±SD. n=8. *P<0.05,**P<0.01 vs CG group; +P<0.05 vs LG group.图2 各组大鼠ROS和GSH-Px结果
3 miR-128-3p表达升高
RT-qPCR 结果显示各组大鼠海马组织中miR-128-3p 的相对表达水平随着麦芽酚铝暴露剂量的增加逐渐上升,高剂量组中miR-128-3p 相对表达水平显著高于对照组(P<0.05),见图3。

Figure 3. The expression of miR-128-3p. The expression of miR-128-3p gradually increased with the increase of maltol aluminum exposure dose. Mean±SD. n=8. *P<0.05 vs CG group.图3 各组大鼠海马组织中miR-128-3p表达水平
4 各组大鼠海马组织中Sirt1、Nrf2和Keap1表达
结果显示各组大鼠海马组织中Sirt1和Nrf2的相对表达水平随着麦芽酚铝暴露剂量的增加逐渐降低,Sirt1 和Nrf2 蛋白相对表达量在3 个麦芽酚铝暴露剂量组均低于对照组,高剂量组显著低于对照组和低剂量组(P<0.05,P<0.01);Keap1 的相对表达水平随着麦芽酚铝暴露剂量的增加逐渐上升,Keap1蛋白相对表达量在3 个麦芽酚铝暴露剂量组均高于对照组,高剂量组显著高于对照组和低剂量组(P<0.05),见图4。
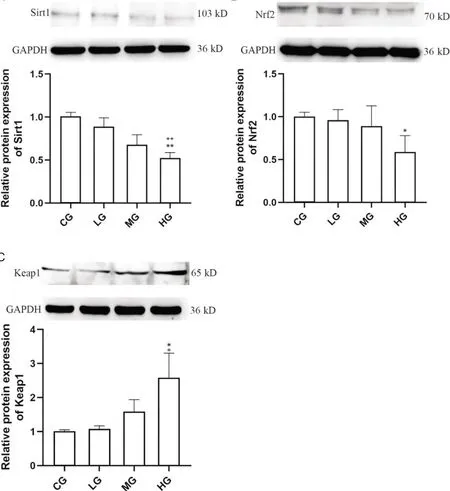
Figure 4. The expression of Sirt1,Nrf2 and Keap1. A: as the exposure dose of maltol aluminum increased,there was a gradual decrease in the relative expression of Sirt1 protein; B: the relative expression of Nrf2 protein gradually decreased with the increase of maltol aluminum exposure dose; C: with the increase of maltol aluminum exposure dose,the relative expression of Keap1 protein showed a gradual increase. Mean±SD. n=8. *P<0.05,**P<0.01 vs CG group; +P<0.05,++P<0.01 vs LG group.图4 各组大鼠海马组织中Sirt1、Nrf2和Keap1的蛋白表达
讨 论
铝是一种神经毒物,当机体长期处于铝暴露的环境中,可导致神经毒性[17]。近年来,铝的神经毒性在不同的动物身上得到证实[18]。在本实验中,Morris水迷宫实验结果显示:在定位巡航实验的第3、4 和5天中,麦芽酚铝暴露的高剂量组与对照组相比逃避潜伏期显著增长,说明亚慢性铝暴露可以损伤大鼠的学习能力;在第6 天的空间探索实验中高剂量组的大鼠穿过平台及平台象限的次数比对照组显著减少,说明亚慢性铝暴露也可以减弱大鼠的记忆能力。麦芽酚铝暴露损害了大鼠的空间学习和记忆能力,与之前研究结果相似[19-20]。
氧化应激是指机体受到刺激后,体内产生过多的ROS,超过了自身的清除能力,使机体的氧化还原系统失衡,导致细胞和组织损伤凋亡的过程[21],在脑组织中引起神经元功能障碍或死亡,是导致神经退行性疾病的发病机制之一[22]。机体内有着抗氧化系统,当组织发生氧化应激时可以激活抗氧化系统,减轻氧化应激损伤[23]。Keap1-Nrf2 是常见的抗氧化通路[24],Nrf2 是机体抗氧化应激防御系统中的关键转录因子,是Sirt1 的关键下游靶点[25],当Sirt1 表达下降时,Nrf2 的表达水平也会下降,负调控氧化应激[26]。
Sirt1-Keap1/Nrf2 信号通路的调控作用在各种疾病中被广泛研究[27],本实验中亚慢性铝暴露后,大鼠海马组织Sirt1 表达水平下降,刺激神经细胞产生ROS,引起神经系统氧化损伤[28]。Keap1 表达水平上调,而Nrf2表达水平下调,提示氧化应激抑制胞浆内Nrf2 向细胞内转位,进而抑制下游抗氧化酶GSH-Px等的表达。GSH-Px 是机体抗氧化系统中的一种抗氧化酶,是机体抗氧化指标之一[29]。GSH-Px 表达水平的降低说明抗氧化系统失衡,抵抗氧化应激损伤的能力下降,使得ROS 对大鼠神经元的攻击作用提升[30]。因此,可以得出Sirt1-Keap1/Nrf2 信号通路在大鼠神经系统抗氧化系统中发挥重要作用,亚慢性铝暴露后可以通过调节Sirt1-Keap1/Nrf2通路引起大鼠脑组织氧化应激增强,抗氧化系统失衡,发生氧化损伤,进而可能导致神经退行性疾病。
miR-128-3p 可以参与调控炎症反应和氧化应激的过程[31],本研究中miR-128-3p 的表达水平随着麦芽酚铝暴露剂量的增加而增加,说明麦芽酚铝的亚慢性暴露可能通过引起大鼠海马组织中miR-128-3p表达水平的升高来降低海马组织的抗氧化能力,刺激大鼠神经系统的氧化应激增强[32],使大鼠神经系统发生氧化损伤。
综上,铝暴露可以通过Sirt1-Keap1/Nrf2 信号通路来调节大鼠神经系统氧化应激,也可以通过miR-128-3p 来调节大鼠神经系统氧化应激,Sirt1 又是miR-128-3p 的重要靶标[33],所以推测铝暴露可能通过调控miR-128-3p影响Sirt1-Keap1/Nrf2信号通路在大鼠神经系统抗氧化系统中的作用。即推测铝暴露可能通过激活大鼠神经系统miR-128-3p 的表达,抑制Sirt1-Keap1/Nrf2 信号通路,使其不能被激活发挥抗氧化能力,导致大鼠神经系统抗氧化系统失衡,造成氧化损伤,诱导大鼠的认知能力减弱。
