Klotho 蛋白在子痫前期患者胎盘外泌体中表达及其对血管内皮细胞氧化应激的影响
2024-01-05薛筱蕾胥保梅
薛筱蕾, 胥保梅
(新疆医科大学第五附属医院产科, 新疆 乌鲁木齐 830011)
子痫前期(pre-eclampsia,PE)作为一种妊娠特有的并发症,是导致母婴患病率和死亡率升高的主要原因[1]。PE 确切病因目前尚未完全阐明。滋养层细胞对子宫螺旋动脉的侵袭不足导致胎盘低灌注和缺血,诱导胎盘氧化应激激活,促进母体循环中炎性介质增加。这一系列的病理改变会导致母体内皮系统活化和功能障碍,从而诱发血管收缩和母体血管通透性增强,最终导致母体出现PE 的临床症状[2]。外泌体(exosomes,Exo)是一种直径为30~150 nm 的胞外囊泡,主要通过与靶细胞融合后释放其内部的蛋白质、脂质、RNA、DNA 和微小RNA (micro RNA,miRNA) 多种信号分子介导细胞间通讯[3]。研究[3-4]显示:来源于胎盘的Exo可与内皮细胞相互作用,在PE 的发生发展中发挥重要作用。
Klotho 蛋白是一种抗衰老蛋白,可参与多种病理过程,如动脉粥样硬化、高血压、急慢性肾脏疾病和糖尿病等[5]。研究[6]显示:Klotho 蛋白可能作为一种重要的体液因子参与氧化应激调节和内皮功能障碍等生物学反应。本课题组前期研究[7]证实:Klotho 蛋白主要表达于滋养细胞中,而PE 患者胎盘组织中Klotho 蛋白的表达较正常对照组明显降低,且母体血清中Klotho 蛋白表达水平与氧化应激产物丙二醛(malondialdehyde,MDA) 水平呈负相关关系,提示Klotho 蛋白可能是PE 的潜在预测指标,可能在PE 的发生发展中起重要作用。然而,Exo 作为妊娠期间胎盘组织与内皮细胞间的重要通信媒介,胎盘组织中Klotho 蛋白表达对内皮细胞功能的影响及其机制尚未完全阐明。本研究通过体内外实验探讨Klotho 蛋白在胎盘Exo 中的表达,并分析其对内皮细胞一氧化氮(nitric oxide,NO)合成和氧化应激的影响。
1 资料与方法
1.1 临床资料收集2020 年6 月—2021 年6 月于本科住院分娩孕产妇的临床资料,其中20 名为正常妊娠(normal pregnancy,NP)者,作为NP 组,其余20 例为PE 患者,作为PE 组。纳入标准:①PE 患者的诊断标准参考人民卫生出版社《妇产科学》(第9 版)[8];②孕产妇年龄为20~35 岁;③孕产妇为自然单胎受孕,无早产和宫内死胎等不良分娩史;④经阴道分娩,且临床资料完整,对本研究内容和目的表示知情理解,并自愿签署书面知情同意书。排除标准:①并发超重或肥胖、慢性高血压、糖尿病和肾脏疾病者;②多胎、胎儿染色体异常或先天性异常者。抽取2 组孕产妇每人5 mL空腹肘静脉血,并将其保存于-80℃冰箱。本研究经本院伦理委员会批准,并获得所有参与者的知情同意。
1.2 细胞、主要试剂和仪器人绒毛膜滋养层细胞(HTR-8/SVneo 细胞) 和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自中国典型培养物保藏中心。DMEM/F12 培养基、Lipofectamin 2000 转染试剂和TRIzol 试剂(美国Invitrogen 公司),肝素和1%青-链霉素混合液(美国Sigma 公司),内皮细胞生长因子(美国R&D 公司),胎牛血清(fetal bovine serum,FBS)(美国Gibco 公司), Klotho 过表达质粒载体(Klotho overexpression vector,oe-Klotho) 和过表达阴性对照质粒(overexpression vector negative control,oe-NC)(广州锐博生物技术有限公司),Exo 透射电镜简易操作试剂盒(北京西美杰科技有限公司),PrimeScrip™RT-qPCR 反转录试剂盒和SYBR®PreMix Ex Taq™Ⅱ试剂盒(日本TaKaRa公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)引物合成由上海生工生物工程公司完成,兔抗CD63 和肿瘤易感基因101(tumor susceptibility gene 101,TSG101)、胎盘碱性磷酸酶(placental alkaline phosphatase,PLAP)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS) 和β-actin 抗体(美国Abcam 公司),兔抗Klotho 抗体(美国Proteintech 公司),辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG) 和BCA 蛋白定量试剂盒(武汉博士德生物技术公司),NO 检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒和MDA 比色法检测试剂盒(南京建成生物工程研究所),活性氧(reactive oxygen species,ROS) 检测试剂盒(江苏碧云天生物技术有限公司)。 透射电子显微镜(transmission electron microscope,TEM)(型号:JEM-101,日本JEOL公司), NanoSight 仪器(型号: LM10, 英国Malvern 公司)。
1.3 胎盘Exo 分离取2 组研究对象肘静脉血,800 g 离心10 min,取上层血清,加入等量的磷酸盐缓冲液(phosphate buffer saline,PBS)稀释后,4 ℃、3 000 g 离心30 min,取上层组织清液,按照参考文献[9]的方法分离血浆中的胎盘Exo,200 μL PBS 缓冲液稀释后用于后续实验。
1.4 细胞培养、转染和滋养层细胞Exo 分离使用含10% FBS 和1%青-链霉素的DMEM/F12 培养基培养HTR-8/SVneo 细胞;HUVECs 培养于含10% FBS、0.1 g·L-1肝素、0.05 g·L-1内皮细胞生长因子和1% 青-链霉素的DMEM/F12 培养基中。2 种细胞均置于37 ℃、5%CO2的培养箱中培养。每2 d更换1次上述培养基,每5 d 细胞传代1 次。参考转染试剂Lipofectamin 2000 说明书方法将oe-Klotho 与oe-NC 质粒转染入HTR-8/SVneo 细胞中,分别为oe-Klotho 组和oe-NC 组。转染48 h 后采用RT-qPCR 和Western blotting 法检测2 组HTR-8/SVneo 细胞中Klotho mRNA 和蛋白表达水平。将生长状态良好的HTR-8/SVneo 细胞按每孔1.5×106个细胞的密度接种至100 mm 细胞培养皿中,将oe-Klotho 和oe-NC 质粒转染入HTR-8/SVneo 细胞中,采用不含Exo 的FBS 溶液于37 ℃、5%CO2培养箱中培养48 h 后,收集各组细胞培养上清液,按照参考文献[10]的方法采用超速离心法收集2 组滋养层细胞Exo,收集并重悬于200 μL PBS 缓冲液稀释后用于后续实验。
1.5 HUVECs 处理和分组取生长状态良好的HUVECs,胰酶消化后调整细胞密度至每孔2×105个细胞,接种至6 孔细胞培养板中,按照蛋白浓度5.0 g·L-1加入胎盘Exo 或滋养层细胞Exo 进行共培养,并按Exo 来源不同将HUVECs 分为PE-Exo组(与PE患者胎盘Exo共培养)、NP-Exo组(与NP 组胎盘Exo 共培养)、oe-Klotho 组(与转染oe-Klotho 的HTR8/SVneo 细胞Exo 共培养) 和oe-NC 组(与转染oe-NC 的HTR8/SVneo 细胞Exo共培养)。将不同来源的Exo与HUVECs于37 ℃、5%CO2培养箱中共培养24 h 后用于后续实验。
1.6 2 组研究对象胎盘Exo 和2 组滋养层细胞Exo鉴定采用TEM 按照说明书操作观察检测Exo 形态表现。Western blotting 法检测Exo 标记分子CD63、TSG101 和胎盘Exo 标记分子PLAP 蛋白表达水平。纳米示踪分析(nano tracing analysis,NTA) 检测Exo 大小、分布和浓度。使用膜标记绿色荧光染料PKH67 标记Exo,并将其于37 ℃、5%CO2培养箱与HUVECs 共孵育24 h 后,4%多聚甲醛固定细胞,0.01 g·L-1DAPI 试剂染核10 min,荧光显微镜观察HUVECs 对Exo 的摄取情况。
1.7 酶 联 免 疫 吸 附 试 验(enzyme-linked immunosorbent assay,ELISA)法 检 测 各 组HUVECs中NO、ROS和MDA水平及SOD活性取各组经过Exo 处理的HUVECs,参考NO 检测试剂盒说明书方法检测各组细胞培养上清液中NO 水平,NO 水平(mmol·L-1)=标准液浓度(mmol·L-1)×标准液体积(L)/待测样品体积(L)。加入DCFDA 试剂进行染色,室温下避光孵育30 min,PBS 缓冲液充分洗涤后,荧光显微镜下观察细胞,采用Image J 软件分析平均荧光强度,平均荧光强度=该区域荧光强度总和/该区域面积,以平均荧光强度代表细胞中ROS 水平。采用RIPA 裂解液于冰上裂解细胞,4 ℃、12 000 g 离心10 min 后收集细胞上清液,参考MDA 检测试剂盒说明书方法,采用酶标仪检测波长532 nm 处吸光度(A)值,计算各组细胞中MDA 水平。超声热裂解法进行裂解细胞,参考SOD 活性检测试剂盒说明书方法,采用酶标仪检测波长560 nm 处A 值,计算各组细胞中SOD 活性。以上实验均单独重复3 次。
1.8 RT-qPCR 法检测2 组研究对象胎盘Exo 和2组滋养层细胞Exo Klotho mRNA 及各组HUVECs中eNOS mRNA 表达水平使用TRIzol 试剂提取Exo 或细胞中总RNA,PrimeScrip™RT-qPCR 逆转录试剂盒反转录为cDNA。使用SYBR®PreMix Ex Taq™Ⅱ试剂盒对cDNA 样品进行RT-qPCR 反应。反应条件:95 ℃、10 min,95 ℃、15 s,60 ℃、1 min,共40个循环。引物序列:Klotho 上游引物5′-ACTCCCCCA-GTCAGGTGGCGGTA-3′,Klotho 下游引物5′-TGG-GCCCGGGAAACCATTGCTGTC-3′;eNOS 上游引物 5′-GGAGAGGCTGCATGACATTG-3′,eNOS 下游引物5′-GGTAGAGCCATAGTGGAATGAC-3′;β-actin上游引物 5′-GTCACCAACTGGGACGATA-3′,β-actin上游引物 5′-GGGGTGTTGAAGGTCTCAAA-3′。采用2-∆∆Ct法计算2 组研究对象胎盘Exo 和2 组滋养层细胞Exo 中Klotho mRNA 及各组HUVECs 中eNOS mRNA 表达水平。每个样品设置5 个复孔,实验单独重复3 次。
1.9 Western blotting 法检测2 组研究对象胎盘Exo 和2 组滋养层细胞Exo 中CD63、TSG101 和Klotho 蛋白及各组HUVECs 中eNOS 蛋白表达水平采用含蛋白酶抑制剂的RIPA 裂解液提取待测Exo 和细胞中的总蛋白。BCA 蛋白定量试剂盒检测蛋白质浓度。10%SDS-PAGE 凝胶电泳法分离蛋白,转移至聚偏氟乙烯膜上。室温下采用5%牛血清白蛋白封闭抗体1 h,然后加入一抗CD63(1∶800)、 TSG101 (1∶800)、 PLAP (1∶800)、Klotho(1∶1 000)、eNOS (1∶800) 和β-actin(1∶2 000),4 ℃孵育过夜,充分洗膜后加入辣根过氧化物酶标记的山羊抗兔二抗(1∶2 000),室温下孵育1 h。加入适量的增强型化学发光工作液,凝胶成像系统中显影,采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。实验单独重复3 次。
1.10 统计学分析采用SPSS 21.0 统计软件进行统计学分析。2 组研究对象胎盘Exo 中CD63、TSG101 和PLAP 蛋白表达水平及Klotho mRNA 和蛋白表达水平,2组滋养层细胞Exo和各组HUVECs中eNOS mRNA 和蛋白表达水平,各组HUVECs中NO、ROS 和MDA 水平及SOD 活性均符合正态分布,以±s表示,2 组间样本均数比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组研究对象临床资料与NP组比较,PE 组患者收缩压和舒张压均升高(P<0.05),Klotho 蛋白表达水平和胎儿出生体质量及胎盘质量均明显降低(P<0.05 或P<0.01)。2 组研究对象临床资料见表1。
表1 2 组研究对象临床资料Tab.1 Clinical data of subjects in two groups(n=20,±s)

表1 2 组研究对象临床资料Tab.1 Clinical data of subjects in two groups(n=20,±s)
*P<0.05,**P<0.01 compared with NP group.
?
2.2 2 组研究对象胎盘Exo 和2 组滋养层细胞Exo鉴定TEM 观察可见来源于2 组研究对象胎盘Exo 均呈圆形和椭圆形的囊泡盘状结构,包膜完整,形状相似,直径为50~100 nm。2 组研究对象胎盘Exo 均高表达Exo 标记蛋白CD63 和TSG101 及胎盘特异性蛋白PLAP。NTA 检测结果显示:2组研究对象胎盘Exo的粒径为50~200 nm。提示由2 组研究对象外周血分离的囊泡均是胎盘来源Exo。见图1~3。TEM、Western blotting和NTA结果可证实来源于oe-NC 组和oe-Klotho 组滋养层细胞囊泡Exo 的典型结构分子标志物和粒径大小特征。见图4~6。
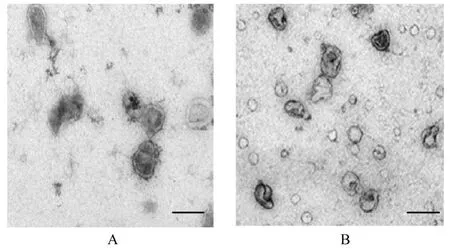
图1 TEM 观察2 组研究对象胎盘Exo 形态表现(Bar=100 μm)Fig. 1 Morphology of placenta Exo of subjects in two groups observed by TEM (Bar=100 μm)
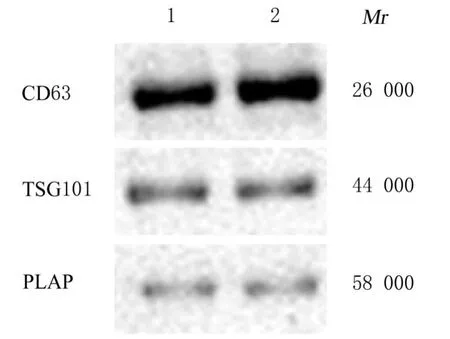
图2 Western blotting 法检测2 组研究对象胎盘Exo中CD63、TSG101 和PLAP 蛋白表达情况Fig. 2 Expressions of CD63, TSG101, and PLAP proteins in placenta Exo of subjects in two groups detected by Western blotting method
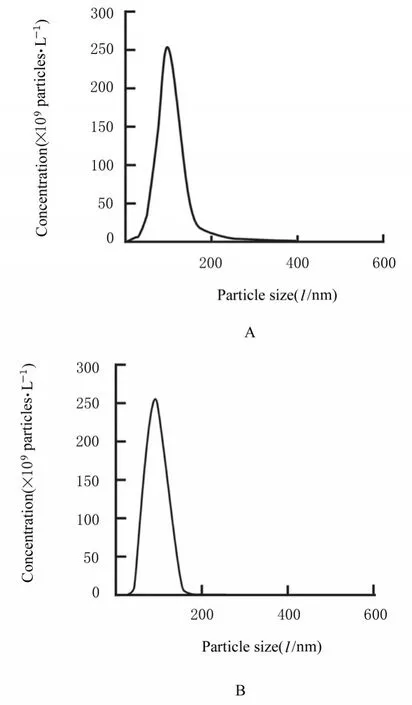
图3 NTA 检测2 组研究对象胎盘Exo粒径大小和浓度Fig. 3 Particle sizes and concentrations of placenta Exo of subjects in the two groups detected by NTA
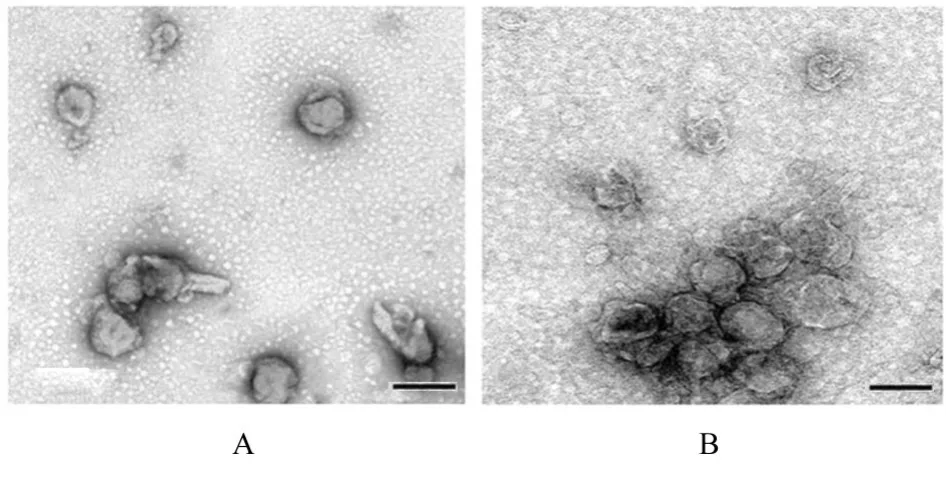
图4 TEM观察2组滋养层细胞Exo形态表现(Bar=100 μm)Fig. 4 Morphology of Exo in trophoblast cells in two groups observed by TEM (Bar=100 μm)
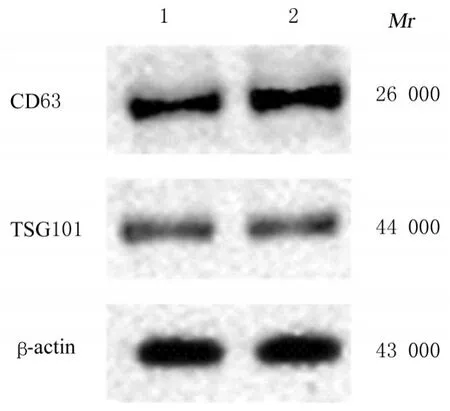
图5 Western blotting 法检测2 组滋养层细胞Exo 中CD63 和TSG101 蛋白表达情况Fig. 5 Expressions of CD63 and TSG101 proteins in Exo in trophoblast cells in two groups detected by Western blotting method
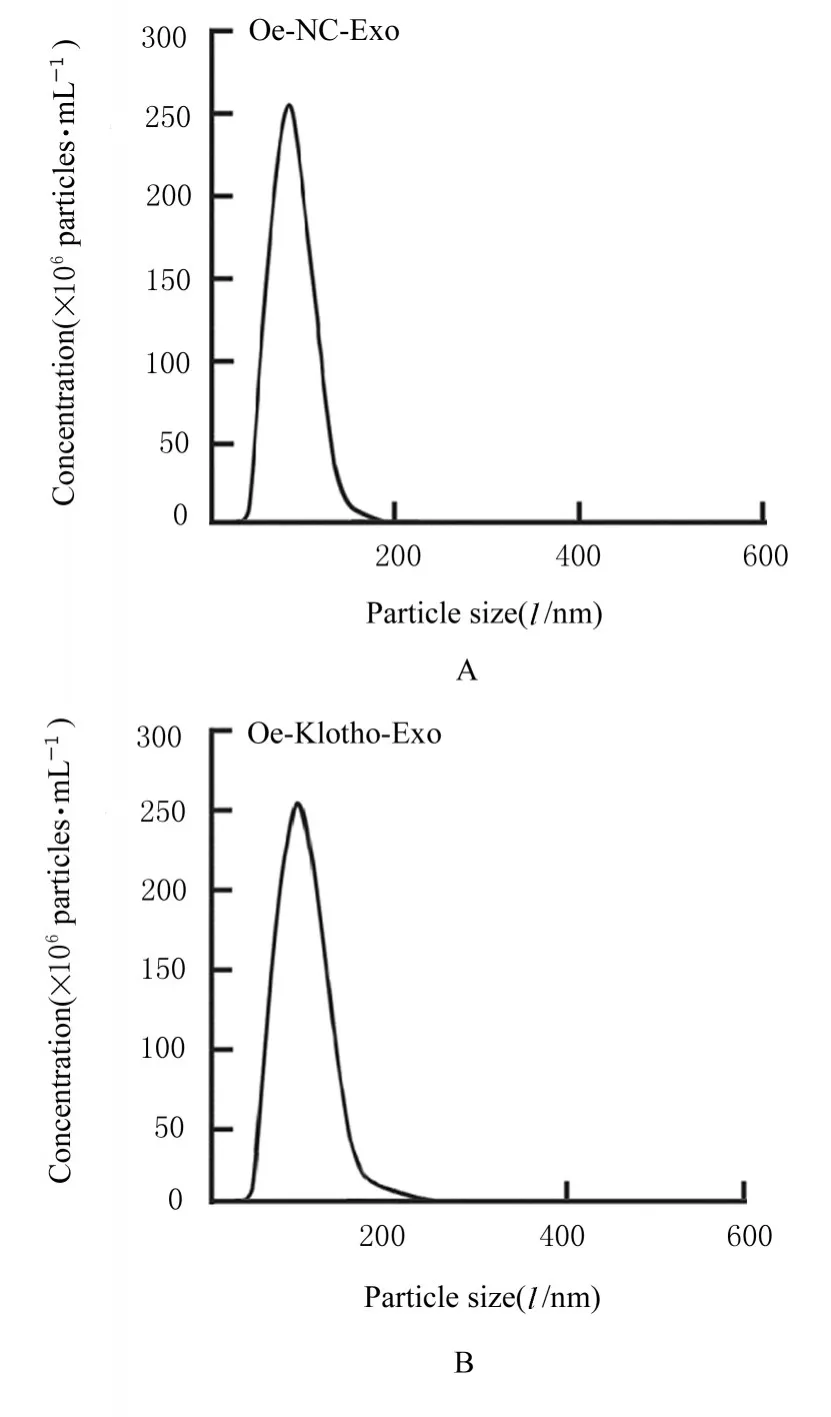
图6 NTA 检测2 组滋养层细胞Exo 粒径大小和浓度Fig. 6 Particle sizes and concentrations of Exo in trophoblast cells in two groups detected by NTA
2.3 HUVECs 摄取2 组研究对象胎盘Exo 和2 组滋养层细胞Exo 情况HUVECs 中均可见到明显的PKH67 标记的Exo 绿色荧光表达,与DAPI 染色融合后可见绿色荧光在细胞中表达。提示2 组研究胎盘Exo 和2 组滋养层细胞Exo 可被HUVECs 摄取。见图7。
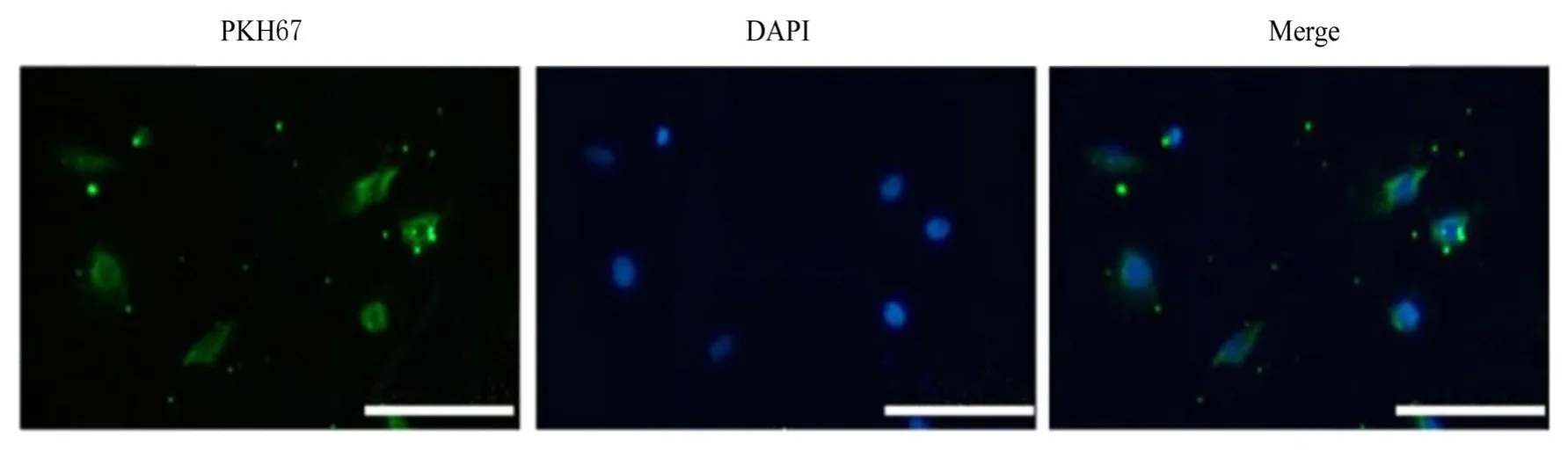
图7 荧光显微镜观察HUVECs 摄取胎盘Exo(Bar=25 μm)Fig. 7 Uptake of placenta Exo by HUVECs observed under fluorescence microscope (Bar=25 μm)
2.4 各组HUVECs 中NO、ROS 和MDA 水平及SOD 活性与NP-Exo 组 (3.42 mmol·L-1±0.87 mmol·L-1)比较,PE-Exo 组HUVECs 中NO水平(1.29 mmol·L-1±0.70 mmol·L-1) 降低(P<0.05);与oe-NC-Exo 组(2.24 mmol·L-1±0.71 mmol·L-1)比较,oe-Klotho-Exo 组HUVECs中NO 水平(4.68 mmol·L-1±0.93 mmol·L-1)升高(P<0.05)。 与NP-Exo 组(413.26±70.53)比较,PE-Exo 组HUVECs 中ROS 水平(947.08±52.11) 明显升高(P<0.01);与oe-NC-Exo 组(672.59±77.48)比较,oe-Klotho-Exo组HUVECs中ROS 水平(225.10±54.13) 明显降低(P<0.01)。与NP-Exo 组比较,PE-Exo 组HUVECs 中SOD 活性明显降低(P<0.01),MDA 水平升高(P<0.05);与oe-NC-Exo组比较,oe-Klotho-Exo组HUVECs 中SOD 活性升高(P<0.05),MDA 水平降低(P<0.05)。见图8 和9。
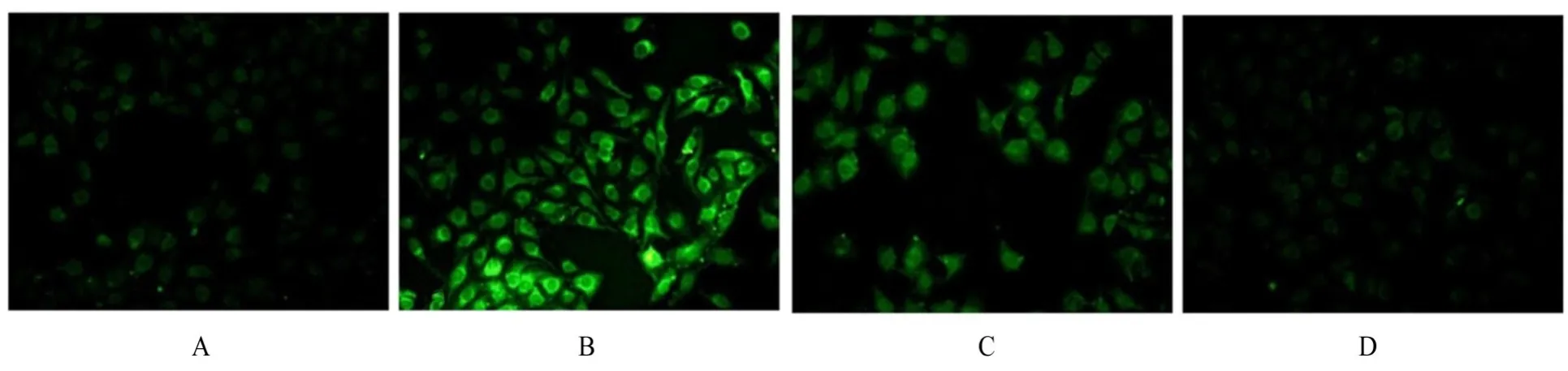
图8 DCFDA 荧光染色法检测各组HUVECs 中ROS 水平(×400)Fig. 8 Level of ROS in HUVECs in various groups detected by DCFDA fluorescence staining(×400)
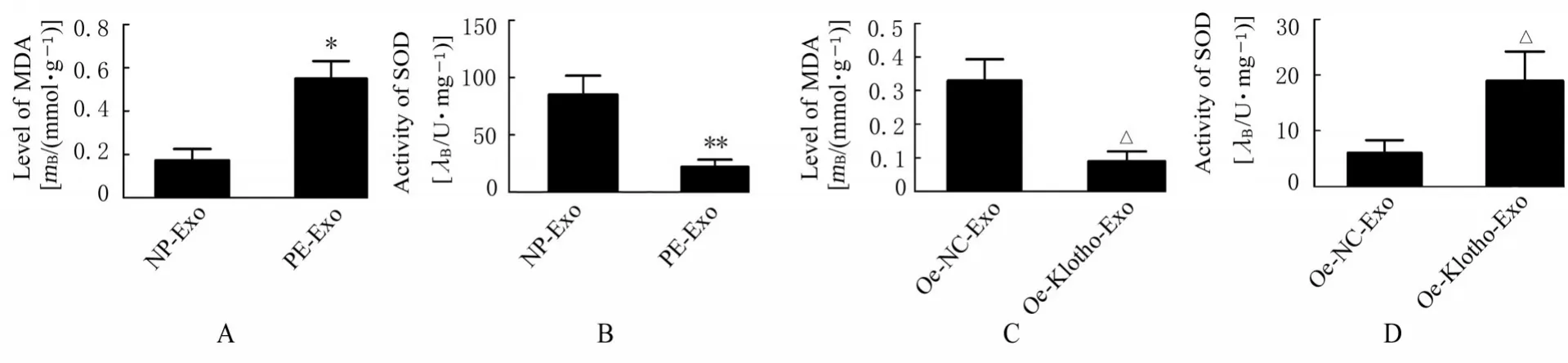
图9 各组HUVECs 中MDA 水平和SOD 活性Fig. 9 Levels of MDA and activities of SOD in HUVECs in various groups
2.5 2 组研究对象胎盘Exo 和2 组滋养层细胞Exo中Klotho mRNA 及各组HUVECs 中eNOS mRNA表达水平与NP 组(1.03±0.09)比较,PE 组研究对象胎盘Exo 中Klotho mRNA 表达水平(0.42±0.15) 明显降低(P<0.01)。与NP-Exo组(1.01±0.11) 比较,PE-Exo 组HUVECs 中eNOS mRNA 表达水平(0.25±0.07) 明显降低(P<0.01)。 与oe-NC 组(1.01±0.08) 比较,oe-Klotho 组滋养层细胞Exo 中Klotho mRNA 表达水平(4.33±0.29) 明显升高(P<0.01)。与oe-NC-Exo 组(1.03±0.18)比较,oe-Klotho-Exo组HUVECs 中eNOS mRNA 表达水平(2.27±0.31)明显升高(P<0.01)。
2.6 2 组研究对象胎盘Exo 和2 组滋养层细胞Exo中Klotho 蛋白及各组细胞中eNOS 蛋白表达水平与NP 组比较,PE 组研究对象胎盘Exo 中Klotho 蛋白表达水平明显降低(P<0.01)。与NP-Exo 组比较,PE-Exo 组HUVECs 中eNOS 蛋白表达水平明显降低(P<0.01)。与oe-NC 组比较,oe-Klotho 组滋养层细胞Exo 中Klotho 蛋白表达水平明显升高(P<0.01)。与oe-NC-Exo 组比较,oe-Klotho-Exo 组HUVECs 中eNOS蛋白表达水平均明显升高(P<0.01)。见图10~12。
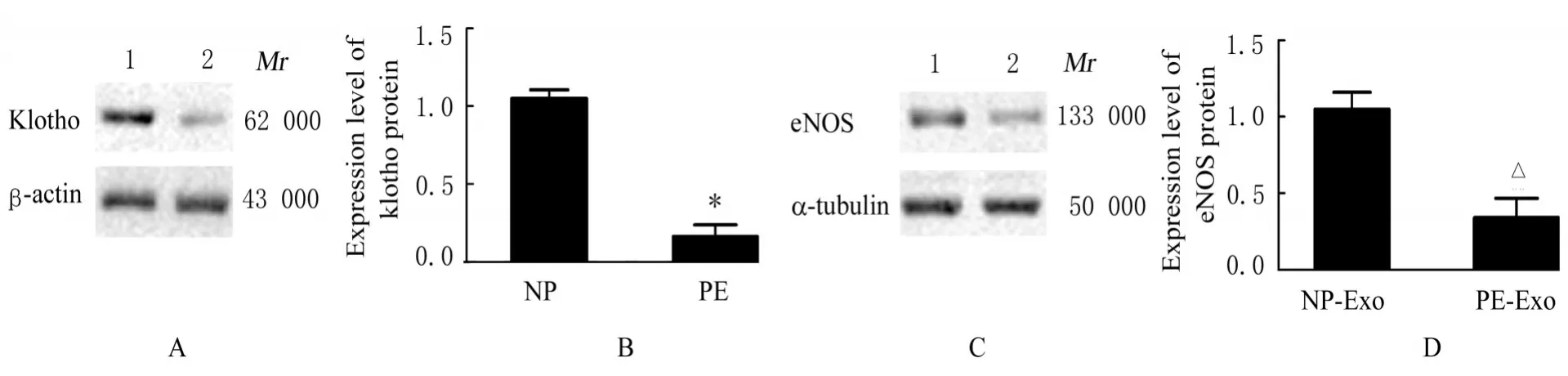
图10 2 组研究对象胎盘Exo 中Klotho 蛋白和各组HUVECs 中eNOS 蛋白表达情况Fig. 10 Expressions of Klotho protein in plancenta Exo of subjects in two groups and expression of eNOS protein in HUVECs in various groups
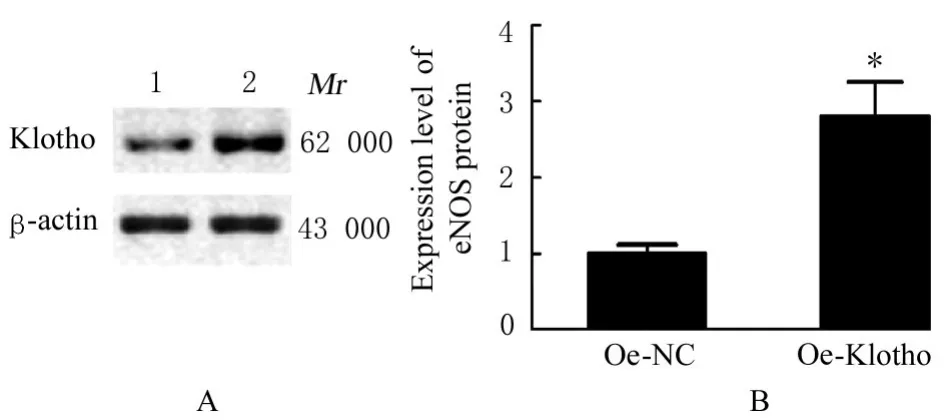
图11 2 组滋养层细胞Exo 中Klotho 蛋白表达电泳图(A)和直条图(B)Fig. 11 Electrophoregram (A) and histogram (B) of expressions of Klotho protein in Exo in trophoblast cells in two groups
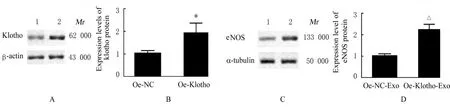
图12 2 组滋养层细胞Exo 中Klotho 和HUVECs 中eNOS 蛋白表达情况Fig. 12 Expressions of Klotho protein in Exo in trophoblast cells and expressions of eNOS protein in HUVECs in two groups
3 讨 论
PE 不仅严重威胁母婴健康,而且还会增加患者远期罹患冠心病、中风和心血管疾病的风险[1-2]。PE 和心血管疾病具有内皮功能障碍、肥胖、胰岛素抵抗、糖尿病、高血压和血脂异常等多种共同危险因素[11]。本研究结果显示:在PE 患者胎盘Exo中下调Klotho 蛋白表达可降低内皮细胞中NO 水平,促进细胞氧化应激反应,而过表达滋养层细胞中Klotho 蛋白可通过Exo 途径传递至HUVECs 中逆转上述现象。
Klotho 蛋白功能变异与人类寿命缩短和冠状动脉疾病的发生发展有关[12]。研究[13]显示:Klotho蛋白具有膜结合形式和可溶性形式,其中以可溶性形式占据主导地位,其主要在肾脏中表达,在胎盘、卵巢、前列腺和小肠等组织及器官中也有发现。可溶性Klotho 蛋白主要参与调节内皮细胞中NO 的产生和肾脏中钙稳态等生理反应[13]。研究[14]显示:在PE 发生期间,由于缺血等情况,胎盘床上血管病变与急性动脉粥样硬化样变相似,具有纤维化、泡沫细胞、成纤维细胞增殖和单个核细胞对血管周围的浸润等共同特征。氧化应激在动脉粥样硬化的发生发展中起重要作用,也可能参与母体胎盘组织缺血的发生。氧化应激和急性动脉粥样硬化样变可能是PE 患者心血管疾病风险增加的主要原因[15-16]。因此,Klotho 蛋白可能反映氧化应激与PE 间的潜在联系。此外,Klotho 蛋白缺陷小鼠表现出血管生成受损,与内皮细胞衍生的NO 水平降低有关,且动物体内可溶性Klotho 蛋白的过度表达可通过诱导对氧化应激的抵抗,避免组织氧化损伤进而保护心血管和肾脏功能[17-19]。研究[7,20-21]显示:Klotho 蛋白在PE 患者外周血和胎盘组织中的表达明显低于健康对照组,提示胎盘Klotho 蛋白可能间接调节某些靶器官参与PE 的发生发展,使其有望成为预测PE 的潜在生物标志物。
Exo 可作为细胞间通讯的重要媒介,妊娠期间Exo 在调节胎盘组织与外周血管内皮细胞之间的细胞间通讯发挥重要作用。JIA 等[22]发现:与来源于胎儿脐带血的Exo 比较,来源母体血清的胎盘Exo 促进HUVECs 的增殖、迁移和成管能力,这可能与胎盘Exo 中独特miRNAs 表达谱有关。SHEN 等[23]研究显示:在PE 患者胎盘Exo 中异常高表达的miR-155 可能会靶向抑制内皮细胞中eNOS 的转录和表达,进而促进PE 患者内皮细胞功能障碍。本研究结果显示:来源于PE 患者的胎盘Exo 可明显降低HUVECs 中NO 水平,下调eNOS 蛋白表达,导致NO 的生物利用度降低,进而使其扩血管作用减弱。同时,PE 来源的胎盘Exo 还可导致HUVECs 中氧化应激水平升高,表现为细胞中ROS 和MDA 水平升高和具有抗氧化作用的SOD 活性降低。氧化应激的过度激活会损伤内皮细胞结构,并诱发功能障碍[15]。上述内皮细胞的一系列病理变化均可由Klotho 表达不足引起,而Klotho 在PE 患者胎盘Exo 中的表达也呈异常降低现象[17]。本研究结果显示:过表达Klotho 的滋养层细胞Exo 可明显降低HUVECs 中NO 的产生,并减少氧化应激反应,提示PE 患者胎盘组织中Klotho 表达下调可能参与血管内皮细胞功能障碍的机制。
综上所述,来源于PE 患者的胎盘Exo 可通过抑制血管内皮细胞中NO 的产生和促进氧化应激水平以损伤内皮细胞的功能,而过表达Klotho 的滋养层细胞Exo 可减少HUVECs 中NO 的产生和氧化应激水平。
