胎鼠神经干细胞原代培养及传代条件优化
2024-01-05朱文豪刘天一张晓宇王海峰
朱文豪, 刘天一, 何 川, 张晓宇, 辛 强, 王海峰
(吉林大学第一医院神经创伤外科,吉林 长春 130021)
目前普遍认为中枢神经元在人出生后短时间便会失去再生能力,成人神经细胞一旦受损死亡便无法更新[1]。研究[2]显示:成年哺乳动物的侧脑室下层和海马齿状回区仍可以不断产生新的神经干细胞(neural stem cells,NSCs),并且这种细胞可以通过迁移对损伤脑组织进行替代和修复。因此,基于神经干细胞移植的治疗方法成为研究热点[3-5]。细胞疗法通过在损伤处移植NSCs,实现外源性神经替代。同时移植的NSCs 能够释放多种营养因子调节宿主微环境,促进神经再生并减少继发性损伤,限制宿主星形胶质细胞活化以减少神经胶质瘢痕形成[4,6-7]。研究[8-10]显示:NSCs 在传代培养后的活性受培养基成分、生长因子浓度、消化时长和吹打力度等方面的影响,但传代的细胞密度和传代时神经球大小对NSCs 活性影响及其作用效果尚未完全阐明。本研究在原代培养NSCs 的基础上,探讨传代的细胞密度和神经球大小对神经干细胞活性的影响,为优化NSCs 的体外培养条件提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器孕12~14 d SPF级SD 大鼠,无特定病原体动物,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号: SCXK (京) 2021-0006。 磷酸盐缓冲液(phosphate buffer saline,PBS)、DMEM/F12 培养基、1%青-链霉素混合液、谷氨酰胺和非必需氨基酸(北京索莱宝科技有限公司),B27 神经干细胞培养补充剂、Accutase 消化酶和钙黄绿素Calcein-AM(美国Gibco 公司),表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF) (美国Peprotech 公司),无血清细胞冻存液(苏州新赛美生物科技有限公司),4%多聚甲醛溶液、兔抗鼠巢蛋白Nestin 抗体和A488 标记的山羊抗兔免疫球蛋白G (immunoglobulin G,IgG) 二抗(英国Abcam 公司)、碘化丙啶(propidium iodide,PI)和Hoechst 33342 (上海碧云天生物技术有限公司)。40 μm 和70 μm 无菌尼龙细胞滤网及CO2培养箱(美国Thermo 公司),激光共聚焦显微镜(日本尼康公司),正置荧光显微镜(日本Olympus公司)。
1.2 胎鼠NSCs 原代培养胎鼠NSCs 原代分离培养方法参考相关文献[9,11]并进行改良。采用DMEM/F12 培养基、20 μg·L-1EGF、20 μg·L-1bFGF、2% B27、1%青-链霉素、1%非必需氨基酸和1%谷氨酰胺配制NSCs 增殖培养基。取材应用的手术器械洗净后高压蒸汽灭菌,然后置于65 ℃烘箱中干燥备用。孕12~14 d SD 大鼠颈椎脱位法处死后采用75%酒精浸泡消毒20 min。将消毒后的大鼠置于相对洁净的手术台中剖腹,取出胚胎后转移至无菌超净台中。去除胎膜,剪下胎鼠头部后PBS 缓冲液洗净置于冰上备用。以显微弯镊插入胎鼠眼眶处固定头部,显微剪沿大脑中线剪开新生的薄层颅骨,再用小弯镊将胎鼠神经节挤压出,置于盛有PBS 缓冲液的培养皿中。将脑组织表面的杂质洗净,显微镊小心剥离脑组织表面的微血管。全部胚胎处理结束后,将收集的脑组织使用显微剪剪碎,巴氏管吹打20~30 下,1 mL 移液枪吹打5~10下。将制得的悬液依次过40 μm 和70 μm 细胞筛网。收集细胞悬液于离心管中,1 500 r·min-1室温离心5 min,加培养基重悬细胞并计数,以1~1.6×105·mL-1的细胞密度接种于T25 或T75 培养瓶中。取培养48~72 h 的细胞, 收集培养液1 500 r·min-1室温离心5 min, 加入2 mL 的Accutase 消化酶并转入3.5 cm 培养皿中,于37 ℃的CO2培养箱中消化5~10 min。每隔2 min 取出培养皿于光学显微镜下观察细胞消化情况,直至NSCs 消化完全并均匀分散,加入4 mL 培养基终止消化。收集悬液1 500 r·min-1室温离心5 min。传代的细胞加培养基重悬、计数并接种细胞。冻存的细胞加入1 mL 无血清细胞冻存液,重悬后于-80 ℃冰箱冻存,长期保存需转移至液氮。
1.3 巢蛋白免疫荧光染色鉴定NSCs多聚赖氨酸包被细胞爬片,将24 孔细胞爬片浸泡于多聚赖氨酸溶液中,5~10 min 后用PBS 缓冲液洗涤3 次,超净台中室温晾干备用。取传代后培养48 h 的NSCs,接种于预先包被多聚赖氨酸细胞爬片的24 孔细胞培养板中,孵育2 h 使细胞贴壁。于培养板中将爬片采用4%多聚甲醛溶液固定30 min 以上,PBS 缓冲液洗涤3 次。0.5% Triton X-100 溶液室温打孔30 min,PBS 缓冲液洗涤3 次。5%牛血清白蛋白溶液室温下封闭1 h 后,滴加兔抗鼠巢蛋白单克隆抗体(1∶100)孵育过夜。PBS 缓冲液洗涤3 次后加入A488 标记山羊抗兔二抗,室温避光孵育2 h,PBS 缓冲液洗涤3 次。采用含DAPI 的抗荧光淬灭封片剂封片,正置荧光显微镜下观察NSCs 并进行图像采集。
1.4 神经球直径测定取培养第3 代的NSCs,以1.0×104、2.0×104、6.0×104、1.0×105、1.6×105和2.0×105mL-1的细胞密度接种于6 孔细胞培养板中,每孔2 mL 培养液。培养48 h 后形成神经球。采用光学显微镜观察神经球形态表现并进行图像采集。每个传代密度重复3个复孔,每个孔内选取随机3个视野成像。采用Image J 1.47v软件分析神经球直径。
1.5 活死细胞染色法检测神经球中NSCs 存活率取传代后72 h 的神经球,培养液中加入终浓度5 μmol·L-1钙黄绿素AM、0.5 g·L-1PI 和5 mg·L-1Hoechst 33342,于室温静置10 min。采用倒置荧光显微镜观察并调整焦距后对神经球最大直径视野进行图像采集。采用Image J 1.47v 软件分别对神经球的直径、该视野下总细胞面积和死细胞面积进行定量分析,计算细胞存活率。细胞存活率=(总细胞面积-死细胞面积)/总细胞面积×100%。
1.6 统计学分析采用SPSS 21.0 统计软件进行统计学分析,GraphPad Prism 8.0 软件绘制图像。各细胞传代密度下神经球直径和细胞存活率均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 神经球中NSCs 鉴定培养的NSCs 呈巢蛋白阳性,且直径约40 μm 神经球中心部分巢蛋白的表达量最高。有少量散在的单个细胞呈巢蛋白阳性,偶尔可见呈巢蛋白阴性的细胞,考虑是由于传代过程中发生凋亡或贴壁后细胞迅速失去干性所导致的。因此,培养的细胞呈较强的巢蛋白表达,提示培养出的细胞为NSCs。见图1。
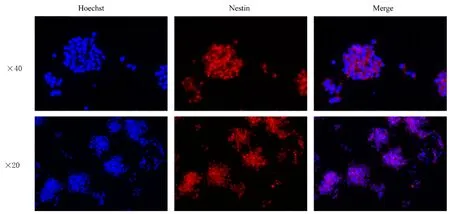
图1 巢蛋白抗体免疫荧光染色法鉴定神经球中NSCsFig. 1 NSCs in neurospheres identificated by nestin antibody immunofluorescence staining method
2.2 传代NSCs 形态表现传代48 h 后NSCs 呈聚集生长趋势,形成神经球。细胞球大小不均一,直径为76.41~306.79 μm,平均直径为(152.72±47.52)μm。NSCs 生长方式呈牢固细胞间黏附聚集模式,球与球之间少有单独的细胞散在。大部分NSCs 聚集呈圆球形或椭圆球形,也有部分因球与球之间的粘连呈串珠状。神经球中细胞间连接紧密且缝隙较小,形成紧密的球形结构。见图2 和3。
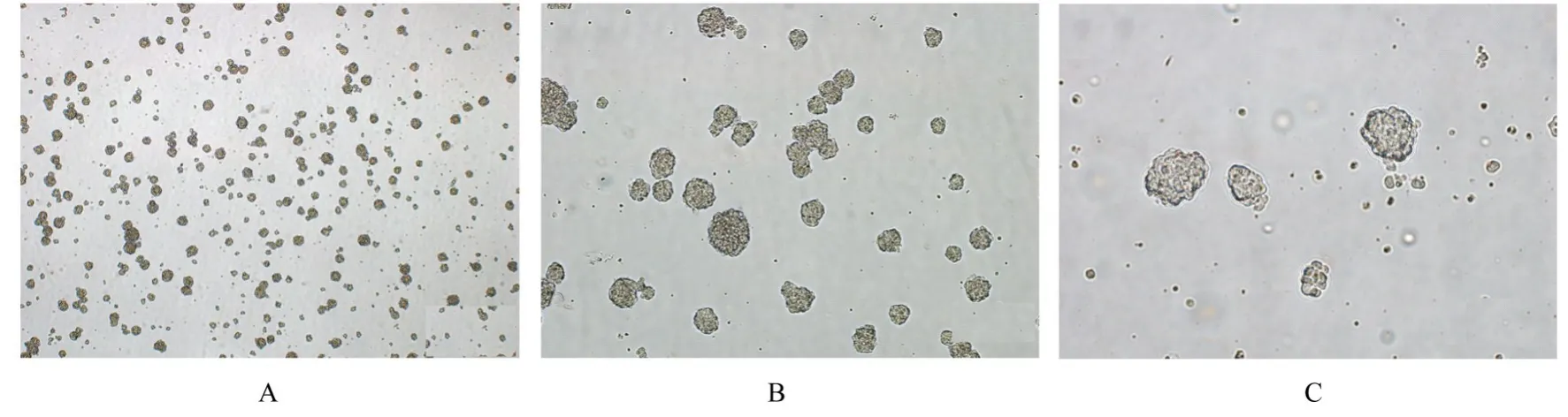
图2 倒置显微镜观察NSCs 传代培养48 h 后神经球形态表现Fig. 2 Morphology of neurospheres after 48 h of subculture of NSCs observed by inverted microscope
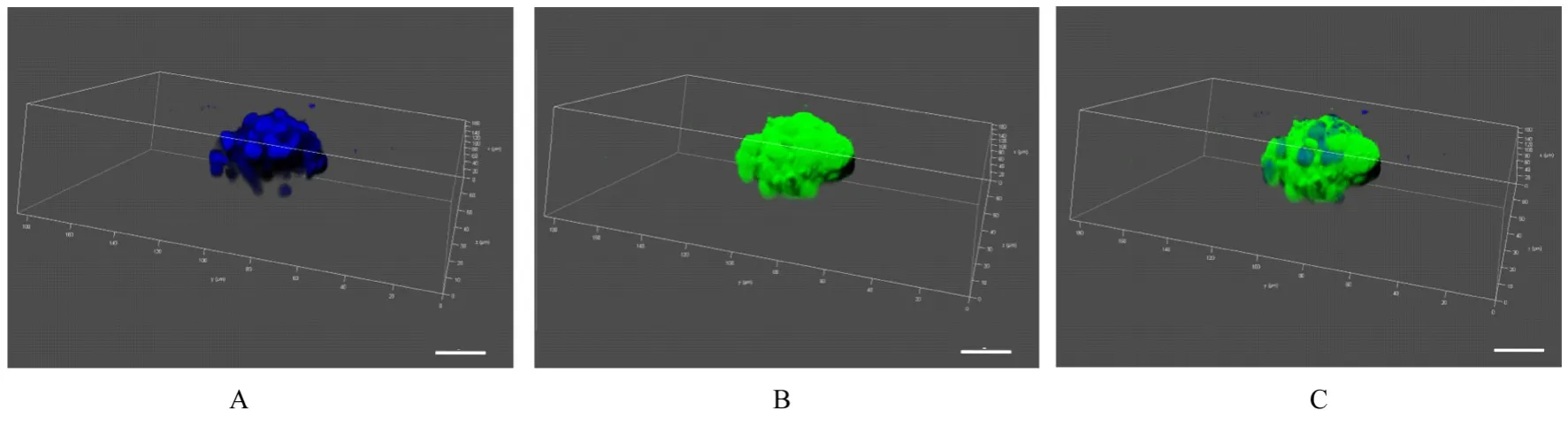
图3 共聚焦显微镜观察活死细胞染色神经球的形态表现(Bar=20 μm)Fig. 3 Morphology of neurospheres with live-death cell staining observed by confocal microscope(Bar=20 μm)
2.3 不同传代密度神经球直径与2.0×104mL-1传代密度(39.01 μm±12.37 μm) 比较,6.0×104mL-1和1.0×105mL-1传代密度的神经球直径(61.99 μm±22.87 μm 和79.72 μm±25.31 μm)增加(P<0.05);1.0×105mL-1、1.6×105mL-1(86.11 μm±30.00 μm)和2.0×105mL-1(79.69 μm±18.43 μm) 传代密度的神经球直径比较差异无统计学意义(P>0.05)。见图4。
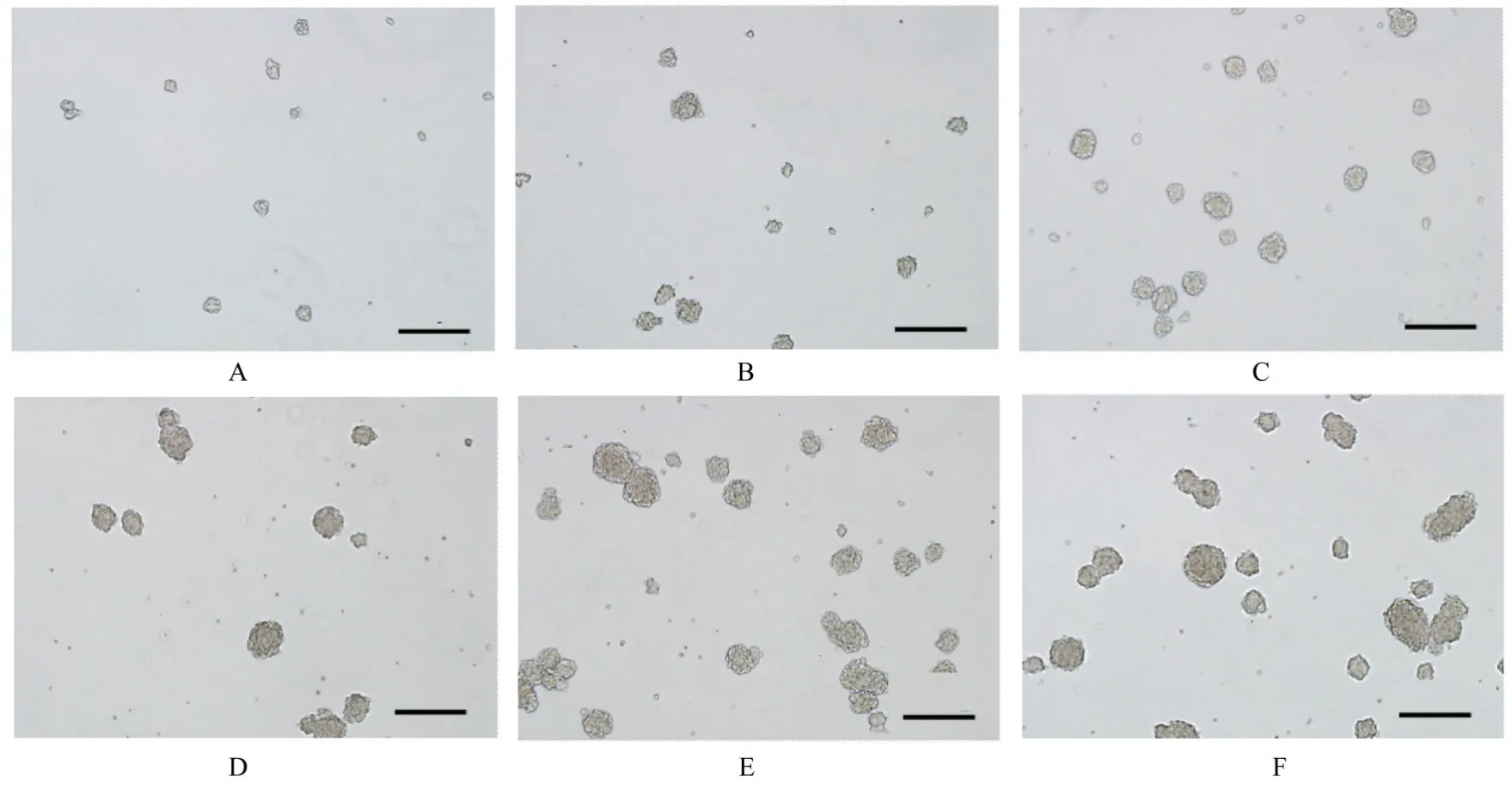
图4 光学显微镜观察不同传代密度神经球直径(Bar=200 μm)Fig. 4 Neurosphere diameters at different transmission densities observed by light microscope(Bar=200 μm)
2.4 不同直径神经球中NSCs 存活率0~40 μm(91.92%±9.69%)、 40~60 μm (87.25%±8.27%)、60~80 μm (78.98%±5.79%) 和80~100 μm 神经球(80.24%±4.93%) 中NSCs 存活率比较差异无统计学意义(P>0.05)。与0~40 μm、60~80 μ m 和80~100 μ m 神经球比较,100~200 μm 神经球中 NSCs 存活率 (65.12%±5.20%)降低(P<0.05)。见图5。
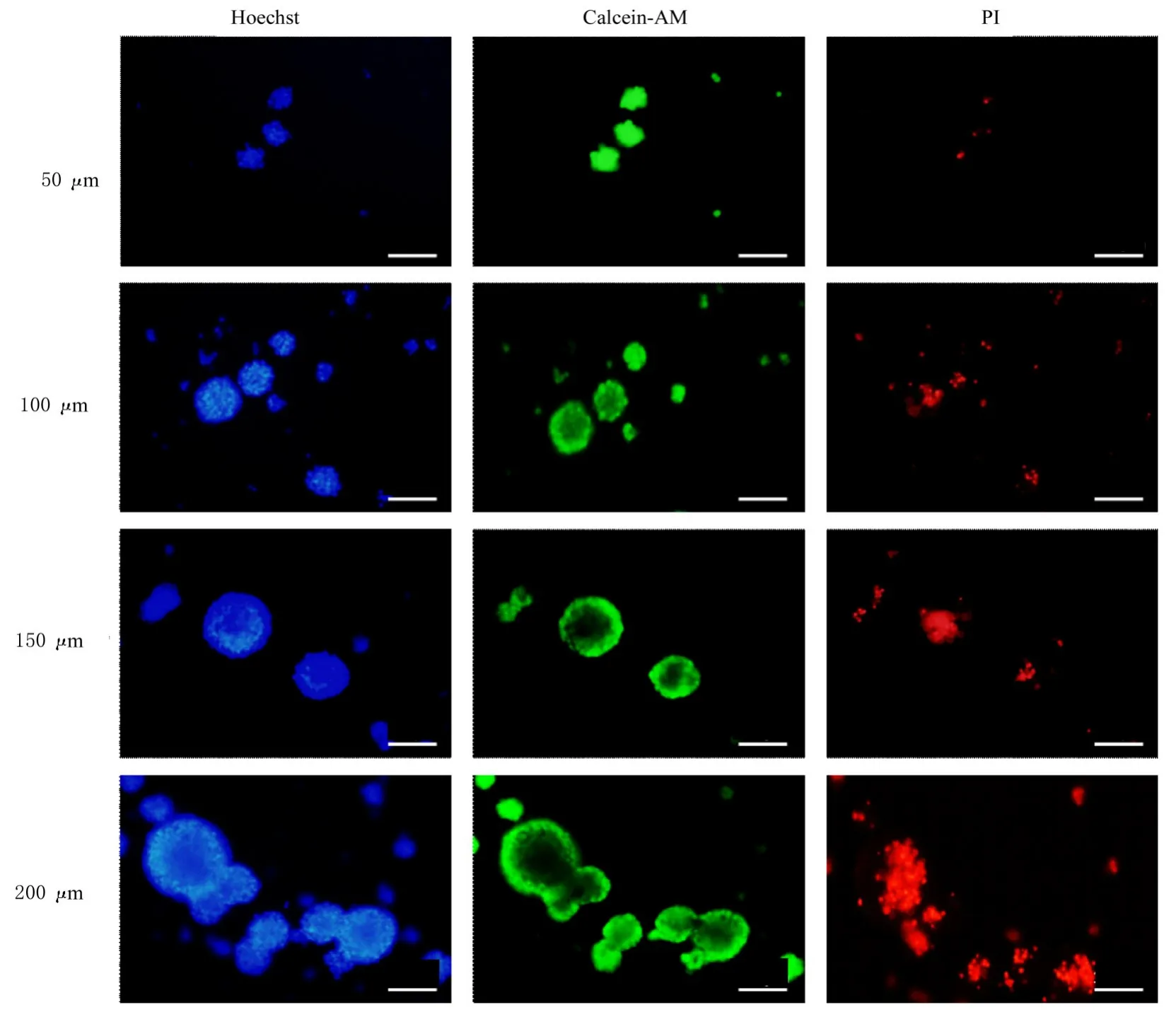
图5 不同直径神经球中NSCs 活性(活死细胞染色,Bar=100 μm)Fig. 5 Activity of NSCs in neurospheres with different diameters(Live-dead cell staining,Bar=100 μm)
3 讨 论
原代提取的NSCs 质量受胎鼠的成熟度、干细胞提取分离方法和传代扩增条件等多个方面的影响,其中首要影响因素为胎鼠发育情况[12]。研究[12-13]显示:发育早期小鼠的螺旋神经节较发育晚期小鼠含有更多的有丝分裂干细胞,同时在孕10.5~14.5 d 的大鼠宫内提取的胎鼠NSCs 细胞活性增加并达到高峰,并于发育后期细胞活性逐渐减弱。因此,NSCs 原代提取的时机对于保持干细胞活性尤为关键。本研究结果显示:采用孕11~14 d的胎鼠可获得能够稳定快速扩增的NSCs,不足孕11 d 胎鼠提取NSCs过少且扩增效率低,超过孕14 d的胎鼠由于发育成熟度较高使获取的NSCs 聚球和增殖活性较差。此外,在NSCs 提取分离过程中有效地分离出单细胞是提升NSCs 质量的关键。研究[9]显示:采用1 mL 枪头反复吹打可以使脑组织迅速分散,但过度吹打易使细胞增殖活性减弱。本研究结果显示:巴氏管吹打20~30 下后1 mL 移液枪吹打5~10 下的分离条件可以在不影响细胞活性前提下高效分离NSCs。
传代的细胞密度较大程度上决定NSCs 的扩增效率,关于传代密度的条件尚未完全统一。有学者[10-11,13-15]采用1×105mL-1和2×105mL-1的传代密度培养5~7 d 消化传代; 研究[16-17]采用5×105mL-1的传代密度培养7 d 消化传代;也有研究[18-19]采用1×106mL-1的传代密度以机械切割分离球的方式传代。NSCs 属于聚团成簇生长类型细胞,细胞在生长过程中会不断分泌营养物质以保持自身生长的环境。因此,细胞传代密度会较大地影响NSCs 的生长环境,过少的细胞会在培养过程中因自身营养物质分泌不足而导致生长迟缓,过量的细胞则会因营养物质的缺乏而导致生长受限[20]。本研究结果显示:当传代密度大于1×105mL-1时,NSCs 神经球直径不再随传代密度的升高而增加。传代密度过大时,由于过量细胞导致培养基中营养物质的竞争耗竭,可能出现神经球形成速度减慢的现象。因此,以1×105mL-1的传代密度进行培养是保持NSCs 活性的最佳传代培养条件。
神经球直径是维持干细胞活性的重要方面。NSCs 呈聚集生长的状态,细胞聚球之后,内部的细胞与外界养分及气体交换减弱,较大地影响了神经球内部细胞活性。随着培养时间的延长,神经球内部缺乏氧气和营养的细胞将大量死亡[9,11,16]。因此,传代时神经球的直径直接决定了NSCs 的活性和培养效率。研究[16-17,21]显示:直径为100~150 μm、100~200 μm 或200 μm 的神经球可进行细胞传代。当神经球直径为150~200 μm 时,神经球球心会出现大量坏死细胞[11]。本研究结果显示:神经球直径大于100 μm 时,神经球中心部位会出现细胞死亡的情况。因此,神经球直径为80~100 μm是传代的最佳时机,既可以最大程度延长培养时间又不会出现明显的细胞死亡。
综上所述,胎鼠的孕期和脑组织吹打分离细胞的方式是高活性NSCs 原代提取的重要因素。传代的细胞密度和传代时机直接影响体外培养NSCs 的细胞活性。因此,选择以1×105mL-1的传代密度进行种板和传代时神经球直径为80~100 μm,可以有效地提高NSCs 传代培养效率和细胞活性。
