机器学习结合磁共振弥散加权成像识别发病4.5 h 内急性脑卒中患者
2024-01-05徐灿飞张开治1
徐灿飞, 黄 艳, 张开治1,
(1. 吉林大学中日联谊医院神经外科,吉林 长春 130033; 2. 浙江大学医学院附属邵逸夫医院病理科,浙江 杭州 310020; 3. 吉林大学中日联谊医院医疗保险管理部,吉林 长春 130033)
急性缺血性脑卒中(acute ischemic stroke,AIS)以其高发病率、高致残率和高死亡率等特点严重危害人民健康[1]。在发病4.5 h 内行重组人组织型纤溶酶原激活剂 (recombinant tissue plasminogen activator,rt-PA) 静脉溶栓为AIS 目前常用的治疗方案[1-4]。rt-PA 静脉溶栓治疗有严格的时间窗要求,超过时间窗将增加患者颅内出血的风险[5]。约20%的AIS 患者无法明确发病时间,因患者发病时间不明确未能接受rt-PA 静脉溶栓,导致其预后不佳[6]。因此,有效识别发病4.5 h 内的AIS 患者是当前研究的热点。机器学习方法采用计算机通过模拟人类的学习方式获取新的知识,在对获得的知识结构进行重组后进一步完善自身性能[7]。随着计算机技术的不断改进,机器学习方法在医学影像辅助诊断方面的应用较为广泛[8-9]。有研究[10-11]报道了结合多模态影像识别发病4.5 h 内AIS 患者的机器学习方法,而依据磁共振弥散加权成像(diffusion weighted imaging,DWI)评估AIS患者发病时间的机器学习方法尚未完全阐明。本研究以发病时间明确的AIS 患者的DWI 为依据,训练可用于识别发病时间在4.5 h 内AIS 患者的机器学习模型,以期辅助临床医师有效评估发病时间不明的AIS 患者对rt-PA 静脉溶栓治疗的适应性。
1 资料与方法
1.1 一般资料选择2021 年1 月—2021 年7 月于吉林大学中日联谊医院神经内科和神经外科收治的DWI 资料完整的AIS 患者227 例。纳入标准:①前循环AIS;②有明确的发病时间;③在发病后24 h内接受DWI 检查;④DWI 成像清晰。排除标准:①颅内出血、肿瘤或创伤;②DWI 有运动伪影图像无法评估;③DWI 检查前接受血管再通治疗。最终纳入227 例患者,其中男性患者165 例,女性患者62例,患者年龄30~93岁,平均年龄64.5 岁。根据发病至DWI 检查时间,将患者分为发病时间≤4.5 h 组(n=70)和发病时间>4.5 h 组(n=157)。227 例患者采用完全随机法按照7∶3 的比例划分为训练集和测试集。训练集患者158 例,其中发病时间≤4.5 h 组49 例,发病时间>4.5 h 组109 例;测试集患者69 例,其中发病时间≤4.5 h组21 例,发病时间>4.5 h 组48 例。
1.2 DWI 检查方法所有患者的DWI 检查均由西门子3.0T 核磁扫描设备(德国西门子公司)完成。扫描参数:TR 4300 ms,TE 98 ms,矩阵160×160,3 个方向,视野230 mm×230 mm,反转角90°,层数20,层厚5 mm,b=1 000 s·mm-2。
1.3 图像采集和标注将AIS 患者的DWI 以DICOM 格式由图像存储与传输系统中导出,由1 名具有5 年以上头部核磁影像诊断经验的神经外科医师采用ITK-SNAP 软件(www. itksnap. org)于DWI 上沿病灶边缘仔细绘制轮廓线,逐层分割感兴趣区域(region of interest,ROI),并由2 名具有15 年以上头部核磁影像诊断经验的神经外科医师进行校对。见图1。
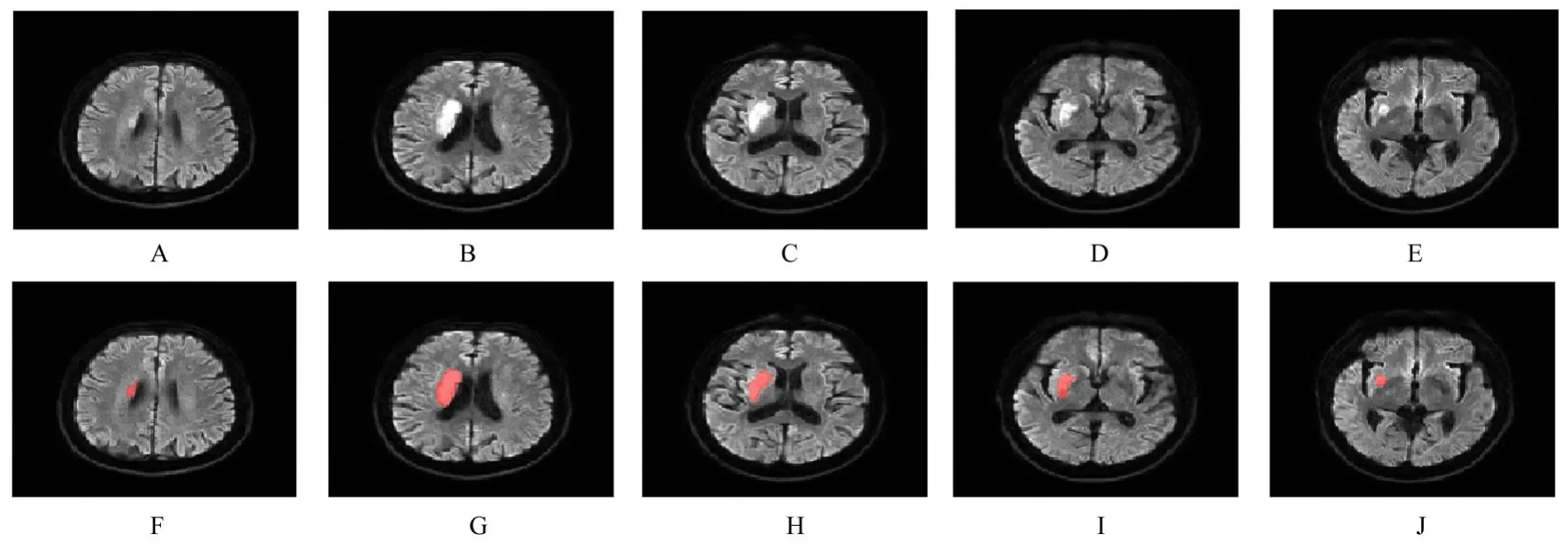
图1 AIS 患者头部DWIFig. 1 DWI of head of patients with AIS
1.4 特征提取采用Python 软件“Pyradioiomics”包由AIS 患者头部DWI 的ROI 图像中提取图像特征[12]。目前可由医学影像中提取的图像特征主要包括一阶特征、形态特征和纹理特征,可从不同方面解析图像的隐含特点。一阶特征采用ROI 图像的特征值,以直方图定量描述图像内的信号强度及其分布情况;形态特征可以量化ROI 图像的形状和大小,如ROI 图像的周长、球形度、长轴长度和短轴长度等;纹理特征可定量刻画脑梗死灶内的异质性[13-14]。灰度共生矩阵(gray level co-occurrence matrix,GLCM)定义ROI 图像的二阶联合概率函数,包括集群显著性、集群阴影和联合熵等;灰度相关矩阵(gray level dependence matrix,GLDM)通过统计ROI 图像中某个像素与周围像素的差值小于特定阈值的情况描述纹理特征,如灰度方差、依赖方差和依赖熵等;灰度游程矩阵(gray level run length matrix,GLRLM) 以ROI 图像中一维方向记录连续多个相同像素值出现的情况描述纹理特征,如运行长度非均匀性、运行长度非均匀归一化和运行熵等;灰度区域大小矩阵(gray level size zone matrix,GLSZM) 定义了具有相同灰度强度连接体素的数量,如区域熵、低灰度区域强调和高灰度区域强调等;邻域灰度差矩阵(neighborhood gray tone difference matrix,NGTDM)量化在给定距离内的灰度值与其相邻距离内的平均灰度值的差值,包括粗糙度、对比度、繁忙度、复杂度和强度。
1.5 特征选择对提取后的特征进行特征选择,去除相似和冗余的特征以提高算法的计算效率及防止过拟合的发生。将提取的特征值进行Z-score 正则化处理,Spearman 相关性检验评估各特征的相关性,排除一致性过高的特征[15-16]。Spearman 相关系数的正负值反映特征变化方向是否一致,绝对值越大表示特征间相关性越高,当2 个特征的Spearman 相关系数绝对值>0.9 时,可以认为2 个特征存在较高的一致性,可以相互替代,即为冗余特征。使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归模型对剩余特征进行压缩,参数λ 反映了LASSO 回归模型对特征系数的压缩程度,λ 值增大,特征系数被逐渐压缩为0[17]。λ 值过大会因系数过度压缩而导致部分有意义的特征被排除,若λ 值过小会因系数压缩不足而导致部分冗余的特征被保留。结合10 倍交叉验证法确定λ 的最佳值,根据不同λ值对应的均方误差筛选均方误差最小时的最佳λ 值。获取发病时间≤4.5 h 组和发病时间>4.5 h 组患者存在显著差异的特征。
1.6 模型训练和测试基于筛选后的图像特征,在训练集中分别采用支持向量机(support vector machines,SVM)、K 近邻 (k-nearest neighbor,KNN)、决策树、极限树、随机森林、XGBoost 和LightGBM 共7 种机器学习算法进行模型训练[18-23]。在测试集中以受试者工作特征曲线(receiver operating characteristic curve,ROC)和曲线下面积(area under curve,AUC)评估模型识别发病4.5 h内AIS 患者的效果并计算95% 置信区间(confidence interval,CI)。对以上模型进行100 次随机校验,最终得到每种算法的最优模型并进行比较。
2 结 果
2.1 特征提取和特征选择于ROI 图像中共提取107 个特征,包括18 个一阶特征、14 个形态特征和75 个纹理特征。采用Spearman 相关分析的方法,共排除79 个冗余特征。见图2。

图2 使用Pyradiomics 提取107 个特征的Spearman 相关系数图Fig. 2 Spearman correlation coefficient diagram of 107 features extracted by Pyradionics
采用LASSO 回归模型压缩剩余的28 个特征系数(图3),横坐标为λ值,纵坐标为特征系数。最终获取22 个可用于识别发病4.5 h 内AIS 患者的图像特征,包括4 个一阶特征、6 个形态特征和12 个纹理特征。见图3~5。
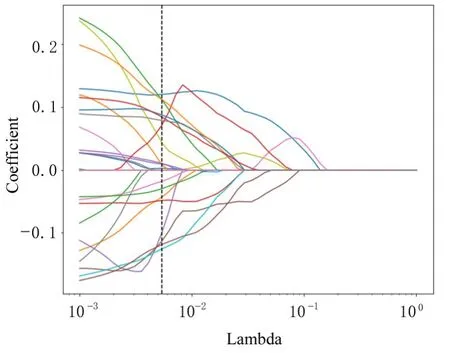
图3 LASSO 回归模型压缩的特征系数收敛图Fig. 3 Convergence diagram of characteristic coefficients compressed with LASSO regression model
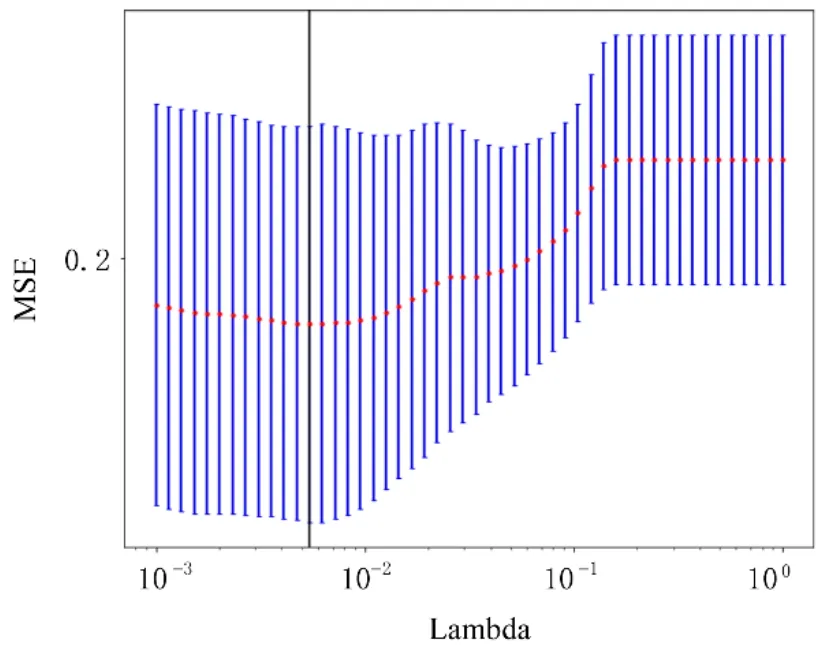
图4 10 倍交叉验证结果Fig. 4 10-fold cross validation results
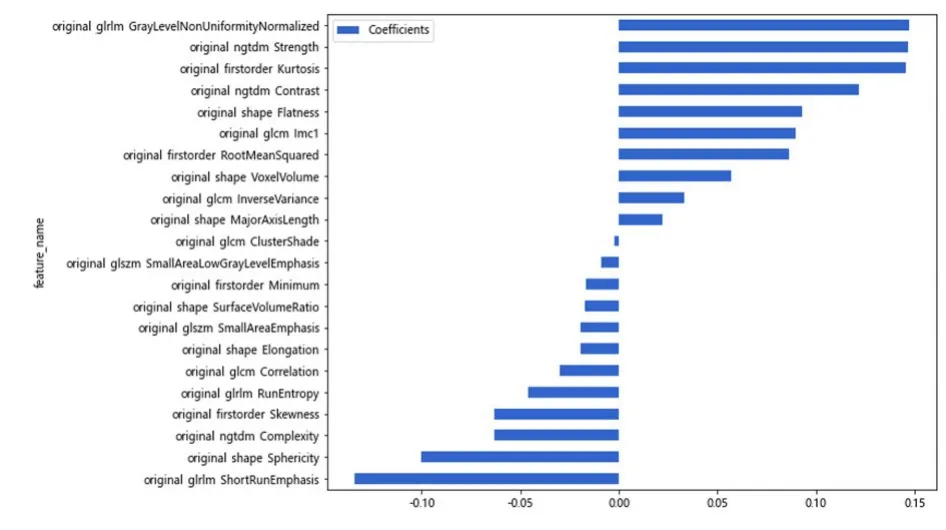
图5 22 个特征直观图Fig. 5 Pictorial diagram of 22 features
2.2 发病4.5 h 内AIS 患者识别情况经过100 次随机校验后获得SVM、 KNN、 Decision Tree、Random Forest、 Extra Trees、 XGBoost 和LightGBM 算法的最优模型。SVM 模型的AUC 为0.735 (95%CI: 0.595~0.874), KNN 模型的AUC 为0.532(95%CI:0.364~0.700),Decision Tree 模型的AUC 为0.624 (95%CI: 0.481~0.768), Random Forest 模型的AUC 为0.761(95%CI: 0.643~0.879), Extra Trees 模型的AUC 为0.670(95%CI:0.508~0.833),XGBoost模型的AUC 为0.817 (95%CI:0.697~0.938),LightGBM 模 型 的 AUC 为 0.775 (95%CI:0.642~0.908)。其中XGBoost 模型识别发病4.5 h内AIS 患者的AUC 最大,模型的准确率、灵敏度和特异度分别为0.739、0.733 和0.814。见图6和表1。
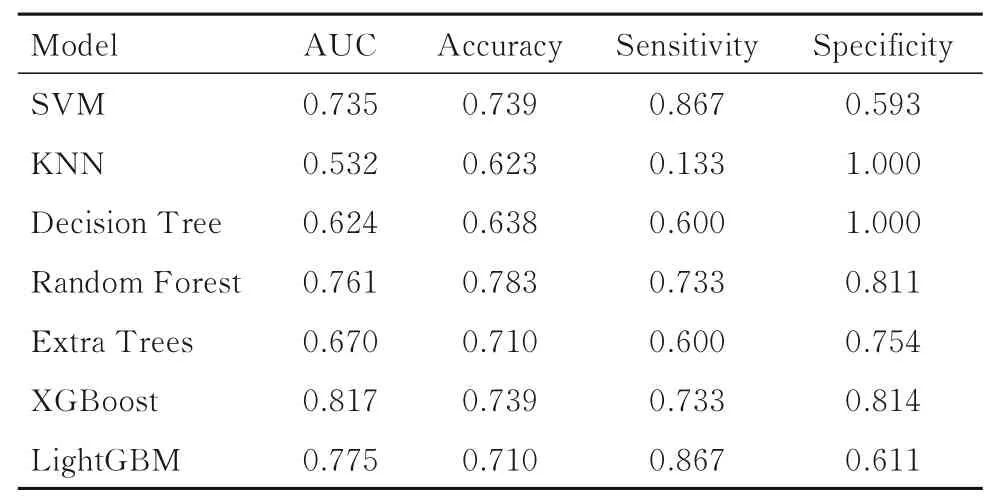
表1 7 种模型识别发病4.5 h 内AIS 患者的性能Tab. 1 Performances of 7 models in identification of AIS patients with onset time within 4.5 h
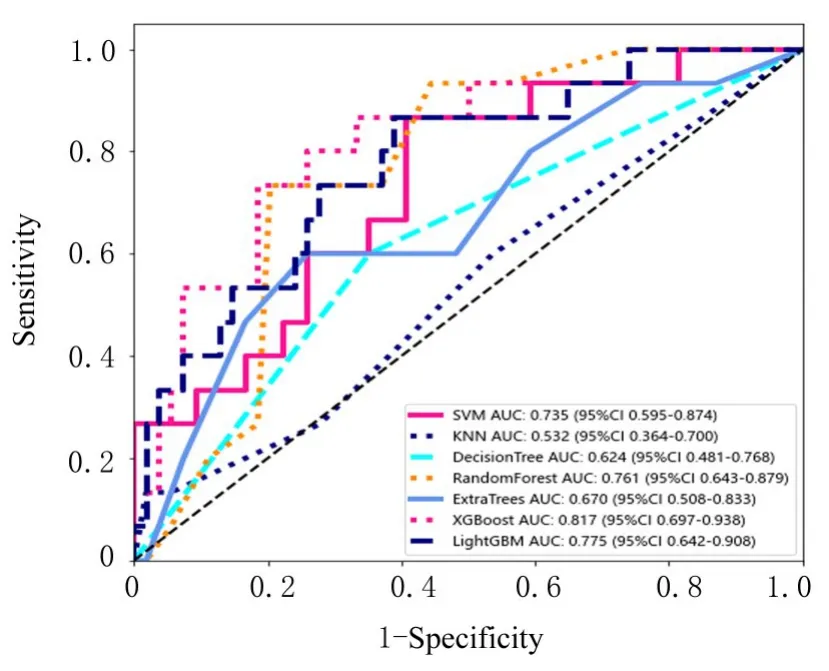
图6 7 种模型识别发病4.5 h 内AIS 患者的ROC 曲线Fig. 6 ROC curves of AIS patients with onset time within 4.5 h identified by 7 models
3 讨 论
与AIS 相关的影像学检查中,DWI 是反映脑组织缺血后发生细胞毒性水肿最敏感的序列,液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR) 可以较好地显示发生血管源性水肿的脑梗死病灶[24]。FLAIR 高信号提示血脑屏障的完整性遭到破坏,该影像学现象常出现于AIS 发生后的数小时内[25]。对于发病时间不明的AIS 患者,可通过读取DWI-FLAIR 不匹配信息判断患者发病时间是否在4.5 h 内[26-27],常规的人工判读难以对其进行精准区分,EMERIAU 等[28]发现:通过人工读取DWI-FLAIR 不匹配信息识别发病4.5 h 内AIS 患者的敏感度和特异度仅为0.55 和0.60。郭静丽等[29]报道:人工通过DWI-FLAIR 识别发病4.5 h 内AIS 患者的AUC、准确率、灵敏度和特异度分别为0.634、63.8%、0.667 和0.622。评估DWI 存在较强的主观性,DWI-FLAIR 不匹配信号的人工读取结果一致性偏低。LEE[11]等发现:由2 名脑卒中疾病的专家对DWI-FLAIR 不匹配信息的视觉评估一致性仅为73.2%。与传统的人工方法比较,机器学习模型可以更有效地识别发病4.5 h 内的AIS 患者。
随着计算机技术的不断改进,机器学习在AIS领域的应用呈现出强劲的增长态势。使用机器学习方法可进行AIS 患者早期诊断和病灶自动分割、自动化Alberta 卒中项目早期CT 评分(Alberta Stroke Program Early CT Score,ASPECTS)、自动化TOAST 分型、预测AIS 患者最终梗死灶、预测AIS 患者出血转化概率和预测AIS 患者预后效果等[30-35]。目前,结合DWI 识别发病4.5 h 内AIS 患者的机器学习方法的研究较多,HO 等[10]等以DWI、FLAIR、表观弥散系数(apparent diffusion coefficient, ADC) 序列和灌注加权成像(perfusion weighted imaging,PWI)四模态核磁影像为基础训练的Logistic 回归模型识别发病4.5 h 内AIS 患者的AUC、灵敏度和特异度分别为0.765、0.788 和0.609。LEE 等[11]依据DWI、ADC 和FLAIR 影像训练的Random Forest 模型识别AIS 患者的AUC、灵敏度和特异度分别为0.851、0.758和0.826。本研究结果显示:XGBoost 模型识别发病4.5 h 内AIS 患者具有较大的AUC 和较高的准确度、灵敏度和特异度。本研究可仅使用DWI 训练模型识别发病4.5 h 内AIS 患者,DWI 较FLAIR 和PWI 在AIS 的诊疗中使用更加广泛,且更为廉价和易获取,在部分经济欠发达和医疗水平相对落后的地区也可常规获取,具有较好的通用性。
综上所述,基于DWI 的XGBoost 模型可有效识别发病4.5 h 内AIS 患者,对于辅助评估AIS 患者发病时间具有一定的临床意义。
