亚硝基苯胲铵在金红石表面的吸附机制及其对浮选行为的影响
2023-12-29肖巍余俊甫陈阳万昕洋刘剑飞李宏静张鹤杨娟高碧荷
肖巍 ,余俊甫,陈阳,万昕洋,刘剑飞,李宏静,张鹤,杨娟,高碧荷
(1. 西安建筑科技大学 资源工程学院,陕西 西安,710055;2. 包钢集团矿山研究院 (有限责任公司),内蒙古 包头,014000;3. 山阳秦鼎矿业有限责任公司,陕西 商洛,726403)
近年来,金属钛被广泛应用于医药、航海、航空航天、功能材料等领域,钛产业的开发与利用越来越受到重视[1-6]。在当代工业体系中,钛冶金海绵和金属钛均以金红石(TiO2)和钛铁矿(FeTiO3)作为原材料。与钛铁矿相比,金红石中的钛更容易被利用,因此,许多研究涉及金红石选矿[7-8]。然而,由于其矿物组成成分复杂、矿石品位低、与脉石矿物相结合后粒度较小等原因,金红石矿的开发利用仍被制约[9]。尽管可通过重选、磁选、电选相结合的方法进行金红石矿提纯,但浮选仍是解决这一问题最为有效的方法之一[8,10]。目前,浮选金红石矿常用的捕收剂都存在不足之处,如脂肪酸类捕收剂的捕收能力很强,但是选择性不佳[10-12];膦酸类[13-14]和羟肟酸类捕收剂[15-18]的捕收选择性强,但使用成本很高;胂酸类捕收剂因具有毒性,在很多情况下被禁止使用[19-20]。徐金球等[21]介绍了新型捕收剂亚硝基苯胲胺的合成方法,该合成方法所采用的合成原料来源广泛,易工业化,经济环保,试验回收率稳定。刘明宝等[22-23]从吸附动力学及热力学的角度揭示了亚硝基苯胲胺在矿物表面以药剂离子排开表面吸附的水分子,从而吸附在矿物表面,属于离子交换吸附。
目前,有关亚硝基苯胲胺与其他氧化矿相互作用的机理研究较多,例如戴子林等[24]通过Zeta电位分析、红外光谱测定发现,亚硝基苯胲胺在锡石和方解石的表面产生了特异性吸附,并在矿物表面生成了螯合物。TIAN等[25]使用亚硝基苯胲胺为新型替代捕收剂,并采用Zeta电位测量、XPS分析和第一性原理密度泛函理论(DFT)计算对低剂量Pb2+中锡石与石英的选择性分离机理进行了研究,发现锡石表面上的Sn4+是铜铁离子吸附的主要反应位点,且其反应性远高于石英表面上的Si 原子,这一结论为研究更清洁的锡石选矿浮选药剂提供了新的思路。BAHRI 等[26]以亚硝基苯胲胺为螯合剂、十二烷基硫酸钠为阴离子捕收剂,采用浮选方法研究了镓与铝的选择性分离,结果表明,由于Ga(Ⅲ)与亚硝基苯胲胺盐离子的相互作用具有较高的螯合强度,亚硝基苯胲胺盐离子能有效地将镓与铝分离。这些研究为亚硝基苯胲胺与金红石相互作用的机理研究提供了理论基础。但是,有关亚硝基苯胲胺浮选金红石的机理研究较少。亚硝基苯胲胺(俗称铜铁试剂)是一种含N和O基团的有机合成试剂,易溶于水,其分子中羟氨上的氧可在弱酸与强酸环境中与金属离子发生键合,并形成稳定的络合物[26-27],它的盐可能是内络合物型[24]。在此,本文作者根据矿物表面溶液化学,运用动电位测定、接触角试验、红外光谱测试及基团电负性理论计算等手段研究亚硝基苯胲胺对金红石的捕收性能,讨论亚硝基苯胲胺对金红石的捕收机理。
1 实验
1.1 实验材料与试剂
试验所用的金红石原矿取自山东省威海的海滨砂矿。金红石的X射线荧光光谱分析结果如表1所示,其X 射线衍射分析结果见图1。由表1 和图1 可知,金红石原矿中TiO2的含量(质量分数)在98%以上,且主要的杂质为SiO2和Fe2O3等。在金红石样品中未检测到其他杂质峰,说明金红石纯度很高。可见:试验所用金红石满足纯矿物浮选的试验要求。

图1 样品的XRD图谱Fig. 1 XRD pattern of sample
在试验过程中,先对金红石矿进行陶瓷球磨、磁选、摇床、电选提纯预处理等,再通过振动筛分得到粒度为0.038~0.074 mm 的单矿物,作为试验样品。
采用盐酸与氢氧化钠调节pH,以亚硝基苯胲铵为捕收剂、MIBC为起泡剂,试验试剂均为分析纯,试验用水采用Milli-Q生产的超纯水。
1.2 试验方法
1.2.1 单矿物浮选试验
将XFG 型浮选机转速调节至2 000 r/min,选用容积为40 mL的浮选槽,控制浮选温度为25 ℃。浮选试验流程如图2 所示。首先,取2 g 矿样加入浮选槽内,然后添加纯水,调节pH后,加入亚硝基苯胲胺和起泡剂MIBC,最后进行充气刮泡,刮泡过程为手动刮泡,对泡沫产品(精矿)过滤后、干燥、称质量。
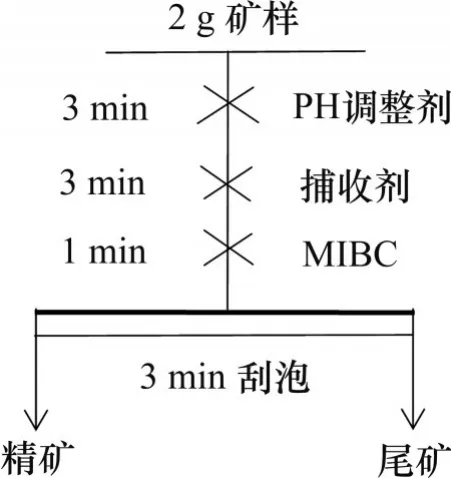
图2 金红石浮选试验流程Fig. 2 Flotation flowchart of rutile
1.2.2 Zeta电位测量
称取50 mg 矿样放入烧杯,再加50 mL 纯水,用磁力搅拌器搅拌后,调节矿浆pH,随后加入亚硝基苯胲胺,静置5 min,取上清液并采用JS94H微电泳仪(上海中辰数码技术仪器有限公司生产)测量Zeta电位,至少重复测量3次,结果取平均值。
1.2.3 表面接触角测定
先取矿样放入模具中压片,随后将矿样依次加入100~600 mg/L 的亚硝基苯胲胺溶液中浸泡搅拌10 min,并过滤、烘干、压片。
将矿样放入磨具压片,再将水滴滴在所压薄片之上,在测量温度为25 ℃时,采用测量仪器JC2000C(上海中辰数码技术仪器有限公司生产)分别测量液滴高度和接触长度,均重复测量3次,结果取平均值,测量误差为±2°之内。
1.2.4 红外光谱测定
首先,将金红石单矿物置于40 mL 浮选槽内,加入纯水后,调节矿浆pH,再加入一定量的亚硝基苯胲胺,充分搅拌均匀后过滤,用纯水洗涤矿物3 次,最后,将样品过滤,真空干燥。在FTIR(Nezus 470-FT-IR)上,采用溴化钾压片法对制得的试样进行红外光谱测试,测量范围为400~4 000 cm-1,分辨率为4.0 cm-1。
1.2.5 捕收剂基团电负性计算
基团电负性[28]是指分子中原子将电子拉向自己的能力,当两个原子的电负性相差较大时,价电子偏向电负性大的原子一边,使其具有极性,基团的电负性越大[27],得电子的能力就越强,反之,失去电子的能力就越大。
绘制亚硝基苯胲胺的结构式[26],并标记出2个氧原子与2个氮原子的位置,结合红外光谱的检测结果,再计算捕收剂基团电负性,进一步验证药剂与矿物特异性吸附的键合方式。
基团电负性计算公式[24]为
式中:xg为基团的电负性;r为参与键合的原子半径;n*为有效价电子数。
2 结果与讨论
2.1 单矿物浮选试验结果
图3所示为不同pH下金红石的回收率。由图3可知,pH=4~7 时,金红石都表现出了较好的上浮率,而当pH增大后,上浮率随之下降。

图3 矿浆pH与矿物回收率的关系Fig. 3 Relationship between pulp pH value and mineral recovery
当pH=6.4~6.8 时亚硝基苯胲胺用量与矿物回收率的关系如图4所示。由图4可知:金红石回收率随亚硝基苯胲胺用量的增大而逐渐上升,当亚硝基苯胲胺质量浓度为400 mg/L 时,金红石回收率达到最大值81.5%;继续增加捕收剂亚硝基苯胲胺的质量浓度,金红石回收率有所降低[22,25]。由此可见,在适宜的pH范围内,亚硝基苯胲胺对金红石的捕收果很显著,即对金红石的选择性强,且药剂总用量小。
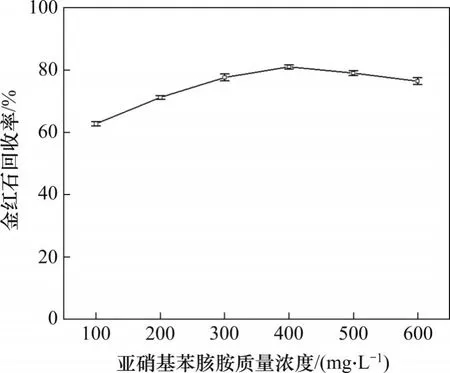
图4 亚硝基苯胲胺质量浓度与矿物回收率的关系Fig. 4 Relationship between recovery rate of mineral and dosage of cupferron
2.2 机理讨论
2.2.1 金红石表面Zeta电位
Zeta电位是表征浮选药剂与矿物表面相互作用的有效参数[25]。通过测量Zeta 电位可以探究捕收剂亚硝基苯胲胺对矿物表面动电位的影响,并以此揭示捕收剂在矿物表面作用的机理。图5所示为金红石表面的Zeta电位与pH的关系。
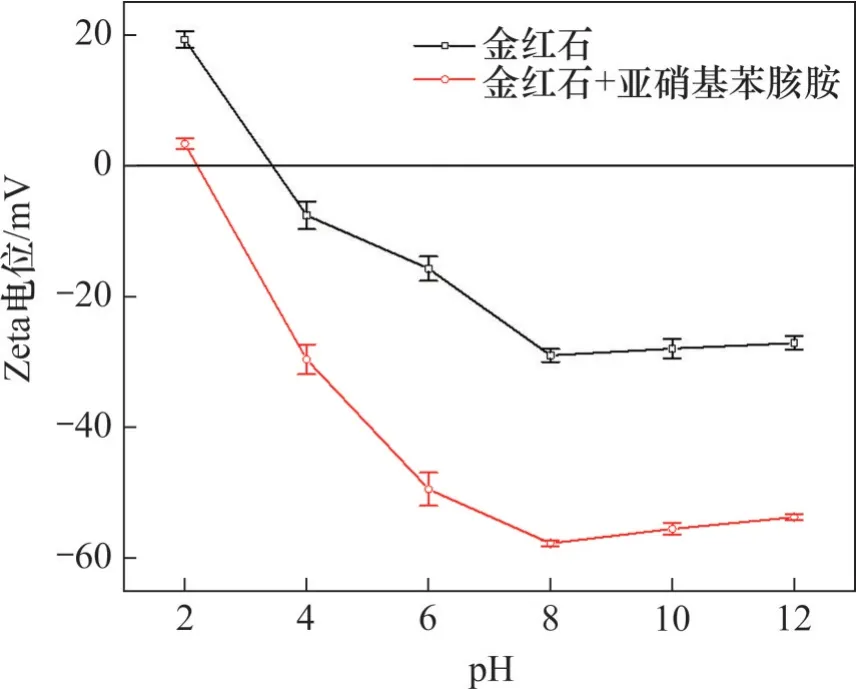
图5 矿物的Zeta电位与pH的关系Fig. 5 Relationship between Zeta potential of minerals and pH value
从图5 可见:金红石的零电点在pH 为3.9 左右,这与文献报道结果一致[29-30]。且根据矿物表面的荷电机理[31]可知,当pH<3.9 时,金红石表面带正电;当pH>3.9 时,金红石表面带负电;当pH=3.9 时,金红石的表面呈现电中性。当加入捕收剂亚硝基苯胲胺时,相同pH 下Zeta 电位负移显著,对应的电位绝对值也相继增大,金红石的零电点降低至2.2左右;当pH<2.2时,电位相较原始状态发生负移,这可能是亚硝基苯胲胺与金红石表面的活性质点发生了物理吸附;当pH>2.2 时,加入亚硝基苯胲胺也可使相同pH条件下矿物的Zeta电位继续负移,且电位降低的幅度更显著,尤其是在金红石浮选回收率较高的pH范围内,这说明亚硝基苯胲胺在金红石表面发生了强烈的吸附,并形成了络合物,且吸附方式主要以化学吸附为主[32],物理吸附次之;而随后Zeta 电位逐渐趋于平稳,这说明亚硝基苯胲胺与金红石表面钛质点的吸附达到了饱和,原因可能是:1) 捕收剂亚硝基苯胲胺在碱性环境下的稳定性比酸性条件下的稳定性弱[22];2) 强碱性介质或矿物表面的羟化占据了优势,使金红石与捕收剂亚硝基苯胲胺的吸附受到了抑制[33-34],即氢氧根离子与捕收剂存在竞争吸附,致使浮选回收率降低,且逐渐趋于稳定。
另外,根据浮选溶液化学理论[35]可知,金红石颗粒表面有Ti—O键存在,Ti—O键断裂后,会造成金红石表面的活性质点在水溶液中发生水化,从而生成Ti4+、 Ti(OH)3+、 Ti(OH)22+、 Ti(OH)+3、Ti(OH)4(aq)、Ti(OH)4(s),并使得溶液呈现平衡状态。其反应离子方程式和对应的平衡常数K如下:
式中:[ ]表示物质浓度。
由物质的量守恒定律可知,水解后溶液中的钛组分始终与总钛的浓度保持一致,因此可得:
的分布系数α1~α5分别为
由此可计算出不同pH 条件下,钛质点水解后Ti4+、Ti(OH)3+、Ti(OH)22+、Ti(OH)+3、Ti(OH)4的分布系数,如图6所示。
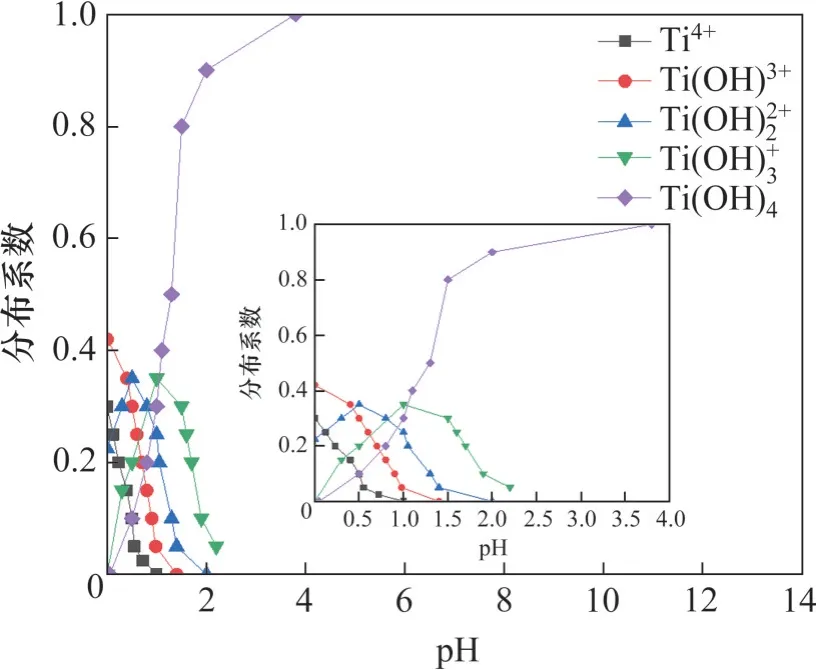
图6 pH对钛质点水解后溶液中各组分的影响Fig. 6 Influence of pH on each component in solution after titanium particle hydrolysis
根据钛质点水解后生成羟基络合物的稳定性常数和溶液平衡关系[36],金属离子水解组分与pH的关系如图7 所示。由图7 可知,当pH<4 时,水溶液中存在有Ti4+、Ti(OH)3+、Ti(OH)22+、Ti(OH)+3、Ti(OH)4;当4<pH<6 时,水溶液中以Ti(OH)22+和Ti(OH)+3为主,并且Ti(OH)+3占水解优势组分;当pH=6~11时,水溶液中仅存在Ti(OH)+3。

图7 金红石溶液中各组分的lgc和pH的关系[36]Fig. 7 Relationship between lgc of rutile solution components and pH[36]
由图3 可知,在pH 为4~7 时,捕收剂亚硝基苯胲胺与金红石表面活性质点相互作用,使得金红石的回收率明显提高。结合图3和图7可知,与捕收剂亚硝基苯胲胺作用的主要优势组分为Ti(OH)22+和Ti(OH)+3,而在pH=6.4~6.8 时,金红石的回收率达到最大值,这主要是亚硝基苯胲胺与Ti(OH)+3相互作用的结果。
2.2.2 亚硝基苯胲胺对金红石表面接触角的影响
为了研究亚硝基苯胲胺浓度对金红石表面润湿性的影响,分别测定了未加入与加入亚硝基苯胲胺(100~600 mg/L)后水在金红石表面的接触角,如图8所示。从图8可以发现:未加入亚硝基苯胲胺时,水在金红石表面的接触角为26.24°±1.5°,这说明在自然条件下,金红石表面具有一定的疏水性能,与文献[7, 37]研究的结果一致;而随着亚硝基苯胲胺质量浓度的增大,水在金红石表面的接触角增大,在亚硝基苯胲胺质量浓度为400 mg/L时,接触角最大至69.21°±2°,即疏水性最强,随后接触角降低。这说明亚硝基苯胲胺能够明显增强金红石表面的疏水性能,与上述浮选试验结果相对应。
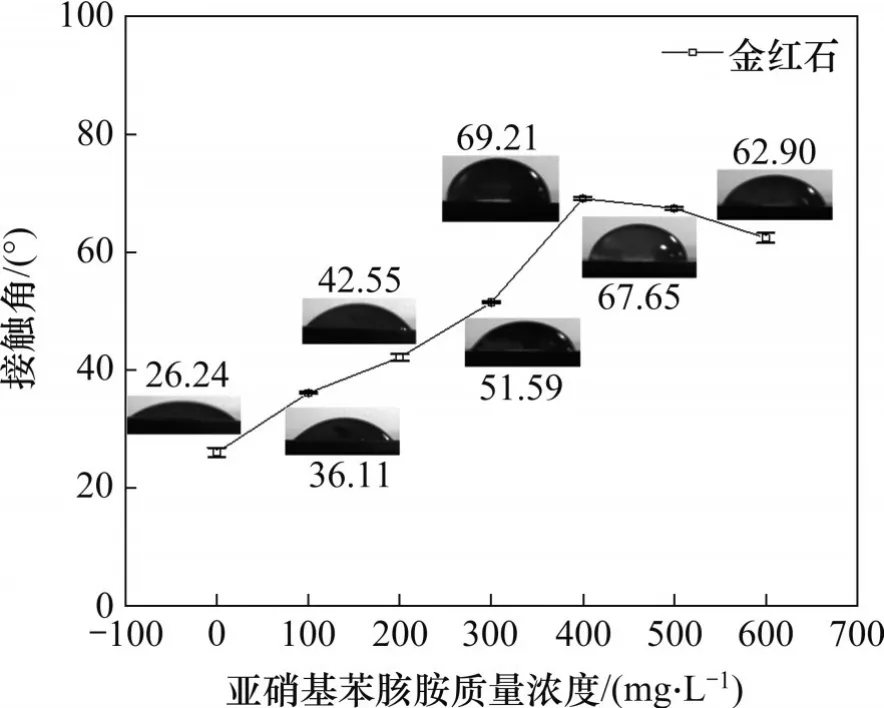
图8 亚硝基苯胲胺质量浓度与接触角的关系Fig. 8 Relationship between Dosage of cupferron and contact Angle
2.2.3 红外光谱分析
在矿浆pH=6.4~6.8,亚硝基苯胲胺质量浓度为1 g/L 的条件下,对吸附亚硝基苯胲胺前后的金红石样品和亚硝基苯胲胺样品进行红外光谱测试,测试结果如图9所示。
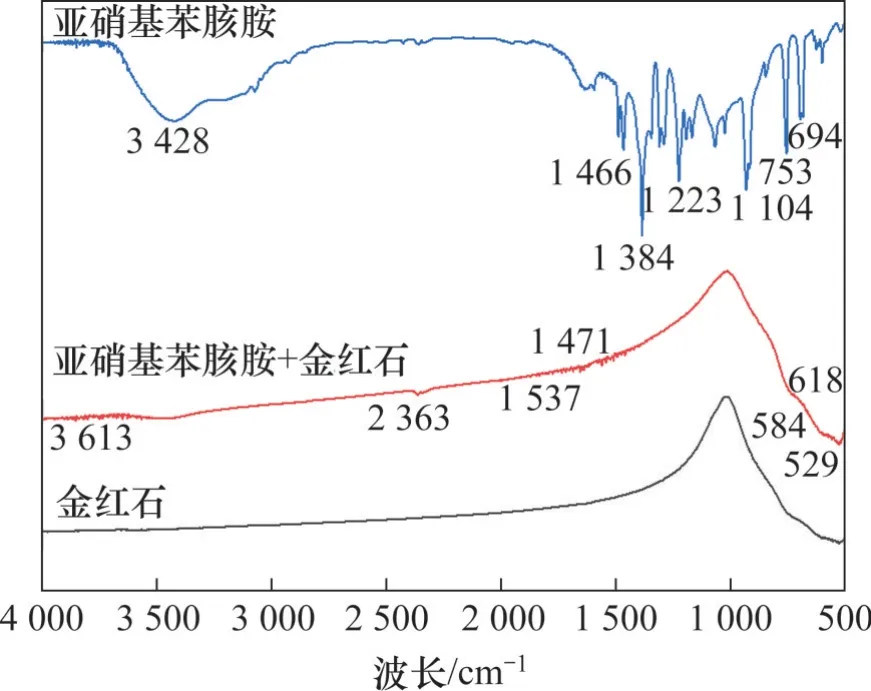
图9 亚硝基苯胲胺与金红石作用前后的红外光谱Fig. 9 Infrared spectra of cupferron and rutile before and after interaction
从图9 可见:在亚硝基苯胲胺的红外光谱中,1 223 cm-1和1 384 cm-1处的吸收峰为=N—O的吸收峰,在1 446 cm-1处的吸收峰为—N=O 的吸收峰,在753 cm-1和694 cm-1处的吸收峰为其面内弯曲振动吸收峰。经与亚硝基苯胲胺作用后,金红石红外光谱图发生了明显的峰值变化,在1 537 cm-1和1 471 cm-1处出现了新的峰值波动,这与亚硝基苯胲胺中1 466 cm-1和1 384 cm-1吸收峰的变化相对应。且由文献[38]可知,金红石的钛氧八面体伸缩吸收特征峰均在600 cm-1以内,而在618~529 cm-1处,金红石的伸缩吸收特征峰变化极其明显,这说明此处才是金红石的特征峰,也表明亚硝基苯胲胺上的—N—O 和—N=O 官能团与金红石表面的活性质点发生了键合,证明亚硝基苯胲胺在金红石表面发生了化学吸附,可能是亚硝基苯胲胺中的氧原子及氮原子与金红石表面的钛质点键合形成了络合物。
2.2.4 以捕收剂基团电负性来分析在金红石表面的作用机理
当亚硝基苯胲胺参与金属螯合时,亚硝基苯胲胺中的2个氧原子和2个氮原子均参与到络合反应中。2 个氧原子有效价电子数n*分别为6.856 和6.693,氧原子半径为0.73,代入式(1)可得到2 个氧原子的电负性分别为3.84和3.78。同理可得2个氮原子电负性分别为3.40和3.49。
由上述计算分析结果可知:2个氧原子的电负性要比2个氮原子的电负性大。因此,根据电负性理论[24]可知:以亚硝基苯胲胺为络合捕收剂时,其与矿物表面上的活性质点相互作用并生成络合产物主要是2个氧原子引起的[26],并生成了含苯环的金属络合物。从亚硝基苯胲胺分子结构的角度分析可知,2 个氮原子均处于支链的中间位置[26],会受到苯环与氧原子位阻效应的影响[24-25],因此,2个氮原子引起络合作用的能力要比氧原子络合作用的能力小得多。从亚硝基苯胲胺与金红石表面活性质点生成络合产物的几何形态角度分析,N和N 络合可生成三元环,N 和O 络合仅能生成四元环,而O和O络合可生成五元环[39-40],五元环的稳定性要远远大于三元环和四元环的稳定性。因此,可猜测亚硝基苯胲胺以O 和O 络合并生成了含苯环的五元环络合物。
从红外光谱的测定与分析可知亚硝基苯胲胺在金红石的表面产生了化学吸附,再根据上述分析可模拟出亚硝基苯胲胺与钛质点吸附方式的平面与立体结构模型,如图10所示。
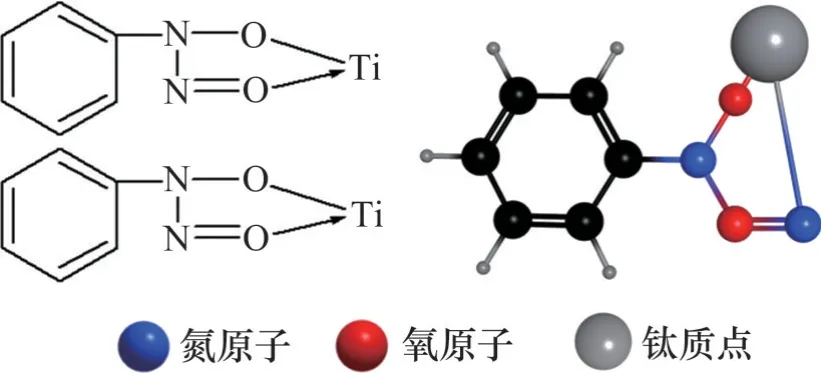
图10 亚硝基苯胲胺与钛质点吸附方式的结构模型Fig. 10 Structure models of adsorption mode between nitrite phenylamine and titanium
3 结论
1) 亚硝基苯胲胺对金红石具有良好的捕收性能,且在pH=6.4~6.8、亚硝基苯胲胺用量为400 mg/L时,金红石的可浮性最佳。
2) 在金红石可浮性较好的范围内,主要是亚硝基苯胲胺与Ti(OH)+3相互作用的结果,加入亚硝基苯胲胺后,金红石的动电位由3.9降至2.2左右,在亚硝基苯胲胺质量浓度为400 mg/L 时,接触角最大,疏水性最强;亚硝基苯胲胺与金红石表面活性质点发生键合,并且生成了含苯环的络合物。浮选溶液化学分析、Zeta 电位测定、接触角检测、红外光谱分析结果都表明亚硝基苯胲胺与金红石发生了吸附。
3) 从原子基团电负性的角度上计算分析,再结合药剂分子结构、络合产物几何形态、络合产物稳定性分析可知亚硝基苯胲胺与O 和O 络合的可能性最大,并生成了含苯环的五元环络合物。
