5-氮杂胞苷诱导内生真菌Penicillium sp. GZWMJZ-042代谢抗α-葡萄糖苷酶活性产物研究
2023-12-26王晓洋龚倩玉许言超左明星王立平朱伟明
王晓洋 龚倩玉 许言超 左明星 王立平 朱伟明
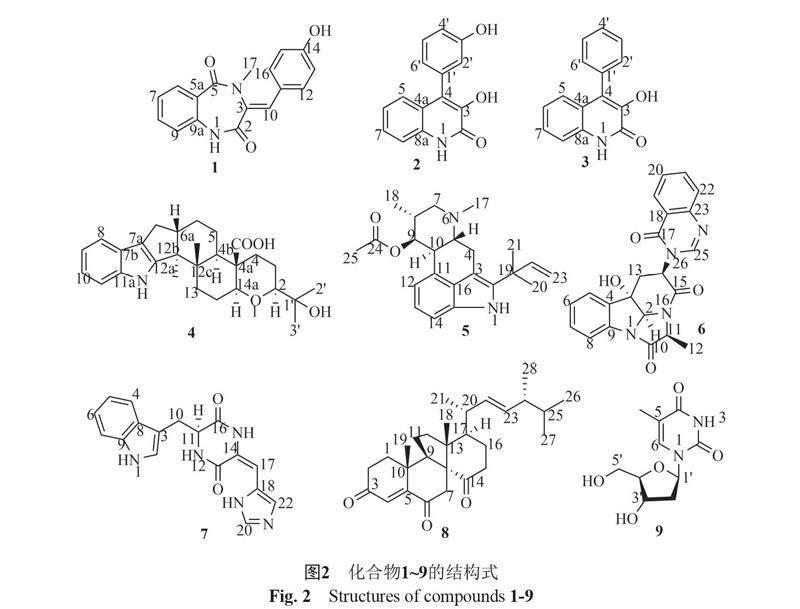

摘要:目的 利用表觀遗传修饰剂诱导杜仲内生真菌Penicillium sp. GZWMJZ-042产生活性代谢产物。方法 在大米固体培养基中添加5-氮杂胞苷对真菌进行培养;利用柱色谱及高效液相色谱等对发酵产物进行分离、纯化;运用质谱、核磁共振和比旋光等鉴定化合物的结构;采用PNPG法测试化合物的α-葡萄糖苷酶抑制活性。结果 从菌株GZWMJZ-042的发酵产物中分离并鉴定了9个单体化合物,其中化合物1为新化合物,其结构分别鉴定为14-hydrocyclopeptin(1)、viridicatol(2)、viridicatin(3)、(2S, 4aR, 4bR, 6aS, 12bS, 12cS, 14aS)-4a-demethylpaspaline-4a-carboxylic acid(4)、fumigaclavine C(5)、(-)chaetominine(6)、cyclo(dehydrohistidyl-L-tryptophyl)(7)、dankasterones A(8)和2'-deoxythymidine(9)。化合物1,2,4,6~9对α-葡萄糖苷酶表现出较强的抑制作用,IC50分别为147.0、118.7、110.5、65.9、74.6、40.6和151.5 μg/mL,阳性对照阿卡波糖的IC50为163.9 μg/mL。结论 利用表观遗传修饰剂可诱导杜仲内生真菌产生结构新颖的活性化合物。
关键词:内生真菌;表观遗传修饰;活性产物;α-葡萄糖苷酶
中图分类号:R978.1文献标志码:A
Study on the α-glucosidase inhibitors from endophytic Penicillium sp. GZWMJZ-042 induced by 5-azacytidine
Wang Xiaoyang1,2, Gong Qianyu1, Xu Yanchao1, Zuo Mingxing1,2, Wang Liping1,2, and Zhu Weiming1,3
(1 State Key Laborataory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550014;
2 Natural Products Research Center of Guizhou Province, Guiyang 550014; 3 School of Medicine and Pharmacy,
Ocean University of China, Qingdao 266003)
Abstract Objective To induce the production of active metabolites in endophytic fungus Penicillium sp. GZWMJZ-042 from Eucommia ulmoides using epigenetic activation strategy. Methods The fungus was fermented on rice solid medium supplemented with 5-azacytidine. The isolation and purification of compounds were performed by means of column chromatography and HPLC. Their structures were elucidated through the analysis of MS, NMR and specific rotation. The inhibitory activities against α-glucosidase were assayed by PNPG method. Results Nine compounds(1-9) including one new compound(1) were isolated from the cultural broth of Penicillium sp. GZWMJZ-042. Their structures were identified as 14-hydrocyclopeptin(1), viridicatol(2), viridicatin(3),(2S, 4aR, 4bR, 6aS, 12bS, 12cS, 14aS)-4a-demethylpaspaline-4a-carboxylic acid(4), fumigaclavine C(5),(-)chaetominine(6), cyclo(dehydrohistidyl-L-tryptophyl)(7), dankasterones A(8) and 2'-deoxythymidine(9), respectively. Compounds 1, 2, 4, 6-9 showed significant activities against α-glucosidase with IC50 values of 147.0, 118.7, 110.5, 65.9, 74.6, 40.6 and 151.5 μg/mL, respectively. Acarbose, used as the positive control, had an IC50 of 163.9 μg/mL. Conclusion Epigenetic modifiers can induce endophytic fungi from Eucommia ulmoides to produce bioactive compounds with novel structures.
Key words Endophytic fungi; Epigenetic modification; Active products; α-glucosidase
真菌的代谢产物是药物分子的重要来源之一,如青霉素类抗生素和他汀类降血脂药物,挽救了无数的生命。但是经过上百年的研究,真菌来源的药物研究遇到了瓶颈,如何更有效的发掘菌株的代谢潜力,是研究真菌药物迫切需要解决的问题。基因组学研究表明,真菌包含了大量的代谢产物基因簇,但是在常规培养条件下大部分基因簇处于沉默状态。这是因为真核生物中DNA甲基化可诱导局部组蛋白去乙酰化,使染色质乙酰化水平降低,且甲基化的序列可募集甲基CpG结合蛋白与组蛋白去乙酰化酶复合物,对基因的表达起到抑制作用[1],即DNA甲基化与组蛋白的去乙酰化可引起表达基因的“沉默”。在不改变基因序列的条件下,表观遗传修饰,如DNA甲基化酶(DNMT)抑制剂与组蛋白去乙酰化酶(HDAC)抑制剂可以将真菌沉默基因激活。对内生真菌Stagonospora nodorum培养基中加入组蛋白去乙酰化酶抑制剂伏立诺他(SAHA)和烟酰胺,代谢产生了1个结构新颖的丁酰基苯类化合物(+)-4'-methoxy-(2S)-methylbutyrophenone,具有较好的抗菌活性,对Fusarium solani 的MIC为50 ?g/mL,强于阳性对照酮康唑[2];在Penicillium citreonigrum的大米培养基中加入5-氮杂胞苷(5-aza),代谢产生了两个结构新颖的化合物altlantiones A和B[3]。上述结果表明,表观遗传修饰技术可用于发掘真菌的代谢潜力发现结构新颖的活性化合物。
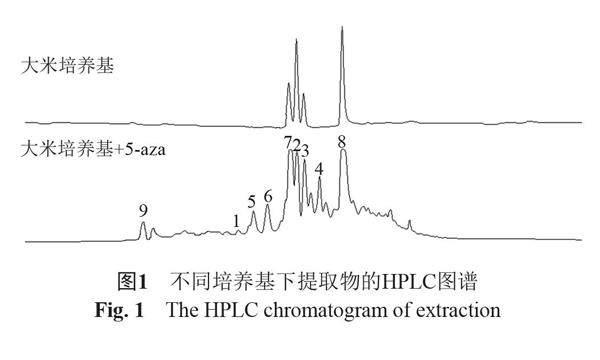
杜仲是一种重要的药用植物,其内生菌也引起了研究者的兴趣,但是在常规培养条件下仅分离得到了一些已知化合物[4-8]。为发掘杜仲内生菌的活性天然产物,对分离自黔产杜仲树叶的一株内生真菌Penicillium sp. GZWMJZ-042通过添加5-aza来进行代谢调控,发现添加了表观遗传修饰剂后发酵提取物的丰富程度明显增加,液相检测图谱如图1所示。对表观遗传修饰后的发酵产物进行研究,分离鉴定了9个化合物,包括1个新化合物,其结构依次为14-hydrocyclopeptin(1)、viridicatol(2)、viridicatin(3)、(2S, 4aR, 4bR, 6aS, 12bS, 12cS, 14aS)-4a-demethylpaspaline-4a-carboxylic acid(4)、fumigaclavine C(5)、(-)chaetominine(6)、cyclo(dehydrohistidyl-L-tryptophyl)(7)、dankasterones A(8)和2'-deoxythymidine(9),其結构如图2所示。测试了化合物1~9对α-葡萄糖苷酶的抑制活性,发现化合物1,2,4,6~9的活性较强,IC50值分别为147.0,118.7,110.5,65.9,74.6,40.6 和151.5 μg/mL,
阳性对照阿卡波糖的IC50为163.9 μg/mL。
1 实验部分
1.1 实验仪器与试剂
实验仪器:Waters 2695 LCQ-MS型质谱仪(美国Thermo Finnigan公司);INOVA-400MHz型核磁共振仪(美国Varian公司)(氘代溶剂中添加TMS为内标物);Primaide型分析型和制备型高效液相色谱仪(日本日立公司);Air Tech型洁净工作台(苏州安泰空气技术有限公司);ZF-6型三用紫外线分析仪(上海嘉鹏科技有限公司);LDZX-75KBS型高压灭菌锅(上海申安医疗器械厂);FA1104型电子分析天平(上海天平仪器厂);ZWY-2112型恒温培养振荡器(上海智城分析仪器制造有限公司);GF254型薄层层析板(青岛海洋化工集团公司);分离用正相硅胶(青岛谱科分离材料有限公司);羟丙基葡聚糖LH-20凝胶(瑞典Amersham Pharmacia Biotech AB公司)。
试剂:提取和分离所用的分析纯溶剂,如甲醇、乙酸乙酯、二氯甲烷和石油醚等(上海沃化化工有限公司),液相用色谱纯甲醇(上海星可高纯溶剂有限公司)。
1.2 实验菌株
菌株GZWMJZ-042分离自采集于贵州省贵阳市药用植物园的杜仲叶,保藏于贵州省天然产物研究中心。菌株委托北京六合华大基因科技有限公司武汉分公司进行ITS的提取、扩增和测序,基因序列经NCBI数据库进行blast比对,鉴定为青霉属真菌,其GenBank登录号为No. KY038581。
1.3 菌株发酵
将保藏于4 ℃的菌株接种到马铃薯葡萄糖琼脂(PDA)平板上,28 ℃条件下培养3 d。然后挑取单菌落接种到真菌二号培养基中,于恒温震荡培养器中培养4 d,其条件为28 ℃下180 r/min。菌液经超声破碎,菌体在溶液中均匀分散后,作为种子液后续发酵接种使用。后将种子液接种到由50 g大米+50 mL含有表观遗传修饰剂5-aza(0.25 g/L)水溶液配置的固体培养基中,于28 ℃静置发酵培养3 d,发酵量10 kg。
1.4 活性产物的提取分离
菌株GZWMJZ-042提取物的制备:30 d发酵结束后,在培养基中加入乙酸乙酯将菌株灭活,然后用发酵物3倍体积的乙酸乙酯搅拌提取3次(搅拌时间分别为1,2和4 h),将提取液减压浓缩,共得到提取物137.24 g。
代谢产物的分离:提取物首先进行正相硅胶柱色谱分离,依次用石油醚,石油醚:二氯甲烷(V:V=1:1),二氯甲烷,二氯甲烷:甲醇(V:V=100:1,50:1,20:1,10:1,5:1,2:1,1:1)的溶液梯度洗脱,得到8个组分(Fr.1~8)。Fr.2通过正相硅胶柱色谱,分别用石油醚:乙酸乙酯(V:V= 5:1,2:1,1:1)的溶液梯度洗脱,得到6个组分(Fr.2.1~6)。Fr.2.3(4.05 g)通过Sephadex LH-20葡聚糖凝胶柱层析[二氯甲烷:甲醇(V:V=1:1)]洗脱,得到13个组分(Fr.2.3.1~13)。Fr.2.3.5通过正相硅胶柱色谱,石油醚:乙酸乙酯(V:V =2:1)洗脱,得到 6 个组分(Fr.2.3.5.1~6)。Fr. 2.3.5.6经HPLC(ODS-C18柱,95% MeOH:H2O,4 mL/min)得到化合物 8(tR=6.5 min,8.3mg)。Fr. 2.3.11通过正相硅胶柱色谱,石油醚:乙酸乙酯(V:V=2:1) 洗脱,得到9个组分(Fr.2.3.11.1~9)。Fr.2.3.11.6 经HPLC(ODS-C18柱, 80% MeOH:H2O,4 mL/min)得到化合物3
(tR=6.0 min,14.0 mg)。Fr.3(11.17 g) 通过Sephadex LH-20葡聚糖凝胶柱层析(MeOH)洗脱,得到15个组分(Fr.3.1~15)。Fr.3.5 通过正相硅胶柱色谱,二氯甲烷:甲醇(V:V=10:1) 洗脱,得到3个组分(Fr.3.5.1~3),Fr.3.5.2 经 HPLC(ODS-C18柱,60% MeOH:H2O,
4 mL/min)得到化合物5(tR=5.8 min,22.7 mg)。Fr. 3.9 通过正相硅胶柱色谱,二氯甲烷:甲烷(V:V=5:1)洗脱,得到6个组分(Fr.3.9.1~6),Fr.3-9-6 经 HPLC(ODS-C18 柱,90% MeOH:H2O,4 mL/min)
得到化合物4(tR=7.8 min,3.3 mg)。Fr.3.12 经HPLC(ODS-C18柱,60% MeOH:H2O,4 mL/min)得到化合物1(tR=5.0 min,6.0 mg)和化合物6(tR=
7.8 min, 14.0 mg)。Fr.6(3.09 g)通过 Sephadex LH-20葡聚糖凝胶柱色谱分离,洗脱剂为甲醇,得到11个组分(Fr.6.1~11)。Fr.6.10经 HPLC(ODS-C18柱,60% MeOH:H2O,4 mL/min)得到化合物2(tR=8.5 min,
8.6 mg)。Fr.7(9.37 g)通过Sephadex LH-20葡聚糖凝胶柱色谱分离,洗脱剂为甲醇,得到16个组分(Fr.7.1~16)。Fr.7.3通过正相硅胶柱色谱,二氯甲烷:甲醇(V:V=5:1)洗脱,得到化合物9(20.4 mg)。Fr. 7.11通过正相硅胶柱色谱,二氯甲烷:甲醇(V:V=8:1)洗脱,得到化合物7(40.3 mg)。
1.5 活性评价方法
化合物1~9的α-葡萄糖苷酶抑制活性测试采用PNPG法。准备好磷酸盐缓冲溶液(取0.1 mol/L的磷酸二氢钠和0.1 mol/L磷酸氢二钠溶液等体积混合),PNPG 溶液(用0.1 mol/L PBS溶液将PNPG配制成2.5 mmol/L 的溶液),0.2 mol/L的碳酸钠溶液、10% DMSO。將阿卡波糖和待测化合物用二甲基亚砜溶解,然后用PBS稀释配制成2.5 mg/mL的溶液。96孔板上设有空白对照、阴性对照、阳性对照、实验组和背景组。空白对照:80 μL PBS溶液+20 μL 10% DMSO; 阴性对照:70 μL PBS溶液+10 μL 10% DMSO+20 μL α-葡萄糖苷酶;阳性对照:70 μL PBS溶液+10 μL阿卡波糖+20 μL α-葡萄糖苷酶;实验组:70 μL PBS溶液+10 μL化合物+20 μL α-葡萄糖苷酶;背景组:90 μL PBS溶液+10 μL化合物。每组设置3个平行孔。分别加好以上各组后,将96孔板置于37 ℃的恒温培养箱中孵育15 min;取出96孔板,分别在每孔中加入20 μL PNPG溶液,置于37 ℃的恒温培养箱中孵育30 min;取出96孔板,分别在每孔中加入80 μL碳酸钠溶液,于405 nm波长下酶标仪读取数据;依据数据计算每组的平均值并按照公式计算抑制率:[抑制率 =(阴性对照-空白对照)-(实验组-背景组)/(阴性对照-空白对照)]×100%。有活性的化合物继续稀释测试抑制率,用SPSS软件计算得出IC50[9]。
2 结果与分析
2.1 化合物结构鉴定
化合物1:棕色固体,高分辨质谱在 m/z 295.1074 处给出[M+H]+准分子离子峰(calcd. [M+H]+ 295.1038),提示化合物1的分子量为294,分子式为C17H14N2O3,不饱和度为12。红外光谱(KBr, cm-1)在3422,2924,1675,1627,1396,1205波长处给出吸收峰,紫外光谱λmax(logε):219(3.17),216(3.06),293(2.17)处的吸收峰提示可能含酚羟基、酯基、苯环等结构。化合物的核磁共振图谱(表1)给出7个季碳信号(δC 170.7,166.2,159.0,136.9,131.0,125.4,122.9),9个次甲基信号(δC 132.6,131.2×2,130.7,129.5,124.1,120.8,116.0×2)和1个甲基碳信号(δC35.0),以上信号与文献报道的dehydrocyclopeptin比较接近[10-11],其主要区别在于苯环片段有羟基取代。在HMBC谱中,1-NH(δH 10.46)与C-3和C-5a相关,H-6(δH 7.77)与C-5和C-9a相关,H-8(δH 7.49)与C-9a相关,H-9(δH 7.13)与C-5a相关,H-10(δH 6.75)与C-2和C-12/16相关,H-13/15(δH 6.81)与C-10相关,H3-17(δH 3.05)与C-3和C-5相关,14-OH(δH 10.09)与C-13/15相关;1H-1H COSY谱中,H-6/H-7/H-8/H-9之间有相关信号,H-12/16与H-13/15之间有相关信号,证明了化合物是dehydrocyclopeptin的14位羟基取代的衍生物,NOESY谱中,H3-17与H-12/16之间的相关信号表明双键构型为Z型,因此化合物1的结构得以确证,并命名为14-hydrocyclopeptin(图3)。
化合物2:棕褐色固体。阴离子质谱ESI-MS在m/z 252.1处给出[M-H]-峰,提示该化合物的分子量为253,并结合1H、13C NMR确定其分子式为C15H11NO3。1H NMR(400 MHz, DMSO-d6) δH 12.22(1H, s, 3-OH), 9.56(1H, s, 3'-OH), 9.17(1H, s, 1-NH), 7.34-7.28(3H, m, H-5/8/5'), 7.11-7.05(2H, m, H-6/7), 6.82(1H, d, J=7.3 Hz, H-6'), 6.72(1H, d, J=7.3 Hz, H-4'), 6.71(1H, s, H-2');13C NMR(100 MHz, DMSO-d6) δC 158.4(C-2), 157.3(C-3'), 142.3(C-8a), 135.0(C-1'), 133.1(C-3), 129.4(C-5'), 126.5(C-7), 124.5(C-5), 124.1(C-4), 122.2(C-6), 121.0(C-4a), 120.4(C-6'), 116.7(C-4'), 115.3(C-8), 114.7(C-2')。以上数据与文献报道基本一致[12],故鉴定化合物2为viridicatol。
化合物3:淡紫色固体。阴离子质谱ESI-MS在m/z 236.1处给出[M-H]-峰,提示该化合物的分子量为237,并结合1H、13C NMR确定其分子式为C15H11NO2。1H NMR(400 MHz, DMSO-d6) δH 12.24(1H, s, 1-NH), 9.23(1H, s, 3-OH), 7.51(2H, t, J=7.7 Hz, H-3'/5'), 7.43(1H, t, J=7.1 Hz, H-4'), 7.36-7.31(4H, m, H-5/8/2'/6'), 7.09-7.03(2H, m, H-6/7); 13C NMR(100 MHz, DMSO-d6) δC 158.3(C-2), 142.5(C-8a), 133.8(C-1'), 133.2(C-3), 129.9(C-2'/6'), 128.4(C-3'/5'), 127.7(C-4'), 126.5(C-7), 124.4(C-5), 124.0(C-4), 122.2(C-6), 121.0(C-4a), 115.3(C-8)。以上数据与文献报道基本一致[13],故鉴定化合物3为viridicatin。
化合物4:淡灰色固体,[α]–7.5(c 0.53, MeOH)。阳离子质谱ESI-MS在m/z 474.2处给出[M+Na]+峰,提示分子量为451,并结合1H、13C NMR确定其分子式为C28H37NO4。1H NMR(400 MHz, DMSO-d6 ) δH 10.58(1H, s, 12-NH), 7.26(1H, d, J=7.4 Hz, H-11), 7.24(1H, d, J=7.4 Hz, H-8), 6.92(1H, t, J=7.4 Hz, H-10), 6.89(1H, t, J=7.4 Hz, H-9), 3.12(1H, br s, H-2), 3.10(1H, br s, H-14a), 2.65~2.59(1H, m, H-6a), 2.59~2.56(1H, m, H-7α), 2.57~2.53(1H, m, H-14β), 2.35(1H, d, J =11.6 Hz, H-4β), 2.25~2.20(1H, m, H-7β), 1.98(1H, d, J =12.6 Hz, H-13β), 1.86~1.76(2H, m, H-13α/5β), 1.71~1.65(2H, m, H-4b/6β), 1.65~1.56(3H, m, H-3α/5α/14α), 1.54~1.47(1H, m, H-6α), 1.28~1.22(1H, m, H-4α), 1.22~1.15(1H, m, H-3β), 1.08(3H, s, H-3'), 0.99(3H, s, H-2'), 0.96(3H, s, H-12c-CH3 ), 0.92(3H, s, H-12b-CH3); 13C NMR(100 MHz, DMSO-d6) δC 175.5(C-4a-COOH), 151.1(C-12a), 140.3(C-11a), 124.5(C-7b), 119.5(C-10), 118.6(C-9), 117.8(C-8), 116.0(C-7a), 112.0(C-11), 84.3(C-2), 83.7(C-14a), 70.5(C-1'), 51.8(C-12b), 48.8(C-6a), 47.4(C-4a), 46.1(C-4b), 39.9(C-12c), 35.4(C-4), 32.5(C-13), 27.1(C-7), 27.1(C-3'), 25.3(C-14), 24.9(C-6), 24.6(C-2'), 22.9(C-3), 22.3(C-5), 16.3(C-12c-CH3), 14.6(C-12b-CH3)。以上数据与文献报道基本一致[14],故鉴定化合物4为已知化合物(2S, 4aR, 4bR, 6aS, 12bS, 12cS, 14aS)-4a-demethylpaspaline-4a-carboxylic acid。
化合物5:淡棕色固体,[α]–40.8(c 2.45, MeOH)。阳离子质谱ESI-MS在m/z 367.1处给出[M+H]+峰,提示分子量为366,并结合1H、13C NMR确定其分子式为C23H30N2O2。1H NMR(400 MHz, DMSO-d6) δH 10.67(1H, s, 1-NH), 7.14(1H, d, J=7.9 Hz, H-14), 6.99(1H, t, J=7.9 Hz, H-13), 6.61(1H, d, J=7.9 Hz, H-12), 6.15(1H, dd, J=17.1, 10.8 Hz, H-22), 5.59(1H, br s, H-9), 5.08(1H, br s, H-23a), 5.05(1H, d, J=7.4 Hz, H-23b), 3.68~3.62(2H, m, H-4a/10), 3.59(1H, br s, H-5), 3.44(2H, br s, H-7), 3.03(3H, s, H-17), 3.00~2.90(1H, m, H-4b), 2.33(1H, br s, H-8), 1.85(3H, s, H-25), 1.50(3H, s, H-20), 1.49(3H, s, H-21), 1.31(3H, d, J=7.4 Hz, H-18); 13C NMR(100 MHz, DMSO-d6) δC 169.8(C-24), 145.8(C-22), 138.4(C-2), 132.6(C-15), 126.6(C-11), 125.2(C-16), 121.5(C-13), 112.0(C-12), 111.3(C-23), 109.0(C-14), 101.7(C-3), 68.4(C-9), 61.3(C-5), 55.9(C-7), 41.0(C-17), 38.8(C-10), 36.7(C-19), 31.3(C-8), 27.4(C-21), 27.2(C-20), 24.3(C-4), 20.8(C-25), 14.9(C-18)。以上數据与文献报道基本一致[15],故鉴定化合物5为已知化合物fumigaclavine C。
化合物6:棕色固体,[α]–27.4(c 1.75, MeOH)。阳离子质谱ESI-MS在m/z 425.0给出准分子离子峰[M+Na]+,提示分子量为402,并结合1H、13C NMR确定其分子式为C22H18N4O4。1H NMR(400 MHz, DMSO-d6) δH 8.28(1H, br s, H-25), 8.18(1H, br s, H-19), 7.85(1H, t, J=7.4 Hz, H-21), 7.69(1H, d, J=7.4 Hz, H-22), 7.58(1H, t, J=7.4 Hz, H-20), 7.52~7.48(2H, m, H-5/8), 7.43(1H, t, J=7.4 Hz, H-7), 7.25(1H, t, J=7.4 Hz, H-6), 5.91(1H, br s, H-14), 5.60(1H, s, H-2), 4.61(1H, q, J=6.4 Hz, H-11), 2.93(1H, t, J=12.5 Hz, H-13αβ), 2.50(1H, br s, H-13β), 1.60(3H, d, J=6.4 Hz, H-12); 13C NMR(100 MHz, DMSO-d6) δC 172.1(C-10), 165.5(C-17), 160.1(C-15), 148.6(C-24), 147.4(C-23), 138.7(C-9), 136.7(C-4), 134.8(C-21), 129.9(C-7), 127.3(C-22), 127.2(C-20), 126.4(C-19), 125.5(C-6), 124.9(C-5), 121.1(C-18), 114.5(C-8 ), 82.6(C-2), 76.4(C-3), 59.6(C-11), 50.8(C-14), 38.6(C-13), 14.0(C-12)。以上數据与文献报道基本一致[16],故鉴定化合物6为已知化合物(-)chaetominine。
化合物7:黄棕色固体,[α]+50.5(c 2.22, MeOH)。阳离子质谱ESI-MS在m/z 322.0给出准分子离子峰[M+H]+,提示分子量为321,并结合1H、13C NMR确定其分子式为C17H15N5O2。1H NMR(400 MHz, DMSO-d6) δH 12.76(1H, br s, 1-NH), 10.90(1H, s, 15-NH), 10.15(1H, s, 12-NH), 8.78(1H, br s, 19-NH), 7.62(1H, s, H-20), 7.57(1H, d, J=7.7 Hz, H-4), 7.23(1H, d, J=7.7 Hz, H-7), 7.04(1H, s, H-22), 7.01(1H, s, H-2), 7.00(1H, t, J=7.7 Hz, H-6), 6.94(1H, t, J=7.7 Hz, H-5), 5.96(1H, br s, H-17), 4.34(1H, br s, H-11), 3.31(1H, dd, J=14.3, 3.7 Hz, H-10b), 3.09(1H, dd, J=14.3, 4.7 Hz, H-10a); 13C NMR(100 MHz, DMSO-d6) δC 166.0(C-16), 160.7(C-13), 136.7(C-9), 136.0(C-20), 133.2(C-22), 127.7(C-8), 125.6(C-18), 124.6(C-2), 121.9(C-14), 120.9(C-6), 118.8(C-4), 118.5(C-5), 111.2(C-7), 107.9(C-3), 106.9(C-17), 56.0(C-11), 29.4(C-10)。以上数据与文献报道基本一致[17],故鉴定化合物7为已知化合物cyclo(dehydrohistidyl-L-tryptophyl)。
化合物8:黄色固体,[α]+14.8(c 0.81, MeOH)。阳离子质谱ESI-MS在m/z 447.3处给出[M+Na]+峰,提示分子量为424,并结合1H、13C NMR确定其分子式为C28H40O3。1H NMR(400 MHz, DMSO-d6) δH 5.94(1H, s, H-4), 5.29-5.25(2H, m, H-22/23), 2.76(1H, t, J=8.5 Hz, H-9), 2.68~2.62(1H, m, H-7α), 2.62~2.58(1H, m, H-7β), 2.43~2.40(2H, m, H-15α/15β), 2.37~2.22(2H, m, H2-2), 2.24~2.21(1H, m, H-20), 1.91~1.88(1H, m, H-1α), 1.88~1.86(1H, m, H-β), 1.86~1.84(1H, m, H-11α), 1.84~1.82(1H, m, H-11β), 1.82~1.80(1H, m, H-16α), 1.80~1.77(1H, m, H-24), 1.71~1.66(1H, m, H-12α), 1.66~1.61(1H, m, H-12β), 1.61~1.57(1H, m, H-16β), 1.55(1H, dd, J=12.8, 5.2 Hz, H-17), 1.48~1.40(1H, m, H-25), 1.19(3H, s, H-19), 1.06(3H, d, J=6.8 Hz, H-21), 0.86(3H, s, H-18), 0.80-0.77(9H, m, H3-26/27/28); 13C NMR(100 MHz, DMSO-d6) δC 215.5(C-14), 200.3(C-6), 199.2(C-3), 157.6(C-5), 133.9(C-23), 133.0(C-22), 124.7(C-4), 62.2(C-8), 54.3(C-13), 48.9(C-9), 46.4(C-17), 42.6(C-24), 40.0(C-7), 38.3(C-1), 37.7(C-12), 36.7(C-20), 36.5(C-15), 36.0(C-10), 34.1(C-2), 32.6(C-25), 24.6(C-11), 23.6(C-19), 23.4(C-16/21), 20.0(C-27), 19.6(C-26), 17.5(C-28), 16.5(C-18)。以上数据与文献报道基本一致[18],故鉴定化合物8为已知化合物 dankasterones A。
化合物9:棕色油状物。[α]+18.6(c 2.94, MeOH),阳离子质谱ESI-MS在m/z 265.0处给出[M+Na]+峰,提示分子量为242,并结合1H、13C NMR确定其分子式为C10H14N2O5。1H NMR(400 MHz, DMSO-d6) δH 7.70(1H, s, H-6), 6.16(1H, t, J=7.0 Hz, H-1'), 4.24(1H, m, H-4'), 3.77~3.73(1H, m, H-3'), 3.60~3.52(2H, m, H2-5'), 2.08~2.04(2H, m, H2-2'), 1.76(3H, s, H-7);13C NMR(100 MHz, DMSO-d6) δC 164.0(C-4), 150.7(C-2), 136.2(C-6), 109.4(C-5), 87.3(C-1'), 83.8(C-4'), 70.4(C-3'), 61.3(C-5'), 39.4(C-2'), 12.4(C-7)。以上波谱数据与文献报道基本一致[19],该化合物鉴定为已知化合物 2'-deoxythymidine。
2.2 α-葡萄糖苷酶抑制测试结果
化合物1~9采用PNPG法测试对α-葡萄糖苷酶的抑制活性,结果见表2。
3 讨论
α-葡萄糖苷酶抑制剂是通过抑制淀粉等多糖的降解,延迟小肠对葡萄糖的吸收起到降糖作用,这类药物既能有效降低餐后高血糖又不会引起低血糖症状,其对以碳水化合物为主要热量来源的中国患者具有较好的治疗效果。目前临床上使用的α-葡萄糖苷酶抑制剂阿卡波糖、米格列醇和伏格列波糖,均是来源于微生物的代谢产物或者其衍生物,由此可以认为从微生物代谢产物中寻找新的α-葡萄糖苷酶抑制剂具有独特优势。课题组开展了杜仲内生菌来源的α-葡萄糖苷酶抑制活性化合物的研究工作,在一株曲霉菌的培养基中添加杜仲叶,诱导菌株产生了结构多样的联三苯类化合物,并结合化学修饰进一步拓展了其化学结构,表现出了较好的α-葡萄糖苷酶抑制活性[20]。本研究对另一株杜仲内生菌进行了表观遗传修饰调控,发现其代谢产物的丰富程度明显提升,从中分离得到了1个新化合物及8个已知化合物,大部分都为生物碱类化合物。新化合物1具有苯并二氮杂环的母核且3位有苯烯基取代,天然来源的此类骨架的化合物报道较
少[10-11,21],相比于天然产物dehydrocyclopeptin和trans-3-(3'-hydroxybenzylidene)-3,4-dihydro-4-methyl-lH-1,4-benzodiazepin-2,5-dione[11],其结构新颖性在于苯烯片段中苯环的取代羟基处于对位。活性评价发现分离的9个化合物大多具有较好的α-葡萄糖苷酶抑制活性,化合物2的活性优于化合物3,推测是取代苯环上多了一个羟基所致活性增加。综上,菌株在添加5-aza进行表观遗传修饰调控后,代谢产生了结构新颖并且具有较好α-葡萄糖苷酶抑制活性的化合物,为杜仲内生菌次级代谢产物的研究提供了新的研究思路,并为α-葡萄糖苷酶抑制剂药物的研究提供了物质基础。
参 考 文 献
Ng H H, Jeppesen P, Bird A. Active repression of methylated genes by the chromosomal protein MBD1[J]. Mol Cell Biol, 2000, 20(4): 1394-1406.
Yang X L, Awakawa T, Wakimoto T, et al. Induced biosyntheses of a novel butyrophenone and two aromatic polyketides in the plant pathogen Stagonospora nodorum[J]. Nat Prod Bioprospect, 2013, 3: 141-144.
Wang X, Sena Filho J G, Hoover A R, et al. Chemical epigenetics alters the secondary metabolite composition of guttate excreted by an atlantic-forest-soil-derived Penicillium citreonigrum[J]. J Nat Prod, 2010, 73(5): 942-948.
龚倩玉, 许言超, 左明星, 等. 杜仲内生青霉菌GZWMJZ-
068次生代谢产物研究[J]. 天然产物研究与开发, 2018, 30(10): 1721-1727.
杨秀芳, 田从丽, 张弘弛, 等. 杜仲內生真菌 EL09 次生代谢产物的研究[J]. 中成药, 2012, 34(6): 1115-1118.
Zhang H C, Liu R, Zhou F, et al. Antimicrobial metabolites from the endophytic fungus Aspergillus sp. of Eucommia ulmoides[J]. Chem Nat Compd, 2014, 50(3): 526-528.
Ma Y M, Zhang H C, Zhao J, et al. Secondary anti-fungi metabolites from the endophytic fungus Fusarium sp. in Eucommia ulmoides[J]. Chem Nat Compd, 2012, 48(1): 170-171.
Liu W, Liu Y, Yang F, et al. Asperflaloids A and B from Aspergillus flavipes DZ-3, an endophytic fungus of Eucommia ulmoides Oliver[J]. Molecules, 2021, 26: 3514.
Shim Y J, Doo H K, Ahn S Y, et al. Inhibitory effect of aqueous extract from the gall of Rhus chinensis on alpha-glucosidase activity and postprandial blood glucose[J]. J Ethnopharmacol, 2003, 85(2-3): 283-287.
Framm J, Nover L, Azzouny A E, et al. Cyclopeptin and dehydrocyclopeptin: Intermediates of biosynthesis of alkaloids of cyclopenin viridicatin group in Penicillium cyclopium westling[J]. Eur J Biochem, 1973, 37(1): 78-85.
Zhang C C, Ding S S, Shi W S, et al. A new quinolinone from freshwater lake-derived fungus Myrothecium verrucaria[J]. Nat Prod Res, 2017, 31(1): 99-103.
Shu Z, Liu Q, Xing C, et al. Viridicatol isolated from deep-sea Penicillium griseofulvum alleviates anaphylaxis and repairs the intestinal barrier in mice by suppressing mast cell activation[J]. Mar Drugs, 2020, 18(10): 517.
Rudolf O, Rouchal M, Lycka A, et al. Pinacol rearrangement of 3,4-dihydro-3,4-dihydroxyquinolin-2(1H)-ones: An alternative pathway to viridicatin alkaloids and their analogs[J]. Helv Chim Acta, 2013, 96(10): 1905-1917.
Fan Y, Wang Y, Liu P, et al. Indole-diterpenoids with anti-H1N1 activity from the aciduric fungus Penicillium camemberti OUCMDZ-1492[J]. J Nat Prod, 2013, 76(7): 1328-1336.
Xu J, Song Y, Guo Y, et al. Fumigaclavines D–H, new ergot alkaloids from endophytic Aspergillus fumigatus[J]. Planta Med, 2014, 80(13): 1131-1137.
左明星, 周彦伶, 许言超, 等. 烟曲霉GZWMJZ-152茶粕发酵代谢产物[J]. 菌物学报, 2019, 38(2): 264-271.
Noh H J, Sohn M J, Yu H E, et al. Cyclo(dehydrohistidyl-L-tryptophyl), an inhibitor of nitric oxide production from a fungal strain, Fb956[J]. J Microbiol Biotechnol, 2007, 17(10): 1717-1720.
Amagata T, Tanaka M, Yamada T, et al. Variation in cytostatic constituents of a sponge-derived Gymnascella dankaliensis by manipulating the carbon source[J]. J Nat Prod, 2007, 70(11): 1731-1740.
Ouyang M A. A new adenosyl-alkaloid from Ostrea rivularis[J]. Nat Prod Res, 2006, 20(1): 79-83.
Xu Y, Wang Y, Wu D, et al. p-Terphenyls from Aspergillus sp. GZWMJZ-055: identification, derivation, antioxidant and α-glycosidase inhibitory activities[J]. Front Microbiol, 2021, 12: 654963.
巨凤, 罗凡, 冯丹, 等. 冬虫夏草内生菌Penicillium crustosum的化学成分研究[J]. 天然产物研究与开发, 2021, 33(7): 1147-1155.
收稿日期:2023-04-06
基金项目:贵州省“百人领军人才”计划;中国科学院西部青年学者(院外);贵州省基础研究(自然科学)(No. 黔科合基础-ZK[2022]一般392)
作者简介:王晓洋,女,生于1996年,在讀硕士研究生,主要研究方向:微生物代谢产物,E-mail: wxyang217@163.com
*通信作者,王立平,E-mail: wangliping2022@gmc.edu.cn:朱伟明,E-mail: weimingzhu@ouc.edu.cn
