多西环素联合利福平对耐碳青霉烯类肺炎克雷伯菌体内外抗菌活性
2023-12-26王保贵王娜娜周思绪陈俊羽吴秋云徐荣胡文陈春林
王保贵 王娜娜 周思绪 陈俊羽 吴秋云 徐荣 胡文 陈春林
摘要:目的 探究多西环素联合利福平对耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)体内外抗菌活性。方法 收集宜春市人民醫院临床分离的非重复CRKP,测定多种常用抗菌药物对其最低抑菌浓度(minimum inhibitory concentration, MIC)。通过棋盘稀释法进行联合药敏试验,计算部分抑菌浓度指数(fractional inhibitory concentration index, FIC)判定联合效果。体外时间-杀菌曲线观察联合杀菌作用。采用结晶紫染色法测定两药联用对生物膜形成的抑制作用及清除作用。鼻腔滴注法建立小鼠肺部肺炎克雷伯菌感染模型,检测鼠肺部细菌浓度变化、血清C-反应蛋白(CRP)、IL-6水平。HE染色观察肺组织病理形态学改变。结果 棋盘法显示多西环素联合利福平效果最好,两药联用时多西环素的MIC值从(4~256 μg/mL)下降到(2~8 μg/mL),利福平的MIC值从(16~256 μg/mL)下降到(2~16 μg/mL)。时间-杀菌曲线显示,多西环素联合利福平对细菌作用24 h内,使细菌数较初始细菌数降低≥2lg CFU/mL,呈现抑菌或杀菌作用。结晶紫染色法测定,联合组对细菌生物膜抑制生长和破坏作用较对照组差异性明显(P<0.05)。动物实验表明,联合组小鼠肺部组织细菌数、C-反应蛋白(CRP)、IL-6水平显著降低,感染情况明显改善,肺泡结构清晰,充血减少,差异均有统计学意义(P<0.05)。结论 体外实验表明,多西环素联用利福平对CRKP具有协同抗菌或杀菌作用,动物实验证实多西环素联用利福平可降低炎性指标,有效治疗肺组织细菌感染,有体内抗菌作用。此结果可供临床参考。
关键词:碳青霉烯类耐药肺炎克雷伯菌;联合药敏;杀菌曲线;生物膜;动物实验
中图分类号:R965文献标志码:A
In vitro and in vivo antibacterial activity of doxycycline combined with rifampicin against carbapenem-resistant Klebsiella pneumoniae
Wang Baogui1, Wang Nana2, Zhou Sixu1, Chen JunYu1, Wu Qiuyun1, Xu Rong3, Hu Wen3, and Chen Chunlin1
(1 School of Chemical and Biological Engineering, Yichun University, Yichun 336000; 2 Lanling People's Hospital, Linyi 276000;
3 Yichun People's Hospital, Yichun 336000)
Abstract Objective To investigate the antibacterial activity of doxycycline combined with rifampicin against carbapenem-resistant Klebsiella pneumoniae (CRKP) in vitro and in vivo. Methods The clinical isolates of non-repetitive CRKP were collected from Yichun People's Hospital, and the minimum inhibitory concentrations of various commonly used antibiotics to them were determined. The checkerboard dilution method was used to perform the combined drug sensitivity test, and the fractional inhibitory concentration index (FICI) was calculated to determine the combined effect. The time-killing curve in vitro was used to observe the bactericidal effect of the combination. Crystal violet staining was used to determine the inhibitory effect of the two drugs on biofilm formation and clearance. A mouse model of Klebsiella pneumoniae infection in the lungs of mice was established by nasal instillation. The changes in lung bacterial concentration and serum levels of C-reactive protein (CRP) and IL-6 were detected. HE staining was used to observe the pathological changes of lung tissue. Results The checkboard test results showed that doxycycline combined with rifampicin had the best effect. When combined, the MIC value of doxycycline decreased from (4~256 μg/mL) to (2~8 μg/mL); while that of rifampicin decreased from (16~256 μg/mL) to (2~16 μg/mL).
The time-killing curve showed that doxycycline combined with rifampicin could reduce the number of bacteria by ≥2lg CFU/mL within 24 hours compared with the initial bacterial count, indicating an antibacterial or bactericidal effect. Crystal violet staining showed that the growth inhibition and destruction of bacterial biofilm in the combined group were significantly different from those in the control group (P<0.05). Animal experiments showed that the number of bacteria, CRP, and IL-6 levels in the lung tissue of mice in the combination group were significantly reduced, the infection situation was significantly improved, the alveolar structure was clear, and the congestion was reduced. The differences were statistically significant (P<0.05). Conclusion Doxycycline combined with rifampicin has synergistic antibacterial or bactericidal effect against CRKP in vitro. Animal experiments have confirmed that doxycycline combined with rifampicin can reduce inflammatory markers, effectively treat lung tissue bacterial infection, and have antibacterial effect in vivo. The results can be used as clinical references.
Key words Carbapenem-resistant Klebsiella pneumoniae; Combined drμg sensitivity; Bactericidal curve; Biofilm; Animal experiments
碳青霉烯类抗生素被视为治疗多重耐药革兰阴性菌的最后一道防线[1]。耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)出现后,由于耐药基因广泛,预后差,死亡率高[2]。现有抗菌药物缺少有效性,给临床治疗带来极大困扰,亟需寻找新的有效治疗方案。
多西环素属四环素类,可特异性与细菌核糖体30S亚基在A位置结合,改变细胞膜通透性,发挥抑菌作用[3]。对CRKP有较高敏感性,与阿米卡星联用时,对CRKP有协同抑菌作用[4]。多西环素单用时有“低耐药潜力”特质,几乎没有副作用,抗菌潜力有待挖掘[5]。利福平通过抑制细菌RNA,破坏蛋白质合成,且具有穿透生物膜特性[6]。利福平与其他抗菌药物联用对CRKP表现出良好的协同作用[7-8]。临床上,多西环素与利福平联用治疗布鲁菌病时呈现良好协同效果[9]。
目前,多数实验表明药物联用对CRKP抗菌效果更好[10],临床上对于CRKP感染的治療效果和预后联合用药也优于单药治疗[11]。CRKP对四环素类药物(替加环素、米诺环素)一直保持较高敏感度[12],利福平和其他抗生素联用时对CRKP有抗菌效果[13]。本实验旨在通过体外实验和动物实验,评估多西环素联用利福平体内外抗菌效果,探索药物方案合理性,以期为临床治疗CRKP提供新的用药选择。
1 材料与方法
1.1 材料
1.1.1 菌株来源
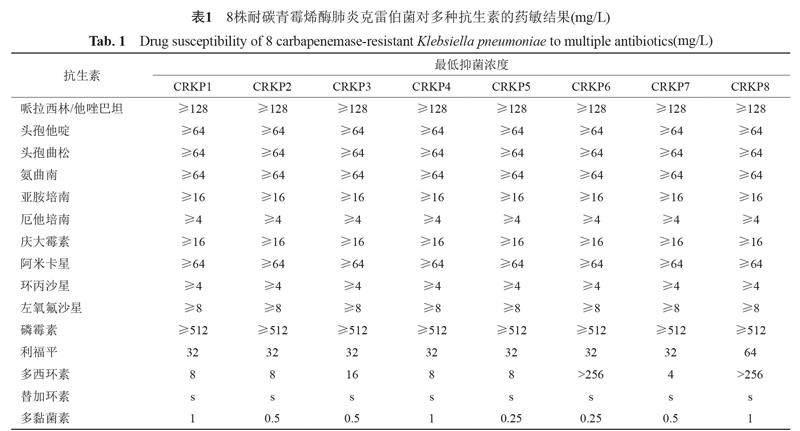
宜春市人民医院2021年分离的8株非重复CRKP,来自神经外科和ICU感染患者标本。分别取自感染患者痰液和脑脊液。8株非重复肺炎克雷伯菌对亚胺培南、美罗培南的最低抑菌浓度(minimum inhibitory concentration,MIC)≥4 mg/L,符合CDC对于碳青霉烯类耐药肠杆菌科细菌(CRE)最新定义标准,既全为CRKP[14]。
1.1.2 培养基和抗菌药物
抗菌药物多西环素(上海阿拉丁生化科技股份有限公司,批号:D2129050)、利福平(上海阿拉丁生化科技股份有限公司,批号:F2116178)、磷霉素(上海阿拉丁生化科技股份有限公司,批号:C11480181)、头孢他啶(海南海灵化学制药有限公司,批号:1906212)、左氧氟沙星(上海阿拉丁生化科技股份有限公司,批号:F2115338)、美罗培南(海口市制药厂有限公司,批号:09191105)、亚胺培南(Merck Sharp &Dohme Corp.U.S.A,批号:T008366)。M-H琼脂、M-H肉汤培养基,由各试剂配制而成(可溶性淀粉(上海阿拉丁生化科技股份有限公司,批号:200114)、酸水解酪蛋白(上海阿拉丁生化科技股份有限公司,批号:A2213608)、牛肉膏(北京索莱宝生物科技有限公司,批号:NO. 312D051)、琼脂粉(北京索莱宝生物科技有限公司,批号:NO. 507V025)。
1.1.3 仪器
WGZ-2XJ 细菌浊度仪(上海昕瑞仪器仪表有限公司),TECAN Infinite 200 PRO全波段酶标仪(北京世贸远东科学仪器有限公司),Phoenix-100全自动细菌鉴定仪(美国BD公司)。
1.1.4 动物
动物50只ICR种雄性小白鼠,鼠龄8周,体重18~22 g,由湖南斯莱克景达实验有限公司提供。动物许可证号:SCXK(湘)2019-0004。
1.2 实验方法
1.2.1 微量稀释法药敏实验
采用微量肉汤稀释法测定西环素、利福平、磷霉素、头孢他啶、左氧氟沙星和美罗培南等12种抗菌药物对8株CRKP的最低抑菌浓度(MIC),参照美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)2017年M100s-27th推荐的规范和折点实施试验和判读结果[15]。
1.2.2 联合药敏实验
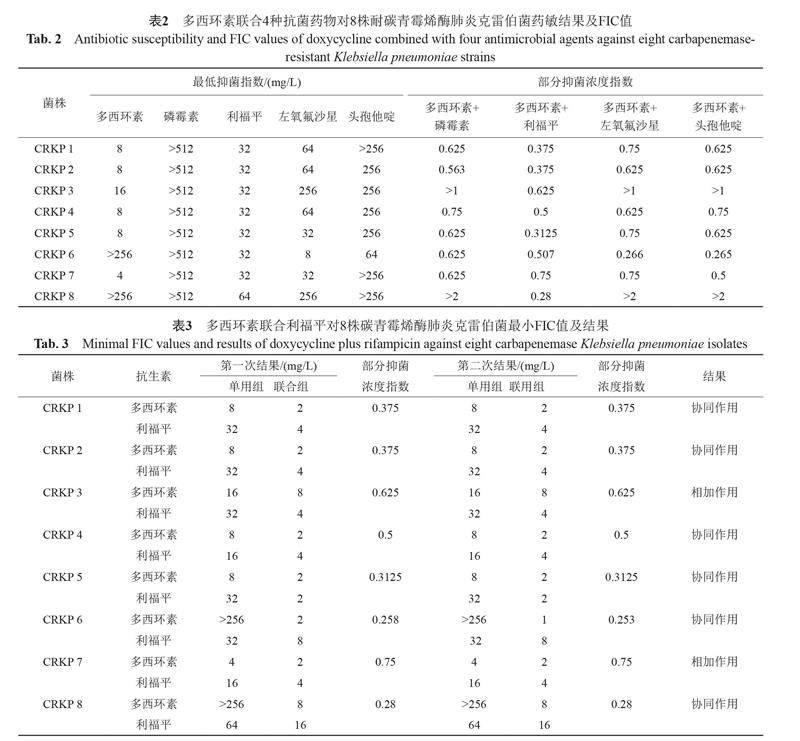
棋盘法测定多西环素(doxycycline,DOX)分别联合利福平(rifampicin,RIF)、磷霉素(fosfomycin,FOS)、头孢他啶(ceftazidime,CAZ)、左氧氟沙星(levofloxacin,LEV)的4种药物方案的联合药敏,每个抗生素的药物浓度测试范围是0.25~512 mg/L。部分抑菌浓度指数(fractional inhibitory concentration index,FIC)作为联合药敏试验结果的判断依据。FIC=MIC甲药联合/MIC甲药单药+MIC乙药联合/ MIC乙药单药。FIC≤0.5为协同作用,0.5<FIC≤1为相加作用,1<FIC≤2为无关作用,FIC>2为拮抗作用[16]。
1.2.3 时间杀菌曲线
使用时间杀伤试验绘制协同杀菌曲线。杀伤效果通过标准时间杀伤试验进行量化,使用棋盘实验数据顯示的有效药物组合最低抑菌浓度[17]。判断标准:细菌数较初始细菌数降低≥3lg CFU/mL为杀菌效应;细菌数较初始细菌数降低≥2lg CFU/mL为抑菌效应;联用后细菌数较最有效单药降低>2lg CFU/mL为协同作用。
1.2.4 抗菌药物对生物膜的影响
生物膜形成能力检测:采用结晶紫染色法检测生物膜形成能力[18],以A值(阴性对照的平均A值+3×标准差值)为临界值。大于该A值则判定为可形成生物膜(A:光密度,可以反映生物膜的黏附能力)。
1.2.5 生物被膜抑制试验
采用结晶紫染色法检测生物膜形成能力[19-20]。本次实验选取时间杀菌曲线结果最好的药物组合,同时考虑两药联用时使MIC降低的程度和药物在体内可以达到的浓度范围。实验在96孔组织培养板上进行,合理选取3孔作为一组,分别为多西环素组,利福平组,联用组,每孔各加入100 μL稀释后菌液和100 μL药液。同时设置只含培养基和菌液的对照组。37 ℃恒温箱中培养24 h后拿出,吸出孔中液体,用无菌PBS清洗3次,以便清洗附着细菌。然后加99%甲醇固定15 min,自然干燥后加入200 μL浓度为0.1%结晶紫染液,染色15 min,然后用PBS彻底清洗,洗去剩余的结晶紫染液,室温晾干20 min后加入的95%乙醇溶解,放置15 min,溶解附着的生物膜。然后用酶标仪测定590 nm波长处的生物膜的A值,计算抑制率。
1.2.6 生物被膜清除试验
此实验与生物膜抑制实验稍有不同,首先是细菌生物膜培养,先于96孔板中加入200 μL菌液,在37 ℃
条件下恒温箱中培养72 h,使其形成稳态成熟期生物膜。然后照“1.2.5”操作,测定数值,计算清除率。
1.2.7 小鼠感染模型建立[21]
小鼠麻醉后,鼻腔滴入新鲜配制肺炎克雷伯菌液30 μL(108 CFU/mL),接种后使小鼠保持直立体位20 s,以保证菌液因重力作用而进入肺组织,接种后置于笼中自由取食。将50只老鼠随机分为模型组、对照组、多西环素组、利福平组、多西环素和利福平联用组,每组10只。连续给药5 d(动物实验由宜春学院医学伦理委员会审批通过)。
1.2.8 肺组织菌落计数[22]
给药5 d后,对老鼠麻醉后,无菌开胸取肺,用无菌生理盐水冲洗干净,右肺组织吸干表面水分后称重,置于1 mL生理盐水中匀浆并10倍稀释(1:101~1:105),分别取100 μL用L形玻璃棒均匀涂抹于无药MH琼脂平板上,37 ℃孵育24 h,进行细菌计数。
1.2.9 血清CPR和炎性因子IL-6指标检测
麻醉小鼠,眼球取血暂存EP管中,3500 r/min,离心10 min,采用酶联免疫法检测血清CRP、和IL-6水平,步骤严格按照试剂说明书要求操作。
1.2.10 肺组织HE染色[23]
切取部分小鼠肺组织,经4%多聚甲醛中固定,然后常规脱水、包埋、切片、HE染色,光镜下观察肺组织病理状态变化。
1.2.11 统计学分析
采用GraphPad Prism 8.0对数据进行统计学分析及图片绘制,P<0.05为差异有统计学意义。
2 结果
2.1 CRKP的药敏结果
8株CRKP菌株对多黏菌素(polymyxin,POL)、替加环素(tigecycline,TGC)敏感率为100%,对多西环素(DOX)敏感率为12.5%,对头孢哌酮舒巴坦钠(sulbactam and cefoperazone,CSL)、哌拉西林/他唑巴坦(piperacillin sodium and tazobactam sodium for injection,TZP)、头孢他啶(CAZ)、头孢曲松(ceftriaxone sodium,CRO)、氨曲南(aztreonam,ATM)、亚胺培南(imipenem,IMP)、厄他培南(ertapenem,ETP)、庆大霉素(gentamicin,GEN)、阿米卡星(amikacin,AMK)、环丙沙星(ciprofloxacin,CIP)、左氧氟沙星(LEV)、磷霉素(FOS)、利福平(RIF)耐药率为100%,见表1。
2.2 多西环素与利福平等联合药敏
棋盘法药敏结果显示,多西环素与利福平药物联用组合对8株CRKP体外抑菌实验效果最为显著,4株显示协同作用,4株显示相加作用。多西环素与左氧氟沙星、头孢他啶或磷霉素联合中,对2株显示无关或拮抗作用,其中与头孢他啶联合对另外2株显示协同作用,其他4株为相加作用;与左氧氟沙星联用,对另1株显示协同作用,其他5株为相加作用;与磷霉素联用,对另外6株显示相加作用,见表2~3。
2.3 多西环素与利福平等联合时间杀菌曲线
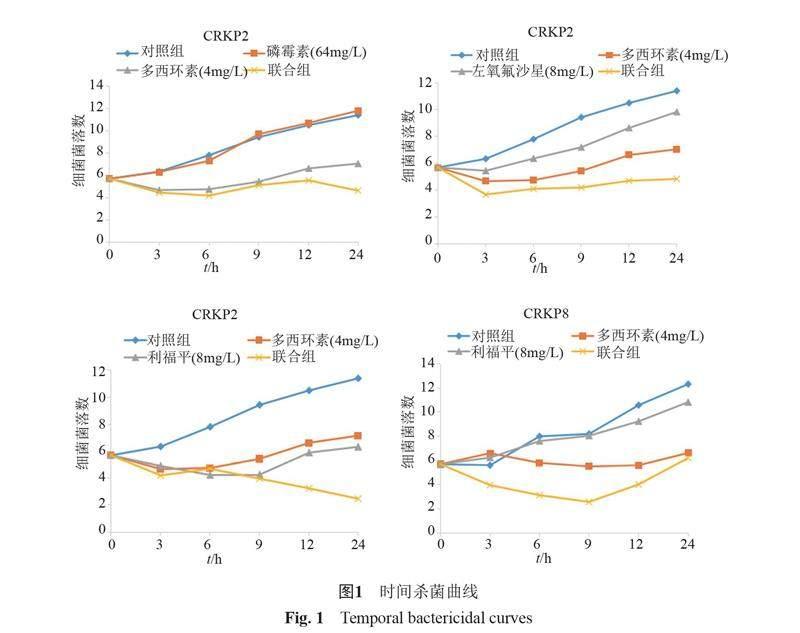
基于棋盘法联合药敏实验结果,选取CRKP2、CRKP8进行体外时间杀菌曲线实验,观察多西环素与利福平等药物联合后杀菌作用。依据FIC值和药物在体内可达到血药浓度,合理选取药物浓度。结果显示,多西环素与磷霉素和左氧氟沙星的药物组合,两药联合均有相加作用,但对细菌没有起到杀菌或抑菌作用。多西环素与利福平联用对CRKP2在(t+24)时达到杀菌效果,曲线呈下行趋势。多西环素和利福平联用对CRKP8在(t+9)时达到杀菌效果,之后细菌呈增长趋势,见图1。
2.4 结晶紫染色法检测生物膜成膜能力
于96孔板对生物膜进行72 h培养后定量可知,CRKP2成膜能力最强,见图2。
2.5 多西环素与利福平联合对生物膜的抑制作用
基于杀菌曲线结果和细菌成膜能力的比较,实验选取CRKP2分为4组(多西环素组、利福平组、联合组、对照组)进行生物膜抑制作用实验,生物膜生长情况和生物膜抑制率,见图3。
多西环素组抑制率为64%,利福平组抑制率为47%,联合组抑制率91%,联合组与多西环素组和利福平组相比较抑制率分别提高了27%,44%(P<0.001,具有统计学意义)。
2.6 多西環素与利福平等联合对生物膜清除作用
基于杀菌曲线结果和细菌成膜能力的比较,实验选取CRKP2分为4组(多西环素组、利福平组、联合组和对照组)进行生物膜清除作用实验,各组生物膜生长情况和药物对生物膜清除率见图4。
多西环素组清除率为28%,利福平组清除率为23%,联合组清除率为65%,联合组与多西环素组和利福平组相比较抑制率分别提高了37%和42%(P<0.001,具有统计学意义)。
2.7 各组小鼠肺组织菌落计数
由实验结果可见,模型组菌落数明显高于正常组,感染严重。联合组小鼠肺组织菌落数数量明显低于模型组和单药组,趋近于正常组。联合组与各组比较,差异均有统计学意义(P<0.001),见图5。
2.8 血清CPR和炎性因子IL-6的指标变化
由实验结果可见,与正常组相比,模型组血清中CRP和IL-6的数值明显升高,与模型组相比,联合组血清中CRP和IL-6的水平显著下降,差异具有统计学意义(P<0.05),见图6。
2.9 各组小鼠肺组织HE染色情况
由实验结果可见,正常组肺脏组织表面被覆一层光滑的浆膜,无明显异常;肺脏实质为肺内支气管各级分支及其终末的大量肺泡,各级支气管结构无明显异常,肺泡壁由单层上皮组成,结构清晰;间质包括肺内结缔组织及血管等,均无明显异常;未见明显的炎性改变。与正常组相比,模型组大面积的肺泡壁轻度增厚,肺泡间距增宽,并伴有少量的粒细胞浸润(蓝色箭头)。肺泡腔内浸润大量炎性细胞,肺泡结构模糊(黄色箭头)。与正常组相比,大面积的肺泡壁轻度增厚,肺泡间距增宽,结构相对清晰(蓝色箭头);局部血管周围轻度出血,可见少量的红细胞(黄色箭头),见图7。
通过HE染色,对肺组织炎症细胞计数,与正常组相比,模型组数据显著升高,与模型组相比,联合组数据明显下降。与模型组、单药组相比,差异性显著,具有统计学意义(P<0.001),见图8。
3 讨论
肺炎克雷伯菌为革兰阴性杆菌,可致人体多个部位感染,是医院常见条件致病菌[24]。因为抗生素不合理应用,肺炎克雷伯菌对碳青霉烯类药物耐药率越来越高,检出率越来越高,2018年CHINET细菌耐药性监测结果显示:肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2018年的25.0%和26.3%,耐药率上升幅度超过8倍,且在革兰阴性杆菌中的检出率占比亦在上升[25],可选择治疗药物越来越少,治疗难度逐渐增大,成为一个亟需解决的临床感染治疗难题。
此次实验中,多西环素联用利福平对8株CRKP表现出最有效协同作用,两药联用时MIC值较单药下降明显,药物浓度均在可达到的正常范围内。时间杀菌曲线实验中,多西环素(4 mg/L)+利福平(8 mg/L)、多西环素(8 mg/L)+利福平(8 mg/L)分别对CRKP2/CRKP8在24 h内呈现出杀菌效果,提示临床上两药联用对治疗CRKP感染可能会有协同杀菌作用。两药属于浓度依赖性抗生素,在耐受安全的情况下,更高剂量的药物浓度可能有更好治疗效果。研究发现[26],生物膜能增强细菌的耐药性,与超过65%的院内感染有关。CRKP有较强生物膜形成能力,形成生物膜后治疗起来更难,死亡率更高[27]。生物膜实验证明,多西环素联合利福平可有效抑制早期生物膜的形成,抑制率高达91%,对成熟生物膜的清除率也可达到65%,能有效降低细菌生物膜耐药性,增强抗菌效果。动物实验中,联合组小鼠CRP、血清炎性因子指标(IL-6)、肺组织菌落数和炎症细胞较模型组水平均下降明显(P<0.05)[28-29],具有统计学意义。联合组小鼠肺部感染状况得到明显改善,证明多西环素联合利福平在体内有明显抗感染作用,与体外实验结论一致。
体外实验与动物实验均证明多西环素联合利福平对CRKP有抗菌作用,这可能为临床治疗CRKP感染提供新的用药参考。
参 考 文 献
El-Sayed Ahmed M A E, Zhong L L, Shen C, et al. Colistin and its role in the era of antibiotic resistance: An extended review (2000—2019)[J]. Emerg Microbes Infect, 2020, 9(1): 868-885.
刘婧娴, 俞静, 刘瑛. 产碳青霉烯酶肺炎克雷伯菌的耐药基因及流行病学研究进展[J]. 中国感染与化疗杂志, 2015, 15(1): 91-96.
Nguyen F, Starosta A L, Arenz S, et al. Tetracycline antibiotics and resistance mechanisms[J]. Biol Chem, 2014, 395(5): 559-575
Lai C C, Chen C C, Huang H L, et al. The role of doxycycline in the therapy of multidrug-resistant E. coli-an in vitro study[J]. Sci Rep, 2016, 6: 31964.
Cunha B A, Baron J, Cunha C B. Similarities and differences between doxycycline and minocycline: Clinical and antimicrobial stewardship considerations[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(1): 15-20.
Chen L F, Kaye D. Current use for old antibacterial agents: Polymyxins, rifamycins, and aminoglycosides[J]. Med Clin North Am, 2011,95(4): 819-842.
Geladari A, Simitsopoulou M, Antachopoulos C, et al. Dose-dependent synergistic interactions of colistin with rifampin, meropenem, and tigecycline against carbapenem-resistant Klebsiella pneumoniae biofilms[J]. Antimicrob Agents Ch, 2019, 63(3): e02357-18.
Tascini C, Tagliaferri E, Giani T, et al. Synergistic activity of colistin plus rifampin against colistin-resistant KPC-producing Klebsiella pneumoniae[J]. Antimicrob Agents Ch, 2013, 57(8): 3990-3993.
Skalsky K, Yahav D, Bishara J, et al. Treatment of human brucellosis: Systematic review and meta-analysis of randomised controlled trials[J]. BMJ, 2008, 336(7646): 701-704.
曹玲, 肖斌, 陳丽丹, 等. 碳青霉烯类药物联合用药治疗广泛耐药肺炎克雷伯菌的研究进展[J]. 中国感染控制杂志, 2017, 16(12): 1195-1200.
Wang X J, Wang Q, Cao B, et al. Retrospective observational study from a Chinese network of the impact of combination therapy versus monotherapy on mortality from carbapenemresistant Enterobacteriaceae bacteremia[J]. Antimicrob Agents Ch, 2019, 63(1): e01511-18.
刘妍, 袁应华. 耐碳青霉烯类药物肺炎克雷伯菌和鲍曼不动杆菌对替加环素的敏感性及药物敏感性试验的临床应用[J]. 检验医学, 2018, 33(2): 147-151.
Lagerb?ck P, Khine W W T, Giske C G, et al. Evaluation of antibacterial activities of colistin, rifampicin and meropenem combinations against NDM-1-producing Klebsiella pneumoniae in 24 h in vitro time—kill experiments[J]. J Antimicrob Chemother, 2016, 71(8): 2321-2325.
胡付品, 朱德妹. 医疗机构碳青霉烯类耐药肠杆菌科细菌感染防控指南简介[J]. 中国感染与化疗杂志, 2018, 18(3): 331-335.
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. 2017, M100-S27.
Zhang W, Guo Y, Yang Y, et al. Study of in vitro synergistic bactericidal activity of dual β-lactam antibiotics against KPC-2-producing Klebsiella pneumoniae[J]. Microb Drug Resist, 2020, 26(3): 204-210.
Sopirala M M, Mangino J E, Gebreyes W A, et al. Synergy testing by E-test, microdilution checkerboard, and time-kill methods for pan-drug-resistant Acinetobacter baumannii[J].Antimicrob Agents Chemother, 2010, 54(11): 4678-4683.
Xu Z, Liang Y, Lin S, et al. Crystal violet and XTT assays on Staphylococcus aureus biofilm quantification[J]. Curr Microbiol, 2016, 73(4): 474-482.
Chanda W, Joseph T P, Padhiar A A, et al. Combined effect of linolenic acid and tobramycin on Pseudomonas aeruginosa biofilm formation and quorum sensing[J]. Exp Ther Med, 2017, 14(5): 4328-4338.
孟千琳, 彭勤, 凌保东. 抗菌药物联合中药单体对泛耐药鲍曼不动杆菌生物被膜的影响[J]. 中国抗生素杂志, 2022, 47(7): 697-702.
李晓冰, 何晓静, 徐辉, 等. 左氧氟沙星在肺炎克雷伯菌肺部感染小鼠体内的药动学[J]. 中国医院药学杂志, 2017, 37(7): 575-578.
庞露, 肇丽梅, 于莹, 等. 左氧氟沙星对肺炎克雷伯菌感染小鼠的治疗作用[J]. 中国医院药学杂志, 2012, 32(3): 173-175.
Vasilev G, Ivanova M, Ivanova-Todorova E, et al. Secretory factors produced by adipose mesenchymal stem cells downregulate Th17 and increase Treg cells in peripheral blood mononuclear cells from rheumatoid arthritis patients[J]. Rheumatol Int, 2019, 39(5): 819-826.
Mil-Homen S D, Martins M, Barbosa J, et al. Carbapen-em-resistant Klebsiella pneumoniae clinical isolates: In vivo virulence assessment in galleria mellonella and potential therapeutics by polycationic oligoethyleneimine[J]. Antibiotics( Basel), 2021, 10( 1): 56.
胡付品, 郭燕, 朱德姝, 等. 2018年CHINET中國细菌耐药性监测[J]. 中国感染与化疗杂志, 2020, 20(1): 1-10.
Khodadadian R, Rahdar H A, Javadi A, et al. Detection of VIM-1 and IMP-1 genes in Klebsiella pneumoniae and relationship with biofilm formation[J]. Microb Pathog, 2018, 115: 25-30.
贾雯, 郭瑞林. 肺炎克雷伯菌生物膜形成及调控机制的研究进展[J]. 中国医学科学院学报, 2021, 43(6): 936-944.
刘洋, 李艳菊, 陶奕汐, 等. 肺炎克雷伯菌两种感染方法小鼠模型的研究[J]. 中华医院感染学杂志, 2018, 28(19): 2881-2884.
Sutherland R E, Olsen J S, McKinstry A, et al. Mast cell IL-6 improves survival from Klebsiella pneumoniae and sepsis by enhancing neutrophil killing[J]. J Immunol, 2008, 181(8): 5598-5605.
收稿日期:2022-12-26
作者简介:王保贵,男,生于1993年,在读硕士研究生,主要研究方向为临床药学,E-mail: wy71897@163.com
*通信作者,E-mail: chenchunlinycxy@163.com
