应用TaqMan-MGB探针实时荧光定量PCR技术快速检测青海省海西州鼠疫自然疫源地鼠疫耶尔森菌耐链霉素基因
2023-12-26张琪李胜靳娟何建杨晓艳辛有全柏吉祥周奎章张晓璐蒋可代瑞霞
张琪 李胜 靳娟 何建 杨晓艳 辛有全 柏吉祥 周奎章 张晓璐 蒋可 代瑞霞

摘要:目的 应用TaqMan-MGB探针实时荧光定量PCR技术快速检测青海省海西州鼠疫自然疫源地鼠疫菌耐链霉素基因,为今后该地区突发人间鼠疫的精准临床用药提供理论依据。方法 分离培养海西地区1957—2009年间取自鼠疫患者、媒介昆虫及中间宿主的代表性鼠疫菌110株,提取其DNA,针对我国链霉素耐药基因rpsl基因设计引物P-F和P-R和TaqMan-MGB探针Probe1 [FAM]和Probe2[VIC],利用荧光定量PCR技术,进行耐药rpsl基因筛查。结果 110株被试菌株中FAM检测均为阳性(RFU峰值>2000);VIC阳性的为0株(RFU峰值<200)。阳性对照和空白对照成立。结论 实时荧光定量PCR结果显示,该地区未检测出耐链霉素菌株。
关键词:鼠疫菌;TaqMan-MGB探针;荧光定量PCR技术;耐链霉素;青海省海西州
中图分类号:R978.1文献标志码:A
The TaqMan-MGB probe was used in the quantitative real-time PCR technique for rapid detection streptomycin resistance gene of Yersinia pestis,
the natural source of plague in Haixi
Zhang Qi1, Li Sheng1, Jin Juan1, He Jian1, Yang Xiao-yan1, Xin You-quan1, Bai Ji-xiang1, Zhou Kui-zhang2,
Zhang Xiao-lu1, Jiang Ke3, and Dai Rui-xia1
(1 Specialized Laboratory of Yersinia pestis,Qinghai Institute for Endemic Disease Prevention and Control, Xi'ning 810021;
2 Department of Plague, Qinghai Institute for Endemic Disease Prevention and Control, Xi'ning 810021;
3 Department of Public Health, Medical School, Qinghai University, Xi'ning 810001)
Abstract Objective To rapidly detect streptomycin resistance genes of Yersinia pestis in the Natural Focus of Plague of Haixi prefecture in Qinghai province by TaqMan MGB probe fluorescence real-time quantitative PCR, and to provide the theoretical basis for precise clinical drug use of plague emergencies in this area. Methods 110 representative strains of Yersinia pestis collected from 1957 to 2009 from plague patients, vector insects and intermediate hosts were isolated and cultured, with their DNA being extracted. Probe1[FAM] and Probe2[VIC], which were probes of Primers P-F and P-R and TaqMan-MGB, were designed for the rpsl gene, which was a streptomycin resistance gene often found in China, and fluorescence quantitative PCR was utilized to screen the rpsl gene of plague resistance genes. Results In FAM detection, all 110 strains had positive value (RFU peak> 2000). No strains were positive in VIC detection (RFU peak<200). The positive control and the blank control proved to be effective. Conclusion Results of real-time quantitative PCR demonstrated that streptomycin resistant strains were not detected in the tested strains in this area.
Key words Yersinia pestis; TaqMan-MGB probe; Fluorescence quantitative PCR technology; Streptomycin resistance; Haixi, Qinghai Province
鼠疫耶爾森菌(Yersinia pestis)(以下简称“鼠疫菌”),属假结核肠杆菌属,兼性厌氧革兰阴性杆菌,是鼠疫病原体和潜在的致命性生物武器,严重威胁着人类健康[1-3]。1928年,Alexander Fleming偶然间发现了青霉素,至此人类开启了医学新时代,抗生素是现代医学的主要支柱,被称为是20世纪的最伟大成就[4-5]。链霉素作为治疗鼠疫的首选药物,显著提高了鼠疫患者的治愈率,死亡率也由之前的50%~90%降低到5%以下[6-7]。但是耐药株的出现给临床治疗带来了新的挑战[8-9]。
海西州地处青海省西部,疫源面积大,宿主多样。1956年判定为喜马拉雅旱獭鼠疫自然疫源地[10],该地区分离鼠疫菌毒力强,近年来海西州喜马拉雅旱獭疫源地动物疫情异常活跃,是青海省鼠疫较为活跃和危害严重的地区之一[11-12]。因此对该地区分离鼠疫菌的耐链霉素基因筛查很有意义。
1 材料与方法
1.1 材料
1.1.1 实验用菌株
从分离1957—2009年青海省海西州自然疫源地内的鼠疫菌株,选择不同地点、不同时间、不同宿主及媒介的代表性鼠疫菌株共110株作为实验菌株,以上菌株由青海省地方病预防控制所保存。
1.1.2 实验菌株培养及DNA提取
将被受试菌株接种于赫氏琼脂培养基,28 ℃培养24 h,同时做鼠疫菌特异性噬菌体裂解实验,培养结果为纯鼠疫菌时,采用传统的苯酚-氯仿混合抽提法提取菌株DNA[13],以保证DNA的纯度。
1.1.3 主要试剂及仪器
TransStart Probe qPCR SuperMix 购自全式金生物技术有限公司,PCR产物纯化试剂盒购自北京诺博莱德科技有限公司。Real-time Thermal Cycler购自美国赛默飞世尔科技有限公司(型号:5100)。MGB荧光探针及引物由上海辉睿生物科技有限公司合成,引物序列见表1。
1.2 方法
1.2.1 TaqMan-MGB荧光探针法
PCR 体系含DNA(浓度2 ng/μL)模板1 μL, TransStart Probe qPCR SuperMix 10 μL、上游引物和下游引物各1 μL,浓度均为0.1 μmol/L ,0.1 μmol/L rpsL Probe1 [FAM]和Probe2 [VIC]探针各1 μL,去离子水5 μL,每个反应总体积为20 μL。反应条件:94 ℃预变性5 min;95 ℃变性15 s,58 ℃ 延伸30 s,扩增40个循环。阳性对照模板为文献[21]中S19960127菌株DNA。
2 结果
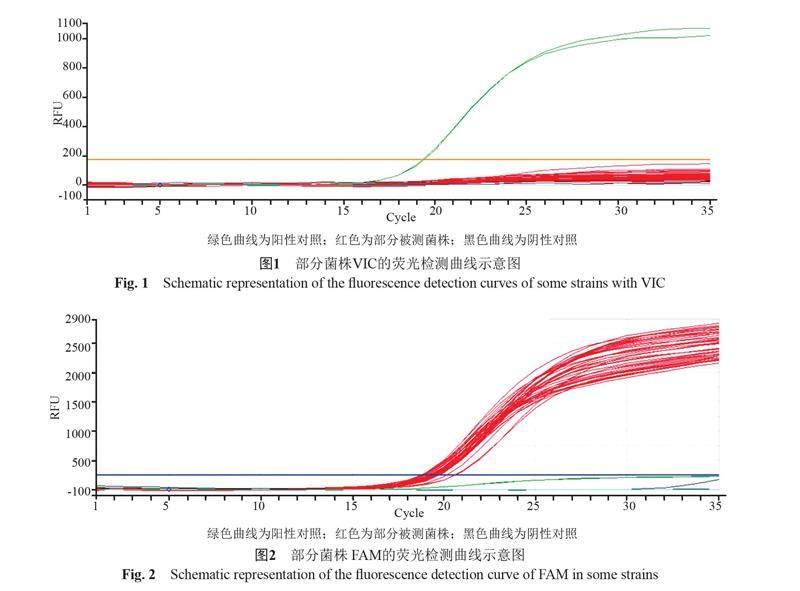
110株被试菌株中Probe2[VIC]阳性的为0株,对应检测rpsl(128:G),RFU峰值<200,阳性>1000。Probe2 [FAM]阳性的为110株,对应检测rpsl (128:A),RFU峰值>2000,阴性<200;如图1~2所示。结果显示,该地区未检测出耐链霉素菌株。
3 讨论
细菌耐药性主要是由于细菌的自然选择、及抗生素过度应用、滥用所导致[14]。自40年代开始采用链霉素治疗鼠疫后,便陆续出现了耐链霉素菌株。目前,我国仍以链霉素作为治疗鼠疫患者的首选特效药物,2003年戴瑞霞等[15]对青海各鼠疫自然疫源地不同宿主的鼠疫菌,包括海西地区分离鼠疫菌,应用链霉素纸片扩散法进行了链霉素耐药性监测,结果未发现耐链霉素菌株。2018年何建等[16]针对耐链霉素strA和strB基因设计引物,对分离自海西州鼠疫自然疫源地鼠疫菌的DNA进行PCR扩增,也未发现链霉素抗药菌株。2020年何建等[17]又利用鼠疫菌最低抑菌(minimum inhibitory concentration,MIC)方法测定12种抗菌药物对分离自青海鼠疫自然疫源地的328株鼠疫菌株的体外抑菌活性,其中包括链霉素,结果发现均对链霉素敏感。法国科学家Galimand等[18]研究证实,耐链霉素鼠疫菌通过接合转移其他细菌的耐药质粒作用于氨基糖的特定羟基,使其磷酸化,导致了耐药。但随着研究的不断深入,2020和2021年相继报道了中国和马达加斯加耐链霉素鼠疫菌耐药新机制,即通过编辑核糖体蛋白S12的rpsL基因点突变(A→G)后引起的氨基酸43位点(K43R)的替换获得耐基因突变,导致链霉素不能与S12蛋白结合而表现出链霉素抗性[19-21]。由于TaqMan-MGB探针实时荧光定量PCR技术,特点是对AT含量高的序列探针的设计有很大帮助[22],尤其在细菌耐药基因检测方面,具有快速且灵敏的优势[23-24],能快速检测rpsL基因点突变导致链霉素耐药鼠疫菌。因此,本研究应用TaqMan-MGB探针实时荧光定量PCR技术,针对我国链霉素耐药基因rpsl基因设计引物和TaqMan-MGB探针,快速筛检海西州鼠疫自然疫源地鼠疫菌耐链霉素基因,以此掌握當地的鼠疫菌株耐药情况,这将对突发人间鼠疫的精准治疗及提高患者的生存率意义重大。
本研究结果显示,该地区110株分离鼠疫菌中FAM检测均为阳性(RFU峰值>2000);VIC阳性的为0株(RFU峰值<200),所有被测菌株未检测出耐链霉素菌株。实验结果说明该地区今后仍以链霉素作为首选药物治疗鼠疫患者是合理的。但链霉素的使用剂量要适当,既要避免过大剂量的应用造成药物毒副反应出现,又要注意由于剂量不足或联合用药不当而造成耐药,替代传统抗生素的新药研发也是今后的重要研究方向之一。
参 考 文 献
纪树立. 鼠疫[M]. 北京: 人民卫生出版社, 1988: 207-216.
张涛. 鼠疫高级细菌学[M]. 宁夏: 宁夏人民出版社, 2006: 1-26.
杨瑞馥. 鼠疫耶尔森菌的研究及其军事医学意义[J]. 解放军医学杂志, 2012, 37(3): 172-176.
张帆. 青霉素的发现简史[J]. 生物学教学, 2008, (7): 70-71.
Uddin T M, Chakraborty A J, Khusro A, et al. Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects[J]. J Infection Public Heal, 2021, 14(12): 1750-1766.
Meyer K F. Modern therapy of plague[J]. J Am Med Assoc, 1950, 144(5): 982-985.
Meyer K F. Effective treatment of plague[J]. Ann NY Acad Sci, 1952, 55(6): 1228-1274.
Welch T J, Fricke W F, McDermott P F, et al. Multiple antimicrobial resistance in plague: An emerging public health risk[J]. PLoS One, 2007, 2(3): e309.
Rosario-Acevedo R, Biryukov S S, Bozue J A, et al. Plague prevention and therapy: Perspectives on current and future strategies[J]. Biomedicines, 2021, 9(10): 1421.
尚国宝, 田富彰, 李国昌, 等. 2008—2013年青海省海西州鼠疫病原监测分析[J]. 疾病监测, 2016, 31(6): 482-484.
吴海生, 田富彰, 陈洪舰, 等. 青藏铁路沿线青海段2003—2013年鼠疫流行态势分析[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 561-563.
王梅, 唐新元, 王祖郧, 等. 青海省鼠疫疫源地分布特征的研究[J]. 中国媒介生物学及控制杂志, 2015, 26(2): 194-195.
Li Y, Dai E, Cui Y, et al. Different region analysis for genotyping Yersinia pestis isolates from China[J]. PLoS One, 2008, 3(5): e2166.
Chokshi A, Sifri Z, Cennimo D, et al. Global contributors to antibiotic resistance[J]. J Glob Infect Dis, 2019, 11(1): 36-42.
戴瑞霞, 李敏, 趙海红, 等. 中国鼠疫菌耐链霉素菌株的监测[J]. 中华流行病学杂志, 2003, 24(11): 1066.
何建, 杨晓艳, 辛有全, 等. 鼠疫耶尔森菌多种耐药基因PCR检测方法的建立与应用[J]. 中华地方病学杂志, 2018, 37(3): 207-211.
何建, 辛有全, 李胜, 等. 青海鼠疫菌株对12种抗生素体外抑菌活性分析[J]. 中国地方病防治, 2020, 35(3): 223-224.
Galimand M, Guiyoule A, Gerbaud G, et al. Multidrug resistance in Yersinia pestis mediated by a transferable plasmid[J]. New Engl J Med, 1997, 337(10): 677-681.
梁云, 胡晓玲, 洪梅, 等. 两型鼠疫菌耐链霉素菌株的检测[J]. 医学动物防制, 2007, 23(1): 26-28.
Dai R X, He J, Zha X, et al. A novel mechanism of streptomycin resistance in Yersinia pestis: Mutation in the rpsL gene[J]. PLoS Negl Trop Dis, 2021, 15(4): e0009324.
Andrianaivoarimanana V, Wagner D M, Birdsell D N, et al. Transmission of antimicrobial resistant Yersinia pestis during a pneumonic plague outbreak[J]. Clin Infect Dis, 2022, 74(4): 695-702.
Kuang S Y, Jackson P E, Wang J B, et al. Specific mutations of hepatitis B virus in plasma predict liver cancer development[J]. Proc Nat Acad Sci USA, 2004, 101(10): 3575-3580.
陈建, 王缦, 陈华, 等. 实时荧光PCR法快速检测乙型肝炎病毒基因YMDD突变株[J]. 中国生物制品学杂志, 2008, (4): 333-335.
李鸽. 实时定量荧光PCR法快速检测突变型HBX基因的方法建立及其应用研究[D]. 杭州: 浙江中医药大学, 2016.
孙双勇, 王蒙蒙, 李丽, 等. 抗生素耐药与抗生素新药开发的研究进展[J]. 现代药物与临床, 2022, 37(2): 221-229.
收稿日期:2022-12-12
基金项目:国家自然科学基金项目(No. 82260401)
作者简介:张琪,女,生于1988年,在读硕士研究生,主管医师,主要从事鼠疫防治及鼠疫菌种鉴定,E-mail: 449132626@qq.com
*通信作者,E-mail: drx200907@163.com
