ε-聚赖氨酸微生物生产及其应用研究进展
2023-12-26庄孝东白森萌李博彦胡翠英王靖英晓莉鞠鑫扶教龙李良智
庄孝东?白森萌?李博彦?胡翠英?王靖?英晓莉 鞠鑫 扶教龙 李良智
摘要:ε-聚赖氨酸是一种同聚酰胺生物聚合物,由25~35个L-赖氨酸残基通过α-羧基和ε-氨基缩合形成的酰胺键连接而成。因其独特的结构,ε-聚赖氨酸具有许多优异的性能,如可食性、水溶性、热稳定性、可降解性、广谱抗菌活性和无毒性等。因此,ε-聚赖氨酸已在日本、韩国、美国和中国等国家被广泛用作食品防腐剂。目前,ε-聚赖氨酸主要由白色链霉菌发酵生产。自ε-聚赖氨酸于1977年由日本学者发现以来,ε-聚赖氨酸发酵生产得到了很大提高,对其应用研究也由最初的食品领域拓展到了许多其他的领域。本文首先概述了ε-聚赖氨酸生物合成机理、菌种选育和发酵生产策略,在简要介绍其抑菌机制基础上,着重介绍了ε-聚赖氨酸在食品、医学和材料等领域应用研究进展,最后,对相关研究进行了展望,以期为ε-聚赖氨酸微生物生产及其应用研究提供有益的借鉴。
关键词:ε-聚赖氨酸;微生物生产;抗菌机制;应用研究;白色链霉菌
中图分类号:R978.1文献标志码:A
Recent advances in microbial production of ε-poly-L-lysine and its applications
Zhuang Xiaodong, Bai Senmeng, Li Boyan, Hu Cuiying, Wang Jing, Ying Xiaoli, Ju Xin, Fu Jiaolong, and Li Liangzhi
(College of Chemical and Life Sciences, Suzhou University of Science and Technology, Suzhou 215009)
Abstract ε-poly-L-lysine (ε-PL) is a natural homo-polyamide biopolymer consisting of 25-35 L-lysine residues with the amide linkages formed between the ε-amino and α-carboxyl groups. Due to its unique structure, ?-PL has many excellent properties, such as edibility, water solubility, thermostability, biodegradability, broad-spectrum antibacterial activity, and nontoxicity. Therefore, ε-PL has been widely used as a food preservative in Japan, Korea, the United States, China, and other countries. At present, ε-PL is mainly produced by the aerobic fermentation of Streptomyces albulus. Since ε-PL was discovered by Japanese scholars in 1977, the fermentation production of ε-PL has been greatly improved, and the application of ε-PL has also expanded from the initial food field to many other fields. This paper firstly outlined the biosynthesis mechanism, strain selection, and fermentation production strategy of ε-PL, and highlighted the progress of research on ε-PL in food, medical and material applications based on its bacterial inhibition mechanism. Finally, an outlook on related research is given to provide a useful reference for the microbial production of ε-PL and its application research.
Key words ε-poly-L-lysine; Microbial production; Antibacterial mechanism; Application; Streptomyces albulus
ε-聚賴氨酸(ε-poly-L-lysine, ε-PL)是由25-35个L-赖氨酸残基通过α-羧基与ε-氨基缩合形成的一种阳离子多肽聚合物[1]。ε-PL是一种微苦、易吸潮的淡黄色的天然生物聚合物,可以被人体完全消化为赖氨酸。由于其独特的结构,ε-PL具有多种优异的性能,如水溶性、生物降解性、可食性、耐热性和对环境无毒性等[2-3]。ε-PL对很多革兰阴性和革兰阳性菌具有明显的抑制作用,如金黄色葡萄球菌、真菌、酵母菌和某些病毒等[4-5],因此,ε-PL被广泛用作天然食品防腐剂,使用过程中往往复合多种抗菌剂来提高抗菌效果[6]。自1989年日本首次批准ε-PL用作食品防腐剂后,还有美国、韩国、中国和其他一些国家也纷纷获批准使用[7],且ε-PL还应用于医学、材料和农业等其他领域[8]。
1977年,日本学者Shima等[9]在白色链霉菌(Streptomyces albulus)发酵液中首次发现ε-PL。ε-PL一般是通过白色链霉菌的好氧发酵法进行生产,但野生型菌株合成ε-PL的能力通常较低,必须对ε-PL产生菌进行育种改造。最经典的,要数日本科学家Hiraki等[10]于1998年采用“S-2-(氨基乙基)-L-半胱氨酸(AEC)+甘氨酸(Gly)”抗性筛选结合诱变方法选育出了一株“AECr+Glyr”诱变株S. albulus 11011A,其ε-PL产量达到2.11 g/L,为野生菌产量的10倍。为了早日实现ε-PL的大规模生产,研究者们在发酵生产工艺上更深入研究。自2001年Kahar等[11]首次建立两阶段pH调控策略(ε-PL产量为48.3 g/L)以来,对ε-PL发酵工艺的研究更多了,如培养基的优化、pH的控制、溶解氧(DO)的控制等策略。
本文首先简要介绍ε-PL生物合成机理、微生物育种和发酵生产工艺进展,在简要概述了其抑菌机制的基础上,着重介绍了近年来ε-PL在食品、材料、医学等各个领域的最新应用研究进展。最后对ε-PL应用研究及相关研究进行了展望。期望本文能为有关科研人员提供一定的帮助和参考,同时也为进一步拓展ε-PL应用范围提供借鉴。
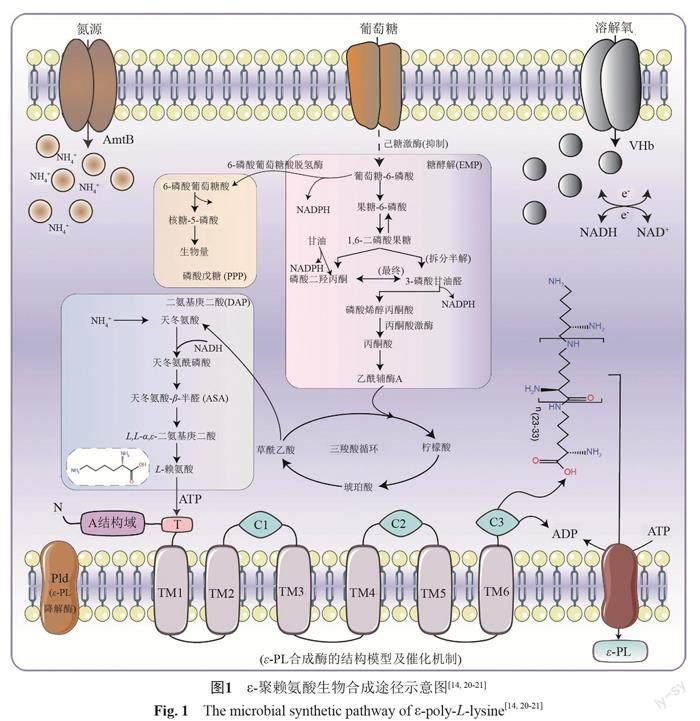
1 ε-聚赖氨酸生物合成途径与机理
自?-PL发现以来,其生物合成机理一直被广大研究人员所关注。作为?-PL的前体,L-赖氨酸是通过二氨基庚二酸途径(DAP)合成,最终由ε-PL合成酶(Pls)聚合形成?-PL。Hamano等[12]发现白色链霉菌在表达天门冬氨酸激酶后,细菌对L-赖氨酸的耐受性显著提高。因此,推测ε-PL的合成可能是先通过糖酵解途径(EMP)和三羧酸循环(TCA)途径合成草酰乙酸,草酰乙酸被催化成L-天冬酰胺。接着,L-天冬酰胺被天门冬氨酸激酶和天冬氨酸-β-半醛脱氢酶通过二氨基庚二酸途径转化为L-赖氨酸。最后,在ε-PL合成酶(Pls)的催化下,L-赖氨酸聚合形成ε-PL。
Yamanaka等[13]从白色链霉菌中分离并鉴定了Pls,Pls是一种非核糖体肽合成酶(NRPSs),含有1319个氨基酸。如图1所示,与传统NRPSs相比,Pls是一个典型的具有腺苷化结构域(A结构域)和硫代化结构域(T结构域)的NRPSs,不包含缩合域(C结构域)和硫酯酶域(TE结构域),但是它有6个跨膜结构域(TM1-TM6)和3个在C端的串联可溶性结构域(C1-C3)。有研究学者基于Pls的结构,推测其催化机理并进行实验验证[14-15]。首先,A结构域借助ATP将离散的L-赖氨酸进行腺苷酰化,其次,T结构域对其硫醇化,分子延伸部分由3个可溶性结构域(C1-C3)与6个跨膜结构域(TM1-TM6)来完成,最后产生一个L-赖氨酸二聚体,L-赖氨酸二聚体进一步发生聚合反应,生成一系列具有多链长的ε-聚赖氨酸。另外有研究表明[16],Pls与聚L-二氨基丙酸(PDAPs)的合成酶具有类似的结构域,这种单独模块NRPS结构有可能是这类同聚氨基酸合成酶的共同特征。ε-PL的生物合成和聚合程度可以直接由Pls控制,細胞内ATP影响Pls的活性,且聚合度的大小与抑菌的活性密切相关,通常微生物产生的ε-聚赖氨酸的聚合度在25~35,当其聚合度大于9时便具有明显的抑菌性能,即理论上讲,根据人们的需求对其聚合度进行选择性地调控就能制造出有益的抗菌衍生产品[17]。
此外,ε-PL产生菌能够分泌ε-PL降解酶(Pld),Yamanaka等[18]发现白色链霉菌中存在另一种具有内源性肽酶活性的Pld(PldII),理论上讲,敲除plds基因可以减少ε-PL的降解,提高ε-PL的产量。Li等[19]基于pSET152的整合质粒CRISPRI系统对ε-PL降解酶(pldII)进行转录抑制,通过改变dCas9的识别位点来调节pldII的表达,抑菌实验发现pldII的抑制提高了ε-PL产物的抗菌效果。然而,研究发现plds基因的敲除对ε-PL的产生和聚合程度没有直接影响,这表明Pld不参与ε-PL的生物合成和聚合物长度的调控,因此,ε-PL的生物合成主要受Pls的作用。目前,关于Pls和Pld的结构和功能已有不少研究,但ε-PL生物合成机制的框架还需进一步完善。
2 ε-聚赖氨酸生产菌育种
2.1 诱变育种
野生菌株在发酵过程中ε-PL产量往往较低,不能够满足工业上的需求,为了提高ε-PL的产量,不少研究集中在改良?-PL产生菌上。日本学者Hiraki
等[10]最早通过AEC抗性选育方法,获得一株突变菌株S. albulus 11011A,其ε-PL产量为2.11 g/L,是野生菌的10倍。其后大多的育种方法都是基于此进行改良,如传统的物理化学诱变、核糖体工程、基因组重排以及基因工程等方法,都被用作ε-PL高产菌的选育。
物理化学诱变是指用物理或者化学的方法以诱发遗传物质的突变,从而引起细胞形态特征的变异,来获得高产菌株。如常压室温等离子体(ARTP)诱变,该法是现阶段较为先进的物理诱变方法,其优点是突变效率高、适用范围广[22]。Xiang等[23]通过ARTP诱变结合抗性平板与抑菌圈筛选得到了突变菌株S. albulus SAR 14-116,摇瓶产量为1.04 g/L,较初始菌株提高了18.46%。化学诱变如应用多种诱变剂的方法,Song等[24]采用NTG(亚硝基胍)+UV(紫外)+LiCl(氯化锂)复合突变,得到了高产的生产菌株Streptomyces diastatochromogenes 6#-7,结果显示ε-PL在72 h时摇瓶产量可达到(0.775±0.046) g/L,比初始菌株高42.2%。基因组重排(genome shuffling)是指通过对一些经过传统诱变之后的目的突变株进行多轮原生质体融合,使他们的染色体重组,从而达到获得目的产物大量提升的正向突变株。Li等[25]利用基因组重组的方法提高了ε-PL产量,筛得的突变株S. albulus FEEL-1的?-PL产量达到24.5 g/L,比亲本株提高了63%。Wang等[26]使用庆大霉素诱导白色链霉菌珠W-156,经过3轮基因组重组,得到一个AG3-28突变体,在摇瓶中ε-PL产量为3.43 g/L。核糖体工程是一种通过引入抗生素对核糖体蛋白S12、RNA聚合酶和其他核糖体蛋白和翻译因子进行激活或增强次生代谢产物产生的方法。Wang等[27]引入链霉素、庆大霉素和利福平等抗生素,筛选出单抗和双抗突变体(S-88和SG-31),提高ε-PL的产量分别为2.81和3.83 g/L,是初始菌株S. albulus FEEL-1的1.75和2.39倍。而后Wang等[28]在之前的基础上,经过对Str、Gen、Rif、Gnt、Par和Lin 6种抗生素抗性的耐药筛选,选育出突变菌株S. albulus R6,其ε-PL的摇瓶产量提高至4.41 g/L,较出发菌株提高了2.75倍。
值得一提的是,菌株在长期使用同一诱变剂后会产生诱变剂“疲劳效应”,会引起菌种生长周期延长、孢子量减少以及代谢减慢等,这对发酵工艺的控制不利,在实际生产中多采用几种诱变剂复合处理、交叉使用的方法进行菌株诱变。另外,不管是单一诱变还是复合诱变,诱变的过程中都具有随机性,因此高效的筛选方法显得尤为重要,应提高筛选效率,如采用高通量筛选技术等[29]。
2.2 基因工程育种
基因工程是在分子水平上对基因进行操作的技术。为了提高氮的利用能力,Xu等[30]使用基因工程技术在白色链霉菌PD-1中表达了一个铵转运蛋白基因(amtB),ε-PL产量从22.7 g/L提高到35.7 g/L。
Hamano等[12]为了研究细胞对?-PL的反馈抑制作用,设计了一个突变的Ask基因,并将此基因在S. albulus中表达,其突变基因Ask(M68V)能有效抵抗反馈抑制,显著提高了ε-PL的产量。最近,Li等[31]在淀粉酶产色链霉菌中表达了二氢吡啶二羧酸合酶基因(dapA),延长了5 L发酵罐中的发酵时间,重组菌株12#-2的ε-PL产量提高至30.54 g/L,较原菌株提高了19.8%。赖氨酸是合成ε-PL的唯一前体,它是由ε-聚赖氨酸合成酶(Pls)聚合而成,因此,过表达pls基因也是一种提高ε-PL产量的可行策略。张重阳等[32]从ε-PL的合成途径出发,筛选出一系列酶进行基因过表达,对比发现磷酸烯醇式丙酮酸羧化酶基因(ppc)、丙酮酸羧化酶基因(pyc)、ε-聚赖氨酸合成酶基因(pls)能够有效提高ε-PL产量。Wang等[33]
利用启动子连接噬菌体的核糖体结合位点,在
S. albulus CICC11022进行pls过表达,得到一株变异菌株S. albulus Q-PL2,较野生菌株在摇瓶发酵中提高88.2%±8.3%。无独有偶,Purev等[34]在真菌
E. festucae E437过表达epls基因,结果显示,较野生菌株ε-PL的产量提高近7倍之多。又如其他途径的基因工程育种,Purev等[34]在E. festucae F11中过表达VibA基因,该基因能够提高Pls活性,其最终ε-PL的产量提高近4倍之多。此外,消除产生副产物的代谢途径,通常也能够增加ε-PL的浓度。如Yamanaka
等[35]使用靶向灭活技术,消除ε-PL生产菌株S. albulus 14147的基因组中类抗生素的生物合成基因,增加了20%的ε-PL的生物合成通量,这种新型敲除技术为ε-PL菌株提供了新的选育思路。随着对?-PL生物合成途径及机理的深入研究,相信诱变育种与代谢工程和基因工程相结合的方法将在?-PL高产菌选育中发挥越来越大的作用。
3 ε-聚赖氨酸发酵生产工艺
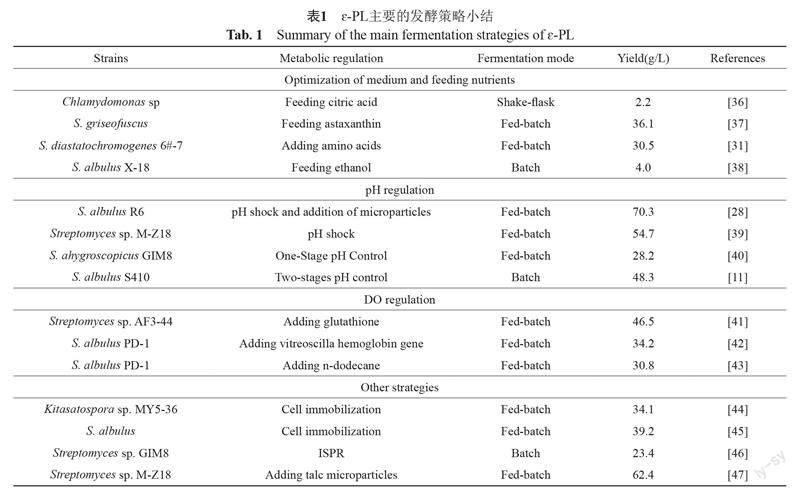
经典的?-PL发酵策略为两段pH控制策略,即发酵液pH先保持在5.0以上一段时间以促进细胞生长,然后降至pH为4.0左右以促进?-PL生物合成。该策略最早是由Kahar等[11]于2001年提出的,使用该法将?-PL产量提高到48.3 g/L,该产量在随后十几年时间内,保持了最高水平,之后相关发酵工艺的研究都是基于此进行优化,如培养基的优化、pH的调控、溶解氧的控制等策略(表1)。
3.1 培养基的优化
自1977年研究者Shima等[9]首次将产生菌S. albulus筛选出来后,发现以硫酸铵和酵母粉为氮源,甘油或葡萄糖为碳源的营养条件比较适合该菌发酵生成?-PL,当时产量很低仅有0.3 g/L。
一开始M3G培养基先应用到ε-PL的生产中,其中涉及到的酵母提取物的费用较高,为了降低?-PL发酵的成本,研究人员寻找其他可代替碳源(如甘油或糖蜜)来生产?-PL[48]。甘油作为碳源时,在5 L生物反应器中发酵192 h后?-PL的产量为62.36 g/L[47]。Sivaramakrishnan等[36]利用衣藻菌Chlamydomonas在补充4 mmol/L柠檬酸发酵110 h后,将?-PL产量提高到2.24 g/L。由于虾青素能够增强抗氧化能力,Li等[37]尝试添加1.0 g/L的虾青素并将灰褐链霉菌Streptomyces griseofuscus发酵的ε-PL产量提升至36.1 g/L,比对照组提高36.3%。Li等[31]在添加部分氨基酸后,能够将淀粉酶产色链霉菌S. diastatochromogenes 12#2发酵的?-PL产量提高到30.54 g/L,比对照组增长了19.8%。Wang等[38]使用S. albulus X-18在摇瓶发酵中,产量提高了41.42%,在10 L发酵罐中加入1%乙醇发酵,产量提高了37.02%。综上表明在不同碳源下对ε-PL的产量有不同,葡萄糖和甘油的协同消耗加速了能量代謝和碳通量,提供足够的含碳有机分子和ATP用于生产更多的ε-PL[21, 49]。
3.2 pH控制策略
最早的一种发酵?-PL的两段pH控制策略是由Kahar等[11]提出的,随后,研究人员对该策略进行改进。ε-PL产生菌受到酸胁迫时,耐酸能力的增强有利于发酵,Wang等[28]采用了酸性pH胁迫策略,筛选出的突变菌株R6在5 L生物反应器中的ε-PL最高产率为70.3 g/L。同样,另一种新型的两段发酵(培养阶段和发酵阶段)在传统pH酸性胁迫的基础上,提高ε-PL产量至32.22 g/L,比常规发酵提高32.3%[50]。然而pH冲击策略提高ε-PL发酵产能的机制尚不清楚[51]。Ren等[39]在5 L发酵罐中,研究了酸性pH冲击对链霉菌Streptomyces sp. M-Z18的ε-PL产量的影响,发酵192 h后ε-PL产量达到54.70 g/L,比未受pH冲击的对照组提高52.50%。综上所述,当在pH小于5.0时,pH才对ε-PL合成有积极影响,并且在pH为4.0左右时其合成速率最大,而较高的pH(大于4.5)有利于细胞生长,因此,严格控制pH对实现ε-PL的高产量至关重要[39]。
3.3 溶解氧(DO)控制策略
溶解氧(DO)水平是ε-PL发酵的另一个关键影响因素。在ε-PL发酵过程中,高浓度的细胞密度导致氧气难以从气体传递到培养液中,这就需要改进氧气供应的方法,如提高发酵罐的曝气率、搅拌速度、微生物输送氧气的能力和添加载氧剂等方法均能有效供氧。
高DO水平有利于ATP的形成,进而促进细胞生长和ε-PL生物合成。比如,在细胞生长期将DO水平固定在40%,之后在ε-PL生物合成阶段将DO水平降低到20%,最终使生物量和ε-PL的产量分别提高到1.99 mg/L和20.73 g/L[52]。细胞生理学和转录组学分析表明,过量活性氧(ROS)导致氧化应激反应,影响ε-PL的合成产量下降[53]。这种情况可以通过添加还原剂,如抗氧化谷胱甘肽和外源虾青素,添加此类还原剂能够缓解过度的氧化应激反应,有助于在发酵过程中保持较高的ε-PL合成率[37]。在添加抗氧化剂谷胱甘肽后的菌株Streptomyces sp. AF3-44的ε-PL产量为46.5 g/L,提高了68.8%[41]。此外,由于菌丝缠绕在一起,细胞密度高,培养基变得黏稠,导致氧传递效率降低[54],仅通过增强搅拌速率和曝气较难提高DO水平,因此,可通过向发酵液中添加氧载体来保持DO的水平,如添加0.5%正十二烷使DO保持在32%以上,ε-PL产量从23.4 g/L提高到30.8 g/L[43]。同样,在白色链霉菌S. albulus PD-1的染色体中引入类血红蛋白基因后,白色链霉菌的氧结合能力相应增强,ε-PL的产量比野生型株增加了50.7%[42]。
3.4 其他策略
细胞固定化也是一种提高微生物发酵产能的有效策略。在分批发酵过程中,能重复利用微生物细胞、有效缩短发酵时间,提高生产效率,还可以增强细胞对有毒物质的抗性,不污染环境等特点。Zhang等[44]发现丝瓜海绵作为固定化材料可以显著提高?-PL产量至34.1 g/L。在发酵液中,?-PL浓度过高可能导致最终产物的反馈抑制,因此,在发酵过程中通常采用原位产物去除法(ISPR)。Liu等[46]使用D152树脂结合ISPR的方法来提高Streptomyces sp. GIM8菌株发酵的ε-PL,该产量从3.76 g/L提高到
23.4 g/L。Liu等[55]对固定化培养瓶进行连续ISPR,ε-PL产率高达3.51 g/L,而对照组的ε-PL产率仅为0.51 g/L。Wang等[45]利用丝瓜海绵(rGOLS)载体制备还原氧化石墨烯,用于ε-聚赖氨酸的细胞固定化生产,rGOLS-1与好氧植物纤维床生物反应器(rGOLS-1-AFPB)顺序分批培养白色链霉菌时,ε-PL浓度和生产率最高可达(39.2±0.63) g/L和0.48 g/(L·h),该研究设计了一种先进的固定化载体,为提高固定化细胞的发酵性能提供了有效途径。另外,Ren等[47]添加
10 g/L滑石粉微粒,最终使Streptomyces sp. M-Z18在5 L发酵罐的?-PL产量达到62.36 g/L,然而,这种方法也有缺点,例如营养、基质和氧气等不能被充分吸收。
4 ε-聚赖氨酸抑菌机制
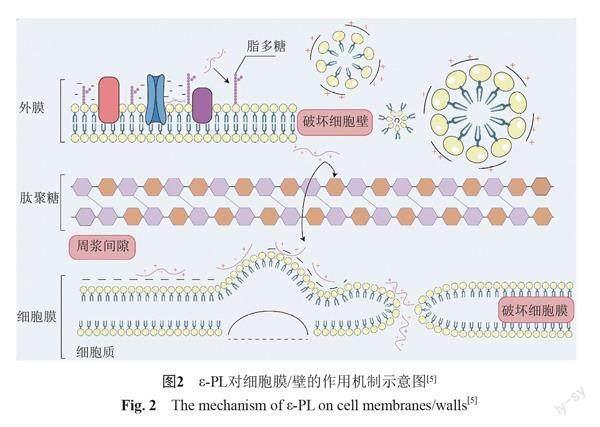
研究表明,ε-PL能够增强大肠埃希菌细胞表面的疏水性、细胞膜的通透性,在破坏细胞壁后,能与细胞膜表面的负电荷结合,改变膜内外电势,造成细胞膜裂解,引起细胞内物质大量渗出[56]。ε-PL与大肠埃希菌的作用机制中,ε-PL和磷脂基共同作用导致细胞膜以一种非特异性的、地毯状的机制扭曲和收缩,细胞膜被迫向自身折叠,膜上出现孔洞、囊泡和微胶团[5]。
ε-PL对大肠埃希菌的作用类似于抗菌肽抑菌机制中的毡毯模型,即ε-PL先是通过静电作用与细胞膜结合,铺满细胞膜表面,使大肠埃希菌细胞磷脂双分子层弯曲受损,细胞膜逐渐分解,细胞内物质如电解质、胞内核酸与蛋白质流出,进而导致菌体死亡。如图2中所示,大肠埃希菌的细胞膜包含细胞外膜、肽聚糖层和细胞膜,外膜由脂多糖构成。ε-PL和脂多糖之间存在静电作用,最终将移除脂多糖层。ε-PL能够进入周浆间隙,但是否以一种毡毯机制与肽聚糖层作用,或穿过肽聚糖层与细胞膜作用是未知的。当ε-PL在细胞膜上达到一定浓度时,它能使部分膜发生弯曲。一旦细胞膜的外层、内层依次被ε-PL除去,去除内外层的磷脂会形成小泡,在膜间隙留下孔隙,大量的ε-PL可以通过这个孔进入细胞质,对细胞进一步造成损伤。上述说明,ε-PL能够破坏大肠埃希菌的细胞结构,从而达到抑菌效果。
随着研究学者对抗菌肽的深入研究,发现不少抗菌肽的抑菌过程可以用ROS诱导细胞凋亡模型进行解释。如图3所示,ε-PL进入细胞质后,会刺激活性氧(reactive oxygen species,ROS)的产生,影响细胞对氧化应激和自卫的反应,最终阻碍细胞呼吸,影响细胞活力,进而诱导细胞死亡。Ye等[60]发现ε-PL在大肠埃希菌中可诱导细胞内ROS的積累,提高氧化应激基因(sodA和oxyR)的表达。ε-PL除了杀死动物、植物的某些病原体外,还可以触发宿主的防御信号,例如,ε-PL在已染菌的枣中诱导了防御反应基因的表达[61]。另外,蛋白质组学显示ε-PL可下调腐败希瓦菌蛋白质合成组分的表达[58],代谢组学分析表明ε-PL诱导的应激反应会抑制酿酒酵母和葡萄球菌的主要代谢途径(糖酵解和三羧酸循环)[62]。
最近,白森萌等[63]提出ε-PL的抑菌机制可能存在一种复合模型。当ε-聚赖氨酸发生抑菌作用时,先是沿着细胞膜周围铺满抑菌肽,使脂双分子层发生变形出现间隙,ε-聚赖氨酸沿着间隙进入细胞,引起ROS胁迫,导致细胞死亡。由于该模型还只是一种猜想,所以日后还需实验验证。
5 ε-聚赖氨酸应用研究进展
通常细菌的外膜带有负电荷,而ε-PL是一种带正电荷的抗菌肽,能够通过静电作用与细菌的细胞壁和细胞膜结合来破坏其完整性和通透性,ε-PL破坏细胞壁后,进而与细胞膜表面负电荷结合,使细胞膜裂解,引起细胞内的物质、能量和信息传递中断,最终导致细胞死亡,这种作用机制使得细菌难以产生耐药性,从而提高了抑菌效率,使ε-PL能够应用于更宽的领域[91-92](表2)。
5.1 ε-聚赖氨酸在食品领域的应用
ε-PL在食品领域广泛用作食品防腐剂,如淀粉类、乳制品、海鲜、肉制品和果蔬等食品,且相较于其他常见食品抗菌剂抑菌范围更广、稳定性更优(表3)。
5.1.1 淀粉类
米饭、面条、面包、馒头、包子等一系列高淀粉类食物,pH值介于中性和弱碱性之间。由于ε-PL的最适抑菌pH值范围为弱酸性,所以将ε-PL添加入淀粉类食物中能达到很好的抑菌效果。Cheng等[64]以不同ε-聚赖氨酸含量的淀粉/明胶(S/G)为原料,采用低温挤压吹塑法制备了食用抗菌膜。S/G膜中含有ε-PL,改善了鲜面包的膜柔度、水接触角值、膨胀度和保鲜期,也降低了鲜面包的水蒸气渗透性和抗拉强度,该实验表明ε-PL在食品保鲜/包装方面的潜在价值。Lu等[65]研究使用ε-聚赖氨酸处理过的酵母对冻融循环后面团面筋聚合和馒头品质的影响,与未处理过的酵母的冷冻面团制成的馒头相比,ε-PL处理过的酵母的冷冻面团制成的馒头比体积更大,硬度更低,气孔更大,整体口感更好。
5.1.2 乳制品
Ning等[66]发现ε-PL在贮藏期(0~5 d)能有效灭活或杀死巴氏奶中的金黄色葡萄球菌。ε-PL不仅能使金黄色葡萄球菌的跨膜电位明显降低,并引起K+离子的泄漏,造成细胞损伤,还能刺激金黄色葡萄球菌产生活性氧,诱导细菌细胞凋亡。Lin等[67]表明ε-PL在0.1 mg/mL的ε-PL低剂量下对奶酪中的单核增生乳杆菌具有良好的抗菌活性,呼吸代谢结果表明ε-PL能抑制Embden-Meyerhof-Parnas通路及该通路中的三种关键酶,ε-PL不仅能最大限度地减少奶酪的变质,还能保持奶酪的感官品质。
5.1.3 水产类
为抑制太平洋白虾中一种重要的嗜冷腐坏菌腐败希瓦菌(Shewanella putrefaciens)的活性,Qian
等[69]研究ε-聚赖氨酸(ε-PL)和牛至精油(OEO)对肉汤和虾中腐败希瓦氏菌QY38的抑制效果,在原位实验中,ε-PL+OEO联合处理抑制了腐烂链球菌QY38在虾中的总活菌数从9.11 log cfu/g (CK)至6.35 log cfu/g
(CK),质子磁共振成像结果表明,防腐剂可以延缓虾肌的水分迁移和水分流失。侯温甫等[68]分析ε-聚赖氨酸对草鱼鱼肉微生物群落结构的影响,并鉴定出优势腐败菌菌株,1.0 mg/mL的ε-PL可以完全抑制假单胞菌属、腐败希瓦菌和气单胞菌的生长。Kazem
等[70]研究了复合刺蕁麻提取物(3%和6%)和?-聚赖氨酸(0.1%和0.2%)对聚乙烯袋装(常压条件下)4 ℃冷藏12 d的虹鳟鱼鱼片微生物特性和稳定性的影响。在贮藏过程中,虹鳟鱼样品中挥发性碱氮(TVB-N)含量增加,而总酚含量下降,这些天然成分可以用来维持虹鳟鱼的肉质。
5.1.4 肉制品
Lee等[71]采用结晶紫试验和共聚焦激光扫描显微镜(CLSM)观察ε-PL时,发现ε-PL可诱导细菌细胞膜的损伤,这些结果表明在鸡肉加工时ε-PL可作为抗生素的内在潜力。Kazem等[72]研究了?-聚赖氨酸涂层(0.5%和1%)和刺荨麻提取物(3%、6%和9%)在4 ℃条件下放置12 d对牛肉品质性状和货架期的组合影响。结果表明,?-聚赖氨酸复合荨麻提取物(SNE)对聚乙烯袋装牛肉样品灰分、脂肪、蛋白质和水分含量无显著影响,ε-PL包覆SNE可以有效地延长牛肉的货架期,且不会对感官属性产生负面影响。Huang
等[73]研发了一种纳米乳化剂可食性涂层作为一种新型的抗菌和抗氧化材料,能有效地维持活性化合物在肉表面的释放,提高即食肉制品安全和质量,与对照组相比,纳米乳剂涂层的炭化鸡肉的货架期延长了至少6 d。
5.1.5 果蔬
高倩等[74]研发了一种涂膜保鲜液,成分含有连翘精油1.50%、壳聚糖2.0%、ε-聚赖氨酸0.50%、nisin(乳酸链球菌素)0.05%,在湿度65%条件下,能延长番茄储藏10 d,维持番茄新鲜的表面。除了将ε-PL与抗菌剂、保鲜剂等联合使用,还可以结合物理保鲜方法(超声处理、紫外线辐射、脉冲电场等)来破坏病原菌细胞结构,二者联合使用能有效协同抑制病原菌的生长[95]。郁杰等[75]用低强度的紫外光结合ε-PL重复照射鲜切菠菜,有效抑制腐败菌的生长,减缓营养成分的丢失和叶绿素的消耗,并延长货架期半天时间。Li等[76]研究表明,超声波技术结合ε-PL能够稳定水分子水平,从而抑制果蔬的新陈代谢,延长保质期。以上研究表明,将ε-PL与抗菌剂、保鲜剂、物理保鲜等方法联合使用时可有效提高其保鲜效果,延长果蔬货架期,也维持食物的营养价值和风味。
5.2 ε-聚赖氨酸在医学领域的应用
ε-PL在医学领域的应用主要包括:医学材料、药物载体和核酸载体等。
5.2.1 医学材料
ε-PL与羧甲基纤维素结合时,可形成一种能够自降解、凝胶化速度快、刺激性低的水凝胶,该凝胶在未来可能用于医用止血敷料[78]。Hyon等[77]开发出1种含有ε-PL的医用黏合剂,在止血方面有良好的医用价值。Fazli等[96]报道了含有ε-聚赖氨酸的BC(细菌纤维素)基敷料,由生物相容性和贻贝激发的聚多巴胺(PDA)交联,可促进感染性伤口愈合,与照组相比,改性膜组新生儿皮肤厚度更大、更光滑。糖尿病足溃疡(DFUs)是一种难以愈合的慢性伤口,易受细菌感染,传统的水凝胶敷料在高温下容易失水或在低温下容易结冰,不适合长期使用或在极端环境中使用。Liu等[97]采用聚丙烯酰胺、明胶和ε-聚赖氨酸拼合制备了耐高温(20 ℃~60 ℃)的抗菌水凝胶敷料,结果表明,双网络G-PAGL水凝胶敷料能促进胶原沉积、血管生成,抑制细菌繁殖,有效促进DFUs愈合。这些结果表明,功能化膜在感染伤口的敷料的临床应用中具有巨大潜力。
铜绿假单胞菌是最常见的分离性院内病原体之一,约占所有医院获得性感染的10%,由于其抗生素耐药性而难以用已知的抗生素治疗,Zhang等[98]合成了涂有ε-聚赖氨酸和聚乙烯亚胺(PEI)的AgNPs材料,这些材料在低浓度(IC50: 7.284 μg/mL)下显示出很强的抗铜绿假单胞菌能力。Liu等[79]合成了一种磁性介孔二氧化硅/ε-PL纳米复合材料对血液中铅离子有较高的去除能力,在治疗重金属中毒方面具有不错的潜力。
5.2.2 药物载体
临床上抗肿瘤药物如阿霉素、紫杉醇和长春新碱等均存在水溶性差、适用性差和毒副作用大等问题。申有青等[80]制备了一种复合的ε-PL纳米胶束,该纳米胶束载药效率高、兼容性好、毒作用小且持续时间长,可作为一种安全可靠的疏水性药物载体。Wu等[81]使用盐酸二甲双胍(MetHCL)作为原始药物,设计了由羧甲基纤维素/聚赖氨酸/三聚磷酸盐复合(CMC/PLL/TPP)形成的药片,该药片载药效率好且溶解速度快。
5.2.3 核酸载体
不安全的基因载体问题是当前临床治疗面临的最大困难之一,阳离子聚合物(非病毒载体)是一类很有应用潜力的载体。杨波等[82]研发了一种新型ε-PL-聚乙烯亚胺-β-环糊精聚合物,该聚合物具有水溶性好、兼容性佳和几乎没有毒副作用的优点,在基因载体领域有很好的应用潜能。袁晓燕等[83]制备了一种核酸载体,包含葡聚糖、ε-PL和多肽VAPG,可以运载核酸药物安全地进入靶细胞,运输效率高达63.2%,有效减轻了对其他细胞的生物毒性,在生物医用基因治疗领域有较大的应用前景。ε-PL还是酶的理想保护剂,因为它的线性结构为酶表面的氨基修饰提供了足够的空间,从而提高了酶活性位点[99]。
5.3 ε-聚赖氨酸在材料领域的应用
ε-PL在材料领域的应用主要包括:纤维素材料、纳米材料、凝胶复合材料等。
5.3.1 纤维素材料
Wu等[84]提出了一种合成抗菌ε-聚赖氨酸锚定二羧基纤维素小球的新方法,采用溶胶-凝胶过渡法制备纤维素小球,经高碘酸钠和亚氯酸钠氧化形成羧基,用碳二亚胺介导的酰胺化反应将ε-PL固定在小球上,样品在12 h内对金黄色葡萄球菌、酸性土化脂肪酸环杆菌和大肠埃希菌表现出良好的抑菌活性,20 d后可在土壤中被生物降解,这种生物可降解珠子对环境较友好。Nie等[85]制备了一种接枝纤维素珠,包含2,2,6,6-四甲基哌啶-1-氧基(TEMPO)、碳二亚胺和ε?PL,该类球珠对金黄色葡萄球菌和大肠埃希菌等具有良好的抑菌活性,此类生物复合微珠在水净化方面具有潜在的应用前景。
5.3.2 其他材料
纳米材料具有比表面积大、孔隙率高和安全性高的特点[100]。Jiang等[86]用纳米沉淀法结合ε-PL与脱氧核糖核酸(DNA)合成纳米复合物,该纳米颗粒具有广泛的抑菌能力,即使在含磷酸盐的不利条件下也能保持抑菌能力。Zhen等[87]采用甲基丙烯酸缩水甘油酯通过接枝反应制备了一种基于ε-PL的光固化水凝胶复合材料,由于添加了TA,水凝胶的抗菌性能和抗氧化活性大大增强,以上研究说明ε-PL在与其他材料结合时显示出重要的应用价值。
5.4 ε-聚赖氨酸在其他领域的应用
在其他领域,ε-PL可以应用到生物电子领域,如纳米级电路、光学存储器和多通道阵列方传感器等的制造,又如ε-聚赖氨酸在环境监测的生物传感器中作为固定剂,其应用前景相当可观[101]。ε-PL可制成高吸水性的材料,如ε-PL和γ-PGA用γ-射线交联,能得到高吸水性的树脂[88],所以还可用于女性卫生巾、婴儿尿片等生活用品。又如ε-PL作为膳食剂时在农业领域的应用,能夠抑制脂肪从小肠吸收,ε-PL可通过调控猪肠道菌群来改善营养物质的利用(如蛋白质、脂质和纤维素)[89],在未来的研究中ε-PL的应用潜力可能不仅局限于猪这一动物,也有可能应用于鸡、牛和羊等。侯馨怡等[90]将纳他霉素
50 mg/L和ε-聚赖氨酸500 mg/L混合应用于植物组织培养中,有效抑制了真菌生长,丰富了ε-PL在农业领域的应用。
6 总结与展望
本文在简要概述ε-PL抑菌机制的基础上,着重介绍ε-PL在应用领域的最新研究进展,提到ε-PL生物合成机理、微生物育种和发酵生产工艺进展,旨在为开拓ε-PL的应用范围提供帮助。根据当前的研究情况,提出以下几点展望:①近年来,国内ε-PL的合成产量取得了较大的突破,研究主要集中在生产菌株选育和发酵工艺两方面,但对生物合成高产机制的探索不够深入,因此,使用基因组、转录组等方法对比高、低产菌株,解析高产机制显得尤为重要,日后ε-PL生产菌株的基因组可能被确定,有可能运用基因工程等先进技术进行基因组装,提高其合成产量。②由于ε-PL易吸潮的缺点,常将其制成盐酸盐储备使用,但ε-PL生物合成成本较高,与其他食品防腐剂缺乏竞争力。为尽快实现ε-PL的日常使用,一方面要大力开发在食品领域的应用,另一方面要进一步提高生物合成ε-PL的效率,才能使得ε-PL及其盐酸盐的使用成本降低。③当前,虽然ε-PL的主要用途是食品防腐剂,但其在临床医学、农业病虫害防治及抗菌材料研发等领域展现出良好的应用潜能,未来应深入扩宽ε-PL的抑菌范围,如加强ε-PL对人体致病菌和植物病原菌的抗菌研究。
参 考 文 献
Li S, Mao Y, Zhang L, et al. Recent advances in microbial ε-poly-L-lysine fermentation and its diverse applications[J]. Biotechnol Biofuels, 2022, 15(1): 1-16.
Bucatariu F, Schwarz D, Zaharia M, et al. Nanostructured polymer composites for selective heavy metal ion sorption[J]. Colloids Surf A Physicochem Eng Asp, 2020, 603: 1-10.
Shao Z, Yang Y, Fang S, et al. Mechanism of the antimicrobial activity of whey protein-ε-poly-lysine complexes against Escherichia coli and its application in sauced duck products[J]. Int J Food Microbiol, 2020, 328: 1-8.
王瑜欣, 李靜, 付开来, 等. 噬菌体裂解酶Lysin1902原核表达及其与ε-聚赖氨酸联用效果评价[J]. 微生物学报, 2023, 63(2): 834-844.
Hyldgaard M, Mygind T, Vad B S, et al. The antimicrobial mechanism of action of epsilon-poly-L-lysine[J]. Appl Environ Microbiol, 2014, 80(24): 7758-7770.
李颖畅, 张馨元, 孙皓齐, 等. 复合保鲜剂对阿根廷鱿鱼中生物胺的控制作用[J]. 中国食品学报, 2021, 21(7): 251-258.
Su R, Li T, Fan D, et al. The inhibition mechanism of ε-poly-lysine against Bacillus cereus emerging in surimi gel during refrigerated storage[J]. J Sci Food Agric, 2019, 99(6): 2922-2930.
Pandey A K, Kumar A. Improved microbial biosynthesis strategies and multifarious applications of the natural biopolymer epsilon-poly-L-lysine[J]. Process Biochem, 2014, 49(3): 496-505.
Shima S, Sakai H. poly-lysine produced by Streptomyces[J]. Agric For Meteorol, 1977, 41(9): 1807-1809.
Hiraki J, Hatakeyama M, Morita H, et al. Improved epsilon-poly-L-lysine production of an S-(2-aminoethyl)-L-cysteine resistant mutant of Streptomyces albulus[J]. Seibutsu-kogaku Kaishi, 1998, 76(12): 487-493.
Kahar P, Iwata T, Hiraki J, et al. Enhancement of ε-poly-lysine production by Streptomyces albulus strain 410 using pH control[J]. J Biosci Bioeng, 2001, 91(2): 190-194.
Hamano Y, Nicchu I, Shimizu T, et al. ?-Poly-L-lysine producer, Streptomyces albulus, has feedback-inhibition resistant aspartokinase[J]. Appl Microbiol Biotechnol, 2007, 76(4): 873-882.
Yamanaka K, Maruyama C, Takagi H, et al. ε-poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase[J]. Nat Chem Biol, 2008, 4(12): 766-772.
Hamano Y, Kito N, Kita A, et al. ε-Poly-L-lysine peptide chain length regulated by the linkers connecting the transmembrane domains of ε-poly-L-lysine synthetase[J]. Appl Environ Microbiol, 2014, 80(16): 4993-5000.
Yamanaka K, Kito N, Kita A, et al. Development of a recombinant ε-poly-L-lysine synthetase expression system to perform mutational analysis[J]. J Biosci Bioeng, 2011, 111(6): 646-649.
Xu Z, Sun Z, Li S, et al. Systematic unravelling of the biosynthesis of poly (L-diaminopropionic acid) in Streptomyces albulus PD-1[J]. Scientific reports, 2015, 5(1): 1-10.
Chen X S, Wang K F, Zheng G C, et al. Preparation, characterization and antimicrobial activity of ε-poly-L-lysine with short chain length produced from glycerol by Streptomyces albulus[J]. Process Biochem, 2018, 68: 22-29.
Yamanaka K, Kito N, Imokawa Y, et al. Mechanism of ε-poly-L-lysine production and accumulation revealed by identification and analysis of an ε-poly-L-lysine-degrading enzyme[J]. Appl Environ Microbiol, 2010, 76(17): 5669-5675.
Li Q, Chen X, Wu Y, et al. A Study of Type Ⅱ ?-PL Degrading Enzyme (pldII) in Streptomyces albulus through the CRISPRi System[J]. Int J Mol Sci, 2022, 23(12): 1-15.
Yang H, Zhu D J, Kai L, et al. Engineering Streptomyces albulus to enhance ε-poly-L-lysine production by introducing a polyphosphate kinase-mediated ATP regeneration system[J]. Microbial Cell Factories, 2023, 22(1): 1-14.
Zeng X, Zhao J J, Chen X S, et al. Insights into the simultaneous utilization of glucose and glycerol by Streptomyces albulus M-Z18 for high ε-poly-L-lysine productivity[J]. Bioprocess Biosyst Eng, 2017, 40(12): 1775-1785.
Ottenheim C, Nawrath M, Wu J C. Microbial mutagenesis by atmospheric and room-temperature plasma (ARTP): The latest development[J]. Bioresour Bioprocess, 2018, 5(1): 1-14.
Xiang J, Yang Y, Dabbour M, et al. Metabolomic and genomic profiles of Streptomyces albulus with a higher ε-poly-lysine production through ARTP mutagenesis[J]. Biochem Eng J, 2020, 162: 1-12.
Song S, Tan Z, Guo F, et al. Breeding of Streptomyces diastatochromogenes for mass-producing ε-poly-L-lysine by composite mutation; proceedings of the Proceedings of the 2012 International Conference on Applied Biotechnology (ICAB 2012), F, 2014 [C]. Springer.
Li S, Chen X, Dong C, et al. Combining genome shuffling and interspecific hybridization among Streptomyces improved ε-poly-L-lysine production[J]. Appl Biochem Biotechnol, 2013, 169(1): 338-350.
Wang L, Chen X, Wu G, et al. Genome shuffling and gentamicin-resistance to improve ε-poly-L-lysine productivity of Streptomyces albulus W-156[J]. Appl Biochem Biotechnol, 2016, 180(8): 1601-1617.
Wang L, Chen X, Wu G, et al. Enhanced ε-poly-L-lysine production by inducing double antibiotic-resistant mutations in Streptomyces albulus[J]. Bioprocess Biosyst Eng, 2017, 40(2): 271-283.
Wang L, Li S, Zhao J, et al. Efficiently activated ε-poly-L-lysine production by multiple antibiotic-resistance mutations and acidic pH shock optimization in Streptomyces albulus[J]. Microbiology Open, 2019, 8(5): 1-13.
Liu Y J, Chen X S, Zhao J J, et al. Development of microtiter plate culture method for rapid screening of ε-poly-L-lysine-producing strains[J]. Appl Biochem Biotechnol, 2017, 183(4): 1209-1223.
Xu D, Yao H, Cao C, et al. Enhancement of ε-poly-L-lysine production by overexpressing the ammonium transporter gene in Streptomyces albulus PD-1[J]. Bioprocess Biosyst Eng, 2018, 41(9): 1337-1345.
Li W, Lv J, Dong T, et al. Effects of amino acids and overexpression of dapA gene on the production of ε-poly-L-lysine by Streptomyces diastatochromogenes strains[J]. Curr Microbiol, 2021, 78(7): 2640-2647.
張重阳, 杨昊, 朱道君, 等. 过表达L-赖氨酸合成途径关键基因和ε-聚赖氨酸合成酶基因对ε-聚赖氨酸合成的影响[J]. 食品与发酵工业, 2023, 49(6): 1-9.
Wang A, Tian W, Cheng L, et al. Enhanced ε-poly-L-lysine production by the synergistic effect of ε-poly-L-lysine synthetase overexpression and citrate in Streptomyces albulus[J]. Front Bioeng Biotechnol, 2020: 1-9.
Purev E, Kondo T, Takemoto D, et al. Identification of ε-poly-L-lysine as an antimicrobial product from an Epichlo? endophyte and isolation of fungal ε-PL synthetase gene[J]. Molecules, 2020, 25(5): 1-15.
Yamanaka K, Hamano Y, Oikawa T. Enhancement of metabolic flux toward ε-poly-L-lysine biosynthesis by targeted inactivation of concomitant polyene macrolide biosynthesis in Streptomyces albulus[J]. J Biosci Bioeng, 2020, 129(5): 558-564.
Sivaramakrishnan R, Suresh S, Incharoensakdi A. Chlamydomonas sp. as dynamic biorefinery feedstock for the production of methyl ester and ?-poly-lysine[J]. Bioresour Technol, 2019, 272: 281-287.
Li S, Ji J, Hu S, et al. Enhancement of ε-poly-L-lysine production in Streptomyces griseofuscus by addition of exogenous astaxanthin[J]. Bioprocess Biosyst Eng, 2020, 43(10): 1813-1821.
Wang D, Xu P, Sun J, et al. Effects of ethanol stress on epsilon-poly-L-lysine (ε-PL) biosynthesis in Streptomyces albulus X-18[J]. Enzyme Microb Technol, 2022, 153: 1-10.
Ren X D, Chen X S, Zeng X, et al. Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation by Streptomyces sp. M-Z18 from agro-industrial by-products[J]. Bioprocess Biosyst Eng, 2015, 38(6): 1113-1125.
Liu S R, Wu Q P, Zhang J M, et al. Efficient production of ε-poly-L-lysine by Streptomyces ahygroscopicus using one-stage pH control fed-batch fermentation coupled with nutrient feeding[J]. World J Microbiol Biotechnol, 2015, 25(3): 358-365.
Yan P, Sun H, Lu P, et al. Enhancement of ε-poly-L-lysine synthesis in Streptomyces by exogenous glutathione[J]. Bioprocess Biosyst Eng, 2018, 41(1): 129-134.
Xu Z, Cao C, Sun Z, et al. Construction of a genetic system for Streptomyces albulus PD-1 and improving poly (ε-L-lysine) production through expression of Vitreoscilla hemoglobin[J]. World J Microbiol Biotechnol, 2015, 25(11): 1819-1826.
Xu Z, Bo F, Xia J, et al. Effects of oxygen-vectors on the synthesis of epsilon-poly-lysine and the metabolic characterization of Streptomyces albulus PD-1[J]. Biochem Eng J, 2015, 94: 58-64.
Zhang Y, Feng X, Xu H, et al. ε-poly-L-lysine production by immobilized cells of Kitasatospora sp. MY 5-36 in repeated fed-batch cultures[J]. Bioresour Technol, 2010, 101(14): 5523-5527.
Wang C, Chen X, Jiang Y, et al. Facile and green synthesis of reduced graphene oxide/loofah sponge for Streptomyces albulus immobilization and ε-poly-L-lysine production[J]. Bioresour Technol, 2022, 349: 1-6.
Liu S, Wu Q, Zhang J, et al. Production of ε-poly-L-lysine by Streptomyces sp. using resin-based, in situ product removal[J]. Biotechnol Lett, 2011, 33(8): 1581-1585.
Ren X D, Xu Y J, Zeng X, et al. Microparticle-enhanced production of ε-poly-L-lysine in fed-batch fermentation[J]. RSC Adv, 2015, 5(100): 82138-82143.
Xia J, Xu Z, Xu H, et al. Economical production of poly(ε-L-lysine) and poly(l-diaminopropionic acid) using cane molasses and hydrolysate of streptomyces cells by Streptomyces albulus PD-1[J]. Bioresour Technol, 2014, 164: 241-247.
Zhang J H, Zeng X, Chen X S, et al. Metabolic analyses of the improved ε-poly-L-lysine productivity using a glucose-glycerol mixed carbon source in chemostat cultures[J]. Bioprocess Biosyst Eng, 2018, 41(8): 1143-1151.
Pan L, Chen X S, Liu M M, et al. Efficient production of ε-poly-L-lysine from glucose by two-stage fermentation using pH shock strategy[J]. Process Biochem, 2017, 63: 8-15.
Pan L, Chen X, Wang K, et al. Understanding high ε-poly-L-lysine production by Streptomyces albulus using pH shock strategy in the level of transcriptomics[J]. J Ind Microbiol Biotechnol, 2019, 46(12): 1781-1792.
Bankar S B, Singhal R S. Improved poly-L-ysine biosynthesis using Streptomyces noursei NRRL 5126 by controlling dissolved oxygen during fermentation[J]. World J Microbiol Biotechnol, 2011, 21(6): 652-658.
Zeng X, Chen X S, Gao Y, et al. Continuously high reactive oxygen species generation decreased the specific ε-poly-L-lysine formation rate in fed-batch fermentation using glucose and glycerol as a mixed carbon source[J]. Process Biochem, 2015, 50(12): 1993-2003.
Ren X D, Chen X S, Tang L, et al. Efficient production of ε-poly-L-lysine from agro-industrial by-products by Streptomyces sp. M-Z18[J]. Ann Microbiol, 2015, 65(2): 733-743.
Liu S R, Yang X J, Sun D F. Enhanced production of ε-poly-L-lysine by immobilized Streptomyces ahygroscopicus through repeated-batch or fed-batch fermentation with in situ product removal[J]. Bioprocess Biosyst Eng, 2021, 44(10): 2109-2120.
劉萌, 魏莲花, 林赋桂, 等. ε-聚赖氨酸对耐甲氧西林金黄色葡萄球菌USA300的作用机制[J]. 中国抗生素杂志, 2022, 47(11): 1172-1177.
Wang L, Zhang C, Zhang J, et al. Epsilon-poly-L-lysine: recent advances in biomanufacturing and applications[J]. Front Bioeng Biotechnol, 2021, 9: 1-21.
Hou W, Zhang Y, Zhang Y, et al. Label-free proteomics study on Shewanella putrefaciens regulated by ε-poly-lysine treatment[J]. J Appl Microbiol, 2021, 131(2): 791-800.
Zhou Y P, Yan P, Tang L. Self-protection of Streptomyces to ε-poly-L-lysine improves fermentation efficacy[J]. Biochem Eng J, 2021, 168: 1-6.
Ye R, Xu H, Wan C, et al. Antibacterial activity and mechanism of action of ε-poly-L-lysine[J]. Biochem Biophys Res Commun, 2013, 439(1): 148-153.
Li H, He C, Li G, et al. The modes of action of epsilon-poly-lysine (ε-PL) against Botrytis cinerea in jujube fruit[J]. Postharvest Biol Technol, 2019, 147: 1-9.
Tan Z, Shi Y, Xing B, et al. The antimicrobial effects and mechanism of ε-poly-lysine against Staphylococcus aureus[J]. Bioresour Bioprocess, 2019, 6(1): 1-10.
白森萌, 扶教龙, 王月, 等. ε-聚赖氨酸抑菌性能的研究进展[J]. 微生物学通报, 2023, 50(3): 1310-1323.
Cheng Y, Gao S, Wang W, et al. Low temperature extrusion blown ε-poly-lysine hydrochloride-loaded starch/gelatin edible antimicrobial films[J]. Carbohydr Polym, 2022, 278: 1-9.
Lu L, Xing J J, Yang Z, et al. Influence of ε-poly-L-lysine treated yeast on gluten polymerization and freeze–thaw tolerance of frozen dough[J]. Food Chem, 2021, 343: 1-36.
Ning H Q, Li Y Q, Lin H, et al. Apoptosis-induction effect of ε-poly-lysine against Staphylococcus aureus and its application on pasteurized milk[J]. LWT, 2021, 137: 1-9.
Lin L, Gu Y, Li C, et al. Antibacterial mechanism of ε-poly-lysine against Listeria monocytogenes and its application on cheese[J]. Food Control, 2018, 91: 76-84.
侯温甫, 岳琪琪, 韩千慧, 等. ε-聚赖氨酸对草鱼鱼肉优势腐败菌的抑制作用及其冷藏期间微生物多样性的影响(英文)[J]. 食品科学, 2020, 41(17): 223-230.
Qian Y F, Cheng Y, Ye J X, et al. Targeting shrimp spoiler Shewanella putrefaciens: Application of ε-poly-lysine and oregano essential oil in Pacific white shrimp preservation[J]. Food Control, 2021, 123: 1-8.
Alirezalu K, Yaghoubi M, Nemati Z, et al. Efficacy of stinging nettle extract in combination with ε-poly-lysine on the quality, safety, and shelf life of rainbow trout fillets[J]. FNS, 2021, 9(3): 1542-1550.
Lee D U, Park Y J, Yu H H, et al. Antimicrobial and antibiofilm effect of ε-poly-lysine against Salmonella Enteritidis, Listeria monocytogenes, and Escherichia coli in tryptic soy broth and chicken juice[J]. Foods, 2021, 10(9): 1-13.
Alirezalu K, Movlan H S, Yaghoubi M, et al. ?-poly-lysine coating with stinging nettle extract for fresh beef preservation[J]. Meat Sci, 2021, 176: 1-8.
Huang M, Wang H, Xu X, et al. Effects of nanoemulsion-based edible coatings with composite mixture of rosemary extract and ε-poly-L-lysine on the shelf life of ready-to-eat carbonado chicken[J]. Food Hydrocoll, 2020, 102: 1-9.
高倩, 张晓虎, 郭元园. 連翘精油-ε-pL-Nisin 复合涂膜保鲜液配制[J]. 陕西农业科学, 2022, 68(1): 14-21.
郁杰, 张雨宸, 谢晶. 低强度UV-A光循环照射结合ε-聚赖氨酸处理对4℃下鲜切菠菜保鲜效果的研究[J]. 食品与发酵工业, 2020, 46(18): 154-160.
Li N, Chen F, Cui F, et al. Improved postharvest quality and respiratory activity of straw mushroom (Volvariella volvacea) with ultrasound treatment and controlled relative humidity[J]. Sci Hortic, 2017, 225: 56-64.
Hyon W, Shibata S, Ozaki E, et al. Elucidating the degradation mechanism of a self-degradable dextran-based medical adhesive[J]. Carbohydr Polym, 2022, 278: 1-11.
Wang Y, Cao H, Wang X. Synthesis and characterization of an injectable ε-poly-lysine/carboxymethyl chitosan hydrogel used in medical application[J]. Mater Chem Phys, 2020, 248: 1-13.
Liu J N, Chang S L, Xu P W, et al. Structural changes and antibacterial activity of epsilon-poly-L-lysine in response to pH and phase transition and their mechanisms[J]. J Agric Food Chem, 2020, 68(4): 1101-1109.
申有青, 吴碧寒, 相佳佳, 等. 一种聚乙二醇-聚赖氨酸/异硫氰酸酯键合物及其作为药物载体的应用: CN, 110041522B[P]. 2020-05-29.
Wu Q X, Wang Z D, Zheng M F, et al. Development of metformin hydrochloride loaded dissolving tablets with novel carboxymethylcellulose/poly-L-lysine/TPP complex[J]. Int J Biol Macromol, 2020, 155: 411-420.
杨波, 吕品, 廖荣强, 等. ε-聚赖氨酸-聚乙烯亚胺-β环糊精聚合物及其制备方法和应用: CN, 105837827B [P]. 2018-12-14.
袁晓燕, 周培琼, 刘波, 赵蕴慧, 任丽霞. 一种葡聚糖-g-聚(L-赖氨酸)-VAPG核酸载体及其制备方法和应用: CN, 107397962B[P]. 2020-04-07.
Wu H, Hu S, Nie C, et al. Fabrication and characterization of antibacterial epsilon-poly-L-lysine anchored dicarboxyl cellulose beads[J]. Carbohydr Polym, 2021, 255: 1-9.
Nie C, Shen T, Hu W, et al. Characterization and antibacterial properties of epsilon-poly-L-lysine grafted multi-functional cellulose beads[J]. Carbohydr Polym, 2021, 262: 1-8.
Jiang S, Zeng M, Zhao Y, et al. Nano-complexation of ε-poly-L-lysine with DNA: Improvement of antimicrobial activity under high phosphate conditions[J]. Int J Biol Macromol, 2019, 127: 349-356.
Meng Z, He Y, Wang F, et al. Enhancement of antibacterial and mechanical properties of photocurable ε-poly-L-lysine hydrogels by tannic acid treatment[J]. ACS Appl Bio Mater, 2021, 4(3): 2713-2722.
Choi H J, Yang R, Kunioka M. Synthesis and characterization of pH-sensitive and biodegradable hydrogels prepared by γ irradiation using microbial poly (γ-glutamic acid) and poly (ε-lysine)[J]. J Appl Polym Sci, 1995, 58(4): 807-814.
Zhang X, Hou Z, Xu B, et al. Dietary supplementation of ε-poly-lysine beneficially affects ileal microbiota structure and function in Ningxiang pigs[J]. Front Microbiol, 2020, 11: 1-12.
侯馨怡, 陳燕, 李彩侠, 等. 利用防腐剂控制植物组织培养中的微生物污染[J]. 应用与环境生物学报, 2023, 29(3): 730-735.
Dou Y, Routledge M N, Gong Y, et al. Efficacy of epsilon-poly-L-lysine inhibition of postharvest blue mold in apples and potential mechanisms[J]. Postharvest Biol Technol, 2021, 171: 1-39.
时文静, 余甜, 李可可, 等. ε-聚赖氨酸对鲍曼不动杆菌生长及生物膜形成的影响[J]. 中国抗生素杂志, 2020, 45(1): 73-77.
Aparicio J F, Barreales E G, Payero T D, et al. Biotechnological production and application of the antibiotic pimaricin: Biosynthesis and its regulation[J]. Appl Microbiol Biotechnol, 2016, 100(1): 61-78.
Daba G M, Elnahas M O, Elkhateeb W A. Beyond biopreservatives, bacteriocins biotechnological applications: History, current status, and promising potentials[J]. Biocatal Agr Biotechnol, 2022, 39: 1-16.
李光荣, 刘欢, 张文祥, 等. 生物保鲜剂结合物理技术在果蔬保鲜中应用的研究进展[J]. 食品工业科技, 2021, 42(12): 383-388.
Wahid F, Zhao X J, Zhao X Q, et al. Fabrication of bacterial cellulose-based dressings for promoting infected wound healing[J]. ACS Appl Mater Interfaces, 2021, 13(28): 32716-32728.
Liu H, Li Z, Zhao Y, et al. Novel diabetic foot wound dressing based on multifunctional hydrogels with extensive temperature-tolerant, durable, adhesive, and intrinsic antibacterial properties[J]. ACS Appl Mater Interfaces, 2021, 13(23): 26770-26781.
Zhang J, Qu F, Liang T, et al. Novel ε-poly-lysine/polyethyleneimine-coated Ag nanoparticles for in vitro treatment of Pseudomonas aeruginosa[J]. Biochem Eng J, 2021, 168: 1-9.
Huang J, Zhuang W, Ge L, et al. Improving biocatalytic microenvironment with biocompatible ε-poly-L-lysine for one step gluconic acid production in low pH enzymatic systems[J]. Process Biochem, 2019, 76: 118-127.
Noruzi M. Electrospun nanofibres in agriculture and the food industry: A review[J]. J Sci Food Agric, 2016, 96(14): 4663-4678.
Cai L, Tabata H, Kawai T. Probing electrical properties of oriented DNA by conducting atomic force microscopy[J]. Nanotechnology, 2001, 12(3): 211-216.
收稿日期:2022-10-24
项目基金:国家自然科学基金(No. 21676173);苏州科技大学科研基金资助项目(No. XKZ201411)
作者简介:庄孝东,男,生于1998年,在读硕士研究生,研究方向为微生物代谢工程,E-mail: 970690820@qq.com
*通信作者,E-mail: jlfu999@126.com
