ε-聚赖氨酸产生菌及其应用研究概述
2016-10-13石慧李婵娟张俊红
石慧,李婵娟,张俊红
1(武汉设计工程学院 食品与生物科技学院,湖北 武汉,430205)2(华中农业大学 园艺林学学院,湖北 武汉,430070)
ε-聚赖氨酸产生菌及其应用研究概述
石慧1,李婵娟1,张俊红2*
1(武汉设计工程学院 食品与生物科技学院,湖北 武汉,430205)2(华中农业大学 园艺林学学院,湖北 武汉,430070)
ε-聚赖氨酸是由微生物分泌的、具广谱抗微生物活性的多肽类物质,易被生物降解,对人体无害。主要由白色链霉菌属、北里孢菌属和麦角真菌分泌,近年来也有报道灰橙链霉菌、 稠李链霉菌、芽孢杆菌和蜡样芽孢杆菌等也能分泌ε-聚赖氨酸。筛选方法多在NISHIKAWA和OGAWA方法的基础上改进。研究者通过诱变育种和分子改良提高菌株的产量。最常用的诱变剂为DES和UV或两者协同诱变。分子改良常用技术为原生质体融合,基因组重排及染色体步移。摇瓶发酵ε-聚赖氨酸产量最高的菌株为日本的S.aureofaciern菌株,达到了4.5 g/L,我国摇瓶发酵产量最高的菌株为Streptomycessp. 达到了3.11 g/L。ε-聚赖氨酸具有广阔的应用前景,在食品添加剂上已经投入使用,特别是食品防腐剂,在医药及生物材料上也具有较强的应用潜力。
ε-聚赖氨酸;筛选;诱变育种;分子育种
ε-聚赖氨酸是一种非核糖体合成的L-赖氨酸均聚物,是由ε-氨基和α-羧基依次连接而成的,具独特功能的多肽结构[1],也是一种生物碱,具有广谱抗菌活性[2]和抗噬菌体的活性[3]。ε-聚赖氨酸的残基数量10~40个不等,容易被生物降解,对人体无毒害[4]。25~35个氨基酸残基的ε-聚赖氨酸具有较强的抗微生物活性,通常用作食品防腐剂,本世纪初由日本率先进行商业生产,并在日本、韩国和美国的食品防腐中广泛应用[1,4]。在NISHIKAWA和OGAWA[5]发明新的菌种筛选方法前,研究者筛选到分泌ε-聚赖氨酸的菌种均为白色链霉菌,很少有其他新的菌种。主要研究单位有日本的チッン株式会社,滋贺县立大学和冈山生物科学研究所[6]。21世纪初,中国江南大学、天津科技大学、南京工业大学、华南理工大学和南开大学等单位在ε-聚赖氨酸产生菌株的筛选、诱变、分子改良育种及发酵生产上做了大量的研究,其中江南大学的研究取得了巨大进展,该课题组采用Streptomycessp. M-Z18菌株补料发酵,ε-聚赖氨酸的批生产量为54.70 g/L[7],达到了商业生产的要求,甚至高于日本商业生产用菌Streptomycesalbulusno.410的生产能力(48.3 g/L)[6]。
1 ε-聚赖氨酸产生菌的筛选
1.1筛选方法
ε-聚赖氨酸研究者筛选到的菌株主要为放线菌中的白色链霉菌属、北里孢菌属和麦角真菌[10]。近年来也有报道筛选到灰橙链霉菌[11],稠李链霉菌[12],芽孢杆菌[8]和蜡样芽孢杆菌[9]可以分泌ε-聚赖氨酸。传统的ε-聚赖氨酸产生菌的筛选方法十分复杂,基本程序是筛选出白色链霉菌,然后摇瓶发酵,利用德拉根道夫法筛选出发酵液阳性菌株,最后再通过液相色谱法对发酵液进行进一步的验证,以确定ε-聚赖氨酸产生菌的ε-聚赖氨酸产量,该方法工作量大、周期长、效果不好。2002年,NISHIKAWA和OGAWA[5]采用了一种简便的方法开展ε-聚赖氨酸产生菌的筛选,具体做法是在筛选培养基中加入酸性染料PolyR-478或者碱性染料亚甲基蓝,ε-聚赖氨酸产生菌分泌的ε-聚赖氨酸会通过静电作用与染料聚合,在筛选平板上产生肉眼可见的特殊菌落形态,根据这一特性先筛选出ε-聚赖氨酸产生菌,然后再结合其他的方法进行进一步的鉴定,从而简化筛选过程。目前,ε-聚赖氨酸产生菌的筛选方法较多,但大多是在NISHIKAWA和OGAWA筛选方法的基础上加以改进获得的,它们分为3个主要步骤:(1)放线菌的筛选;(2)产ε-聚赖氨酸放线菌的初筛;(3)产ε-聚赖氨酸放线菌的复筛与产物鉴定。
1.1.1放线菌的筛选
由于ε-聚赖氨酸研究者筛选到的菌株主要是放线菌,所以ε-聚赖氨酸产生菌的筛选主要针对放线菌开展,筛选的第一步就是筛选获得放线菌。目前主要采用的策略是在筛选培养基中添加抑菌剂来抑制细菌和真菌的生长,从而筛选获得放线菌。大多数研究者通过在富集培养基或初筛平板中添加50~150 mg/L K2Cr7O7[6,8,13-15]来抑制细菌及霉菌的生长来获得放线菌。HIDEO等[1]采用放线菌酮、制霉菌素抑制细菌和真菌的生长;LI等[16]则以K2Cr7O7和制霉菌素为主,加少量诺氟沙星和青霉素来联合抑制细菌及真菌的生长以筛选放线菌。筛选到非放线菌的ε-聚赖氨酸产生菌的研究者省略了放线菌的筛选的步骤,直接在亚甲基蓝平板上筛选产碱菌株[9]。
1.1.2产ε-聚赖氨酸的放线菌的初筛
ε-聚赖氨酸是一种生物碱,亚甲基蓝与生物碱可因静电排斥而形成透明圈[10]。ε-聚赖氨酸产生菌的主要研究者在初筛ε-聚赖氨酸产生菌时均采用2~50 mg/L的亚甲基蓝透明圈法去筛选放线菌中产碱菌株[6,8-9,13-16],亚甲基蓝既可以添加在初筛平板中,也可以喷洒在初筛平板上[11]。
1.1.3产ε-聚赖氨酸放线菌的 复筛与产物鉴定
复筛需要鉴定菌株的发酵产物是否可以产生ε-聚赖氨酸的特征反应并做产量测定。绝大多数研究者在复筛时采用发酵产物与Drgaendorff试剂反应产生砖红色沉淀对产物做定性鉴定[6,8-9,13-16],该反应为ε-聚赖氨酸的特征反应。几乎所有的研究者均采用Itzhaki法[17]定量测定ε-聚赖氨酸产生菌株摇瓶发酵产量。有的研究者辅以ε-聚赖氨酸的水解产物反应纸层析[13,15]、薄层层析[6,14-16,18]定性鉴定ε-聚赖氨酸,也有人采用高效液相色谱法[1,8,15],以确定ε-聚赖氨酸产生菌所产ε-聚赖氨酸的特性和产量。
1.2国内外筛选到的ε-聚赖氨酸产生菌及生产能力
ε-聚赖氨酸产生菌的主要研究者均来自日本和中国。从表1可知,筛选到的产生菌的种类主要有链霉菌属、芽孢杆菌属和北里孢菌属,其中链霉菌属包含金霉素链霉菌、白色链霉菌、草绿色链霉菌、浅灰色链霉菌等等,芽孢杆菌属则有枯草芽孢杆菌和蜡样芽胞杆菌。从菌株的ε-聚赖氨酸的生产能力来看,菌株摇瓶发酵产量较高的大多为日本研究者筛选获得,如StreptomycesalbulusNBRC 14147、StreptomyceslydicusUSE-11、Streptomycessp. USE-12、S.albulussubsp. USE-13、S.aureofaciern、Streptomycesnoursei(FERM P-9797)和Streptomycessp. SP-72(FERM-16820),仅1个菌株Streptomycesgriseofuscus为我国研究者筛选。在所筛选到的菌株中,ε-聚赖氨酸的摇瓶发酵产量较高的菌株主要集中在放线菌属的菌株,枯草芽孢杆菌、蜡样芽胞杆菌和北里孢菌ε-聚赖氨酸的摇瓶发酵产量均不高,分别仅为0.7、0.4、0.4 g/L。在不同种类链霉菌中,ε-聚赖氨酸的摇瓶发酵产量相差比较大,最低的仅为0.4 g/L,而最高的金霉素链霉菌的产量可以达到4.5 g/L;同一种放线菌的不同菌株,其ε-聚赖氨酸的摇瓶发酵产量也有较大的差别,如放线菌菌株S.albulusNBRC 14147的摇瓶发酵产量为2.8 g/L,而S.albulusno.410的摇瓶发酵产量仅为0.5 g/L。因此,合适的菌株是提高ε-聚赖氨酸生产能力的基础。

表1 国内外主要研究者筛选到的ε-聚赖氨酸产生菌株的生产能力
2 ε-聚赖氨酸产生菌的诱变选育
2.1诱变方法
自然界筛选到的野生菌种不论是在代谢产物产量上还是质量上均难以适合现代工业化生产的要求,诱变育种仍然是当代菌株改造的重要途径[22]。采用合适的突变菌株筛选方法,应用物理诱变、化学诱变、以及物理诱变和化学诱变进行复合诱变的策略,研究者获得了一批ε-聚赖氨酸产量显著提高的新菌株。
合适的筛选方法是开展高产ε-聚赖氨酸产生菌株诱变育种的基础,目前通常采用S-2-氨基乙基-L-半胱氨酸(S-AEC)作为筛选标记。S-AEC是赖氨酸的结构类似物,通过在培养基中添加S-AEC以选育出带有S-AECr遗传标记的的菌株,该标记可遗传性地解除赖氨酸对天冬氨酸激酶的反馈抑制,增强赖氨酸代谢流,提高菌株的ε-聚赖氨酸产量。以S-AEC和甘氨酸(Gly)为抗性标记,KAHAR等[24]以S.albulus346为出发菌株,得到S.albulus410菌株,ε-聚赖氨酸产量提高了6倍; HIRAKI等[25]也以S.albulus为出发菌株,通过S-AEC为筛选标记筛选突变体,发现99%的突变体的 ε-聚赖氨酸的产量提高,其中有1株试管培养产量提高了10倍。
ε-聚赖氨酸产生菌的物理诱变方法主要有紫外诱变、等离子体诱变仪诱变和30 keV氮离子处理等,再结合合适的诱变筛选培养基,能较大幅度的提高ε-聚赖氨酸产生菌的-聚赖氨酸产量。如姜俊云[27]通过UV诱变得到产量提高15.2%的诱变菌株;杨玉红[18]仅通过UV诱变得到产量提高20.97%的诱变菌株;张超等[29]经大剂量UV诱变处理,用 S-AEC氨基酸结构类似物平板定向育种方法,获得1株ε-聚赖氨酸高产菌C-18,其发酵液中ε-聚赖氨酸产量较出发菌株提高42.9%,在含有50 g/L葡萄糖的培养基中,ε-聚赖氨酸积累可达1.23 g/L;谭之磊等[35]用等离子体诱变仪诱变孢子悬液,再用含有磺胺胍+甘氨酸+L-lysine+AHV 的抗性平板辅以美兰平板筛选,得到1株S.diastatochromogenesL9,产量比出发菌株提高了13%;丛茂林等[32]以TS02菌株出发,注入不同剂量的30 keV 氮离子处理,用抗性平板结合抑菌圈的筛选方法,筛选到1株高产菌株S.albulusGC11,生产能力比出发菌株提高了1.32倍。
在化学诱变育种方面,田丰伟等[34]以白色链霉菌 UN2-71 为出发菌株, 对其原生质体进行DES诱变,得到 1 株稳定性好的高产菌株 D3-32,摇瓶产量达到1.56 g/L,比出发菌株提高 49.43%;陈旭升[31]利用亚硝基胍对白色链霉菌孢子进行诱变,用ε-PL+Gly作为抗性平板筛选高产菌株,获得了一株产量为1.05 g/L,遗传稳定的突变株S.albulusA-l,该突变株较出发菌株产量提高了54%;陈玮玮等[28]以Kitasatosporasp. PL6-3为出发菌株,经DES诱变,获得遗传性能稳定的突变株MY5-36,摇瓶发酵ε-聚赖氨酸产量达1.17 g/L,是出发株的3倍;平木纯[23]等以S.albulus346为出发菌株,用亚硝基胍(NTG)为诱变剂,以S-2-氨基乙基-L-半胱氨酸(S-AEC)为筛选标记,选育到11011A-1菌株,菌株摇瓶发酵的生产能力提高3.3倍,他还用氯霉素处理S.albulus346菌株,得到生产能力提高9倍的菌株50833。
在复合诱变方面,张海涛等[30]以白色链霉菌S.albulusSF-21为出发菌株,先后采用微波,DES和UV进行复合诱变,获得产量为0.848 g/L的菌株,比出发菌株提高了41.3%。董惠钧[26]以S.albulusTF-1为出发菌株,先用紫外线(UV)诱变,再用硫酸二乙酯(DES)诱变得到产量提高113.5%的突变菌株。李双双等[33]以广东省微生物所保藏的S.albulus-8#为出发菌株,采用UV和DES复合诱变处理,同样用ε-PL+Gly作为抗性平板筛选,得到产量提高2.2倍的高产菌株。
2.2诱变后菌株的生产能力
根据表2可知,合适的筛选方法,可以从出发菌株中直接筛选出高产的ε-聚赖氨酸高产菌株,产量可提高6~10倍。在ε-聚赖氨酸产生菌的诱变育种研究主要以放线菌为诱变的出发菌株,且以白色链霉菌居多。普遍采用UV或DES诱变剂,或两者相结合,少数采用离子束、NTG和AEC结构类似物等其他诱变剂。不同的诱变方法,其诱变效果差异明显,中的来说,仅采用物理诱变的效果比较差,如用离子体诱变仪进行诱变后,筛选获得的ε-聚赖氨酸产生菌的ε-聚赖氨酸产量仅提高13%;仅用UV左右诱变剂,诱变后筛选获得的ε-聚赖氨酸产生菌的ε-聚赖氨酸产量仅提高15%~21%;只有采用30 keV 氮离子作为诱变剂,诱变后筛选获得的ε-聚赖氨酸产生菌的ε-聚赖氨酸产量可提高1.32倍。而采用化学诱变剂进行诱变,多数情况下获得的ε-聚赖氨酸产生菌的ε-聚赖氨酸产量可提高50%左右,效果要明显好于仅用物理方法进行诱变。而通过复合诱变,获得的ε-聚赖氨酸产生菌的ε-聚赖氨酸产量可提高1~2倍。因此,在ε-聚赖氨酸产生菌的诱变育种方面,物理与化学诱变剂相结合的复合诱变,更容易获得突变的、产量显著提高的ε-聚赖氨酸产生菌株。

表2 诱变处理后各菌株的生产能力改良情况
3 ε-聚赖氨酸产生菌的分子育种
3.1分子育种方法
为将DNA递送到Streptomycesalbulus中,YOSHIMITSU等[37]开发了基于乙二醇介导的原生质体融合和与大肠杆菌进行属间接合的DNA传递系统,该项研究中采用了新的隐性质粒穿梭载体,这项基因操作系统的开发有助于Streptomycesalbulus分子遗传改良的开展。
LI等[38]采用基因组重排技术提高菌株Streptomycesgraminearusstrain LS-B1 对葡萄糖的耐受能力而增加菌株ε-聚赖氨酸的产量。出发菌株先经过UV和NTG复合诱变,再采用递归原生质体融合,筛选到的阳性融合子经过3轮基因组重排后,用含有不同浓度的葡萄糖营养琼脂筛选,发现能耐受葡萄糖浓度较高的重组子产ε-聚赖氨酸均增高,其中重组菌株F3-4的产量比出发菌株提高了88%,摇瓶发酵达到了2.4 g/L。LI等[39]还先通过5种野生菌株的基因组重排提高ε-聚赖氨酸的产量,然后让所有重排后的菌株通过原生质体融合进行种间杂交,通过其菌落形态及孢子的颜色来筛选改变的菌株,发现重组子FEEL-1 摇瓶产量达到1.12 g/L,比野生菌株提高了2.75倍。ZHOU等[41]通过基因组重排技术筛选到1株高耐受ε-聚赖氨酸的高产菌株,该方法采用DES诱变出发菌株,建立了初始突变体库,经过4轮的原生质体融合,基因组重排后筛选出菌株F4-22,摇瓶培养ε-聚赖氨酸的产量为3.11g/L,比出发菌株提高了1.81倍。
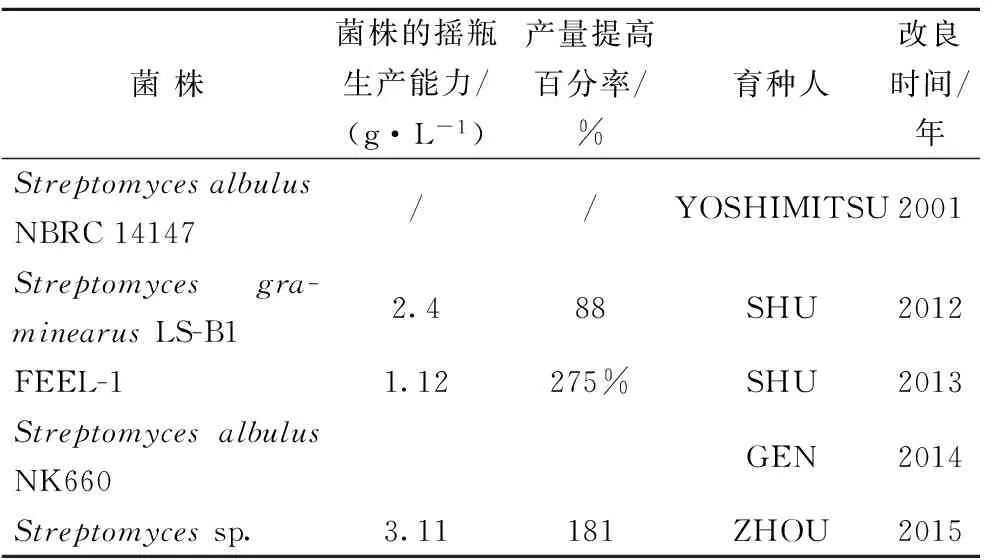
表3 分子改良后菌株的生产能力
3.2分子改良育种的菌株的生产能力
国内研究者在分子育种上也取得了巨大的进展,江南大学采用不同的菌株为出发菌株,主要运用诱变育种、基因重排及原生质体融合相结合,大大提高了出发菌株的产量,单菌摇瓶发酵产量达到3.11 g/L,仅次于日本的S.aureofaciern菌株(4.5 g/L)和StreptomyceslydicusUSE-11菌株(4.0 g/L)。此外,GENG等[40]用染色体步移技术从菌株NK660中克隆到ε-聚赖氨酸的合成基因,将该基因成功导入到链霉菌ZX7中异源表达,筛选到的重组菌株具有合成ε-聚赖氨酸的能力。ε-聚赖氨酸合成基因的异源表达为ε-聚赖氨酸合成的分子育种提供了新的途径。
4 ε-聚赖氨酸的应用潜力
4.1ε-聚赖氨酸应用于食品添加剂
ε-聚赖氨酸是一种天然多肽,也是一种生物碱,具有可溶于水,可生物降解。基于吸收、分布、代谢、排泄及安全性试验,已经证实它对人体和环境无害[42],具有广谱的抗菌活性及优良的热稳定性而被用于食品防腐剂[43-44]。ε-聚赖氨酸本身乳化能力低,但通过麦拉德反应与葡萄糖结合,可以显著提高其乳化活性,优于其他的商业乳化剂,因此也被用于食品乳化剂[43,45]。胰脂肪酶可以促进肠道脂肪的吸收从而导致肥胖,但ε-聚赖氨酸可以抑制胰脂肪酶的活性,是一种可以有效消除肥胖的膳食添加剂[46]。
4.2ε-聚赖氨酸应用于医药
干扰素具有抗病毒和抗肿瘤的作用[47],poly I · poly C可以诱导干扰素的产生,但血清中常常含有核糖核酸酶会很快降解poly I · poly C,导致诱导干扰素的能力低下。LEVY等将poly I poly C 与ε-聚赖氨酸溶解在0.5 %的羧甲基纤维素里,核糖核酸酶的降解活性将降低5~10倍,从而可以提高其诱导干扰素的产量。表明ε-聚赖氨酸在医药上很有应用前景[48]。
抗叶酸剂氨甲蝶呤(MTX)是广泛应用的抗癌药物,但因运载载体的缺陷而产生耐药性[42]。ε-聚赖氨酸被证明容易被细胞摄取,且与MTX结合能显著提高其向细胞内转运的效率,是MTX潜在的载体,能克服MTX由于缺陷运载而产生的耐药性[49-51]。因此ε-聚赖氨酸还能作为药物转送的载体。
20世纪末,利用基因修改体细胞的基因型进而治疗疾病的研究已经取得了巨大进展[52-53],而引进基因到细胞的主要障碍是缺乏运送基因的载体[42]。 ZAUNER等发现ε-聚赖氨酸之类的阳离子聚合物可以通过离子间的相互作用与DNA形成复合物,它还可以压缩DNA分子,阻止其被核酸酶降解,具有用作基因载体的潜能[54]。然而,ε-聚赖氨酸与DNA的结合产物也具有很多缺点,溶解度低,转染效率低,具有一定的细胞毒性等[55]。如果将ε-聚赖氨酸与乳糖和聚乙二醇结合,形成 Lac-PEG-PL复合体, 将能成功解决以上问题,成为基因转运的有效载体[56]。
此外,ε-聚赖氨酸在医药上还有很多其他用途。ε-聚赖氨酸通过与氯甲基交联,形成的水不溶性聚合物,可以有效去除细菌内毒素LPS层[57]。ε-聚赖氨酸还可以通过固定葡萄糖氧化酶,用于葡萄糖传感器的制备[58]。早在10几年前,含有ε-聚赖氨酸或其衍生物的纳米胶囊被设计用于递送眼药和封装用于在体内递送生物活性分子的细胞系[59]。ε-聚赖氨酸还被用于吸水材料,作为生物芯片或生物电子的涂层材料等多种用途[42]。
[1]HIROHARA H, TAKEHARA M, SAIMURA M, et al. Biosynthesis of poly(ε-L-lysine) in two newly isolated strains ofStreptomycessp.[J]. Appl Microbiol Biotechnol,2006,73(2):321-331.
[2]SHIMA S, MATSUOKA H, IWAMOTO T, et al. Antimicrobial action of ε-poly-L-lysine [J]. J Antibiot,1984,37(11):1 449-1 455.
[3]SHIMA S, FUKUHARA Y, SAKAI H. Inactivation of bacteriophages by ε-poly-L-lysine produced byStreptomyces[J]. Agric Biol Chem,1982, 46:1 917-1 919.
[4]HIROHARA H, SAIMURA M, TAKEHARA M, et al. Substantially monodispersed poly(ε-L-lysine)s frequently occurred in newly isolated strains ofStreptomycessp.[J].Appl Microbiol Biotechnol, 2007, 76(5):1 009-1 016.
[5]NISHIKAWA M, OGAWA K. Distribution of microbes producing antimicrobial ε-poly-L-lysine polymers in soil microflora determined by a novel method [J]. Appl Environ Microbiol,2002,68(7):3 575-3 581.
[6]朱宏阳. ε-多聚赖氨酸产生菌株的筛选和发酵条件的研究[D].南京:南京工业大学,2005.
[7]REN X D, CHEN X S, ZENG X, et al. Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation byStreptomycessp. M-Z18 from agro-industrial by-products[J].Bioprocess Biosyst Eng,2015,38(6):1 113-1 125.
[8]EL-SERSY N A, ABDELWAHAB A E, ABOUELKHIIR S S, et al. Antibacterial and anticancer activity of ε-poly-L-lysine (ε-PL) produced by a marineBacillussubtilissp.[J].Journal of Basic Microbiology,2012, 52(5):513-522.
[9]CHHEDA A H, VERNEKAR M R, CHHEDA A H, Improved production of natural food preservative ε-poly-L-lysine using a novel producerBacilluscereus[J].Food Bioscience, 2014,7:56-63.
[10]张超,张东荣,贺魏,等.一种简便的ε-聚赖氨酸产生菌的筛选方法[J].山东大学学报(医学版),2006,44(11):1 104-1 107.
[11]段杉,朱伟珊. ε-聚赖氨酸产生菌的筛选[J].食品与发酵工业,2007,33(8):14-17.
[12]李树,陈旭升,廖莉娟,等.ε-聚赖氨酸产生菌的筛选方法改进[J].食品与生物技术学报,2010,29(2):282-287.
[13]黄 莉,唐仁勇,张佳敏,等.ε-多聚赖氨酸产生菌的筛选及 16S rDNA 测序鉴定[J].食品工业科技,2013,34(17):163-172.
[14]黄静敏.ε-聚赖氨酸产生菌新菌株的筛选和产物结构的鉴定[J].微生物学通报,2011,38(6):871-877.
[15]贾士儒. ε-多聚赖氨酸产生菌TUST-2的分离与鉴定[J].微生物学学报,2010,50(2):191-196.
[16]LI S, TANG L, CHEN X S, Isolation and characterization of a novel ε-poly-L-lysine producing strain:Streptomycesgriseofuscus[J]. J Ind Microbiol Biotechnol, 2011, 38:557-563.
[17]ITHAKI F R. Colorimetric method for estimating polylysine and polyarginine[J].Analytical Biochemistry,1972,50(2):569-574.
[18]杨玉红.ε-聚赖氨酸产生菌的筛选、鉴定及发酵的研究 [D].沈阳:沈阳农业大学,2007.
[19]TAKEHARA M, HIBINO A, SAIMURA M, et al. High-yield production of short chain length poly(ε-llysine) consisting of 5-20 residues byStreptomycesaureofaciens, and its antimicrobial activity[J]. Biotechnol Letter,2010, 32(9): 1 299-1 303.
[20]OUYANG J, XU H, LI S, et al. Production of ε-poly-L-lysine by newly isolatedKitasatosporasp. PL6-3[J].Biotechnol J, 2006, 1(20):1 459-1 463.
[21]SHIMA S, SAKAI H, Poly-L-lysine Produced by Streptomyces. Part III. Chemical Studies[J].Agricultural and Biological Chemistry, 1981,45(11): 2 503-2 508.
[22]刘盛荣. ε-多聚赖氨酸生物合成及代谢调控[D].广州:华南理工大学,2012.
[23]HIRAKI J, MORITA H. Strain mass-producing Epsilon-Poly-L-lysine,a method for Using its strain and a method for producing Epsilon-Poly-L-lysine[P]. European Patent.EP0256423A2,1988.2.24
[24]KAHAR P, IWATA T, HIRAKI J, et al. Enhancement of ε-Polylysine production byStreptomycesalbulusstrain 410 using pH contorl. Journal of Bioscience and Bioengineering,2001,91(2):190-194.
[25]HIRAKI J, HATAKEYAMA M, MORITA S, et al. Improved poly-L-lysine production of an S-(2-aminoethyl)-L-cysteine resistance mutant ofStreptomycesalbulus[J]. Seibutsu Kogaku, 1998, 76(12): 487-493.
[26]董惠钧. 生物防腐剂-ε-多聚赖氨酸的初步研究[D].天津:天津科技大学,2003.
[27]姜俊云. ε-多聚赖氨酸生产菌株的选育与发酵工艺的研究[D]. 天津:天津科技大学,2004.
[28]陈玮玮,朱宏阳,徐虹.ε-聚赖氨酸高产菌株选育及分批发酵的研究[J].工业微生物,2007, 37(2):28-30.
[29]张 超,王正刚,段作营,等.大剂量紫外诱变选育ε-聚赖氨酸高产菌[J]. 生物加工过程,2007, 5(3):64-68.
[30]张海涛,李 燕,欧 杰,等. 诱变选育ε-聚赖氨酸产生菌突变株[J].食品科学,2007, 28(9):398-401.
[31]陈旭升。ε-聚赖氨酸高产菌株选育与发酵过程优化[D].无锡:江南大学,2008.
[32]丛茂林,许鹏,谭之磊,等. 氮离子入法筛选ε-聚赖氨酸高产菌株[J].现代食品科技,2009,25(5):491-494.
[33]李双双,吴振强,吴清平,等.产ε-聚赖氨酸白色链霉菌复合诱变选育研究[J] 中国酿造,2010(12):108-111.
[34]田丰伟,程传荣,袁维涵,等. 原生质体诱变选育ε-聚赖氨酸高产菌株[J].微生物学通报,2010, 37(10): 1 457-1 461.
[35]谭之磊,王甜,宋帅,等.ε-聚赖氨酸高产菌株的诱变选育[J].中国食品添加剂,2011,5:99-102.
[36]WANG T, JIA S R, TAN Z L, et.al. Mutagenesis and selective breeding of a high producing ε-poly-L-lysine strain [J].Front Chem Sci Eng,2012, 6(2): 179-183.
[37]YOSHIMITSU H, INE N, YUSUKE H, et al. Development of gene delivery systems for the -poly-L-lysine producerStreptomycesalbulus[J]. Journal of Bioscience and Bioengineering, 2005,99(6):636-641.
[38]LI S, LI F, CHEN X S, et al. Genome shuffling enhanced ε-poly-L-lysine production by improving glucose tolerance ofStreptomycesgraminearus[J].Appl Biochem Biotechnol,2012, 166(2):414-423.
[39]LI S, CHEN X S, DONG C L, et al. Combining genome shuffling and interspecific hybridization amongStreptomycesimproved ε-poly-L-lysine production[J].Appl Biochem Biotechnol,2013, 169(1):338-350.
[40]GENG W T, YANG C, GU Y Y, et al. Cloning of ε-poly-L-lysine (ε-PL) synthetase gene from a newly isolated ε-PL-producingStreptomycesalbulusNK660 and its heterologous expression inStreptomyceslividans[J]. Microbial Biotechnology,2014,7(2):155-164.
[41]ZHOU YP, REN XD, WANG L, et al. Enhancement of ε-poly-lysine production in ε-poly-lysine-tolerantStreptomycessp. by genome shuffling [J].Bioprocess Biosyst Eng,2015,38(9):1-9.
[42]SHIH I L, SHEN M H, VAN Y T. Microbial synthesis of poly(ε-lysine) and its various applications[J].Bioresource Technology,2006,97(9):1 148-1 159.
[43]HIRAKIJ. Basic and applied studies on ε-polylysine[J]. J Antibact Antifungal Agents, 1995,23: 349-354.
[44]HIRAKIJ. ε-polylysine, its development and utilization [J].Fine Chem,2000,29(1):25-28.
[45]OTSUKA N, KUWAHARA Y, MANABE K, Effect of ε-poly-lysine on preservation of boiled noodles[J].Nippon Shokuhin Kogyo Gakkaishi, 1992,39: 344-347.
[46]KIDO Y, HIRAMOTO S, MURAO M, et al. ε-Polylysine inhibits pancreatic lipase activity and suppresses postprandial hypertriacylglyceridemia in rats[J].J Nutr, 2003,133(6):1 887-1 891.
[47]FIELDS A K, TYTELL A A, LAMPSON G P, et al. Inducers of interferon and host resistance. Multistranded synthetic polynucleotide complexes [J].Proc Natl Acad Sci USA, 1967, 58(3):1 004-1 009.
[48]LEVY H B, BAER G, BARON S, et al. A modified polyriboinosinic-polyribocytidylic acid complex that induces interferon in primates [J].J Infect Dis, 1975,132(4): 434-439.
[49]RYSER H J P, SHEN W C. Conjugation of methotrexate to poly(L-lysine) increase drug transport and overcome drug resistance in cultured cells [J].Proc Natl Acad Sci, 1978,75(8):3 867-3 870.
[50]SHEN W C, RYSER H J P. Poly(L-lysine) and poly(d-lysine) conjugates of methotrexate: different inhibitory effect on drug resistant cells[J].Mol Pharmacol,1979,16(2):614-622.
[51]SHEN W C, RYSER H J P. Poly(L-lysine) has different membrane transport and drug-carrier properties when complexed with heparin[J].Proc Natl Acad Sci, 1981,78(12):7 580-7 593.
[52]MULLIGAN R C. The basic science of gene therapy[J].Science, 1993,260:926-932.
[53]HANANIA E G., KAVANAGH J, HORTOVAGYL G., et al. Recent advances in the application of gene therapy to human disease[J].Am J Med,1995, 99(5):537-552.
[54]ZAUNER W, OGRIS M, WAGNER E. Polylysine-based transfection systems utilising receptor-mediated delivery[J].Adv Drug Delivery Rev, 1998,30:97-113.
[55]LEDLEY F D. Nonviral gene therapy: the promise of genes as pharmaceutical products[J]. Hum Gene Ther, 1995,6(9):1 129-1 144.
[56]CHOI Y H, LIU F, PARK J S, et al. Lactose-poly(ethylene glycol)-grafted poly-L-lysine as heptoma cell-targeted gene carrier[J].Bioconjugate Chem, 1998, 9(6):708-718.
[57]HIRAYAMAC, SAKATA M, NAKAMURA M, et al. Preparation of poly(ε-lysine) adsorbents and application to selective removal of lipopolysaccharides[J].J Chromato, 1999,712(2):187-195.
[58]SUYE S I, KUMON Y, ISHIGAKI A. Immobilization of glucose oxidase on poly-(L-lysine)-modified polycarbonate membrane[J].Biotechonol Appl Biochem, 1998, 27(3):245-248.
[59]OKADA N, MIYAMOTO H, YOSHIOKA T, et al. Immunological studies of SK2 hybridoma cells microencapsulated with alginate-poly(l)lysine-alginate (APA) membrane following allogenic transplantation[J].Biochem Biophys Res Commun, 1997,230(3):524-527.
Research progress on the ε- polylysine producing strains and its application
SHI Hui1, LI Chan-juan1, ZHANG Jun-hong2*
1(School of Food and Biotechnology of Wuhan Institute of Design and Sciences,Wuhan 430205, China)2(College of Horticulture & Forestry Sciences of Huazhong Agriculture University,Wuhan 430070, China)
Epsilon-polylysine is a polypeptide secreted by microorganisms,which has broad-spectrum antibacterial and anti-phage activity. It is easily biodegradable and harmless to the human body. Epsilon-polylysine is mainly secreted byStreptomycesalbusgenus,KitasatofusariumandClaviceospurpurea. In recent years, it has been reported thatStreptomycesgriseoaurantiacus,Strepomycespadanus,BacillussubtilisandBacilluscereusalso can secrete epsilon-polylysine. Most of the selection methods are modified from method of Nishikawa and Ogawa to be more effective. The yield of the strain was generally improved by mutation breeding and molecular modification. DES and UV or both of them are common mutagens used in the mutation breeding, and the protoplast fusion, gene rearrangement and chromosome walking are commonly used molecular modification methods. Now, the highest yield of epsilon-polylysine producing strain for the shaking flask fermentation in the world isS.aureofaciernstrain from Japan with yield of 4.5 g/L. But the strain with the highest yield isStreptomycessp. in China and its yield reaches 3.11 g/L. Epsilon-polylysine shows broad application prospects. It has been used in food additives, especially as a food preservative. Previously research also showed that epsilon-polylysine had great application potential in medicine and biological materials.
epsilon-polylysine;selection;mutation breeding;molecular breeding
10.13995/j.cnki.11-1802/ts.201609044
硕士,副教授(张俊红教授为通讯作者,E-mail: zhangjunhng@mail.hzau.edu.cn)。
2015年度湖北省教育厅优秀青年科技创新团队项目基金(T201534)
2015-10-31,改回日期:2016-04-13
