红豆杉内生真菌Trichoderma sp.次生代谢产物及其抗菌活性研究
2023-12-26黄泽雕王文静廖梁秀鲜鹏杰杨小龙
黄泽雕 王文静 廖梁秀 鲜鹏杰 杨小龙
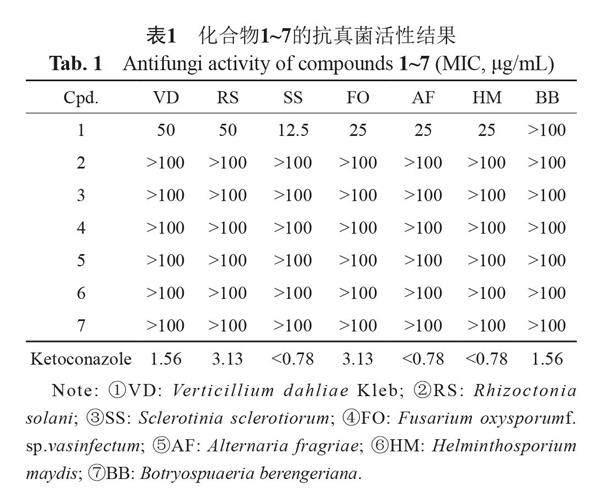
摘要:目的 從红豆杉内生木霉属真菌MPT-009的次生代谢产物中发现具有抗菌活性的单体化合物。方法 采用硅胶、ODS、Sephadex-LH20柱层析和半制备高效液相等方法进行分离,利用高分辨率质谱、NMR波谱数据和电子圆二色谱(ECD)计算等方法确定化合物结构,通过二倍稀释法评价化合物对8种临床耐药性细菌和7种植物病原真菌的抗菌活性。结果 从木霉属真菌MPT-009大米发酵产物中共分离得到了一个新的聚酮化合物trichoketide F (1)和6个已知化合物10-deacetylkoningiopisin D (2)、koninginin A (3)、koninginin B (4)、koninginin D (5)、koninginin E (6)、isoharziandione (7)。化合物1对马铃薯黄萎病菌、水稻纹枯病菌、油菜菌核菌、棉花枯萎病菌、草莓黑斑病菌、玉米小斑病菌显示一定的抑制活性,MIC值为12.5~50 μg/mL。结论 本文对红豆杉内生真菌Trichoderma sp.的次生代谢产物进行了深入研究,分离得到1个新化合物,丰富了木霉属真菌代谢产物,且该化合物对油菜菌核病菌具有较好的抑制活性,MIC值为12.5 μg/mL。
关键词:红豆杉;木霉属;聚酮;ECD计算;抗菌活性
中图分类号:R978.1文献标志码:A
Secondary metabolites and their antimicrobial activities from endophytic fungus Trichoderma sp. isolated from Taxus wallichiana var. chinensis (Pilg.) Florin
Huang Zediao1, Wang Wenjing1, Liao Liangxiu1, Xian Pengjie2, and Yang Xiaolong1
(1 The Modernization Engineering Technology Research Center of Ethnic Minority Medicine of Hubei Province,
School of Pharmaceutical Sciences, South-Central University for Nationalities, Wuhan 430074;
2 School of Pharmaceutical Sciences, Chongqing University, Chongqing 401331)
Abstract Objective To find monomer compounds with antimicrobial activity from the secondary metabolites of the endophytic fungus Trichoderma sp. MPT-009 isolated from Taxus wallichiana var. Chinensis (Pilg.) Florin. Methods Separation is carried out by silica gel, ODS, Sephadex-LH20 column chromatography, and semi-preparative HPLC. The structures were determined by high-resolution mass spectrometry, NMR spectral data, and electron circular discography (ECD) calculation. The antimicrobial activities against eight clinically resistant bacteria and seven plant pathogenic fungi of isolated compounds were evaluated by the double dilution method. Results A new polyketone compound trichoketide F (1), together with six known compounds, 10-deacetylkoningiopisin D (2), koninginin A (3), koninginin B (4), koninginin D (5), koninginin E (6) and isoharziandione (7) were isolated from the rice fermentation product of the endophytic fungus Trichoderma sp MPT-009. Compound 1 showed certain inhibitory activity against Verticillium dahliae Kleb, Rhizoctonia solani, Fusarium oxysporumf. sp. vasinfectum, Sclerotinia sclerotiorum, Alternaria fragriae, and Helminthosporium maydis with MIC values of 12.5~50 μg/mL.
Conclusion In this paper, we investigated the secondary metabolites and their antimicrobial activities from Trichoderma sp., resulting in the isolation of a new polyketone that enriched the metabolites of Trichoderma sp. Furthermore, compound 1 exhibited moderate inhibitory activity against Sclerotinia sclerotiorum with a MIC value of 12.5 μg/mL.
Key words Taxus wallichiana var. chinensis (Pilg.) Florin; Trichoderma sp.; Polyketone; ECD calculation; Antimicrobial activities
植物内生真菌是指可以在健康植物组织中被检测到的微生物[1],由于整个生命周期都存在于寄主植物组织内,它们能够产生大量结构新颖、活性显著的次级代谢产物。在与宿主植物长期互利共存的过程中,内生真菌甚至能产生与宿主结构相同或类似的代谢产物,是微生物化学研究的热点[2]。1993年,Stierle等[3]从短叶红豆杉的树皮中分离出1株内生真菌Taxomyces andreana能够产生与紫杉醇结构相似的化合物;Li等[4]从雷公藤植物内生真菌(Cryptosporiopsis cf. quercina)中分离得到的四胺酸隐球菌素,具有强大的抗真菌活性,对稻瘟菌的最低抑制浓度为0.39 ?g/mL;从澳大利亚植物黑刺蛇(Kennedia nigriscans)中分离得到的链霉菌(Streptomyces sp.)NRRL 30562可以产生多种munumbicin类广谱抗生素,其中munumbicin D对恶性疟原虫有很强的抑制活性,IC50值为4.5 ng/mL[5]。以上研究实例说明植物内生真菌次生代谢产物不仅是药物先导化合物的重要源泉,在农业方面也具有重要研究价值。
植物病原真菌是造成严重植物病害的罪魁祸首,严重影响着农业的可持续发展[6-10],木霉属真菌作为一种著名的生物防治剂,被广泛用于植物真菌病害的防治。国际上已有多种木霉生物防治剂产品注册登记,并进行商业化生产。如利用哈茨木霉Trichoderma harzianum Rifai和绿木霉T. virens (J.H. Mill., Giddens & A.A. Foster) Arx生产的商业制剂TRICHODEXXTM和Soil-GardTM具有广谱的抗植物病源真菌活性,用于玉米、大豆、黄瓜等作物中丝核菌属引起的植物病害的防治[11]。研究表明,木霉属真菌的次级代谢产物化学结构多样,包括聚酮、萜类、非核糖体肽、甾体等,具有抗肿瘤、抗炎、抗菌的活性[12-14]。次级代谢产物的化学多样性是木霉属真菌有效生物防治潜力的来源,因此从木霉菌中寻找具有抗植物病原真菌活性的化合物对农业的发展有重要的意义[15-16]。本研究以1株分离自红豆杉果实的木霉属真菌MPT-009为研究对象,从其发酵产物中分离得到7个化合物,包含1个新的聚酮化合物和6个已知化合物,通过高分辨率质谱、核磁波谱数据和电子圆二色谱(ECD)计算等方法对化合物结构进行鉴定,确定为:trichoketide F (1),10-deacetylkoningiopisin D (2),koninginin A (3),koninginin B (4),koninginin D (5),koninginin E (6)和isoharziandione (7)。并对单体化合物的抗植物病源真菌和临床耐药细菌活性进行了测试,其中化合物1对油菜菌核病具有良好的抑制活性,最小抑菌浓度为12.5 μg/mL。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
Autopol IV自动旋光仪(美国乔治亚州鲁道夫公司);Chirascan Plus圆二色性分光计(英国萨里郡莱瑟黑德英国应用光物理有限公司);IRTracer-100红外分光光度计(日本京都岛津);UH5300紫外分光光度计(日本东京日立有限公司);Bruker Avance Ⅲ 600 MHz和DRX-500 MHz核磁共振儀,(德国卡尔斯鲁厄布鲁克)Bruker Solari X质谱仪(德国卡尔斯鲁厄Bruker);安捷伦1260 Infinity II液相色谱仪(美国加利福尼亚州帕洛阿尔托安捷伦科技公司),Sephadex LH-20(瑞典乌普萨拉安发玛西亚生物技术公司),硅胶(200~300目;中国安徽良辰股份有限公司)。
1.1.2 菌株来源
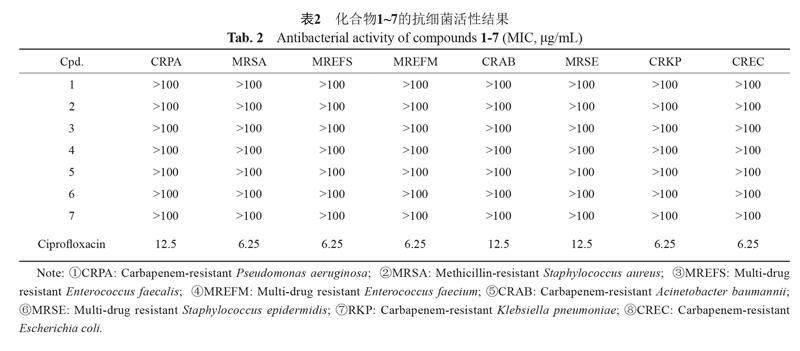
菌株MPT-009于2016年7月从采自中国重庆的红豆杉果实中分离出来,因其PDA固体培养物的甲醇提取物经初步抗菌活性筛选显示较强活性,通过内部转录间隔区(internal transcribed spacer region, ITS)序列进行比对,初步鉴定为木霉属真菌(Trichoderma sp.)。真菌标本(编号:MPT-009)保存于中南民族大学药学院。临床耐药细菌为:耐碳青霉烯铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa)、耐碳青霉烯鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii)、耐碳青霉烯大肠埃希菌(carbapenem-resistant Escherichia coli)、耐碳青霉烯肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae)、耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus)、多耐药性表皮葡萄球菌(multi-drug resistant Staphylococcus epidermidis)、耐多药粪肠球菌(multi-drug resistant Enterococcus faecalis)、多耐药性屎肠球菌(multi-drug resistant Enterococcus faecium)。植物病源真菌:马铃薯黄萎病菌(Verticillium dahliae Kleb)、水稻纹枯病菌(Rhizoctonia solani)、油菜菌核菌(Sclerotinia sclerotiorum)、棉花枯萎病菌(Fusarium oxysporum f. sp. vasinfectum)、草莓黑斑病菌(Alternaria fragriae)、玉米小斑病(Helminthosporium maydis)、苹果轮纹病菌(Botryospuaeria berengeriana)。活性测试菌种由陆军军事医科大学提供。
1.1.3 培养基
(1) 马铃薯葡萄糖培养基(Potato Dextrose Agar, PDA):新鲜去皮马铃薯200 g,葡萄糖20 g,琼脂15-20 g,去离子水1000 mL。
(2) 种子液培养基(高氏培养基):玉米浆2 g,KNO3 0.1 g,NaCl 0.05 g,K2HPO4 0.05 g,MgSO4·7H2O 0.05 g,FeSO4·7H2O 0.001g,去离子水1000 mL。
(3) 大米固体培养基:大米100 g,去离子水80 mL。
(4) LB培养基(细菌培养基):蛋白胨10 g,酵母提取物 5 g,NaCl 10 g,去离子水1000 mL。
(5) PDB培养基(真菌培养基):马铃薯浸粉 3 g,葡萄糖 20 g,去离子水 1000 mL。
1.2 方法
1.2.1 菌株发酵
将菌株MPT-009在28 ℃的马铃薯葡萄糖琼脂(PDA)培养基上培养5 d,将培养物切成小块并转移到含有300 mL高氏培养基的烧瓶(500 mL)中,
28 ℃,160 r/min摇床培养5 d获得种子液,然后接种到无菌的大米固体培养基中(200×500 mL锥形瓶,每瓶包含100 g大米和80 mL蒸馏水),于28 ℃静置培养40 d。
1.2.2 化合物分離纯化
发酵完成后,用两倍体积的甲醇提取发酵物,减压浓缩,然后用乙酸乙酯萃取3次,得到100 g粗提取物。使用二氯甲烷/甲醇作为流动相,以100:1到0:1(V/V)的梯度对乙酸乙酯提取物进行硅胶柱色谱分离,得到五个馏分(Fr.A~Fr.E)。
用石油醚/乙酸乙酯(5:1至1:1,V/V)进行硅胶柱分离,将组分B(7.2 g)进一步分离为3个亚组分(Fr.B1~Fr.B3)。使用Sephadex LH-20柱(二氯甲烷/甲醇,1:1,V/V)进一步纯化Fr.B2组分,然后通过半制备反相C18 HPLC(MeCN–H2O,55:45,V/V)纯化得到化合物7(4 mg,tR=44 min)。使用Sephadex LH-20柱(二氯甲烷/甲醇,1:1,V/V)进一步纯化Fr.B3,再通过半制备HPLC(MeOH–H2O,80:20,V/V)得到化合物4
(5 mg,tR=19 min)。C组分(20 g)通过硅胶柱进行分离,用二氯甲烷/甲醇(50:1至1:1,V/V)洗脱,获得五个亚组分(Fr.C1~Fr.C5)。依次采用Sephadex LH-20柱(二氯甲烷/甲醇,1:1,V/V)和硅胶柱(石油醚/乙酸乙酯,10:1至1:1)进一步分离Fr.C2亚组分,然后通过半制备HPLC(MeCN-H2O,65:35,V/V)得到化合物5(5 mg,tR=18 min)和6(5 mg,tR=20 min)。依次采用Sephadex LH-20柱(二氯甲烷/甲醇,1:1,V/V)和硅胶柱(石油醚/乙酸乙酯,10:1至1:1,V/V)进一步分离Fr.C3亚组分,然后用半制备HPLC(正己烷-异丙醇,70:30,V/V)得到化合物1(5 mg,tR=20 min)和化合物2(10 mg,tR =23 min)。将部分D(15 g)进行硅胶柱分离(二氯甲烷/甲醇,10:1,V/V)得到3个亚组分(Fr.D1~Fr.D3)。Fr.D2组分通过Sephadex LH-20柱(二氯甲烷/甲醇,1:1,V/V)和硅胶柱(石油醚/乙酸乙酯,5:1至1:1,V/V)分离,再采用半制备HPLC(MeOH-H2O,55:45,V/V)得到化合物3(7 mg,tR=28 min)。
1.2.3 抑菌活性测试
单体化合物抗真菌活性评价(表1):采用二倍稀释法评价单体化合物的抗植物病原真菌活性。具体步骤下:使用DMSO作为溶剂将酮康挫、待测单体化合物配置成浓度为10 μg/mL的样品。将抗菌活性所需的PDB培养基100 mL,分装至500mL锥形瓶中。高压蒸汽灭菌后晾凉备用。选取实验所需的7株植物病原真菌接种至PDB培养基中,28 ℃,160 r/min振摇培养48 h。在超净工作台中取100 mL PDB培养基然后加入1 mL真菌液稀释100倍。采用96孔板进行活性检测,设置空白(DMSO)、阳性对照(酮康挫)、待测样品、阴性对照(无菌水),每组平行设置3个重复。在96孔板的第一排加入198 μL稀释后的菌液,第二至八排中加入100 μL稀释后的菌液。第一排孔中分别加入DMSO、无菌水、样品和酮康唑各2 μL,移液枪抽吸混合均匀(此时第一排孔的样品与阳性对照的浓度均为100 μg/mL)后吸取100 μL液体加入到第二排,将其混合均匀后吸取100 μL液体加入到第三排,后面几排操作相同,最后一排孔中吸出100 mL混合液打入废液缸中,使每排样品终浓度依次为100 、50、25、12.5、6.25、3.12、1.56和0.78 μg/mL。将处理好的96孔板置于28 ℃的恒温培养箱中培养24 h,每隔
4 h观察1次,待阴性对照组长满真菌记录活性结果,将最后一排澄清的孔所对应的样品浓度定为该化合物的最小抑菌浓度,同时记录下阳性对照的最小抑菌浓度。将观察完结果的96孔板及所用实验器材进行灭菌后处理。
单体化合物抗细菌活性评价(表2):采用二倍稀释法评价单体化合物的抗临床耐药细菌活性。具体步骤如下:配制LB培养基将4 mL培养基分装到7支
12 mL试管中,高压蒸汽灭菌后晾凉备用。选取实验所需的7株临床耐药细菌,分别接种至已灭菌处理的LB培养基中,37 ℃,160 r/min振摇过夜培养约12 h,
待培养液浑浊且不沉淀,培养完成。使用DMSO溶液将阳性对照(环丙沙星)和待测单体化合物分别配置成浓度为10 μg/mL的溶液。在超净工作台中取100 mL LB培养基,然后加入试管中培养好的细菌液体100 μL,将其稀释1000倍。采用96孔板进行活性检测,设置阳性对照组(环丙沙星),阴性对照(无菌水)、空白(DMSO)、待测样品,每组设置3个平行。在96孔板的第一排加入198 μL稀释后的菌液,第二至八排中分别加入100 μL稀释后的菌液。第一排孔中分别加入DMSO、环丙沙星、待测样品、无菌水各2 μL,稀释操作同抗真菌活性实验。将处理好的96孔板置于37 ℃的恒温培养箱中培养12 h,每隔
2 h观察1次,待阴性对照组长满细菌,记录活性结果。将最后一排澄清的孔所对应的样品浓度定为该化合物的最小抑菌浓度,同时记录阳性对照的最小抑菌浓度。将观察完结果的96孔板及所用实验器材进行灭菌后处理。
2 结果与分析
2.1 结构鉴定
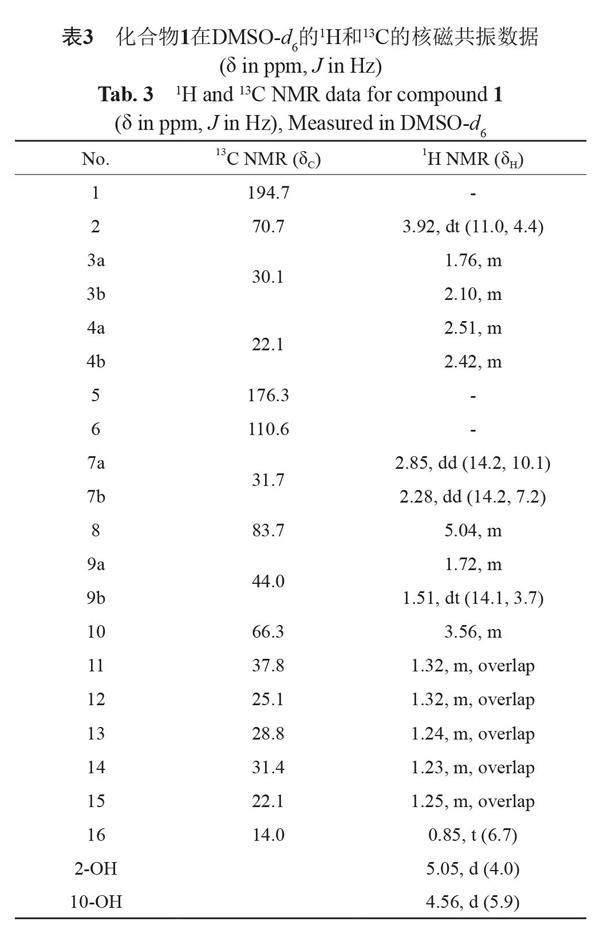
化合物1:黄色油状物,根据其HRESIMS数据(m/z 283.1903 [M+H]+;C16H25O4的计算值为283.1909),确定分子式为C16H24O4,具有5个不饱和度。红外光谱中在3393 cm-1处有一个羟基的宽吸收峰,在1616 cm-1处有一个强吸收峰,提示结构中存在α,β-不饱和羰基片段。1H和13C NMR并结合DEPT图谱(表3)显示:1个α,β-不饱和酮羰基碳(δC 194.7),2个sp2杂化碳(δC 176.3,110.6),3个氧化的sp3杂化亚甲基[δH 5.04 (1H,m),3.92(1H,m)和3.57(1H,m);δC 83.7,70.7和66.3],1个甲基[δH 0.85(3H,t,J=6.7 Hz);δC 14.0],以及九个sp3杂化的亚甲基信号。以上1D NMR数据与10-deacetylkoningiopisin D(2)高度相似。进一步分析化合物1的二维图谱,发现1H-1H COSY谱中显示两个自旋耦合系统H-2–H-4和H-7–H-16。同时,HMBC谱中观察到H-2与C-1、H-3与C-1/C-5、H-4与C-6、H-7与C-4/C-6以及H-8与C-5的相关信号(图1),确定其平面结构与2相同,如图2所示。
化合物1的立体结构通过耦合常数、NOESY相关信号和ECD计算确定。H-2(δH 3.92)与H-4a(δH 2.51)之间存在NOESY相关信号,且H-2与H-3a(δH 1.76)之间的耦合常数为11.0 Hz,说明H-2位于直立键上。H-8和H-10之间的NOESY相关信号表明这两个质子位于同侧。化合物1与2具有相同的平面结构,但在相同的溶剂中两者C-8,9,11的NMR数据存在明显差异(1:83.7,44.1,37.8;2:84.4,43.2,37.3),推测化合物1中C-8和C-10的立体构型与2不同。由此,化合物1的立体构型有4种可能的情况(1a-2R,8S,10S;1b-2R,8R,10R;1c-2S,8R,10R和1d-2S,8S,10S)。采用TDDFT理论在B3LYP/6-311++G(d,p)//B3LYP/6-31+G(d)水平对这4种不同構型在MeOH溶剂中的理论ECD图谱进行计算,如图3所示,1a构型的计算ECD曲线与实验数据基本一致,确定化合物1的绝对构型为2R,8S,10S。
化合物2:白色固体;ESI-MS m/z:283.2 [M+H]+;1H NMR (500 MHz, DMSO-d6 ) δH: 3.93 (1H, dd, J=11.1, 4.7 Hz, H-2), 1.76 (1H, dd, J=12.4, 5.3 Hz, H-3a), 2.10 (1H, m, H-3b), 2.51 (1H, m, H-4a), 2.39 (1H, m, H-4b), 2.78 (1H, m, H-7a), 2.39 (1H, m, H-7b), 4.93 (1H, d, J=2.0 Hz, H-8), 1.82 (1H, ddd, J=11.6, 9.7, 4.7 Hz, H-9a), 1.63 (1H, m, H-9b), 3.50 (1H, m, H-10), 1.36 (1H, m, H-11a), 1.23 (1H, m, H-11b), 1.23 (1H, m H-12), 1.23 (1H, m, H-13), 1.23 (1H, m, H-14), 1.23 (1H, m, H-15), 0.84 (3H, d, J=6.7 Hz, H-16), 13C NMR (125 MHz DMSO-d6) δC: 194.6 ( C-1), 70.6 (C-2), 31.3 (C-3), 22.0 (C-4), 176.4 (C-5), 110.5 (C-6), 37.2 (C-7), 84.4 (C-8), 43.2, (C-9), 66.4 (C-10), 30.1 (C-11), 25.0 (C-12), 28.8 (C-13), 31.3 (C-14), 21.9 (C-15), 13.9 (C-16)。以上数据与文献[17]对照基本一致,因此鉴定化合物2为10-deacetylkoningiopisin D。
化合物3:白色固体;ESI-MS m/z:285.2 [M+H]+; 1H NMR (500 MHz, CDCl3 ) δH:3.89 (1H, d, J=2.5 Hz, H-1), 1.57 (1H, m, H-2a), 1.85 (1H, m, H-2b), 1.85 (1H, m, H-3a), 1.96 (1H, m, H-3b), 3.61 (1H, dd, J=5.4, 11.6 Hz, H-4), 1.57 (1H, m, H-6), 1.72 (1H, m, H-8a), 2.11 (1H, m, H-8b), 1.55 (1H, m, H-8a), 2.25 (1H, ddd, J=13.0, 13.0, 3.5 Hz, H-8b), 4.32 (1H, d, J=2.1 Hz, H-9), 4.03 (1H, dt, J=7.0, 2.1, Hz, H-10), 1.50 (1H, m, H-11a), 1.60 (1H, m, H-11b), 1.30 (1H, m, H-12), 1.30 (1H, m, H-13), 1.30 (1H, m, H-14), 1.30 (1H, m, H-15), 0.90 (3H, d, J=9.0 Hz, H-16), 13C NMR (125 MHz CDCl3) δC: 72.8 (C-1), 30.7 (C-2), 25.2 (C-3), 69.9 (C-4), 109.2 (C-5), 41.3 (C-6), 20.5 (C-7), 27.2 (C-8), 79.1, (C-9), 79.5 (C-10), 35.2 (C-11), 25.6 (C-12), 29.1 (C-13), 31.7 (C-14), 22.6 (C-15), 14.1 (C-16)。以上数据与文献[18]对照基本一致,因此鉴定化合物3为koninginin A。
化合物4:白色固体;ESI-MS m/z:283.2 [M+Na]+; 1H NMR (500 MHz, CDCl3) δH:2.50 (1H, d, J=17.0 Hz, H-2a), 2.60 (1H, dd, J=12.5, 5.0 Hz, H-2b), 1.80 (1H, dd, J=5.5, 2.2 Hz, H-3a), 2.40 (1H, d, J=13.5 Hz, H-3b), 4.10 (1H, d, J=12.5 Hz, H-4), 2.00 (1H, m, H-7a), 2.10 (1H, m, H-7b), 1.70 (1H, dd, J=13.5, 10.5 Hz, H-8a), 2.00 (1H, d, J =2.0 Hz, H-8b), 3.80 (1H, d, J=5.5 Hz, H-9), 3.70 (1H, d, J=6.5 Hz, H-10), 1.60 (1H, m, H-11a), 1.70 (1H, m, H-11b), 1.30 (1H, m, H-12), 1.30 (1H, m, H-13), 1.30 (1H, m, H-14), 1.30 (1H, m, H-15), 0.90 (3H, d, J=6.5Hz, H-16), 13C NMR (125 MHz CDCl3) δC: 198.1 ( C-1), 27.1 (C-2), 29.0 (C-3), 71.0 (C-4), 171.3 (C-5), 109.1 (C-6), 17.6 (C-7), 22.7 (C-8), 80.8, (C-9), 73.2 (C-10), 32.8 (C-11), 25.4 (C-12), 29.2 (C-13), 31.7 (C-14), 22.6 (C-15), 14.0 (C-16)。以上数据与文献[19]对照基本一致,因此鉴定化合物4为koninginin B。
化合物5:白色固体;ESI-MS m/z:299.2 [M+ H]+; 1H NMR (500 MHz, CDCl3) δH:2.60 (1H, ddd, J=17.0, 5.6, 4.7 Hz, H-2), 2.30 (1H, m, H-2), 2.20 (1H, m, H-3), 4.49 (1H, q, J=4.8 Hz, H-4), 4.68 (1H, dd, J=1.0, 2.0 Hz, H-7), 1.60 (3H, m, H-8a), 2.00 (2H, m, H-8b), 4.11 (1H, ddd, 1H, J=12.1, 4.6, 2.2 Hz, H-9), 3.72 (1H, q, J=6.4 Hz, H-10), 1.60 (3H, m, H-11), 1.60 (3H, m, H-12),1.30 (1H, m, H-12), 1.30 (1H, m, H-13), 1.30 (1H, m, H-14), 1.30 (1H, m, H-15), 0.88 (t, 3H, J=6.8 Hz, H-16) 13C NMR (125 MHz CDCl3) δC: 195.8 ( C-1), 33.3 (C-2), 28.8 (C-3), 65.7 (C-4), 171.5 (C-5), 111.9 (C-6), 57.1 (C-7), 31.7 (C-8), 77.7, (C-9), 73.2 (C-10), 32.4 (C-11), 25.1 (C-12), 29.1 (C-13), 32.2 (C-14), 22.6 (C-15), 14.0 (C-16). 以上數据与文献[19]对照基本一致,因此鉴定化合物5为koninginin D。
化合物6:白色固体;ESI-MS m/z:283.2 [M+H]+; 1H NMR (500 MHz, CDCl3 ) δH:2.61 (1H, d, J=17.0 Hz, H-2), 2.45 (1H, m, H-3), 4.40 (1H, d, J=5.3 Hz, H-4), 2.00 (1H, m, , H-7), 2.10 (1H, m, H-7b), 1.70 (1H, dd, J=13.5, 10.5 Hz, H-8), 3.90 (1H, ddd, J=12.9, 5.1, 2.4 Hz, H-9), 3.65 (1H, d, J=2.9, 7.2 Hz, H-10), 1.65 (1H, m, H-11), 1.30 (1H, m, H-12), 1.30 (1H, m, H-13), 1.30 (1H, m, H-14), 1.30 (1H, m, H-15), 0.89 (3H, d, J=6.8 Hz, H-16), 13C NMR (125 MHz CDCl3) δc: 197.6 ( C-1), 33.3 (C-2), 29.0 (C-3), 65.9 (C-4), 169.3 (C-5), 111.4 (C-6), 17.6 (C-7), 22.8 (C-8), 81.3 (C-9), 73.4 (C-10), 32.7 (C-11), 25.1 (C-12), 29.3 (C-13), 31.8 (C-14), 22.6 (C-15), 14.1 (C-16). 以上数据与文献[19]对照基本一致,因此鉴定化合物6为koninginin E。
化合物7:白色固体;ESI-MS m/z:301.2 [M+H]+; 1H NMR (500 MHz, CDCl3 ) δH: 2.28 (1H, d, J=8.0 Hz, H-1), 2.90, (1H, m, H-4a),2.05, (1H, m, H-4b), 2.94 (1H, m, H-5), 1.90 (1H, dd, J=13.0, 6.5 Hz, H-7a), 1.30 (1H, dd, J=14.0, 6.5 Hz, H-7b), 1.40 (1H, t, J=13.6 Hz, H-8a), 2.45 (1H, m, H-8b), 2.57 (1H, d, J=16.0 Hz, H-12a), 2.45 (1H, m, H-12b), 2.49 (1H, m, H-14), 2.03 (1H, m, H-15a), 1.55 (1H, d, J=10.5 Hz, H-15b), 1.00 (3H, s, H-16), 0.99 (3H, s, H-17), 1.12 (3H, d, J=7.2 Hz, H-18), 1.52 (3H, s, H-19), 2.12 (3H, s, H-20), 13C NMR (125 MHz, CDCl3) δc: 40.1 ( C-1), 59.4 (C-2), 214.6 (C-3), 42.7 (C-4), 29.9 (C-5), 51.7 (C-6), 29.9, (C-7), 29.6 (C-8), 149.5 (C-9), 146.6 (C-10), 198.0 (C-11), 60.1 (C-12), 49.7 (C-13), 53.1 (C-14), 26.8 (C-15), 25.2 (C-16), 23.2 (C-17), 21.1 (C-18), 20.8 (C-19), 22.7 (C-20). 以上数据与文献[20]对照基本一致,因此鉴定化合物7为isoharziandione。
2.2 体外抗菌活性
对化合物进行抗临床耐药细菌活性测试,抗植物病原真菌活性结果(表1)显示1对油菜菌核菌具有较强的抑制作用,MIC值為12.5 μg/mL;对棉花枯萎病菌、草莓黑斑病菌、玉米小斑病菌显示中等强度的抑制活性,MIC值为25 μg/mL;对水稻纹枯病菌、马铃薯黄萎病菌、病菌显示较弱的抑制活性,MIC值为50 μg/mL。抗临床耐药性细菌活性结果显示化合物1~7对7种临床耐药性细菌均无明显活性(MIC>
100 μg/mL)(表2)。
3 结论与讨论
本研究从红豆杉来源木霉属真菌发酵产物中分离得到1个新化合物和6个已知化合物,包括聚酮和萜,丰富了木霉属真菌的次生代谢产物,说明植物内生真菌是新颖天然产物的重要资源库。化合物1对马铃薯黄萎病菌、水稻纹枯病菌、油菜菌核菌、棉花枯萎病菌、草莓黑斑病菌、玉米小斑病菌具有一定的抑菌活性,MIC值为12.5~50 μg/mL,进一步证实了木霉属真菌的代谢产物具有较好的抗植物病原真菌活性,是生物防治的潜力菌种。化合物1对油菜菌核菌的抑制作用较强(MIC值12.5 μg/mL),可在此基础上对该菌株进一步挖掘,通过优化发酵条件等对其次级代谢产物进行深入研究,以期获得更多天然抗菌活性化合物,为新型农药的研发提供基础。化合物1和2为差向异构体,C-10的立体构型不同,但是化合物1对多株植物病原真菌表现出抗菌活性,而化合物2对测试菌株均无活性,说明C-10为该类化合物抗菌活性的关键位点,为后续该类化合物的结构修饰提供指导。
参 考 文 献
Yang X L, Zhang J Z, Luo D Q. The taxonomy, biology and chemistry of the fungal Pestalotiopsis genus[J]. Nat Prod Rep, 2012, 29(6): 622-641.
Tan R X, Zou W X. Endophytes: A rich source of functional metabolites[J]. Nat Prod Rep, 2001, 18(4): 448-459.
刘媛媛, 闫芳, 张雪, 等. 荚果蕨植物内生真菌Penicillium sp. SYP-F-7610的抑菌活性次级代谢产物研究[J]. 中国抗生素杂志, 2022, 47(5): 501-506.
Li J Y, Strobel G A, Lobkovsky E, et al. Cryptocin, a potent tetramic acid antimycotic from the endophytic fungus Cryptosporiopsis cf. quercina[J]. J Org Lett, 2000, 2(6): 767-770.
Strobel G, Daisy B, Castillo U, et al. Natural products from endophytic microorganisms[J]. J Nat Prod, 2004, 67(2): 257-268.
Brotman Y, Kapuganti J G and Viterbo A. Trichoderma[J]. Current Biology, 2010, 20(9): 390-391.
Salvatore M M and Andolf A, Phytopathogenic fungi and toxici[J]. Toxins, 2021, 13(10): 689-672.
Doehlemann G, ?kmen B, Zhu W J, et al. Plant pathogenic fungi[J]. Microbiol Spectr, 2017, 5(1): FUNK-0023-2016.
Li L, Zhu X M, Lin F C, et al. Research on the molecular interaction mechanism between plants and pathogenic fungi[J]. Int J Mol Sci, 2020, 23(9): 4658-4673.
Knogge W. Fungal pathogenicity[J]. Curr Opin Plant Biol, 2021, 1(4): 324-328.
朱兆香, 庄文颖. 木霉属研究概况[J]. 菌物学报, 2014, 33(6): 1136-1153.
Vicente I, Baroncelli R, Hermosa R, et al. Role and genetic basis of specialised secondary metabolites in Trichoderma ecophysiology[J]. Fungal Biol Rev, 2021, 39: 83-99.
Zhang J L, Tang W L, Zhang X X,et al. Trichoderma: A treasure house of structurally diverse secondary metabolites with medicinal importance[J]. Front Microbiol, 2021,12: 723828-723849.
Khan R A A, Najeeb S, Hussain S, et al. Bioactive secondary metabolites from Trichoderma sp. against phytopathogenic fungi[J]. Microorganisms, 2020, 8(6): 817-839.
陈长锟, 吴婷, 何若男, 等. 海洋木霉属真菌次生代谢產物活性研究进展[J]. 海峡药学, 2020, 32(9):1-5.
韩长志. 植物病原拮抗菌木霉属真菌的研究进展[J]. 江苏农业学报, 2016, 32(4): 946-952.
Shi X S, Wang D J, Li X M, et al. Antimicrobial polyketides from Trichoderma koningiopsis QA-3, an endophytic fungus obtained from the medicinal plant Artemisia argyi[J]. RSC Adv, 2017, 7(81): 51335-51342.
Almassi F, Ghisalberti E L, Narbey M J, et al. New antibiotics from strains of Trichoderma harzianum[J]. J Nat Prod, 1991, 54(2): 396-402.
Parker S R, Cutler H G, Peter P R. Koninginin E: isolation of a biologically active natural product from Trichoderma koningii[J]. Biosci Biotech Biochem, 1995, 59(9): 1747-1749.
Hisalbe M L, Catherine R, White A H, et al. Harziandione, a new class of diterpene from Trichoderma harzianum[J]. J Nat Prod, 1992, 54(11): 1690-1694.
收稿日期:2022-11-16
基金项目:国家自然科学基金(No. 81872755);中南民族大学中央高校基本科研业务费专项资金项目(No. CZQ22010)
作者简介:黄泽雕,男,生于1995年,在读硕士研究生,研究方向为真菌次级代谢产物分离,E-mail: 18872783771@163.com
*通信作者,E-mail: yxl19830915@163.com
