呋喃妥因作用机制与临床应用研究进展及联合用药策略
2023-12-26李玮玮郭伟鸿张雪张昕阳朱伟伟薛云新王岱赵西林
李玮玮 郭伟鸿?张雪?张昕阳?朱伟伟?薛云新?王岱?赵西林
摘要:细菌耐药性的持续攀升及新型抗菌药物研发进展缓慢,使得临床抗感染治疗面临巨大挑战。早期抗生素呋喃妥因具有较强的抗菌活性和较低的临床耐药率,被重新考虑作为治疗尿路感染的一线药物,但其确切的分子作用靶点仍不清楚。本文回顾了呋喃妥因的抗菌和耐药机制、临床应用现状及联合用药研究,以期为呋喃妥因的合理使用及抗菌策略制定提供参考。
关键词:呋喃妥因,抗菌机制,临床应用,耐药机制,联合用药
中图分类号:R978.1文献标志码:A
Advancement of clinical application, molecular mechanism, and drug combination strategy of nitrofurantoin
Li Weiwei, Guo Weihong, Zhang Xue, Zhang Xinyang, Zhu Weiwei, Xue Yunxin, Wang Dai, and Zhao Xilin
(State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, School of Public Health, Xiamen University, Xiamen 361102)
Abstract Continuous surge of bacterial drug resistance in combination with slow progress in development of new antimicrobial drugs, poses a grave threat to effective anti-infective therapy in the clinic. The early antibiotic nitrofurantoin, due to its strong antimicrobial activity and low clinical resistance rate, has been reconsidered as a first-line drug for the treatment of urinary tract infections. However, the exact molecular target of nitrofurantoin action is still unclear. This article reviews the antimicrobial and drug resistance mechanism of nitrofurantoin, its current clinical application, and strategies of drug combination therapy involving this drug. Such work is expected to provide a reference for the rational use of nitrofurantoin and to guide the formulation of antimicrobial treatment strategies involving nitrofurantoin.
Key words Nitrofurantoin; Antimicrobial mechanism; Clinical application; Drug resistance mechanism; Combination drug therapy
病原菌耐藥性的不断发展使新型抗生素的开发变得刻不容缓。然而,全新药物的研发需要大量经费作为支撑,且抗生素开发的速度远远不及耐药菌的进化速度。现阶段,细菌耐药性的快速蔓延对整个公共卫生体系构成严重威胁,在全球范围内造成巨大的社会和经济负担,而老药的复兴有可能缓解当前药物开发的困境[1-2]。
呋喃妥因用于治疗和预防尿路感染已经有60多年的历史[3]。然而,由于其他抗生素(比如,β-内酰胺类和喹诺酮类等)的不断涌现,该药逐渐被忽视,直到近年来由于抗生素滥用导致耐药细菌的数量激增,才重新调整了呋喃妥因的用药地位[4]。2010年,美国感染病学会和欧洲微生物与感染病学会重新将呋喃妥因列为治疗急性非复杂性尿路感染的一线抗菌药物[5],然而人们对这种抗生素仍缺乏系统性的认识。因此,本文综述了呋喃妥因的化学及抗菌特性、临床应用及耐药率、耐药机制,同时还对其药物联合抗菌策略进行阐述,以期为呋喃妥因的合理使用提供依据与指导。
1 呋喃妥因药物性质
呋喃妥因属于合成型硝基类化合物,常见的硝基类化合物主要包括硝基呋喃类和硝基咪唑类化合物。1959年,甲硝唑首次合成并在抗原虫和抗滴虫中取得很好的效果,从此硝基咪唑类药物便开始逐渐发展[6]。整体而言,硝基咪唑类药物基本都具有抗结核、抗病毒、抗原虫功效;它们的作用方式主要是通过破坏病原体的DNA来发挥抗菌作用[6]。
比较常见的硝基呋喃类化合物主要包括3种(图1):(1)呋喃西林(nitrofurazone, NFZ)是一种含5-硝基呋喃的盐酸氨基脲[7],对各种泌尿道、生殖道感染的预防和治疗有明显效果,常用于局部感染的治疗和临床导尿管涂层,食品防腐剂中也有添加[8];(2)呋喃唑酮(furazolidone, FZ)是一种含2-恶唑烷酮的5-硝基呋喃[7],用于治疗细菌性腹泻,贾第虫病以及作为幽门螺杆菌感染进行组合治疗的一部分[9];(3)呋喃妥因(nitrofurantoin, NFT)是一种含有5-硝基呋喃的环酰胺,主要用于治疗非复杂性尿路感染(urinary tract infections, UTIs),且尿液中的酸性pH环境对呋喃妥因的抗菌活性有明显的增强作用[10]。
2 呋喃妥因抗菌机制
呋喃妥因由于具有多种抗菌机制而很早就受到了研究者们的关注[11]。根据报道,呋喃妥因的抗菌机制整体可以概括为:通过抑制细菌能量代谢中的生化过程而非特异性地影响细菌中蛋白质、DNA、RNA的正常合成[12],但确切的作用机制还有待深入探究。
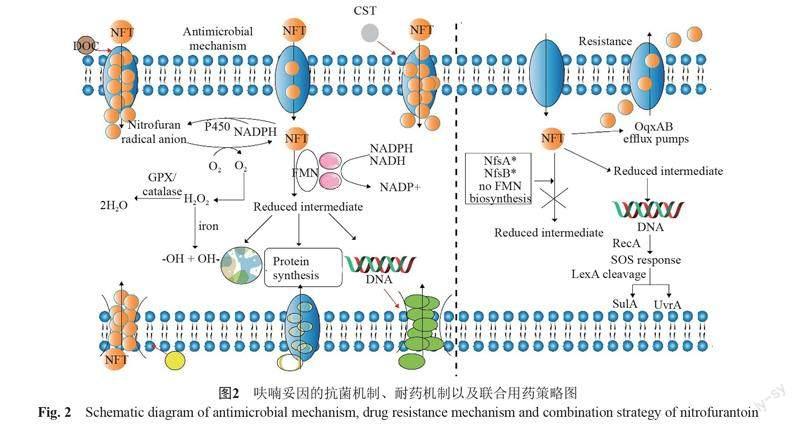
研究显示,细菌外在生存环境中氧气的改变会影响呋喃妥因的抗菌活性,有氧与厌氧条件下呋喃妥因发挥不同的作用[13],这主要是因为呋喃妥因需要硝基还原酶活化才能发挥抗菌作用,而细菌所含硝基还原酶的种类对氧气的敏感度有所不同。根据对氧气敏感度的差异,细菌中硝基还原酶大致可以分为两类:I型硝基还原酶(氧不敏感型)、II型硝基还原酶(氧敏感型)[14]。I型硝基还原酶中比较有代表性的是大肠埃希菌中的nfsA、nfsB基因产物,在对药物中的硝基进行电子还原时,前者(NfsA)只能依賴NADPH,而后者(NfsB)可以依赖两种辅酶NADPH和NADH[15]。呋喃妥因中的硝基在被还原的过程中速率较快,采用的是双电子还原机制(即乒乓机制),最后的还原产物有亚硝基、羟胺和氨基基团等[16],而起关键催化作用的通常为羟胺类化合物[17]。呋喃妥因在尿路感染治疗中经历此还原过程,一系列的还原产物会破坏三羧酸循环,抑制DNA、RNA和蛋白质的合成,从而杀死病原体[7]。II型硝基还原酶只能通过单电子还原机制来还原硝基[18]。
II型硝基还原酶通过依赖于NADPH的细胞色素P450还原酶启动呋喃妥因的单电子硝化还原过程,被还原的硝基会重新被氧化,如此反复,形成一种无效的氧化还原循环[19]。在此循环过程中,自发产生的超氧阴离子自由基在超氧化物歧化酶(superoxide dismutase,SOD)的作用下生成过氧化氢[20],当铁配合物存在时会与过氧化氢发生芬顿反应,产生活性更强的羟基自由基[21]。
研究还发现对呋喃妥因耐药的大肠埃希菌在被EDTA进行渗透作用后会导致呋喃妥因对其最小抑菌浓度(minimum inhibitory concentration, MIC)显著降低,而在这些菌株中,硝基还原酶活性极其微弱甚至可以忽略不计[22]。这些报道表明呋喃妥因存在不依赖于硝基还原而发挥抗菌作用的机制,然而,这种机制尚不完全清楚,具体作用过程还有待后续的进一步的探究[23]。
3 呋喃妥因的临床应用
尿路感染,即泌尿道致病性感染的统称[24],是医院和社区常见的一种疾病[25]。20世纪50年代,呋喃妥因由于其口服后吸收快,尿液中药物浓度高(其他组织部位药物浓度低)而主要被用于治疗尿路感染[4]。尿路感染中大肠埃希菌是最常见的病因,在病因中的占比超过半数,甚至高达75%~95%[26]。由于呋喃妥因对大肠埃希菌的活性高、安全性高且对肠道菌群的影响较小,因此是治疗无并发症尿路感染的首选药物,也是预防复发性尿路感染的首选药物[27]。
3.1 呋喃妥因具有良好的抗感染治疗效果
在一项对513名无并发症、下尿路感染的妇女进行的随机开放性试验中,用呋喃妥因和磷霉素治疗2~4周后的临床结果显示,当研究对象将呋喃妥因按照一天3次共100 mg的用药量连续服用5 d,治疗效果优于磷霉素单次服用3 g剂量的效果,结果具有统计学意义上的差异[28]。另外,在关于呋喃妥因对治疗成人单纯性尿路感染临床疗效的随机对照试验进行的系统回顾中发现,呋喃妥因在单纯性尿路感染的临床和细菌学方面的治疗效果至少与其它抗生素相当,且在一些研究中被证明效果优于复方磺胺甲恶唑[29]。
在比较呋喃妥因和环丙沙星疗效和安全性的研究中,研究人员将收集的60例尿路感染患者的尿样分为两组,分别用呋喃妥因和环丙沙星处理,药物干预前后均进行微生物实验室培养,发现呋喃妥因处理组的尿样中有5例(16.67%)在药物干预后出现微生物生长,环丙沙星处理组的尿样中有14例(46.67%)在药物干预后出现微生物生长,研究者认为这说明呋喃妥因比环丙沙星抗菌效果更好,细菌对环丙沙星的耐药率更高[30]。Spencer等[31]在对英国45个中心(包括538名患者)进行的一项研究中,将呋喃妥因与甲氧苄啶、复方磺胺甲恶唑疗效进行比较,证明呋喃妥因是治疗急性无并发症尿路感染的首选药物。
3.2 呋喃妥因引起较低的耐药率
在尿路感染的患者中,由于经常使用抗生素治疗,导致尿路细菌耐药率持续上升[32]。Konar等[33]在三级护理医院寻找引起无并发症尿路感染最常见的致病菌过程中对2557例临床疑似病例进行了研究,发现最常见的尿路病原体是大肠埃希菌,且大多数分离的大肠埃希菌对呋喃妥因敏感,对喹诺酮类药物耐药。此外,研究人员在呋喃妥因和甲氧苄氨嘧啶进行预防用药的治疗试验时发现随机接受呋喃妥因治疗的儿童中,7%的受试者携带对呋喃妥因耐药的细菌;相比之下,接受甲氧苄氨嘧啶治疗的受试者有47%携带对该药物耐药的细菌,耐药性大幅度增加[34]。
在欧洲,2000年的调查数据显示大肠埃希菌对呋喃妥因的耐药率很低,平均为1.2%,其中葡萄牙和西班牙的耐药率最高,分别为5.8%和4.2%,芬兰最低为0.5%,瑞典几乎没有发现大肠埃希菌对呋喃妥因的耐药性[35]。在亚洲,革兰阴性菌耐药性研究的热点地区-印度的一项监测研究表明,从医院分离出来的病原体对喹诺酮类和头孢菌素类抗生素的耐药率极高,分别为76%和77%[36];而对呋喃妥因的耐药率才9.4%[37]。
根据2010年中国CHINET耐药性监测网对临床尿液标本中9301株分离株的监测结果,革兰阴性菌占比超过70%,其中大肠埃希菌占主要部分,且大肠埃希菌对呋喃妥因的耐药率仅为7.9%,但对环丙沙星和复方磺胺甲恶唑的耐药率均超过了50%,说明呋喃妥因对大肠埃希菌的敏感率仍然较高[4]。
2016年报道的我国2005—2014年10年间CHINET所属的全国19家大型医院收集的临床分离株中关于大肠埃希菌的耐药监测数据显示,有将近50%的大肠埃希菌分离株来源于尿液标本,在这10年间,大肠埃希菌的检出率不断上升,且对常用抗生素的耐药率也在不断上升:对第二代和第三代头孢菌素、氟喹诺酮类药物、复方磺胺甲恶唑的耐药率均超过了50%,但对呋喃妥因的耐药率仍然保持较低水平,总耐药率为6.2%左右[38]。
由此可见,尿路细菌对呋喃妥因仍然保持着低耐药率。同时,已知呋喃妥因的作用靶点并不具有唯一性[7],因此不会与具有确切作用靶点部位的头孢类、喹诺酮类等药物产生交叉耐药,其对治疗尿路感染依然有效。
4 呋喃妥因耐药机制
呋喃妥因的抗菌作用靶点具有多样性,因此其耐药性相较于已知有确切靶点的药物发展缓慢[7]。根据目前临床及体外培养分离得到的少数呋喃妥因耐药菌株,其已知的耐药机制主要归纳为以下3方面:
4.1 基因突变
根据现有的报道,呋喃妥因耐药比较常见的原因是编码细菌硝基还原酶的基因发生突变。呋喃妥因的还原由硝基还原酶系统介导,进而产生药物活性。在大肠埃希菌中nfsA、nfsB两个基因编码氧不敏感的硝基还原酶,这两个基因突变的情况大部分是插入突变,也有少数的缺失和错义突变[39]。基因突变导致氨基酸发生相应的突变,硝基还原酶的合成受到影响,使呋喃妥因不能被还原为有活性的中间代谢产物而发挥抗菌作用,从而导致耐药性细菌的出现[40]。
除此之外,有研究表明ribE基因突变也与耐药有关。ribE基因是二氧四氢喋啶合酶亚基 [41],二氧四氢喋啶合酶是核黄素生产所必需的,核黄素本身不具有任何生物活性,但它是黄素腺嘌呤单核苷酸(FMN)的前体物质[42]。这种辅助因子大多是以非共价结合的方式来发挥作用,不仅与NfsA和NfsB结合,还可以与其它黄素蛋白结合,这些黄素蛋白涉及电子转移过程中的氧化还原反应,并催化代谢物的脱氢,氧化和去羟化反应[43],这使其成为细胞代谢中的必要成分[44]。ribE发生突变,FMN的合成受到影响后使两种硝基还原酶的还原过程也受到影响,从而影响药物发挥抗菌作用,这虽然未使细菌生存受到明显影响,但却加速了耐药的出现。
4.2 遗传毒性诱导的SOS反应
细菌在呋喃妥因的刺激下,會做出应激反应,诱导细胞内SOS反应的发生,该反应涉及在LexA和RecA蛋白控制下的一组基因的表达对DNA损伤的修复过程[45]。在呋喃妥因作用下,细菌DNA发生损伤,此时RecA蛋白激活,充当传感器的角色,与暴露的DNA单链一起形成核蛋白丝[46];与此同时,LexA发生自裂解,激活与SOS反应通路相关的基因表达,例如抑制细胞分裂的sulA、促进DNA修复的uvrA等基因[47]。呋喃妥因造成细菌DNA损伤后,在其修复过程中会保留适应抗生素胁迫而生存下来的菌株,从而促进细菌耐药性、致病性的获得[46]。
4.3 外排泵OqxAB
由质粒携带OqxAB外排泵介导耐药性,具有广泛的底物特异性,常见的包括喹乙醇、氯霉素、环丙沙星、萘啶酸、甲氧苄氨嘧啶和消毒剂(如苯扎溴铵、溴棕三甲铵和氯己定)[48]。在来自中国动物或肉类中的大肠埃希菌和沙门菌分离株中,OqxAB外排泵有较高的流行率[49]。但外排泵介导呋喃妥因耐药的研究较少,就目前已有的报道,可以大致概括为oqxAB基因的过表达量与呋喃妥因的耐药性增强相关[40,50]。
5 呋喃妥因的联合用药
药物的单独使用会加快细菌耐药性的出现,研究者提出联合用药方案来缓解这一问题[51]。解决呋喃妥因耐药现象出现的情况也不例外,也可选用联合用药。当前呋喃妥因的联合用药方向主要集中在与植物性化合物以及与其它常见的抗生素联用来预防、治疗尿路感染,药物的联合用药可以增强呋喃妥因对泌尿致病性大肠埃希菌的抗菌作用,很大程度上减少呋喃妥因抗性细菌的产生。
5.1 呋喃妥因与植物性化合物联用
泌尿致病性大肠埃希菌(uropathogenic Escherichia coli, UPEC)在复杂性和非复杂性尿路感染的病因中占绝大多数[52]。UPEC主要是通过对尿路上皮细胞的黏附、侵袭导致尿路感染的发生,所黏附上皮细胞表面细菌生物膜的形成,会促进UPEC在宿主尿道中的黏附定植,且生存能力强,在极端的pH环境变化下仍然可以生存并进行毒素分泌的过程[53]。有研究揭示多酚类化合物对抗生素有协同抗菌的作用[52]。多酚类化合物具有结构多样性、生物利用度高、无毒的特点,从而被广泛用于UTIs的治疗[52]。呋喃妥因与植物类化合物联用主要是通过植物化合物多酚类降低UPEC的黏附性来发挥抗生物膜活性从而增强呋喃妥因的抗菌效果。
A型原花青素(type A procyanidin, TAP)可以增强呋喃妥因的抗菌效果[52]。从肉桂皮中提取的TAP本身有抗病毒活性的功能[54]。UPEC发挥毒力作用主要与其形成的生物膜有关,而TAP三聚体用于治疗尿路感染时是通过附着在UPEC的P型菌毛上,从而阻止UPEC与尿路上皮细胞的黏附,导致黏附素下调,此时的TAP会通过发挥抗生物膜的活性而与呋喃妥因协同作用[55]。已有研究表明,呋喃妥因发挥抗UPEC的功效与pH有关[10]。在呋喃妥因治疗尿路感染的过程中,会出现抗生素耐药性随尿液pH变化的现象,而TAP与呋喃妥因在不同的pH条件下具有协同作用,且在pH值为5.8时,可对UPEC达到最大的抑制效果[52]。在两者联合作用时,TAP有助于增强呋喃妥因的抗菌活性,很大程度上减少耐药性的出现。
5.2 呋喃妥因与其它类抗生素联用
呋喃妥因除与TAP的联合用药外,与其它类抗生素联用增强抗菌效果也是一种重要的策略。万古霉素(vancomycin, Van)是一种古老的糖肽类抗生素,临床上用于治疗革兰阳性细菌感染[56]。而对于革兰阴性菌而言,由于其外膜是抗菌药物进入细菌内的一层屏障,大分子糖肽很难进入细菌细胞而起到杀伤细菌作用,因此无法有效抵抗革兰阴性菌的感染[57]。一项研究中表明,Van对脱氧胞苷脱氨酶缺陷的大肠埃希菌敏感性增加,这可能是因为极少量的Van进入细胞后产生一些DNA损伤,这种损伤可能与脱氧胞苷脱氨酶缺陷的细菌引起的DNA损伤起到联合作用,这预示着直接破坏细菌DNA的药物可能与Van表现出强烈的协同作用[56]。而呋喃妥因的作用机制之一是破坏细菌DNA的合成[12],在研究结果中显示当万古霉素与呋喃妥因联用时大肠埃希菌的生长率明显降低,显示较强的抗菌活性[56]。
有研究通过体外实验和体内实验证明,呋喃妥因与阿米卡星联合使用会对多重耐药的UPEC的抗菌有显著增强作用[58]。阿米卡星(amikacin, AMK)属于氨基糖苷类抗生素,其作用靶点是细菌的核糖体部位,是以引起错译和阻碍易位的方式来抑制蛋白质翻译过程[59]。而呋喃妥因的几种抗菌作用机制中,涉及对DNA和核糖体的损伤[60]。这两种药物作用机制中都有以核糖体作为靶点的作用方式,这可能是联合用药发挥作用的原因[58]。同时,呋喃妥因会刺激ROS的产生[61],从而促进氨基糖苷类抗生素进入细胞,发挥杀菌作用[62],这也是一种可能的机制。但两者联合用药疗效增强的具体机制尚不明确,有待进一步的探究。
Sabnis等[63]报道,黏菌素可以通过选择性地靶向细胞外膜的LPS从而破坏细胞外膜,但细菌具体的死亡机制尚不清楚。黏菌素(colistin, CST)与呋喃妥因联用时,其通过破坏细胞外膜而影响细胞膜的渗透性,增加细胞对呋喃妥因的摄取从而使呋喃妥因在胞内发挥更好的抗菌作用,达到联合用药的效果,增加抗菌活性[64]。
5.3 硝基呋喃类与脱氧胆酸钠联用
同时,也有关于脱氧胆酸钠增强硝基呋喃类药物抗菌效果的报道[65]。脱氧胆酸钠(sodium deoxychololate, DOC)是一种存在于胆汁中的化合物,它被分泌到十二指肠中,帮助脂质的消化,并具有抗菌作用[66]。然而,大肠埃希菌和沙门菌等革兰阴性菌通过使用多种外排泵、下调外膜孔蛋白和激活各种应激反应可对DOC产生高度耐药性[67]。在一项DOC与5-硝基呋喃类药物联合作用的研究中,发现DOC增强了呋喃唑酮的抗菌效果[65]。呋喃唑酮与DOC协同发挥作用主要是通过呋喃唑酮对外排泵的调节作用,即可能是通过呋喃唑酮介导的DOC在细胞内的积累来发挥两者的协同作用[65]。呋喃妥因屬于5-硝基呋喃中的一种,这侧面暗示了呋喃妥因与DOC联合作用的潜能。
此外,关于5-硝基呋喃与万古霉素、DOC三联协同作用的研究表明,5-硝基呋喃会破坏革兰阴性菌对Van和DOC的耐受性,从而扩大Van和DOC的应用范围,使其不止局限于革兰阳性细菌;同时,联合用药会显著减少药物单独作用时的剂量,避免一些副作用的出现[68]。
6 展望
本文从抗菌机制、耐药机制、临床应用、联合用药等方面对呋喃妥因进行了一个整体的介绍(图2),对呋喃妥因深入的了解,有助于巩固其用药地位,充分发挥老药的价值,使人们对旧抗生素关注度提高,应对新药开发缓慢的现状。但回顾有关呋喃妥因的研究,我们不难发现,呋喃妥因的抗菌机制仍需要进行深层次的探究,找到确切的作用靶点,这有助于防止耐药性的进化,延长药物的使用期限,为开发新型抗生素争取更多的时间。
此外,当呋喃妥因长期被用作非功能性纤维化治疗时,会对肝、肺造成损伤,如:肺纤维化、周围神经病变,肝细胞损伤以及血液病[19]。长期服用呋喃妥因,会使机体出现一些不良反应,包括消化道反应,头痛头晕等神经系统症状[4]。这暗示了呋喃妥因临床使用可能遇到的阻力,尽管耐药率较低。Sasame等[69]通过体内研究实验证明,当呋喃妥因与维生素C共同使用时,会减少呋喃妥因对肺组织的损伤,但这一机制尚不完全清楚,有待后续进一步的探究。积极寻找呋喃妥因的增效剂或优化呋喃妥因自身药效,进而减少使用药量,可能是降低临床副作用风险和减缓耐药性发展的有力策略。
参 考 文 献
Wolska K I, Grze? K, Kurek A. Synergy between novel antimicrobials and conventional antibiotics or bacteriocins[J]. Pol J Microbiol, 2012, 61(2): 95-104.
Gallant J A. Stringent control in Escherichia coli[J]. Annu Rev Genet, 1979,13: 393-415.
Zuma N H, Smit F J, Seldon R, et al. Single-step synthesis and in vitro anti-mycobacterial activity of novel nitrofurantoin analogues[J]. Bioorg Chem, 2020, 96: 103587.
陈冠容. 重新认识呋喃妥因在治疗非复杂性尿路感染中的重要地位[J]. 医药导报, 2017, 36(9): 962-966.
Gupta K, Hooton T M, Naber K G, et al. Infectious international clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the infectious diseases society of america and the european society for microbiology and infectious diseases[J]. Clin Infect Dis, 2011, 52(5): e103-e120
杜乐, 喻世静, 殷智鑫, 等. 硝基咪唑类药物的研究进展[J]. 化学世界, 2020, 61(2): 92-98.
Zuma N H, Aucamp J, N' Da D D. An update on derivatisation and repurposing of clinical nitrofuran drugs[J]. Eur J Pharm Sci, 2019, 140(C): 105092
Mason R P. Redox cycling of radical anion metabolites of toxic chemicals and drugs and the Marcus theory of electron transfer[J]. Environ Health Perspect, 1990, 87: 237-243.
Vass M, Hruska K, Franek M. Nitrofuran antibiotics: A review on the application, prohibition and residual analysis[J]. Vet Med-Czech, 2008, 53: 469-500.
Fransen F, Melchers M J B, Lagarde C M C, et al. Pharmacodynamics of nitrofurantoin at different pH levels against pathogens involved in urinary tract infections[J]. J Antimicrob Chemother, 2017, 72(12): 3366-3373.
Gardiner B J, Stewardson A J, Abbott I J, et al. Nitrofurantoin and fosfomycin for resistant urinary tract infections: Old drugs for emerging problems[J]. Aust Prescr, 2019, 42(1): 14-19.
Khamari B, Adak S, Chanakya P P, et al. Prediction of nitrofurantoin resistance among Enterobacteriaceae and mutational landscape of in vitro selected resistant Escherichia coli[J]. Res Microbiol, 2022, 173(1-2): 103889.
Roldán M D, Pérez-Reinado E, Castillo F, et al. Reduction of polynitroaromatic compounds: The bacterial nitroreductases[J]. FEMS Microbiol Rev, 2008, 32(3): 474-500.
白敬. 大腸杆菌硝基还原酶NfsB的分子改造及其催化特性[D]. 大连: 大连理工大学, 2015.
刘培瑜. 大肠杆菌硝基还原酶可控合成芳香羟胺的性质研究[D]. 大连: 大连理工大学, 2015.
Bryant C, McCalla D R, Leeksma M, et al. Type Ι nitroreductases of Escherichia coli[J]. Can J Microbiol, 1981, 27: 853-859.
Race P R, Lovering A L, Green R M, et al. Structural and mechanistic studies of Escherichia coli nitroreductase with the antibiotic nitrofurazone[J]. J Biol Chem, 2005, 280(14): 13256-13264.
Sternson L A, Chandrasakar R. Further evidence for nitrenium ion intermediacy in N-phenylhydroxylamine rearrangement to aminophenol[J]. J Org Chem, 1984, 49(22): 4295-4297.
Wang Y, Gray J P, Mishin V, et al. Role of cytochrome P450 reductase in nitrofurantoin-induced redox cycling and cytotoxicity[J]. Free Radic Biol Med, 2007, 44(6): 1169-1179.
Wardman P. Some reactions and properties of nitro radical-anions important in biology and medicine[J]. Environ Health Perspect, 1985, 64: 309-320.
Gutteridge J M. Superoxide dismutase inhibits the superoxide-driven fenton reaction at two different levels: Implications for a wider protective role[J]. FEBS Lett, 1985, 185(1): 19-23.
Obaseki-Ebor E E. Enhanced Escherichia coli susceptibility to nitrofurantoin by EDTA and multiple aminoglycoside antibiotics resistance mutation[J]. Chemotherapy, 1984, 30(2): 88-91.
McOsker C C, Fitzpatrick P M. Nitrofurantoin: Mechanism of action and implications for resistance development in common uropathogens[J]. J Antimicrob Chemother, 1994, 33: 23-30.
Tan C W, Chlebicki M P. Urinary tract infections in adults[J]. Singap Med J, 2016, 57(9): 485-490.
El-Wafa W M A, Abouwarda A M. In vitro assessment of the antibacterial effects of the combinations of fosfomycin, colistin, trimethoprim and nitrofurantoin against multi-drug-resistant Escherichia coli[J]. Lett Appl Microbiol, 2022, 74(3): 334-343.
Fazly Bazzaz B S, Fork S D, Ahmadi R, et al. Deep insights into urinary tract infections and effective natural remedies[J]. AFJU, 2021, 27(1): 1-13.
Gupta K, Hooton T M, Naber K G, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the infectious diseases society of America and the European society for microbiology and infectious diseases[J]. Clin Infect Dis, 2011, 52(5): e103-120.
Huttner A, Kowalczyk A, Turjeman A, et al. Effect of 5-day nitrofurantoin vs single-dose fosfomycin on clinical resolution of uncomplicated lower urinary tract infection in women: A randomized clinical trial[J]. JAMA, 2018, 319(17): 1781-1789.
Porreca A, D'Agostino D, Romagnoli D, et al. The clinical efficacy of nitrofurantoin for treating uncomplicated urinary tract infection in adults: A systematic review of randomized control trials[J]. Urol Int, 2021, 105(7-8): 531-540.
Rajneet K, Vijay K, Harjinder S, et al. Evaluation of efficacy and tolerability of nitrofurantoin versus ciprofloxacin in patients of urinary tract infection: A comparative study[J]. Ijbcp, 2017, 6(11): 2690-2690.
Spencer R C, Moseley D J, Greensmith M J. Nitrofurantoin modified release versus trimetfaoprim or co-trimoxazole in the treatment of uncomplicated urinary tract infection in general practice[J]. J Antimicrob Chemother, 1994, 33(Suppl A): 121-129.
Alam S, Rana K, Bhardwaj S, et al. Role of nitrofurantoin in the management of urinary tract infection-A systematic review[J]. J Evol Med Dent Sci, 2019, 8(50): 3805-3812.
Konar J, Ghosh R, Chatterjee S S, et al. Nitrofurantoin: The time tested choice in uncomplicated urinary tract infection[J]. J Evol Med Dent Sci, 2016, 5(34): 1872-1875.
Brendstrup L, Hjelt K, Petersen K E, et al. Nitrofurantoin versus trimethoprim prophylaxis in recurrent urinary tract infection in children. A randomized, double-blind study[J]. Acta Paediatr Scand, 1990, 79(12): 1225-1234.
Kahlmeter G. The ECO*SENS Project: A prospective, multinational, multicentre epidemiological survey of the prevalence and antimicrobial susceptibility of urinary tract pathogens-interim report[J]. J Antimicrob Chemother, 2000, 46(Supppl A): 15-22.
Bouchillon S, Hoban D J, Badal R, et al. Fluoroquinolone resistance among Gram-negative urinary tract pathogens: Global smart program results, 2009-2010[J]. Open Microbiol J, 2012, 6: 74-78.
Chavan R, Naphade B, Waykar B, et al. In vitro activity of fosfomycin and nitrofurantoin against contemporary enterobacterales pathogens isolated from indian tertiary care hospitals[J]. Microb Drug Resist, 2021, 27(5): 678-684.
沈繼录, 潘亚萍, 徐云宏, 等. 2005—2014年CHINET大肠埃希菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(2): 129-140.
Whiteway J, Koziarz P, Veall J, et al. Oxygen-insensitive nitroreductases: analysis of the roles of nfsA and nfsB in development of resistance to 5-nitrofuran derivatives in Escherichia coli[J]. J Bacteriol, 1998, 180(21): 5529-5539.
Osei Sekyere J. Genomic insights into nitrofurantoin resistance mechanisms and epidemiology in clinical Enterobacteriaceae[J]. Future Sci OA, 2018, 4(5): FSO293.
M?rtl S, Fischer M, Richter G, et al. Biosynthesis of riboflavin. Lumazine synthase of Escherichia coli[J]. J Biol Chem, 1996, 271(52): 33201-33207.
Vervoort J, Xavier B B, Stewardson A, et al. An in vitro deletion in ribE encoding lumazine synthase contributes to nitrofurantoin resistance in Escherichia coli[J]. Antimicrob Agents Chemother, 2014, 58(12): 7225-7233.
Fraaije M W, Mattevi A. Flavoenzymes: Diverse catalysts with recurrent features[J]. Trends Biochem Sci, 2000, 25(3): 126-132.
Vogl C, Grill S, Schilling O, et al. Characterization of riboflavin (vitamin B2) transport proteins from Bacillus subtilis and Corynebacterium glutamicum[J]. J Bacteriol, 2007, 189(20): 7367-7375.
Erill I, Campoy S, Barbé J. Aeons of distress: An evolutionary perspective on the bacterial SOS response[J]. FEMS Microbiol Rev, 2007, 31(6): 637-656.
Mo C Y, Manning S A, Roggiani M, et al. Systematically altering bacterial SOS activity under stress reveals therapeutic strategies for potentiating antibiotics[J]. mSphere, 2016, 1(4): e00163-00116.
Dos Santos C, Dos Santos L S, Franco O L. Fosfomycin and nitrofurantoin: Classic antibiotics and perspectives[J]. J Antibiot (Tokyo), 2021, 74(9): 547-558.
Hansen L H, Jensen L B, S?rensen H I, et al. Substrate specificity of the OqxAB multidrug resistance pump in Escherichia coli and selected enteric bacteria[J]. J Antimicrob Chemother, 2007, 60(1): 145-147.
He T, Wang Y, Qian M, et al. Mequindox resistance and in vitro efficacy in animal-derived Escherichia coli strains[J]. Vet Microbiol, 2015, 177(3-4): 341-346.
Ho P L, Ng K Y, Lo W U, et al. Plasmid-mediated OqxAB is an important mechanism for nitrofurantoin resistance in Escherichia coli[J]. Antimicrob Agents Chemother, 2016, 60(1): 537-543.
Wolska K I, Grzes K, KuRek A. Synergy between novel antimicrobials and conventional antibiotics or bacteriocins[J]. Pol J Microbiol, 2012, 61: 95-104.
Vasudevan S, Thamil Selvan G, Bhaskaran S, et al. Reciprocal cooperation of type a procyanidin and nitrofurantoin against multi-drug resistant (MDR) UPEC: A pH-dependent study[J]. Front Cell Infect Microbiol, 2020, 10: 421.
Flores-Mireles A L, Walker J N, Caparon M, et al. Urinary tract infections: Epidemiology, mechanisms of infection and treatment options[J]. Nat Rev Microbiol, 2015, 13(5): 269-284.
Fauvelle C, Lambotin M, Heydmann L, et al. A cinnamon-derived procyanidin type A compound inhibits hepatitis C virus cell entry[J]. Hepatol Int, 2017, 11(5): 440-445.
Foo L Y, Lu Y, Howell A B, et al. A-type proanthocyanidin trimers from cranberry that inhibit adherence of uropathogenic P-fimbriated Escherichia coli[J]. J Nat Prod, 2000, 63(9): 1225-1228.
Zhou A, Kang T M, Yuan J, et al. Synergistic interactions of vancomycin with different antibiotics against Escherichia coli: Trimethoprim and nitrofurantoin display strong synergies with vancomycin against wild-type E. coli[J]. Antimicrob Agents Chemother, 2015, 59(1): 276-281.
Nikaido H. Outer membrane barrier as a mechanism of antimicrobial resistance[J]. Antimicrob Agents Chemother, 1989, 33(11): 1831-1836.
Zhong Z X, Cui Z H, Li X J, et al. Nitrofurantoin combined with amikacin: A promising alternative strategy for combating MDR uropathogenic Escherichia coli[J]. Front Cell Infect Microbiol, 2020, 10: 608547.
Allison K R, Brynildsen M P, Collins J J. Metabolite-enabled eradication of bacterial persisters by aminoglycosides[J]. Nature, 2011, 473(7346): 216-220.
Huttner A, Verhaegh E M, Harbarth S, et al. Nitrofurantoin revisited: A systematic review and meta-analysis of controlled trials[J]. J Antimicrob Chemother, 2015, 70(9): 2456-2464.
Garcia Martinez P, Winston G W, Metash-Dickey C, et al. Nitrofurantoin-stimulated reactive oxygen species production and genotoxicity in digestive gland microsomes and cytosol of the common mussel (Mytilus edulis L.) [J]. Toxicol Appl Pharmacol, 1995,131(2): 332-341.
Ezraty B, Vergnes A, Banzhaf M, et al. Fe-S cluster biosynthesis controls uptake of aminoglycosides in a ROS-less death pathway[J]. Science, 2013, 340(6140): 1583-1587.
Sabnis A, Hagart K L, Kl?ckner A, et al. Colistin kills bacteria by targeting lipopolysaccharide in the cytoplasmic membrane[J]. Elife, 2021, 10: e65836.
Bhosle A, Datey A, Chandrasekharan G, et al. A strategic target rescues trimethoprim sensitivity in Escherichia coli[J]. iScience, 2020, 23(4): 100986.
Le V V H, Olivera C, Spagnuolo J, et al. In vitro synergy between sodium deoxycholate and furazolidone against enterobacteria[J]. BMC Microbiol, 2020, 20(1): 5.
Begley M, Gahan C G, Hill C. The interaction between bacteria and bile[J]. FEMS Microbiol Rev, 2005, 29(4): 625-651.
Sistrunk J R, Nickerson K P, Chanin R B, et al. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection[J]. Clin Microbiol Rev, 2016, 29(4): 819-836.
Olivera C, Le V V H, Davenport C, et al. In vitro synergy of 5-nitrofurans, vancomycin and sodium deoxycholate against Gram-negative pathogens[J]. J Med Microbiol, 2021, 70(3): 001304.
Sasame H A, Boyd M R. Superoxide and hydrogen peroxide production and NADPH oxidation stimulated by nitrofurantoin in lung microsomes: Possible implications for toxicity[J]. Life Sci, 1979, 24(12): 1091-1096.
收稿日期:2022-11-01
基金項目:国家自然科学基金(No. 81971905;No. 82172316)
作者简介:李玮玮,女,生于1997年,在读硕士研究生,主要研究方向为公共卫生,E-mail: 2454313768@qq.com
*通信作者,E-mail: zhaox5@xmu.edu.cn
