老鼠簕内生真菌及其次生代谢产物研究进展
2023-12-26严石焕刘妍颖杨春霞庞秋娟朱丹
严石焕 刘妍颖 杨春霞 庞秋娟 朱丹

摘要:老鼠簕是一种药用红树植物,具有抗炎、抗肿瘤、抗氧化和保肝等药理作用,然而其资源匮乏,发展与应用受到限制。已有研究表明,内生真菌可与宿主植物产生相似或相同的次生代谢产物,利用其次生代谢产物发现药理活性分子或先导化合物是解决药用植物资源匮乏问题的重要举措之一。本文系统地总结了过去20年老鼠簕内生真菌的国内外研究文献,从内生真菌分类及其次级代谢产物的化学成分与药理活性方面进行综述,旨在为老鼠簕内生真菌进一步开发和利用提供参考。
关键词:老鼠簕;内生真菌;次生代谢产物
中图分类号:R978.1文献标志码:A
Advances in endophytic fungi and its secondary metabolites from
Acanthus ilicifolius L.
Yan Shihuan1, Liu Yanying1,2, Yang Chunxia1, Pang Qiujuan1, and Zhu Dan1,2
(1 Pharmaceutical College, Guangxi Medical University, Nanning 530021;
2 Guangxi Key Laboratory of Bioactive Molecules Research and Evaluation, Nanning 530021)
Abstract Acanthus ilicifolius L. (A. ilicifolius) is a mangrove medicinal plant and used in Chinese folk medicine as an anti-inflammatory, anti-tumor, antioxidant, and liver protective medicine. However, its development and application are limited due to its scarce resources. In recent years, more and more studies have shown that endophytic fungi were able to produce the same products with their hosts, and the discovery of pharmacologically active molecules or lead compounds from endophytic fungi is one of the important measures to solve the shortage of medicinal plant resources. This review covers the literature published in the past 20 years and summarizes the classification of endophytic fungi of A. ilicifolius, as well as their chemical constituents and biological activities, which should be useful for the further development of A. ilicifolius derived fungi, especially in the development of new drugs and therapeutics for various diseases.
Key words Acanthus ilicifolius L.; Endophytic fungi; Secondary metabolites
紅树植物老鼠簕(Acanthus ilicifolius L.)系爵床科老鼠簕属植物,收录于《全国中草药汇编》,是广西沿海地区京族的常用药,其全株或根茎入药,具有清热解毒、消肿散结、止咳平喘之功效,主要用于治疗急慢性肝炎、淋巴结肿大、肝脾肿大、胃痛、咳嗽和哮喘等疾病[1],其主要含生物碱、甾醇、黄酮、皂苷等化学成分,具有抗肝炎、抗肿瘤、抗氧化和抑菌等方面药理作用[2]。随着对老鼠簕的开发利用增加,其资源逐渐减少[3-4],不少学者已经把目光转向了老鼠簕内生真菌。目前,关于老鼠簕的研究主要集中在研究老鼠簕植物的化学成分和药理作用等方面,关于其内生真菌的研究和整理不多,为了今后更好开发利用这一民族药,本文对过去20年来国内外有关老鼠簕内生真菌类别、次生代谢产物的化学成分及其药理活性等方面内容进行系统总结,以期为老鼠簕内生真菌的进一步研究提供参考。
1 老鼠簕内生真菌类别
据文献报道目前已从老鼠簕的根部、叶片、果实等部分分离鉴定了19个属别的老鼠簕内生真菌(表1),即:Alternaria、Aspergillus、Aureobasidium、 Bispora、Cephalosporins、Cylindrocarpon、 Dactylaria、Epicoccum、Fusarium、Gloeosporium、 Lasiodiplodia、Penicillium、Phoma、Phomopsis、 Phyllosticta、Talaromyces、Trichosporon、Zalerion、 Zygosporium。
2 老鼠簕内生真菌次级代谢产物
在过去的20年,学者们从老鼠簕内生真菌共分离得到195个次生代谢产物,按照化学结构分类,有生物碱、甾醇、简单芳香类化合物、杂萜、醌、苯并吡喃酮、苯并呋喃酮、大环内酯、毛色二菌素、橘霉素衍生物、二苯醚衍生物、核苷以及其它化合物。
2.1 生物碱
在老鼠簕内生真菌发酵物中发现的生物碱数量最多,共有37个,结构类型包括吲哚类(1~10)、哌啶类(11~14)、喹啉类(15~17)、喹唑酮类(18~22)、吡咯类(23~32)、咪唑类(33~34)和有机胺类(35~37),结构见图1,它们具有细胞毒性、殺虫和抑菌等生物活性。
化合物1~4由陈森华等[22]分离自Penicillium sp. ZJ-WB1,体外实验结果表明,4个化合物均对人乳腺癌细胞有良好的细胞毒活性。化合物5~9分别由Lin[7]和王艳磊[15]从Aspergillus sp. W-6、Aspergillus sp. 9 Hu次级代谢产物中获得,其中化合物5和6对人肺癌细胞A549的增长具有抑制作用。化合物10来自Penicillium sp. GXIMD 03101的代谢物[30]。Wang等[6]从Trichoderma harzianum的代谢物中获得化合物10和化合物36~37。化合物11~13由Shao等[24]从Penicillium sp.次生代谢产物获得,化合物14由Ding等[31]从Phomopsis sp. HNY29-2B次生代谢产物获取,其中化合物11经3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide(MTT)实验表明对人高转移肺癌细胞95-D和人肝癌细胞HepG2具有细胞毒活性,化合物12对小菜蛾的杀虫作用明显。陈森华等[22]从Penicillium sp. ZJ-WB1中分离得到3个喹啉类生物碱(15~17),MTT实验显示对人乳腺癌细胞生长没有抑制作用。化合物18~22为喹唑酮类生物碱[16,22,27],它们均无细胞毒活性。顾谦群课题组从Aspergillus sp. W-6和Aspergillus flavipes ALI8发现10个吡咯类生物碱(23~32),其中化合物26和32对人肺癌细胞A549有较强的细胞毒活性[7,14]。化合物33由夏丽娟从Penicillium aurantiogriseum 299发酵物获得[18],化合物34~35分别由王艳磊[15]、郝丽丽[16]从两株Aspergillus sp.的代谢物中获得。
2.2 甾醇
文献已报道从老鼠簕内生真菌中分离得到的甾醇有10个(38~47),结构见图2。化合物38~46分别由王宾[9]等、王艳磊[15]、郝丽丽[16]和谭玉莹等[30]分离得到。Liu等[23]从Penicillium sp.发现一个抗肿瘤活性较好的甾醇物质(化合物47),MTT实验结果显示其作用于人胶质瘤细胞U251、人脑多型胶质母细胞BT-325、人胶质瘤细胞SHG-44的半抑制浓度(half maximal inhibitory concentration,IC50)均小于5 ?mol/L。
2.3 简单芳香类化合物
在老鼠簕内生真菌代谢物获得的简单芳香类化合物有18个(48~65),结构见图3。孙世伟等[8]从Aspergillus terreus W-8的代谢产物中分离得到的3-propylcatechol(48),MTT实验结果显示50 ?mol/L的化合物48对人肺癌细胞A549、人宫颈癌细胞HeLa、人类红白血病细胞K562有中等强度的细胞毒性作用。方平等[28]、Guo[29]分别从Penicillium sp.的代谢产物中分离出已知化合物49~51,王艳磊[15]、郝丽丽[16]分别从Aspergillus sp.中分离出已知化合物52~54。Shao等[34]从老鼠簕内生真菌B60代谢产物中分离出5个简单芳香类化合物(55~59),化合物55显示出α-葡萄糖苷酶抑制活性。Wang等[6]从Aspergillus candidus中获得化合物terphenyllin(60),MTT实验结果显示化合物60对人宫颈癌细胞HeLa具有微弱的细胞毒性作用,IC50值为19.0 ?mol/L。蔡瑾等[33]从Talaromyces flavus TGGP35的代谢物中获得化合物61~65。
2.4 杂萜
在老鼠簕内生真菌中发现的杂萜化合物有22个(66~87),结构见图4。化合物66~77分别由王宾[9]、Bai[10]、王艳磊[15]和郝丽丽[16]从Aspergillus sp.的代谢产物中获得,其中化合物66~70为新发现的杂萜化合物,12个化合物生物活性尚待研究。此外,方平等[28]从Penicillium aurantiogriseum 299中分离得到新的杂萜化合物78。孙世伟等[8]对一株具有抑制小鼠P388白血病细胞活性的菌株Aspergillus terreus W-8进行液体培养,从其代谢产物中得到4个杂萜化合物(79~82),其中terrein(82)对人肺癌细胞A549、人宫颈癌细胞HeLa、人红白血病细胞K562有明显的细胞毒性作用。刘永宏等[11]在Aspergillus flavipes AIL8的代谢物发现5个杂萜化合物(83~87),其中flavipesins A(83)对金黄色葡萄球菌和枯草芽胞杆菌具有抑制作用。
2.5 醌
迄今为止,从老鼠簕内生真菌分离得到20个醌类化合物(88~107),见图5。郝丽丽[16]和Jin[25]等分别从Aspergillus sp. GXNU-A9和Penicillium sp的代谢物中分离得到两个蒽醌化合物(88~89),其中化合物88表现出抗乙肝病毒活性。化合物89~91、105~107来自Penicillium sp. GXIMD 03101的次生代谢产物[30],其中化合物105对胰腺癌细胞显示出较好的细胞毒活性,浓度为10 μmol/L时,对胰腺癌细胞的抑制率为75.6%。蔡瑾等[33]从Talaromyces flavus TGGP35的代谢物中获得化合物92~93。化合物94~104来自Penicillium sp.、Phomopsis sp. 、Aspergillus sp.的代谢物[16,24-25,29,31],化合物94~95、97~101均为新发现的醌类化合物。
2.6 苯并吡喃酮
在老鼠簕内生真菌代谢产物中得到的苯并吡喃酮化合物有22个(108~129),见图6。Liu等[23]从Penicillium sp.发酵产物得到 (2R, 3S)-pinobanksin-3-cinnamat(108),发现其对皮质酮损伤的大鼠肾上腺髓质嗜铬细胞瘤PC12细胞表现出有效的神经保护作用。Guo等[29]从Penicillium sp.发酵产物得到penicitol B(109),其作用于人宫颈癌细胞HeLa、人肝癌细胞BEL-7402、人胚胎肾细胞HEK -293、人结肠癌细胞HCT-116、人肺癌细胞A549的IC50值分别为3.4、7.0、6.4、3.5、9.6 μmol/L,表现出明显的抗肿瘤活性。化合物110~113源自一株Aspergillus sp.的代谢物[16],其中化合物111对炭疽杆菌有明显的抑制作用,化合物112对枯草芽胞杆菌作用显著。化合物114~125[12,16,20,29]从Penicillium sp.、Epicoccum nigrum、Aspergillus sp.的发酵产物分离得到,其中化合物114对人宫颈癌细胞HeLa、人肺癌细胞A549有较好的生长抑制作用,化合物116~117对人乳腺癌MDA-MB-435细胞具有细胞毒活性。化合物126~129分别由Wang[6]、Cao[35]和蔡瑾等[33]从Trichoderma harzianum、Penicillium sp. 和Talaromyces flavus TGGP35的代谢物中获得。
2.7 苯并呋喃酮
目前从老鼠簕内生真菌代谢物中得到的苯并呋喃酮化合物29个(130~158),见图7。Epicoccum nigrum SCNU-F0002是产生苯并呋喃酮化合物的优势菌株,Yan[19,20,36]等采用小麦固体培养和大米固体培养的方式获得了20个苯并呋喃酮化合物(130~149),体外活性结果显示,化合物131~135具有α-葡萄糖苷酶抑制活性,化合物132对枯草芽胞杆菌、大肠埃希菌、金黄色葡萄球菌有抑制活性,化合物142~145具有清除DPPH自由基的抗氧化活性,化合物141~142对环氧化酶COX-2具有抑制作用。王艳磊[15]和郝丽丽[16]等采取大米固体培养基培养方式,从Aspergillus sp.的次生代谢产物中分离得8个苯并呋喃化合物(150~158),其中化合物150~152是首次从Aspergillus sp.获得。
2.8 大环内酯
从老鼠簕内生真菌次级代谢产物获取的大环内酯化合物有2个(159~160),见图8。2015年王艳磊[15]从Aspergillus sp. 9Hu中分离得到化合物brefeldin A(159),通过肉汤稀释法检测到brefeldin A对大肠埃希菌、枯草芽胞杆菌的最低抑菌浓度(minimum inhibitory concentration, MIC)分别是0.1和0.2 μmol/mL。2022年,Wang等[6]从Penicillium sp.中也分离得到化合物brefeldin A(159)。Asperlide A(160)则来自郝丽丽[16]发现的Aspergillus sp. GXNU-A9,抗炎活性筛选结果表明asperlide A不能抑制NO的释放,无抗炎活性。
2.9 毛色二孢菌素
目前从老鼠簕内生真菌Lasiodiplodia sp.和Aspergillus sp.代谢物获得的毛色二孢菌素有10个(161~170),见图9。Chen等[21]从Lasiodiplodia sp. ZJ-HQ1的大米培养产物共得到9个毛色二孢菌素化合物(161~169),其中化合物161~163为新化合物,与阿卡波糖相比,化合物161~167都表现出较强的α-葡萄糖苷酶抑制活性。S-curvularin(170)来自Aspergillus sp. GXNU-A9的代谢产物[16]。
2.10 橘霉素衍生物
目前,從老鼠簕内生真菌代谢物分离出橘霉素衍生物有6个(171~176),见图10。化合物171~173由Yan等[20]分离自Epicoccum nigrum的代谢物,其生物合成途径与聚酮途径相关,抑菌实验显示化合物173对枯草芽胞杆菌、大肠埃希菌、金黄色葡萄球菌有较好的抑制作用。化合物174~176由Guo等[29]分离自Penicillium chrysogenum的代谢物,其中新橘霉素化合物penicitol A(174)对人宫颈癌细胞HeLa、人肝癌细胞BEL-7402、人结肠癌细胞HCT-116、人肺癌细胞A549、人胚胎肾细胞HEK-293具有很强的细胞毒性作用。
2.11 二苯醚衍生物
目前从老鼠簕内生真菌代谢物中得到的二苯醚衍生物有10个(177~186),结构见图11。化合物177~179分别由刘永宏课题组[9]、高晓霞课题组[37]、龙玉华课题组[19]分离获得,其中化合物178对人乳腺癌细胞MDA-MB-231有生长抑制活性。此外,Cai等[32]利用多种色谱技术分离得到化合物180~186,其中化合物181、183、184表现出α-葡萄糖苷酶抑制活性,化合物181还对枯草芽胞杆菌有抑制作用。
2.12 核苷类
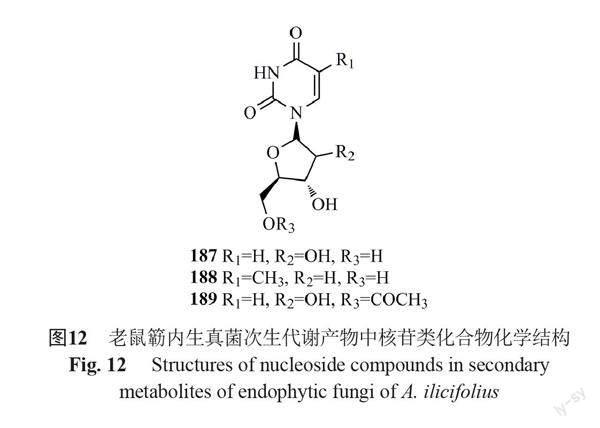
目前,从老鼠簕内生真菌代谢物中得到的核苷类化合物有3个(187~189),结构见图12。2021年,谭玉莹等[30]从红树老鼠簕来源内生青霉Penicillium sp. GXIMD 03101的代谢产物中分离获得3个核苷类化合物,分别为uridine(187),2'-deoxythymidine(188)和5'-O-acetyluridine(189)。
2.13 其它
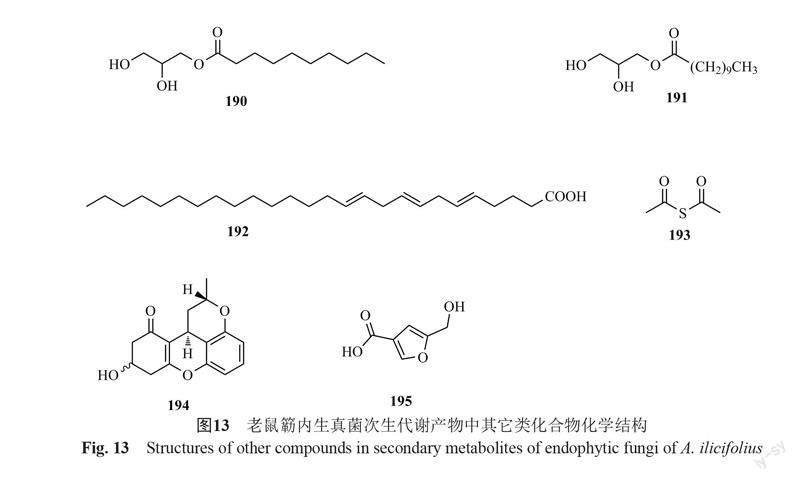
王宾等[9]从老鼠簕内生真菌中分离得到一癸酸甘油酯(190),王艳磊[15]分离得到十一烷酸甘油酯(191),郝丽丽[16]分离得到n-hexacos-5,8,11-trienoic acid(192)、硫代乙酸酐(193),Wang等[6]从Aspergillus flavus中获得carboxylic acid(194),Cao等[35]分离得到对人胰腺癌细胞SW1990具有微弱毒性的化合物penicixanthene E(195),见图13。
3 结语
自Stierle等[38]发现红豆杉内生真菌可产生抗癌药物紫杉醇后,由内生真菌次生代谢产物挖掘潜在的药理活性分子一直是药物开发研究领域的热点课题。由于内生真菌具备代谢周期易调控、代谢周期快、培养价格低廉等特点,因此内生真菌相关研究越来越受到医药行业的关注[39]。
红树植物老鼠簕民间药用历史悠久,具有多种药理活性,其来源的内生真菌有较大的开发利用价值,本文在刘爱荣等[5,40-41]的综述工作基础上,就老鼠簕内生真菌类别及其次级代谢产物化学成分和药理作用进行较为全面的总结。目前,老鼠簕内生真菌相关研究主要集中在Aspergillus sp.和Penicillium sp.真菌,从内生真菌次生代谢产物获得的化合物以生物碱、甾醇等类型为主,与宿主植物老鼠簕的主要化学成分一致[42]。在药理活性方面,在老鼠簕内生真菌中发现的部分化合物具有抗菌、抗病毒、抗氧化及抗肿瘤等活性,其中抗菌、抗病毒活性与老鼠簕传统的清热解毒功效有对应关系,而与消肿散结和止咳平喘等功效相关的抗炎等活性尚未有报道,还有待进一步的研究。
综上所述,本文总结的老鼠簕内生真菌次生代谢产物不仅具有丰富的结构多样性,而且在抗菌、抗肿瘤等药物开发方面具有巨大潜力,然而目前报道的药理活性菌株及其药理活性分子数量少,次生代谢产物的药理作用机制尚未进行系统研究。随着高通量筛选、组合化学、分子生物学等技术的不断发展,后续可在优化内生真菌分离鉴定方法、活性次生代谢产物药理机制研究、通过激活内生真菌沉默基因增加次生代谢产物多样性等方面对老鼠簕内生真菌进行更深入的研究和开发。
参 考 文 献
《全国中草药汇编》编写组. 全国中草药汇编(下册)[M]. 北京: 人民卫生出版社, 1974.
Singh D, Aeri V. Phytochemical and pharmacological potential of Acanthus ilicifolius[J]. J Pharm Bioallied Sci, 2013, 5(1): 17.
李海生, 欧阳美霞, 曾婷, 等. 广州南沙大角山海滨公园红树林植物资源研究[J]. 广东第二师范学院学报, 2019, 39(5): 43-47.
刘镜法. 北仑河口国家级自然保护区的老鼠簕群落[J]. 海洋开发与管理, 2005, 22(1): 41-43.
刘爱荣, 吴晓鹏, 徐同. 红树林内生真菌研究进展[J]. 应用生态学报, 2007, 18(4): 912-918.
Wang C F, Ma J, Jing Q Q, et al. Integrating activity-guided strategy and fingerprint analysis to target potent cytotoxic brefeldin A from a fungal library of the medicinal mangrove Acanthus ilicifolius[J]. Mar Drugs, 2022, 20(7): 432.
Lin Z, Zhu T, Fang Y, et al. 1H and 13C NMR assignments of two new indolic enamide diastereomers from a mangrove endophytic fungus Aspergillus sp.[J]. Magn Reson Chem, 2008, 46(12): 1212-1216.
孙世偉, 林贞健, 朱天骄, 等. 老鼠簕植物内生真菌Aspergillus terreus (W-8)抗肿瘤活性成分的研究[J]. 中国海洋大学学报(自然科学版), 2011, 41(S1): 349-355.
王宾, 白志强, 林秀萍, 等. 红树植物老鼠簕内生真菌Aspergillus flavipes AIL8化学成分的研究[J]. 天然产物研究与开发, 2016, 28(6): 860-863.
Bai Z Q, Lin X P, Wang J F, et al. New meroterpenoids from the endophytic fungus Aspergillus flavipes AIL8 derived from the mangrove plant Acanthus ilicifolius[J]. Mar Drugs, 2015, 13(1): 237-248.
Bai Z Q, Lin X, Wang Y, et al. New phenyl derivatives from endophytic fungus Aspergillus flavipes AIL8 derived of mangrove plant Acanthus ilicifolius[J]. Fitoterapia, 2014, 95: 194-202.
Wu Y N, Chen S H, Liu H J, et al. Cytotoxic isocoumarin derivatives from the mangrove endophytic fungus Aspergillus sp. HN15-5D[J]. Arch Pharm Res, 2019, 42(4): 326-331.
Ananda K, Sridhar K R. Diversity of endophytic fungi in the roots of mangrove species on the west coast of India[J]. Can J Microbiol, 2002, 48(10): 871-878.
Lin Z J, Zhang G J, Zhu T J, et al. Bioactive cytochalasins from Aspergillus flavipes , an endophytic fungus associated with the mangrove plant Acanthus ilicifolius[J]. Helv Chim Acta, 2009, 92(8): 1538-1544.
王艳磊. 阳江红树真菌9Hu和2Y次级代谢产物的研究[D]. 广州: 广东工业大学, 2015.
郝丽丽. 北部湾红树林老鼠簕内生真菌次级代谢产物和百香果皮化学成分及其生物活性研究[D]. 南宁: 广西师范大学, 2020.
邓祖军, 曹理想, 周世宁. 红树林内生真菌的分离及代谢产物生物活性的初步研究[J]. 中山大学学报(自然科学版), 2010, 49(2): 100-104.
夏丽娟. 红树林活性真菌的筛选及两株内生真菌次级代谢产物的研究[D]. 广州: 广东工业大学, 2013.
Yan Z Y, Huang C Y, Guo H X, et al. Isobenzofuranone monomer and dimer derivatives from the mangrove endophytic fungus Epicoccum nigrum SCNU-F0002 possess α-glucosidase inhibitory and antioxidant activity[J]. Bioorg Chem, 2020, 94: 103407.
Yan Z Y, Wen S T, Ding M, et al. The purification, characterization, and biological activity of new polyketides from mangrove-derived endophytic fungus Epicoccum nigrum SCNU-F0002[J]. Mar Drugs, 2019, 17(7): 414.
Chen S H, Liu Z M, Li H X, et al. β-Resorcylic acid derivatives with α-glucosidase inhibitory activity from Lasiodiplodia sp. ZJ-HQ1, an endophytic fungus in the medicinal plant Acanthus ilicifolius[J]. Phytochem Lett, 2015, 13: 141-146.
陈森华, 刘昭明, 陆勇军, 等. 一株南海红树老鼠簕内生真菌的生物碱类代谢产物研究[C]. 2014: 3295.
Liu J F, Chen W J, Xin B R, et al. Metabolites of the endophytic fungus Penicillium sp. FJ-1 of Acanthus ilicifolius[J]. Nat Prod Commun, 2014, 9(6): 799-801.
Shao C L, Wang C Y, Wei M Y, et al. Structure elucidation of two new xanthone derivatives from the marine fungus Penicillium sp. (ZZF 32#) from the South China Sea[J]. Magn Reson Chem, 2008, 46(11): 1066-1069.
Jin Y Z, Qin S D, Gao H, et al. An anti?HBV anthraquinone from aciduric fungus Penicillium sp. OUCMDZ?4736 under low pH stress[J]. Extremophiles, 2018, 22(1): 39-45.
Shao C L, Wang C Y, Gu Y C, et al. Penicinoline, a new pyrrolyl 4-quinolinone alkaloid with an unprecedented ring system from an endophytic fungus Penicillium sp.[J]. Bioorg Med Chem Lett, 2010, 20(11): 3284-3286.
Li J, Zhong Y S, Yuan J, et al. A new terminal cyano group-containing benzodiazepine alkaloid from the mangrove endophytic fungus Penicillium sp.[J]. Nat Prod Commun, 2015, 10(9): 1934578X1501000.
方平, 鐘毅昇, 薛艳钰, 等. 南海红树林内生真菌 Penicillium aurantiogriseum 299次级代谢产物研究[J]. 中草药, 2014, 45(18): 2593-2596.
Guo W Q, Li D, Peng J X, et al. Penicitols A–C and penixanacid A from the mangrove-derived Penicillium chrysogenum HDN11-24[J]. J Nat Prod, 2015, 78(2): 306-310.
谭玉莹, 曹广萍, 黄炯丽, 等. 红树老鼠簕来源内生青霉Penicillium sp. GXIMD 03101的次级代谢产物研究[J]. 广西科学, 2022, 29(5): 839-845.
Ding B, Wang Z Y, Xia G P, et al. Three new chromone derivatives produced by Phomopsis sp. HNY29-2B from Acanthus ilicifolius Linn.[J]. Chin J Chem, 2017, 35(12): 1889-1893.
Cai R L, Chen S H, Long Y H, et al. Depsidones from Talaromyces stipitatus SK-4, an endophytic fungus of the mangrove plant Acanthus ilicifolius[J]. Phytochem Lett, 2017, 20: 196-199.
蔡瑾, 罗运展, 刘婧, 等. 红树老鼠簕来源真菌Talaromyces flavus TGGP35次级代谢产物及其抗氧化活性[J]. 海南师范大学学报(自然科学版), 2022, 35(3): 245-249.
Shao C L, Guo Z Y, Xia X K, et al. Five nitro-phenyl compounds from the South China Sea mangrove fungus[J]. J Asian Nat Prod Res, 2007, 9(7): 643-648.
Cao G P, Xia J L, Zhao L Y, et al. Penicixanthene E, a new xanthene isolated from a mangrove-derived fungus Penicillium sp.[J]. J Antibiot, 2022, 75(9): 526-529.
Yan Z Y, Li J L, Ye G T, et al. Fused multicyclic polyketides with a two-spiro-carbon skeleton from mangrove-derived endophytic fungus Epicoccum nigrum SCNU-F0002[J]. RSC Adv, 2020, 10(48): 28560-28566.
黄益, 于暕辰, 唐戈, 等. 红树林内生真菌来源内酯类化合物 D1952抗肿瘤活性研究[J]. 广东药学院学报, 2016, 32(6): 737-742.
Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific Yew[J]. Science, 1993, 260(5105): 214-216.
Liu J J, Liu G. A analysis of secondary metabolites from plant endophytic fungi[A]. Methods Mol Biol, 2018, 1848: 25-38.
周正平, 李英新, 田峰, 等. 红树共附生真菌活性代谢产物的研究进展[J]. 药物生物技术, 2013, 20(5): 448-452.
Chen S H, Cai R L, Liu Z M, et al. Secondary metabolites from mangrove-associated fungi: Source, chemistry and bioactivities[J]. Nat Prod Rep, 2022, 39(3): 560-595.
霍长虹, 梁鸿, 赵玉英. 老鼠簕屬植物化学成分及其活性研究进展[J]. 中国海洋药物, 2004, (3): 39-44.
收稿日期:2022-11-10
基金项目:国家自然科学基金(No. 82160734);广西自然科学基金(No. 2020GXNSFAA297114);大学生创新创业训练计划项目(No. 202110598026);广西重点研发计划(No. 桂科AB21196048)
作者简介:严石焕,女,生于1996年,硕士,主要从事植物内生真菌活性次生代谢产物研究,E-mail: SHY6519@163.com
*通信作者,E-mail: zdgxmu2006@163.com
