亚胺培南对携带blaNDM-1耐药基因的Escherichia coli耐药性及内膜secY、secE和secG转录水平的影响
2023-12-26吴兆猛赵琼吴玲玲王祖华余春芳金志雄
吴兆猛 赵琼 吴玲玲 王祖华 余春芳 金志雄

摘要:目的 探討亚胺培南(IPM)对blaNDM-1阳性Escherichia coli耐药性及其内膜secY、secE和secG转录水平的影响。方法 以重组质粒pET28a(+)-blaNDM-1转化菌株E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1为研究对象,在梯度浓度增加或撤消IPM暴露下传代培养菌株,检测17种抗生素对IPM暴露菌株的MIC值;SDS-PAGE凝胶电泳检测NDM-1表达;蛋白活性实验检测NDM-1活性;qRT-PCR检测blaNDM-1及内膜secY、secE和secG转录水平。结果 12 μg/mL和020 μg/mL IPM暴露的E. coli DH5α-blaNDM-1菌株CFZ、CXM、FOX、CRO、CAZ、FEP等头孢类药物的MIC值(≥8 μg/mL/≥8 μg/mL、≥32 μg/mL/≥32 μg/mL、≥32 μg/mL/≥32 μg/mL、≥64 μg/mL/= 32 μg/mL、≥32 μg/mL/≥32 μg/mL、≥32 μg/mL/= 8 μg/mL)与0 μg/mL IPM暴露MIC值(≤2 μg/mL、= 16 μg/mL、≤8 μg/mL、≤1 μg/mL、≤4 μg/mL、≤2 μg/mL)相比均显著增高,而IPM和MEM的MIC值与0 μg/mL IPM暴露(≤1 μg/mL和≤1 μg/mL)相比也显著增高(=8 μg/mL/=8 μg/mL和=4 μg/mL/=4 μg/mL)。12 μg/mL和020 μg/mL IPM暴露的E. coli BL21(DE3)-blaNDM-1菌株FOX、CRO、FEP等头孢类药物的MIC值(≥32 μg/mL/≥32 μg/mL、≥64 μg/mL/≥64 μg/mL、= 16 μg/mL/= 16 μg/mL) 与0 μg/mL IPM暴露(≤8 μg/mL、≤1 μg/mL、≤2 μg/mL)相比也均显著增高,而IPM和MEM的MIC值与0 μg/mL IPM暴露(≤1 μg/mL和≤1 μg/mL)相比也均显著增高(≥16 μg/mL/≥16 μg/mL和≥16 μg/mL/≥16 μg/mL)。SDS-PAGE显示,随12 μg/mL IPM暴露时间的延长,菌株NDM-1水解IPM活性增加。qRT-PCR显示,12 μg/mL IPM暴露的E. coli DH5α-blaNDM-1和E. coli BL21(DE3)- blaNDM-1的blaNDM-1、secY、secE和secG转录水平分别上调2.31/2.5、3.05/1.96、2.83/1.24和2.71/1.45倍。结论 IPM可使blaNDM-1阳性E. coli由碳青霉烯类敏感变为耐药且保持稳定,细菌内膜SecYEG跨膜通道蛋白参与菌株耐药性调控,这为认识抗生素压力下肠杆菌科细菌耐药性变化及指导临床合理用药提供理论支撑。
关键词:亚胺培南;暴露;Escherichia coli;NDM-1;SecYEG
中图分类号: R378.2+1文献标志码:A
The effects of imipenem on resistance to blaNDM-1 positive Escherichia coli and transcription levels of secY, secE and secG in intima
Wu Zhaomeng1, Zhao Qiong1, Wu Lingling2, Wang Zuhua3, Yu Chunfang1, and Jin Zhixiong1,2
(1 Department of Basic Medical Science, Hubei University of Medicine, Shiyan 442000;
2 Department of Clinical Laboratory, Dongfeng Hospital, Hubei University of Medicine, Shiyan, 442008;
3 Department of Blood Transfusion, Taihe Hospital, Hubei University of Medicine Shiyan, 442000)
Abstract Objective To investigate the effects of imipenem (IPM) on the resistance of blaNDM-1 positive Escherichia coli and the transcription levels of secY, secE and secG in intima. Method E. coli DH5α-blaNDM-1 and E. coli BL21(DE3)-blaNDM-1 transformed by recombinant plasmid pET28a(+)-blaNDM-1 were used as the research objects, and subcultured under the condition that the gradient concentration was increased or IPM exposure was canceled. The MIC values of 17 kinds of antibiotics against the IPM exposed strains were detected. The expression of NDM-1 was detected by SDS-PAGE gel electrophoresis. NDM-1 activity was detected by the protein activity test. The transcription levels of blaNDM-1, secY, secE and secG in intima were detected by qRT-PCR. Result The MIC values of CFZ, CXM, FOX, CRO, CAZ, FEP, and other cephalosporins on E. coli DH5α-blaNDM-1 strain exposed by 12 μg/mL
and 020 μg/mL IPM( ≥8 μg/mL/≥8 μg/mL, ≥32 μg/mL/≥32 μg/mL, ≥32 μg/mL/≥32 μg/mL, ≥64 μg/mL/= 32 μg/mL, ≥32 μg/mL/≥32 μg/mL, ≥32 μg/mL/= 8 μg/mL) were significantly increased, compared with 0 μg/mL IPM-exposed strain(≤2 μg/mL, = 16 μg/mL, ≤8 μg/mL, ≤1 μg/mL, ≤4 μg/mL, and ≤2 μg/mL) ,and the MIC values of IPM and MEM were also significantly increased (=8 μg/mL/=8 μg/mL and =4 μg/mL/=4 μg/mL), compared with 0 μg/mL IPM-exposed strain (≤1 μg/mL and ≤1 μg/mL). The E. coli BL21(DE3)-blaNDM-1 strain induced by 12 μg/mL and 020 μg/mL IPM ( ≥32 μg/mL/≥32 μg/mL, ≥64 μg/mL/≥64 μg/mL, =16 μg/mL/=16 μg/mL) were also significantly increased, compared with 0 μg/mL IPM-exposed strain (≤8 μg/mL, ≤1 μg/mL, ≤2μg/mL). The MIC values of IPM and MEM were also significantly increased (≥16 μg/mL/≥16 μg/mL and ≥16 μg/mL/≥16 μg/mL), compared with 0 μg/mL IPM-exposed strain (≤1 μg/mL and ≤1 μg/mL). Compared with 0 μg/mL IPM-exposed strain, qRT-PCR showed the expression of blaNDM-1, secY, secE, and secG in E. coli DH5α-blaNDM-1 and E. coli BL21(DE3)-blaNDM-1 induced by 12 μg/mL IPM were increased by 2.31/2.5, 3.05/1.96, 2.83/1.24 and 2.71/1.45 times respectively. Conclusion IPM can make blaNDM-1 positive E. coli changed from carbapenem sensitive to drug resistant and remained stable, and SecYEG transmembrane channel protein in bacterial intima participated in the regulation of bacterial resistance, which provided theoretical support for understanding the change of Enterobacteriaceae bacterial resistance under antibiotic pressure and guiding clinical rational drug use.
Key words Imipenem; Expose; Escherichia coli; NDM-1; SecYEG
碳青霉烯類(carbapenems)是一类不被细菌β-内酰胺酶水解的主要用于对抗耐药性细菌感染的非典型β-内酰胺类抗生素,如亚胺培南(imipenem,IPM)和美罗培南(meropenem,MEM)等。然而,自20世纪80年代英国和美国发现耐碳青霉烯类肠杆菌科细菌以来,耐药菌株遍布美洲、欧洲、亚洲和非洲等地区,碳青霉烯类的治疗效果受到耐药株携带的编码碳青霉烯酶基因的挑战[1-3]。根据Ambler分类法[4](β-内酰胺酶末端的氨基端序列特征),β-内酰胺酶分为:A(TEM、SHV、CTX-M和KPC)、B(IMP、VIM、SPM、GIM、SIM和NDM)、C(CMY、DHA和ADC)和D(OXA)4种类型[5-11]。A、C和D类β-内酰胺酶的活性位点含有丝氨酸残基。B类酶又称金属β-内酰胺酶(metallo-β-lactamases, MBLs),由染色体和质粒编码,包括IMP、VIM、SPM、GIM、SIM、NDM、Bc11、Cpha、FEZ等[12],酶分子的一级结构具有高变异性,氨基酸序列的同源性低于23%[13-14]。依据氨基酸序列的同源性,MBLs分3个亚群B1、B2和B3。其中,B1亚群是最大的MBLs,酶分子氨基酸同源性大于23%。MBLs的活性依赖于二价金属离子(多为Zn2+),其活性中心的二价金属离子结合组氨酸和半胱氨酸并与β-内酰胺环的羰基碳的酰胺键相互作用,水解青霉素类、头孢菌素、头霉素类和碳青霉烯类等抗生素。
2009年,Timothy等[15]发现了一种新型MBLs即新德里金属-β-内酰胺酶(new delhi metallo-β-lactamase-1, NDM-1),NDM-1属B1亚类酶,可水解除氨曲南以外的全部β-内酰胺类药物,包括碳青霉烯类。编码NDM-1的β-内酰胺酶基因(blaNDM-1)含有一个813 bp的开放阅读框,GC含量为57%,有7个亚型,各亚型仅有1~2个氨基酸的差异,其水解酶活性差异不明显。携带blaNDM-1质粒类型众多(包括IncA/C、ColE、IncF、 IncFIA、IncFIB、 IncFII、IncHI1、IncHI3、IncL/M、IncN、IncN2、IncP、IncR、IncT、IncX1、IncX3、IncY等)(https://cge.cbs.dtu.dk/services/PlasmidFinder/),blaNDM-1定位在转座子、整合子或插入序列等移动元件中心区,伴随有遗传元件ISEc33、ISSen4、IS26、IS930或ISCR1及其它耐药酶如OXA-48、VIM、AMP、ESBL、16S rRNA甲基酶、大环内脂酯酶和利福平修饰酶等基因,随质粒在不同肠杆菌的种属细菌间传播[16-17]。
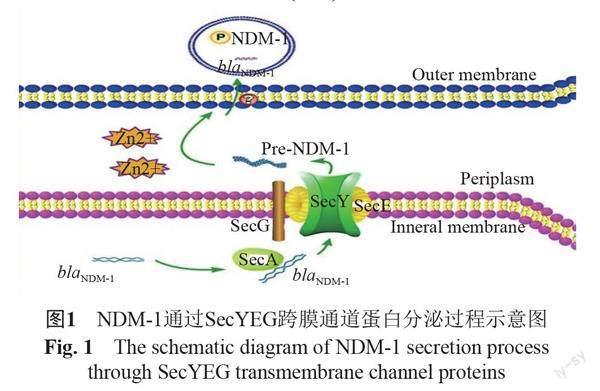
blaNDM-1翻译后的未折叠状NDM-1前蛋白,依靠动力蛋白SecA水解ATP提供的能量,穿过SecY、SecE和SecG蛋白构成的跨膜蛋白通道(SecYEG)输出到周质[18] ,折叠并结合2个Zn2+成具有活性的NDM-1[19],通过外膜囊泡运至膜外[20](图1)。
目前,携带blaNDM-1的质粒已经在肠杆菌目细菌中广泛传播,包括肺炎克雷伯菌(Klebsiella pneumonia)、大肠埃希菌(Escherichia coli)、阴沟肠杆菌(Enterobacter cloacae)和解鸟氨酸乌拉尔菌(Raoultella ornithinolytica)等[21-23]。研究表明,抗生素压力是细菌染色体基因发生突变或潜伏基因(存在于染色体或质粒的低或无表达的基因)扩散从而增强细菌的抗药性和毒力的动因[15, 24-26]。IPM暴露可促使blaNDM-1阳性耐碳青霉烯类菌株的耐药性增强,且blaNDM-1的表达水平与IPM暴露浓度成正相关[27]。然而,IPM暴露菌株的耐药稳定性及其对细菌SecYEG跨膜通道蛋白的影响未见报道。为此,开展了IPM对blaNDM-1阳性E. coli耐药性及其内膜secY、secE和secG转录水平影响的研究。结果显示,经IPM暴露的blaNDM-1转化菌E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1均表现出可稳定传递的耐IPM表型和基因型特性,而且IPM与blaNDM-1、secY、secE和secG的表达存在一定的关联性,这为认识抗生素压力下的肠杆菌科细菌耐药性变化及指导临床合理用药提供一定依据。
1 材料与方法
1.1 菌株与试剂
K. pneumoniae TH-P12158(分离自湖北医药学院附属太和医院临床患者痰液标本,IPM的MIC? 1 μg/mL,碳青霉烯类敏感);E. coli DH5α、E. coli BL21(DE3)(购自南京诺唯赞生物科技有限公司);E. coli DH5α-blaNDM-1、E. coli BL21(DE3)-blaNDM-1(携带blaNDM-1-pET28a(+)质粒的菌株,由本课题组构建并保存于湖北医药学院基础医学研究所)。
IPM(购买自Merck Sharp&Dohme Corp.U.S.A)溶液配制:溶解于PBS中至需要浓度,0.22 ?m滤器除菌,分装放于-20℃冰箱。卡那霉素[购买自生工生物工程(上海)有限公司]溶液(100 mg/mL)配制:称取1 g卡那霉素,加入10 mL ddH2O中完全溶解,0.22 ?m滤器除菌,分装放于-20℃冰箱。异丙基-β-D-硫代半乳糖苷(isopropyl beta-D-thiogalactopyranoside,IPTG)溶液(1 mol/L)配制:称取2.38 g IPTG,加入7 mL ddH2O中,溶解后加ddH2O至10 mL,0.22 ?m滤器除菌,放于-20℃冰箱。
1.2 菌株复活
分别取出-80℃冰箱保存的E. coli DH5α、E. coli BL21(DE3)、E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1菌株,室温静置2 h。取菌液划线接种至LB固体培养基上,37℃,过夜培养细菌。
1.3 菌株传代
挑选E. coli DH5α-blaNDM-1的单菌落于MH液体培养基中,37℃,200 r/min,培养12 h,然后将E. coli DH5α-blaNDM-1菌液按照1:100的比例加入到含有0 (不含IPM的对照)、0.25、0.5、1、2、4、8和12 μg/mL IPM的5 mL MH液体培养基中,37℃,200 r/min,按照增加的IPM浓度依次进行菌株的传代培养(8~12 h内A600=1.5~2.0进行下一浓度传代)。取12 μg/mL的IPM暴露的最后一代菌株,在无IPM液体培养基中连续传代培养20代,本文中用020 μg/mL表示, A600=1.5~2.0。
E. coli BL21(DE3)-blaNDM-1菌株传代方法同上。
2 药物敏感性
2.1 抗菌活性
分别取E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1经0和12 μg/mL的IPM暴露的最后一代细菌及020 μg/mL条件下的第20代细菌菌液的离心沉淀物(4℃, 3000 r/min)适量,1.5×108 CFU/mL。依据VITEK-2 compact微生物自动分析系统操作规程,检测17种抗生素(包括IPM和MEM)的最低抑菌浓度(minimum inhibitory concentation, MIC)。依据CLSI M100抗微生物药物敏感性的标准(2022年第32版),抗菌活性结果判斷为敏感(susceptible, S)、中介(intermediate, I)和耐药(resistant, R)。其中,亚胺培南的MIC≤1 μg/mL为敏感,1<MIC<4 μg/mL为中介,MIC≥4 μg/mL为耐药。
同上述方法检测17种抗生素抑制E. coli DH5α和E. coli BL21(DE3)生长的MIC值。
2.2 NDM-1的表达、分离和纯化
取0和12 μg/mL IPM暴露的E. coli DH5α-blaNDM-1、E. coli BL21(DE3)-blaNDM-1菌株进行NDM-1的表达、分离和纯化。所有培养基中都加入终浓度为100 ?g/mL的卡那霉素(保证无杂菌生长)。
取12 ?g/mL IPM暴露的E. coli BL21(DE3)-blaNDM-1菌液1 mL接种至100 mL LB液体培养基中,37℃,200 r/min,培养12 h。取菌液10 mL接种至1000 mL LB培养基中,37℃、200 r/min,培养细菌至A600=0.4~0.6(约2 h),加入终浓度为0.5 mmol/L的IPTG,16℃,200 r/min,培养20 h。4℃,12000 r/min离心10 min,保留菌体,加入15 mL PBS清洗2次,加入25 mL裂解缓冲液重悬菌体。冰浴。超声30 min(200 W, 超声3 s停5 s)。4℃,12000 r/min离心30 min,将上清转移到离心管中,0.22 ?m滤器过滤,得细菌总蛋白。依据Ni NTA Beads 6FF说明书进行镍柱亲和层析纯化NDM-1,用BCA测定试剂盒检测纯化后NDM-1浓度。取总蛋白和纯化后的NDM-1进行SDS-PAGE凝胶电泳。
其他浓度IPM暴露的E. coli DH5α-blaNDM-1、E. coli BL21(DE3)-blaNDM-1菌株NDM-1的表达、分离和纯化方法同上。
2.3 NDM-1的活性
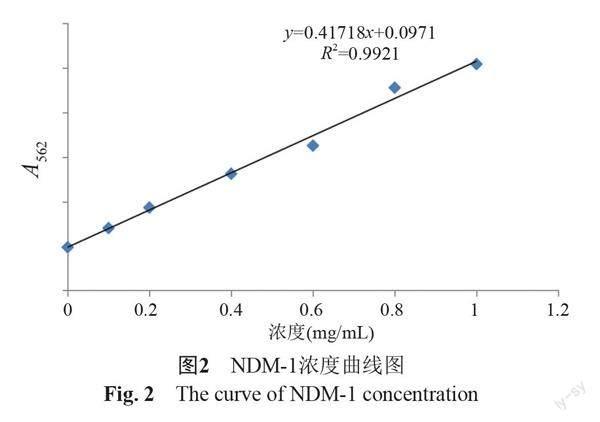
以K. pneumoniae TH-P12158为受试菌株,检测12 μg/mL IPM下E. coli DH5α-blaNDM-1、E. coli BL21(DE3)-blaNDM-1产生的NDM-1水解IPM的能力。依据BCA测定试剂盒操作说明,检测菌液NDM-1浓度并制作标准曲线,如图2所示。
False K. pneumoniae TH-P12158菌液:1.5×108 CFU/mL。NDM-1溶液:E. coli DH5α-blaNDM-1为5.31 mg/mL,E. coli BL21(DE3)-blaNDM-1为2.87 mg/mL。IPM溶液:以无菌生理盐水为溶剂、IPM干粉为溶质配制640、320、160、80、40、20、10、5、2.5和1.25 μg/mL系列浓度的IPM溶液。
NDM-1活性实验,NDM-1为30 μg,总体系为200 μL。实验组:分别在10个孔中加入上述配制的不同浓度的IPM 20 μL,每孔加入E. coli DH5α-blaNDM-1的NDM-1溶液约5.65 μL(E. coli BL21(DE3)-blaNDM-1的NDM-1溶液约10.45 μL),最终加入K. pneumoniae TH-P12158菌液100 μL,加入MH液体培养基补足体积。对照组:每孔分别加入10个浓度的IPM 20 μL和K. pneumoniae TH-P12158菌液100 μL,加入MH液体培养基补足体积。每个对照组和实验组设置3个复孔。37℃条件下进行孵育,用酶标仪检测A600的变化,每隔4 h检测一次,间隔4 h连续检测6次(即4、8、12、16、20和24 h),计算IPM对K. pneumoniae TH-P12158的MIC值变化。
3 qRT-PCR
NCBI数据库查询blaNDM-1、secY、secE和secG的CDS序列并用Oligo 7.0设计其荧光定量引物(表1),采用TIANGEN RNA prep pure培养细菌/细胞总RNA提取试剂盒,分别提取0和12 μg/mL IPM暴露的E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1的总RNA。使用Toyobo反转录试剂盒进行反转录获得cDNA,并将其作为模板进行实时荧光定量PCR (quantitative real-time PCR,qRT-PCR),检测blaNDM-1、secY、secE和secG的mRNA转录水平。
4 统计学分析
采用GraphPad 7.0和SPSS 23.0进行数据分析,实验重复次数均不少于3次,结果用x±s表示。组间数据比较采用t检验,P<0.05为差异有统计学意义。
5 结果
5.1 抗菌活性
抗菌活性结果如表2所示,E. coli DH5α和E. coli BL21(DE3)对临床常用17种抗生素均敏感,而接受了重组质粒blaNDM-1-pET28a(+)的E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1菌株显示出头孢类药物MIC值增加,如前者的CXM (MIC=16 μg/mL, I)和后者的CFZ(MIC≥8μg/mL, R)、CXM(MIC≥32 μg/mL,R)、CAZ(MIC≥32 μg/mL, R)等。
表2显示,与0 IPM暴露的菌株相比,12 μg/mL和020 μg/mL的IPM暴露的E. coli DH5α-blaNDM-1菌株头孢类药CFZ、CXM、FOX、CRO、CAZ、FEP(第一代到第四代)的MIC值均分别增高为≥8 μg/mL/≥8 μg/mL、≥32 μg/mL/≥32 μg/mL、≥32 μg/mL/≥
32 μg/mL、≥64 μg/mL/=32 μg/mL、≥32 μg/mL/≥
32 μg/mL、≥32 μg/mL/ = 8 μg/mL。同时,IPM和MEM的MIC值均分别增高为8 μg/mL/4 μg/mL和
8 μg/mL/4 μg/mL。E.coli BL21(DE3)-blaNDM-1菌株MIC值(≥8 μg/mL/≥8 μg/mL、≥32 μg/mL/≥32 μg/mL、≥32 μg/mL/≥32 μg/mL、≥64 μg/mL/≥64 μg/mL、≥32 μg/mL/≥32 μg/mL、=16 μg/mL/= 16μg/mL)也均顯著增高,而IPM和MEM的MIC值也均显著增高
(≥16 μg/mL/≥16 μg/mL和≥16 μg/mL/≥16 μg/mL)。
5.2 NDM-1的表达、分离与纯化
图3显示,在25~48 kDa之间,E. coli DH5α-blaNDM-1或E. coli BL21(DE3)-blaNDM-1蛋白图谱的丰富度和含量均较E. coli DH5α或E. coli BL21(DE3)明显增强,12 μg/mL IPM暴露菌株相比较0 IPM暴露菌株又有显著增强。同时,12 μg/mL IPM暴露的E.coli DH5α-blaNDM-1或E.coli BL21(DE3)-blaNDM-1菌株均显示32 kD蛋白条带,而0 IPM暴露菌株均未表达出NDM-1条带。
5.3 NDM-1的活性
NDM-1存在下,IPM对K. pneumoniae TH-P12158的MIC值变化如表3所示,12 ?g/mL的IPM暴露E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1分泌 NDM-1水解IPM,使后者的MIC值均由反应4 h时的4 ?g/mL增加至24 h时的16 ?g/mL,这说明纯化得到的NDM-1的活性较好。
5.4 qRT-PCR
菌株blaNDM-1 mRNA转录水平如图4所示,12 μg/mL IPM暴露E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1菌株的blaNDM-1转录水平分别是0 IPM的2.3倍(P<0.001)和2.5倍(P<0.01)。2株E. coli在12 μg/mL IPM的暴露下,blaNDM-1mRNA转录水平都有显著上调,这预示NDM-1表达量有明显增加。
随着IPM浓度由0增加到12 μg/mL,E. coli DH5α-blaNDM-1的secY增加了3.05倍(P<0.05)(图5A)、secE增加了2.83倍(P<0.05)(图5B)和secG增加了2.71倍(P<0.05)(图5C);E. coli BL21(DE3)-blaNDM-1的secY增加了1.96倍(P<0.05)(图5D)、secE增加了1.24倍(P< 0.05)(图5E)和secG增加了1.45倍(P< 0.05) (图5F)。
6 讨论
K. pneumoniae和E. coli是社区和医院获得性感染的重要病原菌,也是常见的多重耐药性细菌。K. pneumoniae和E. coli普遍携带多种类型的β-内酰胺酶基因如blaTEM、blaSHV、blaCTX-M、blaKPC和blaNDM-1等,这些基因存在于染色体或质粒上,赋予细菌耐药特性[21,29-32]。携带blaNDM-1基因的质粒通常大于100 kb,质粒类型包括IncA/C、IncX3或IncF等[33]。有研究认为,宿主兼容性使blaNDM-1质粒多见于K. pneumoniae,很少存在E. coli中[29]。E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1是2株自然转接blaNDM-1-pET28a (+)质粒的菌株,在无IPM压力下(IPM,0),2株菌显示出部分头孢类药物MIC值增高(如CXM、CFZ和CAZ等)(表2),这提示blaNDM-1在E. coli中进行了低水平不足于引起临床耐药的NDM-1表达。同时,blaNDM-1-pET28a (+)质粒构建菌株在普通培养基中显示出快速的生长状态,这体现了blaNDM-1质粒在E. coli中较强的宿主兼容性和水平传播的能力。
抗生素被认为是加速耐药基因转移的最重要推动力,它们对细菌施加的选择性压力促使染色体基因发生突变或潜伏基因扩散,从而增强细菌的抵抗力和毒力[24,26,30,34]。研究表明[27,31,35],低于MIC值的IPM可使blaNDM-1阳性菌的耐药表型(MIC)和基因型(blaNDM-1)增加。本研究发现,低浓度IPM(0.25、0.5、1和2 μg/mL)暴露的菌株初始生长缓慢(12~24 h),3~4次传代后生长迅速(8~12 h);高浓度IPM(4、8和12 μg/mL)暴露的菌株初次生长极为缓慢(>48 h),需要传代10~12次才能正常生长(10~12 h)(数据未显示)。MIC值、NDM-1和blaNDM-1转录水平等数据显示(表2、图3~4),12 μg/mL的IPM显著提高blaNDM-1表达及NDM-1水解IPM能力。表2也显示,撤消IPM并不影响12 μg/mL IPM暴露菌株的耐药性。无论是12或020 μg/mL,IPM暴露菌株均产生了交叉耐药性,而且这种耐药性存在可遗传特性。交叉耐药性是一种对特定药物产生耐药性同时导致对另一种药物产生耐药性的现象[32]。E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1对IPM和其它未暴露抗生素表现出强的耐药性(表2),如12 μg/mL IPM暴露的E. coli DH5α-blaNDM-1和E. coli BL21(DE3)-blaNDM-1菌株对MEM(碳青霉烯类)、CFZ、CXM、FOX、CRO、CAZ、FEP(第一、第二、第三、第四代)的MIC值均显著增高。此外,撤消IPM后菌株保持二十代耐药谱不变。综合分析IPM暴露细菌的生长、耐药表型和基因型数据,认为IPM暴露促使菌株适应压力环境、增强耐药酶活性,而撤消IPM并不影响菌株持久的、不可逆的耐药性,其可能原因是产生染色体基因突变和blaNDM-1高表达菌株。有研究者认为[36],存在于E. coli内的NDM-1前蛋白可以通过SecYEG跨膜通道转运,其blaNDM-1也可以通过此方式进行运输,blaNDM-1和NDM-1都被外膜囊泡包裹后转运细菌外膜上,这不能排除囊泡内的blaNDM-1促使基因水平传播的可能。
无论blaNDM-1协同其它耐药基因或blaNDM-1单一基因,细菌内膜SecYEG跨膜通道是NDM-1前蛋白易位至周质的关键孔道。现有研究无法确定IPM是否特异性促使blaNDM-1表达或者只是一种抗生素压力因子,但IPM对SecYEG跨膜通道产生了一定的影响。本研究显示,相比较0、12 μg/mL IPM暴露E. coli DH5α-blaNDM-1和E. coli BL21(DE3)- blaNDM-1的secY、secE和secG转录水平分别增加了3.05/1.96、2.83 /1.24和2.71/1.45倍(P<0.05)(圖5)。推测IPM可能促使菌株mRNA转录改变提高SecY、SecE和SecG蛋白量或功能促使更多的NDM-1前蛋白快速到达周质结合Zn2+,增强NDM-1酶的水解能力,但是,这需要进一步深入探究。
面对blaNDM-1在全世界的广泛传播性及其对抗生素的多重耐药性的现状,控制blaNDM-1的传递、NDM-1表达及其活性将十分关键。我们的研究显示IPM暴露下的blaNDM-1、NDM-1和SecYEG跨膜通道等三者之间存在一定的关联性,这为选择抗菌药物靶点提供了新思路。
参 考 文 献
杨修文, 崔俊昌, 赵进, 等. 碳青霉烯类耐药肺炎克雷伯菌血流感染的临床特征与死亡危险因素分析[J].中国感染与化疗杂志, 2018, 18(2): 142-149.
Iovleva A, Doi Y. Carbapenem-resistant Enterobacteriaceae[J]. Clin Lab Med, 2017, 37(2): 303-315.
Mills M C, Lee J. The threat of carbapenem-resistant bacteria in the environment: Evidence of widespread contamination of reservoirs at a global scale[J]. Environ Pollut, 2019, 255(1): 113-143.
Ambler R P. The structure of beta-lactamases[J]. Philos Trans R Soc Lond B Biol Sci, 1980, 289(1036): 321-331.
Tooke C L, Hinchliffe P, Bragginton E C, et al. Beta-lactamases and beta-lactamase inhibitors in the 21st century[J]. J Mol Biol, 2019, 431(18): 3472-3500.
Yigit H, Queenan A M, Anderson G J, et al. Novel carbapenem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161.
Majiduddin F K, Palzkill T. Amino acid sequence requirements at residues 69 and 238 for the SME-1 beta-lactamase to confer resistance to beta-lactam antibiotics[J]. Antimicrob Agents Chemother, 2003, 47(3): 1062-1067.
Smith C A, Nossoni Z, Toth M, et al. Role of the conserved disulfide bridge in class A carbapenemases[J]. J Biol Chem, 2016, 291(42): 22196-22206.
Fonseca F, Chudyk E I, Van Der Kamp M W, et al. The basis for carbapenem hydrolysis by class A beta-lactamases: A combined investigation using crystallography and simulations[J]. J Am Chem Soc, 2012, 134(44): 18275-18285.
Rasussen B A, Bush K, Keeney D, et al. Characterization of IMI-1 beta-lactamase, a class A carbapenem-hydrolyzing enzyme from Enterobacter cloacae[J]. Antimicrob Agents Chemother, 1996, 40(9): 2080-2086.
Rodriguez-Martinez J M, Poirel L, Nordmann P. Extended-spectrum cephalosporinases in Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2009, 53(5): 1766-1771.
Mendes R E, Bell J M, Turnidge J D, et al. Carbapenem-resistant isolates of Klebsiella pneumoniae in China and detection of a conjugative plasmid (blaKPC-2 plus qnrB4) and a blaIMP-4 gene[J]. Antimicrob Agents Chemother, 2008, 52(2): 798-799.
Rasmussen B A, Bush K. Carbapenem-hydrolyzing beta-lactamases[J]. Antimicrob Agents Chemother, 1997, 41(2): 223-232.
Walsh T R, Toleman M A, Poirel L, et al. Metallo-beta-lactamases: The quiet before the storm[J]? Clin Microbiol Rev, 2005, 18(2): 306-325.
李子堯, 鲁炳怀. 耐碳青霉烯类肺炎克雷伯菌的耐药机制及其分子检测[J]. 中国临床新医学, 2021, 14(3): 256-261.
Xu Y, Gu B, Huang M, et al. Epidemiology of carbapenem resistant Enterobacteriaceae (CRE) during 2000—2012 in Asia[J]. J Thorac Dis, 2015, 7(3): 376-385.
Petrosillo N, Giannella M, Lewis R, et al. Treatment of carbapenem-resistant Klebsiella pneumoniae: The state of the art[J]. Expert Rev Anti Infect Ther, 2013, 11(2): 159-177.
Corey R A, Allen W J, Komar J, et al. Unlocking the bacterial secY translocon[J]. Structure, 2016, 24(4): 518-527.
Moran-Barrio J, Limansky A S, Viale A M. Secretion of GOB metallo-beta-lactamase in Escherichia coli depends strictly on the cooperation between the cytoplasmic DnaK chaperone system and the Sec machinery: Completion of folding and Zn(II) ion acquisition occur in the bacterial periplasm[J]. Antimicrob Agents Chemother, 2009, 53(7): 2908-2917.
Li L, Park E, Ling J, et al. Crystal structure of a substrate-engaged SecY protein-translocation channel[J]. Nature, 2016, 531(7594): 395-399.
Yong D, Toleman M A, Giske C G, et al. Characterization of a new metallo-beta-lactamase gene, bla(NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India[J]. Antimicrob Agents Chemother, 2009, 53(12): 5046-5054.
Yu C, Wei X, Wang Z, et al. Occurrence of two NDM-1-producing Raoultella ornithinolytica and Enterobacter cloacae in a single patient in China: Probable a novel antimicrobial resistance plasmid transfer in vivo by conjugation[J]. J Glob Antimicrob Resist, 2020, 22: 835-841.
Du N, Liu S, Niu M, et al. Transmission and characterization of blaNDM-1 in Enterobacter cloacae at a teaching hospital in Yunnan, China[J]. Ann Clin Microbiol Antimicrob, 2017, 16(1): 58.
Charpentier X, Polard P, Claverys J P. Induction of competence for genetic transformation by antibiotics: Convergent evolution of stress responses in distant bacterial species lacking SOS[J]? Curr Opin Microbiol, 2012, 15(5): 570-576.
Nordmann P, Poirel L, Walsh T R, et al. The emerging NDM carbapenemases[J]. Trends Microbiol, 2011, 19(12): 588-595.
Neu H C. The crisis in antibiotic resistance[J]. Science, 1992, 257(5073): 1064-1073.
馮伟, 欧阳净, 程林, 等. 细菌NDM-1质粒耐药表型与其表达的相关性研究[J].中国抗生素杂志, 2020, 45(05): 477-481.
吴玲玲. 耐碳青霉烯类肠杆菌耐药基因分析及木犀草苷抗blaNDM-1多耐药菌的机制研究[D]. 湖北: 湖北医药学院, 2021.
Gottig S, Riedel-Christ S, Saleh A, et al. Impact of blaNDM-1 on fitness and pathogenicity of Escherichia coli and Klebsiella pneumoniae[J]. Int J Antimicrob Agents, 2016, 47(6): 430-435.
Brink A J. Epidemiology of carbapenem-resistant Gram-negative infections globally[J]. Curr Opin Infect Dis, 2019, 32(6): 609-616.
Revitt-Mills S A, Robinson A. Antibiotic-induced mutagenesis: Under the microscope[J]. Front Microbiol, 2020, 11: 585175.
Suzuki S, Horinouchi T, Furusawa C. Prediction of antibiotic resistance by gene expression profiles[J]. Nat Commun, 2014, 5: 5792.
An J, Guo L, Zhou L, et al. NDM-producing Enterobacteriaceae in a Chinese hospital, 2014—2015: Identification of NDM-producing Citrobacter werkmanii and acquisition of blaNDM-1-carrying plasmid in vivo in a clinical Escherichia coli isolate[J]. J Med Microbiol, 2016, 65(11): 1253-1259.
Prudhomme M, Attaiech L, Sanchez G, et al. Antibiotic stress induces genetic transformability in the human pathogen Streptococcus pneumoniae[J]. Science, 2006, 313(5783): 89-92.
Poirel L, Dortet L, Bernabeu S, et al. Genetic features of blaNDM-1-positive Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2011, 55(11): 5403-5407.
Gonzalez L J, Bahr G, Nakashige T G, et al. Membrane anchoring stabilizes and favors secretion of New Delhi metallo-beta-lactamase[J]. Nat Chem Biol, 2016, 12(7): 516-522.
收稿日期:2022-11-14
基金項目:湖北省卫生健康委项目(No. WJ2021F049);“十四五”湖北省高等学校优势特色学科群(生物与医药)项目资助
(No. 2022BMXKQY1)
作者简介:吴兆猛,男,生于1998年,在读硕士研究生,主要研究方向为细菌耐药机制与院内感染控制,E-mail: wuzhaomeng2833@163.com
*通信作者,E-mail: Jzx8801150@126.com
