烟粉虱卵黄原蛋白通过影响自噬反应调控共生细菌Rickettsia的丰度
2023-11-30刘炳奇陈展博李楚翘洪继生栾军波
孙 想, 刘炳奇, 陈展博, 李 欢, 李楚翘, 洪继生, 栾军波
(沈阳农业大学植物保护学院, 沈阳 110866)
共生菌在节肢动物中普遍存在,根据共生菌与昆虫共生关系的紧密程度,可将昆虫体内的共生菌分为专性共生菌(obligate symbionts)和兼性共生菌(facultative symbionts)两种类型(Feldhaar, 2011; Douglas, 2015)。专性共生菌通常分布于特化的体细胞——含菌细胞内,为宿主昆虫生长繁殖提供必需的营养物质(Moranetal., 2008; Douglasetal., 2015);兼性共生菌在宿主体内的分布呈多样化,可存在于含菌细胞、卵巢、中肠、血淋巴和唾液腺等多个组织中(Douglasetal., 2015; Shanetal., 2019)。虽然次生共生菌不是宿主昆虫生长繁殖所必需的,但对宿主昆虫的适应性至关重要(Oliveretal., 2010; Douglas, 2016)。例如,豌豆修尾蚜Megouracrassicauda缺失次生共生菌Regiella后无法在苜蓿上繁殖(Tsuchidaetal., 2011);豌豆蚜Acyrthosiphonpisum次生共生菌Rickettsiella有助于宿主昆虫躲避天敌的捕食(Oliveretal., 2010);烟粉虱Bemisiatabaci次生共生菌Rickettsia能够提高宿主昆虫适合度、增强烟粉虱对病原菌和温度的抵抗能力(Bruminetal., 2011; Himleretal., 2011; Hendryetal., 2014)。多数共生菌需要在宿主昆虫体细胞或器官中增殖后,借助宿主昆虫的生殖过程来促进自身的垂直传播(Russelletal., 2019; Perlmutter and Bordenstein, 2020; Fukatsu, 2021)。目前对胞内共生菌功能的研究较为广泛,但对于宿主昆虫调控共生菌增殖的分子机制知之甚少。
卵黄原蛋白(vitellogenin, Vg)作为一个多功能的糖磷脂复合蛋白,既是昆虫生殖的关键蛋白(Raikhel and Dhadialla, 1992; Sappington and Raikhel, 1998; Tufail and Takeda, 2008),也是识别宿主昆虫体内的微生物的关键蛋白(Lietal., 2009; Salmelaetal., 2015),在昆虫繁殖发育和共生菌遗传过程中具有重要功能(Sunetal., 2023)。此外,昆虫细胞自噬作为一种细胞免疫机制,是细胞内受损的蛋白质、细胞器以及感染细胞的细菌和病毒经溶酶体自我降解的过程(He and Klionsky, 2009)。例如,雷帕霉素饲喂烟粉虱诱导自噬,导致烟粉虱体内番茄黄曲叶病毒的外壳蛋白和基因组DNA降解(Wangetal., 2016)。当自噬发生后,自噬蛋白参与调控自噬体形成和成熟的不同阶段(He and Klionsky, 2009)。自噬蛋白Atg8是自噬体形成后唯一保留在自噬体膜上的蛋白质,因此在许多研究中将Atg8作为自噬发生的标记之一(Voroninetal., 2012; 谢昆等, 2013; Klionskyetal., 2014)。研究发现,自噬参与调控果蝇Drosophila和米象Sitophilusoryzae共生菌的增殖(Voroninetal., 2012; Vigneronetal., 2014)。沉默烟粉虱Atg8抑制自噬能够提高烟粉虱的中东小亚细亚MEAM1隐种含菌细胞内Portiera滴度(Wangetal., 2022)。Vg和自噬通路在昆虫-共生菌共生关系维持中均具有重要作用,然而Vg是否通过自噬通路调控共生菌增殖尚无研究。
在烟粉虱MEAM1隐种虫体分布着两类共生菌,其中共生菌Portiera和Hamiltonella分布于含菌细胞,共生菌Rickettsia分布在含菌细胞外的其他细胞(Wangetal., 2020; Baoetal., 2021)。之前的研究表明,抑制Vg表达导致共生菌Rickettsia和Portiera的丰度显著下降(Bruminetal., 2020; Sunetal., 2023);并且烟粉虱共生菌Rickettsia和Portiera丰度的变化与自噬有关(Shanetal., 2021; Wangetal., 2022)。前人研究发现,给羽化3 d内的烟粉虱饲喂10 μmol/L雷帕霉素诱导自噬后第5天时,烟粉虱雌成虫和卵子内Rickettsia丰度均显著降低(Shanetal., 2021)。BtVg和Rickettsia存在直接互作(Bruminetal., 2020),并且在烟粉虱卵子发生过程中,Rickettsia在卵巢内的分布呈动态变化(Shanetal., 2021)。然而,BtVg是否能够通过诱导烟粉虱自噬影响共生菌的丰度尚不明确。本研究通过采用细胞生物学和分子生物学等技术研究了BtVg和自噬对烟粉虱共生菌Rickettsia丰度的影响,明确BtVg能够保护Rickettsia免受自噬的降解。研究结果有助于增进对烟粉虱-Rickettsia互作机制的认识,为阐明烟粉虱调控共生菌增殖的分子机制提供依据。
1 材料与方法
1.1 供试材料
烟粉虱MEAM1隐种由浙江大学刘树生教授惠赠,在人工气候室内以“石远321”棉花Gossypiumhirsutum为寄主植物维持种群用于实验。饲养条件:温度(26±2) ℃,相对湿度60%~80%,光周期14L∶10D。“石远321”棉花的种子由中国农业科学院植物保护研究所陆宴辉研究员惠赠。实验所用的棉花苗的种植方法为:将颜色均一且颗粒饱满的棉花种子用10%甲醛水溶液浸泡1 h后,清水冲洗棉花种子2~3次,清水浸泡过夜,种植于营养土(泥炭∶珍珠岩∶蛭石=3∶1∶1, m/m)中,每3~4 d浇灌一次肥料(Miracle-Gro),待长出6~8片真叶后,用于接种烟粉虱MEAM1隐种。BtVg蛋白抗体由浙江大学叶恭银和王晓伟教授惠赠。表达GFP的质粒由西北农林科技大学田宏刚老师惠赠。
1.2 dsRNAs合成和显微注射
通过显微注射dsBtVg抑制BtVg的表达。基于烟粉虱MEAM1隐种BtVg(GenBank登录号: GU332720.1)和GFP(GenBank登录号: MN623123)序列设计合成dsBtVg和dsGFP的引物(表1),引物由上海生工生物公司合成。采用PrimerSTAR Max DNA Polymerase扩增dsBtVg和dsGFP的目的片段。使用T7 RiboMAXTMExpress RNAi System试剂盒合成dsBtVg和dsGFP。利用本实验室建立的成熟显微注射技术体系(Baoetal., 2021; 栾军波和闫金阳, 2021; Renetal., 2021),将羽化1 d内的烟粉虱MEAM1隐种雌成虫预先置于冰上,每头显微注射10 nL浓度为1.0 μg/μL的dsBtVg和dsGFP(对照)。注射dsRNAs后,将烟粉虱转移至含棉花叶片的培养皿中,并在培养皿底部放一层1.5%的琼脂培养基,于光照培养箱[温度(26±2) ℃,相对湿度60%~80%,光周期14L∶10D]内饲养。

表1 引物信息Table 1 Primer information
显微注射dsRNAs后,将烟粉虱MEAM1隐种雌成虫转移至含棉花叶片的琼脂培养皿中,在显微注射3 d时统计死亡率,每个处理设置5个生物学重复,每个生物学重复有30头个体。取显微注射dsRNAs后3 d时的烟粉虱MEAM1隐种雌成虫,采用Trizol法提取总RNA,采用Hifair Ⅱ 1st Strand cDNA Synthesis Kit(翌圣生物)合成cDNA,利用qRT-PCR检测烟粉虱BtVg和自噬相关基因BtAtg8的表达量,引物序列见表1。qRT-PCR扩增体系: cDNA模板2 μL, TB Green®Premix Ex TaqTMⅡ(TaKaRa)10 μL, 正反向引物(10 μmol/L)各0.8 μL, ddH2O 6.4 μL。反应程序: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环;熔解曲线,95 ℃ 10 s, 65 ℃ 5 s。每个处理设置3个生物学重复,每个生物学重复有10头个体。烟粉虱BtVg和BtAtg8的表达量检测分别以烟粉虱Btactin和BtRPL13为内参基因。
1.3 沉默BtVg后烟粉虱MEAM1隐种雌成虫Rickettsia丰度的测定
取1.2节显微注射dsRNAs后3 d时的烟粉虱MEAM1隐种雌成虫单头提取总DNA,基于共生菌Rickettsia的基因gltA(GenBank登录号: U59729)序列设计引物(表1),利用qPCR检测共生菌Rickettsia的gltA的表达量,测定Rickettsia的丰度。以烟粉虱β-actin为内参基因,qPCR扩增体系: DNA模板2 μL, iTaq Universal SYBR Green Supermix 10 μL,正反向引物(10 μmol/L)各0.8 μL, 添加无酶水至20 μL。反应程序: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环;熔解曲线: 95 ℃ 10 s, 65 ℃ 5 s。每个处理有10个生物学重复。
1.4 沉默BtVg后BtVg, Rickettsia和BtAtg8定位的免疫荧光标记观察
取1.2节显微注射RNAs后3 d时烟粉虱MEAM1隐种雌成虫,于PBS缓冲液中解剖卵巢和中肠,4%的多聚甲醛固定和0.2% Triton X-100渗透后,用Vg抗体(Guoetal., 2012)、Atg8抗体(Wangetal., 2022)和Rickettsia荧光探针(TCCACG TCGCCGTCTTGC-Cy5)(Gottliebetal., 2006)孵育卵巢管(Ⅱ-Ⅲ级),使用Rickettsia荧光探针孵育中肠,随后室温避光条件下用相对应的二抗[(Vg-Anti-Mouse IgG (H+L) Alexa-Fluor 594; Atg8-Anti-Rabbit IgG (H+L) Alexa-Fluor 488)]孵育2 h并用DAPI染细胞核30 min,用激光共聚焦显微镜观察BtVg和BtAtg8的表达和定位,以及Rickettsia的丰度。每个处理有3个生物学重复。
1.5 雷帕霉素处理后Rickettsia丰度和烟粉虱卵巢管内Atg8定位的检测
收集100头羽化2 d内烟粉虱MEAM1隐种雌成虫至饲喂管中,处理组饲喂含10 μmol/L雷帕霉素(用DMSO溶解)的人工饲料(25%蔗糖溶液),对照组饲喂含DMSO的25%蔗糖溶液的人工饲料(Wangetal., 2022),每隔2 d更换一次人工饲料,雷帕霉素处理后5 d时收集个体,于PBS缓冲液中解剖卵巢,固定、渗透后,用BtAtg8抗体孵育卵巢管,激光共聚焦显微镜观察BtAtg8在卵巢管中的表达和定位,具体方法同1.4节,每个处理设置3个生物学重复。此外,取雷帕霉素饲喂处理后3和5 d时的个体解剖卵巢提取总DNA,通过qPCR检测烟粉虱共生菌RickettsiagltA的表达量,测定Rickettsia丰度,每处理设置3个生物学重复,每生物学重复解剖10头个体,具体方法同1.3节。
1.6 数据分析
采用独立样本t检验方法对BtVg和BtAtg8的表达量、Rickettsia的丰度、烟粉虱雌成虫死亡率和BtAtg8的荧光值进行差异显著性比较。百分比数据在分析前转换为反正弦平方根。ImageJ软件用于荧光值分析。采用STATISTICA v6.1软件进行数据分析。GraphPad软件用于作图。
2 结果
2.1 沉默BtVg后对Rickettsia丰度和烟粉虱MEAM1隐种雌成虫死亡率的影响
与注射dsGFP的对照组相比,注射dsBtVg后3 d时BtVg的相对表达量显著降低(P=0.0025)(图1: A),表明BtVg表达被抑制;Rickettsia的gltA表达量显著降低(P=0.00124)(图1: B),表明Rickettsia丰度显著降低;同时,烟粉虱雌成虫死亡率显著升高 (P=0.011)(图1: C)。
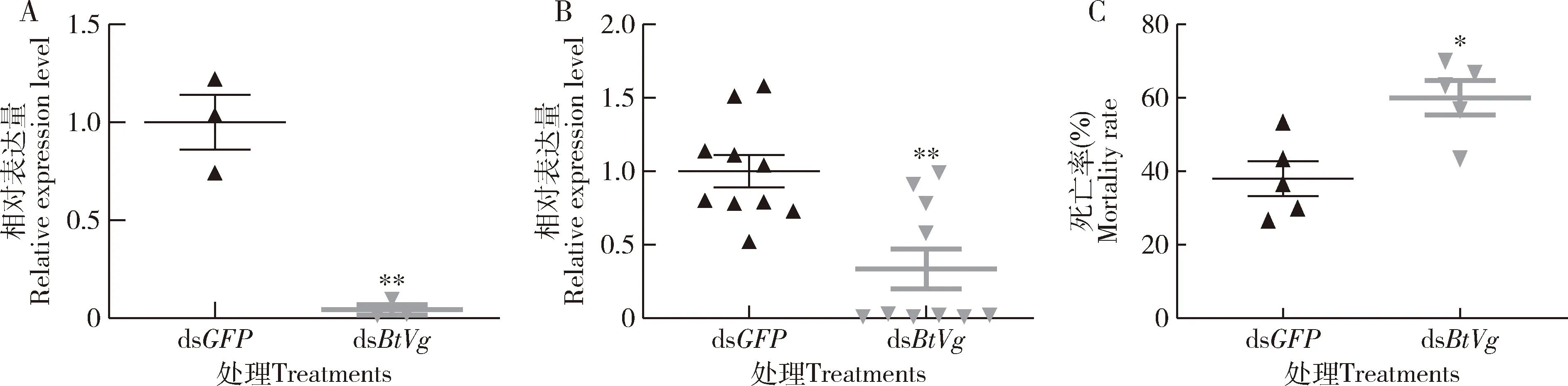
图1 显微注射烟粉虱MEAM1隐种雌成虫dsRNAs后3 d时BtVg (A) 和Rickettsia的gltA(B)表达量以及雌成虫死亡率(C)Fig. 1 Relative expression levels of BtVg (A) and gltA of Rickettsia (B), and mortality rates of female adults (C) at 3 d after microinjection of dsRNAs into the female adult of Bemisia tabaci MEAM1dsGFP: 对照Control. 图中数据为平均值±标准误;星号表示两组间差异显著(*P<0.05; **P<0.01; ***P<0.001)(t检验)。Data in the figure are mean±SE. Asterisks indicate significant difference between two groups (*P<0.05; **P<0.01; ***P<0.001)(t-test). 下图同。The same for the following figures.
2.2 沉默BtVg后对Rickettsia在烟粉虱MEAM1隐种雌成虫卵巢管和中肠内分布的影响
激光共聚焦显微镜观察表明,与注射dsGFP的对照组相比,注射dsBtVg后3 d时烟粉虱MEAM1隐种雌成虫Ⅱ-Ⅲ级卵巢管的卵原区(tropharium)和初级卵母细胞区(vitellarium)内BtVg的表达受到抑制,同时Rickettsia的丰度显著减少,表明BtVg能够影响Rickettsia在Ⅱ-Ⅲ级卵巢管内的定位(图2: A, B, D, E)。另外,激光共聚焦显微镜观察发现,与注射dsGFP的对照组相比,注射dsBtVg后3 d时烟粉虱MEAM1隐种雌成虫中肠内Rickettsia的丰度减少。与中肠内Rickettsia丰度下降程度相比,Ⅱ-Ⅲ级卵巢管内Rickettsia丰度下降更显著(图2: C, F)。
2.3 沉默BtVg后对BtAtg8在烟粉虱MEAM1隐种雌成虫中表达和在卵巢管中定位的影响
根据2.1和2.2节的结果可知,抑制BtVg表达导致烟粉虱雌成虫Rickettsia丰度显著降低,卵巢内Rickettsia的分布减少。为了明确抑制BtVg表达对Rickettsia丰度和分布的影响是否与自噬有关,qRT-PCR检测BtAtg8的表达量和BtAtg8的在卵巢管内的定位。结果表明,与注射dsGFP的对照组相比,注射dsBtVg后3 d时BtAtg8的表达量显著提高2.31倍(P=0.0116)(图3: A),BtAtg8在卵巢中的表达明显受到激活(图3: B)。综上表明,沉默BtVg诱导烟粉虱自噬。
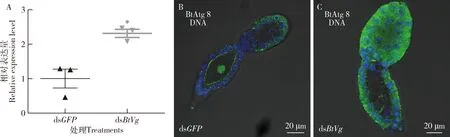
图3 显微注射烟粉虱MEAM1隐种雌成虫dsRNAs后3 d时BtAtg8的相对表达量(A)和BtAtg8(绿色)在卵巢管中的定位(B, C)Fig. 3 Relative expression level of BtAtg8 (A) and localization of BtAtg8 (green) in ovarioles (B, C) at 3 d after microinjection of dsRNAs into the female adult of Bemisia tabaci MEAM1
2.4 雷帕霉素处理烟粉虱MEAM1隐种雌成虫诱导自噬后对卵巢管中BtAtg8的表达和定位以及Rickettsia丰度的影响
与对照(DMSO)相比,饲喂雷帕霉素5 d时,BtAtg8在卵巢管内的表达明显上调(图4: A, B),BtAtg8在烟粉虱卵巢管内荧光值显著升高(P=0.0013)(图4: C), 表明BtAtg8表达量升高, 自噬被激活;饲喂雷帕霉素3和5 d时烟粉虱卵巢内Rickettsia的gltA表达量分别显著降低50%(P=0.0008)和26%(P=0.038)(图4: D),表明Rickettsia丰度显著降低。这些结果提示卵巢Rickettsia丰度降低可能与自噬被激活相关。
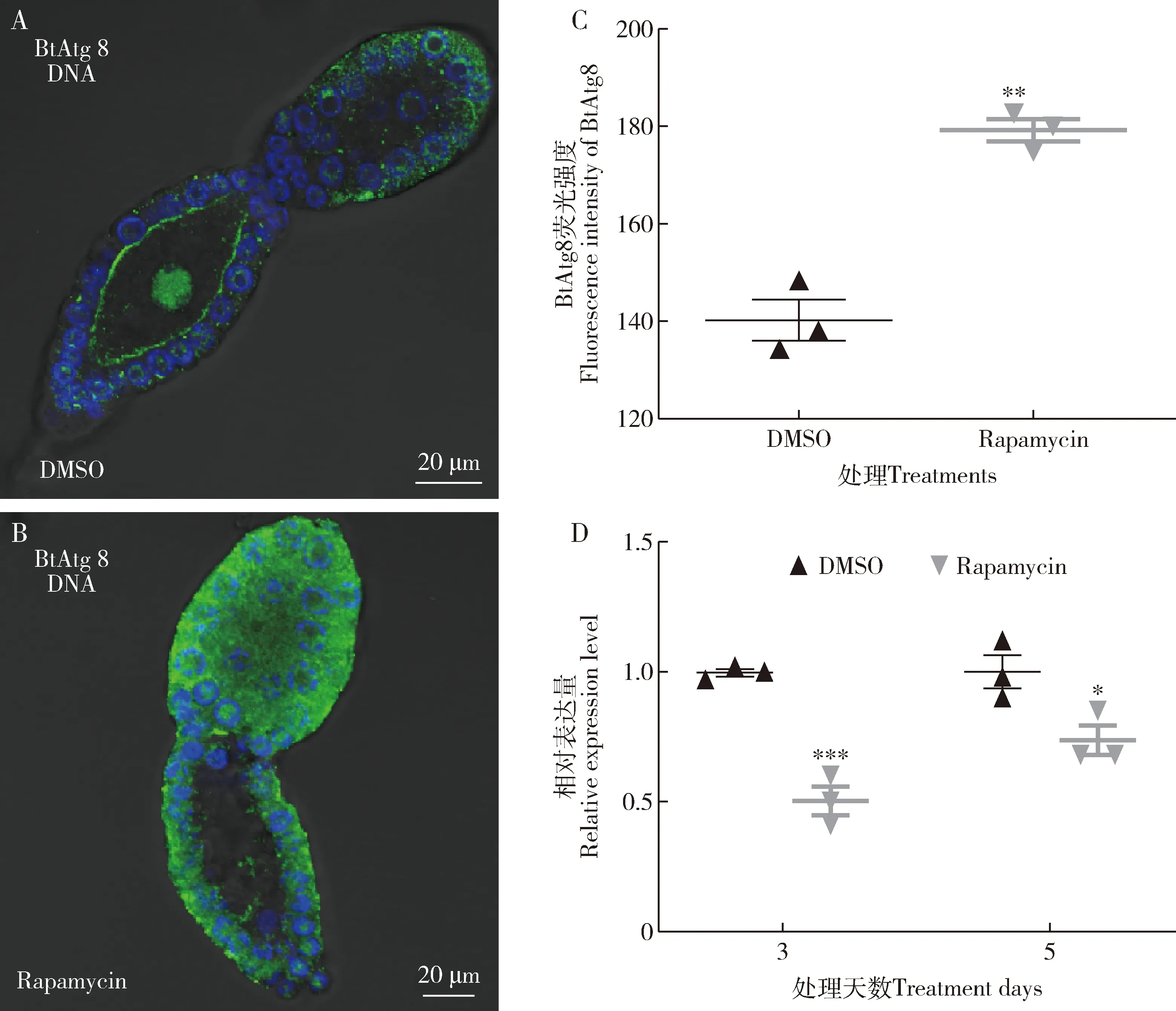
图4 饲喂烟粉虱MEAM1隐种雌成虫含雷帕霉素(10 μmol/L)人工饲料5 d时卵巢管中BtAtg8的定位(绿色)(A, B)和荧光强度(C)以及饲喂3和5 d时Rickettsia的gltA在卵巢内的相对表达量(D)Fig. 4 Localization (green) (A, B) and fluorescence intensity (C) of BtAtg8 in ovarioles at 5 d and relative expression level of gltA of Rickettsia (D) in ovaries at 3 and 5 d after feeding of the female adult of Bemisia tabaciMEAM1 with the artificial diet containing rapamycin (10 μmol/L)DMSO: 二甲基亚砜对照Dimethyl sulfoxide (control); Rapamycin: 雷帕霉素.
3 讨论
Rickettsia能够影响宿主昆虫适合度(Oliveretal., 2003; Sakuraietal., 2005; Giorginietal., 2010; Majerus and Majerus, 2010; Himleretal., 2011)。本研究发现,沉默BtVg导致烟粉虱Rickettsia丰度降低(图1: B),烟粉虱雌成虫的死亡率升高(图1: C),进一步表明Rickettsia可能影响烟粉虱雌虫存活率。共生菌在宿主昆虫种群世代间稳定地垂直传播,是协助宿主昆虫种群世代适应自然环境的基础(安鹏等, 2019)。因此,Rickettsia能够在宿主世代间稳定地垂直传播可能是影响烟粉虱MEAM1隐种雌成虫存活率的前提。已有研究表明,Rickettsia在烟粉虱体内通过两条途径侵染卵巢管实现垂直传播:一是通过内吞作用侵入卵巢管的卵原区后,通过营养索进入初级卵母细胞区;二是通过粘附在含菌细胞外进入初级卵母细胞(Shanetal., 2021)。本研究发现,沉默BtVg导致烟粉虱雌虫整虫Rickettsia丰度降低(图1: B),卵巢管内Rickettsia的分布减少(图2)。烟粉虱BtVg能够与Rickettsia互作(Bruminetal., 2020),并且BtVg在含菌细胞和卵巢管(卵原区和初级卵母细胞区)内高表达(Shanetal., 2021; Sunetal., 2023)。此外,果蝇Drosophila共生细菌Spiroplasma与Vg相互作用,借助VgR介导的内吞作用入卵垂直传播(Herrenetal., 2013)。推测烟粉虱Rickettsia可能通过与BtVg互作,借助BtVgR介导的内吞作用经卵巢传播。然而,抑制BtVg表达是否导致Rickettsia入卵受阻还需进一步探究。本研究发现,Rickettsia进入烟粉虱卵巢管(Ⅱ级)后,抑制BtVg表达能够诱导烟粉虱卵巢(Ⅱ级)自噬(图3),饲喂雷帕霉素激活卵巢管(Ⅱ级)自噬导致卵巢Rickettsia丰度降低(图4)。这些结果提示,BtVg可能通过自噬反应调控入卵后的Rickettsia丰度。
共生菌在宿主昆虫体内垂直传播的过程中,既要突破宿主各组织器官的物理屏障,还需要躲避宿主的体液和细胞免疫反应(Fukatsu, 2021)。一方面,宿主昆虫为了维持与共生菌之间的共生关系,需要降低其对共生菌的免疫能力。例如,褐飞虱Nilaparvatalugens为了维持其与类酵母共生菌之间的共生关系,通过降低雌虫的免疫相关基因defensin的表达量以减弱雌虫对类酵母共生菌的免疫能力(Baoetal., 2013)。自噬是宿主细胞抵御胞内微生物的重要途径(Amanoetal., 2006; Joetal., 2013; Paulusetal., 2015)。前期研究发现,BtVg定位于烟粉虱雌成虫携带Portiera的含菌细胞和携带Rickettsia的卵巢(Shanetal., 2021; Sunetal., 2023)。抑制烟粉虱BtVg的表达后,含菌细胞内Portiera滴度降低(Sunetal., 2023),卵巢内Rickettsia的分布减少(图2)。本研究结果进一步发现,沉默BtVg诱导烟粉虱卵巢自噬(图3),进而降低Rickettsia丰度(图4)。另外一方面,共生菌能够通过调节宿主昆虫细胞的自噬反应躲避宿主昆虫免疫反应(Chevalieretal., 2012; Voroninetal., 2012)。与携带Rickettsia的烟粉虱相比,缺失Rickettsia导致烟粉虱BtVg的表达水平下调(Kliotetal., 2019)。本研究结果发现,抑制BtVg表达能够诱导烟粉虱自噬(图3),表明BtVg可能通过调控自噬反应的强度维持烟粉虱-Rickettsia共生关系。
