黑翅土白蚁肠道放线菌菌株BYC-18及其抗菌代谢产物的分离鉴定
2023-11-30尹彩萍白雪妍NaeemABBAS孙璐璐殷欣冉张应烙
尹彩萍, 白雪妍, Naeem ABBAS, 孙璐璐, 殷欣冉, 张应烙
(安徽农业大学生命科学学院, 合肥 230036)
抗生素的发现和使用解决了细菌感染难以治疗这一难题,大大降低了人类及动物因细菌感染而死亡的几率,为人类的健康做出了巨大的贡献。由于其卓越的治疗效果,抗生素被广泛应用于畜牧业、水产养殖业、农业等各个领域,并且随着人类对抗生素功能的不断开发,其应用范围还在不断增加(卢明等, 2019)。但由于抗生素的过度使用导致致病菌耐药性不断增强,使得可供人类使用的抗生素种类不断减少(Bakeretal., 2018; Phametal., 2019; Berman and Krysan, 2020),人类很有可能陷入“无药可用”的困境(Sepúlvedaetal., 2017)。开发新型抗菌药物是解决致病菌耐药性的一种有效解决途径(Landmanetal., 2011),然而目前使用的抗生素主要来自土壤微生物(Fisheretal., 2022),由于重复的研究使得分离得到新型抗菌物质的概率很小(Lietal., 2016),因此寻找新的抗生素来源刻不容缓。昆虫共生放线菌作为一种特殊环境微生物,在与宿主的共进化过程中逐渐形成特殊的代谢通路(Jiangetal., 2017),是新型抗生素研发的宝贵资源(Li and Lou, 2018)。
黑翅土白蚁Odontotermesformosanus属昆虫纲(Insecta)等翅目(Isoptera)白蚁科(Termitidae)土白蚁属Odontotermes。这种白蚁在农作物、房屋建筑、档案图书等方面存在危害,威胁到人类的经济与生活(姜丽红等, 2017; 严少辉等, 2021);它们一般生活在阴暗潮湿、封闭恶劣的环境中,其巢穴二氧化碳浓度较高,且常有各类寄生病原菌的威胁,但其自身却不会被其中的诸多病菌感染,这说明黑翅土白蚁具有一套独特的自我防御机制。已有研究表明昆虫共生菌具有提高寄主抵御各种病害的能力(Ferrietal., 2017),因此黑翅土白蚁的防病机制可能与共生菌有关。本研究拟对黑翅土白蚁肠道放线菌进行分离鉴定,测定其对多种人类致病菌的抗菌活性,进一步追踪分离活性菌株的抑菌成分并鉴定其化学结构,旨在发现新颖的抗菌先导化合物,为新型抗生素的研发以及解决致病菌耐药性问题奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1样品采集:2017年2月,于浙江师范大学(29°00′17.37″N, 119°29′54.84″E)校园内采集供试黑翅土白蚁O.formosanus工蚁。
1.1.2供试致病菌:金黄色葡萄球菌Staphylococcusaureus、大肠杆菌Escherichiacoli、枯草芽孢杆菌Bacillussubtilis和白色念珠菌Candidaalbicans。
1.2 黑翅土白蚁共生放线菌的分离纯化
将捕捉到的供试黑翅土白蚁工蚁转移至实验室内保存。在经过24 h的饥饿处理后并在无菌条件下,将黑翅土白蚁的表面用75%的酒精进行消毒处理2~3 min后,用无菌水洗涤3次,每次30 s。用无菌的镊子,将虫体的肠道解剖出来,并将肠道放入灭菌的研钵中,加入少量无菌水研磨,将研磨液按梯度依次稀释为10-1, 10-2和10-3备用。各梯度稀释液用移液枪吸取200 μL,涂布于高氏一号培养基上。置于30 ℃培养箱内恒温培养2~3 d。纯化得到单菌落菌株接种到斜面试管,培养2~3 d后于4 ℃冰箱中保存备用。
1.3 黑翅土白蚁菌株发酵液的制取
将纯菌株接种到高氏一号液体培养基(250 mL锥形瓶内装有100 mL液体培养基)中,在摇床220 r/min 30 ℃下振荡培养7 d。将所得发酵液用纱布(6~8层)粗过滤后,利用无菌滤膜(直径0.22 μm)过滤除菌,并保存10 mL发酵液于已灭菌的离心管中备用。
1.4 抗菌活性测试
采用牛津杯法(Shangetal., 2014; Bernardinietal., 2018)测定发酵液对白色念珠菌和3种致病细菌的抑制活性。将4种供试菌在牛肉膏蛋白胨(NA)液体培养基中培养过夜后,将其培养液稀释到 3.0×108cfu/mL,涂布到NA固体培养基上。将灭菌后的牛津杯放置于凝固的培养基上,每杯用移液枪吸取并加入100 μL待测发酵液。以高氏一号液体培养基作为阴性对照,硫酸庆大霉素和两性霉素B分别作为抗细菌和酵母菌的阳性对照,每组对照重复3次。于37 ℃(细菌)或28 ℃(白色念珠菌)的培养箱中培养2 d,用十字交叉法测量抑菌圈的直径。
1.5 黑翅土白蚁肠道放线菌的鉴定
1.5.1形态学特征鉴定:将纯化好的菌株活化培养3 d后,利用插片法培养放线菌并用封口膜进行封口。30 ℃培养3 d后观察其菌落的外部形态特征。利用光学显微镜,观察气生菌丝、基内菌丝、孢子丝和孢子,并对菌株进行初步鉴定。根据其形态学结构,通过鉴定手册对其进行初步鉴定。
1.5.2分子生物学鉴定:菌株活化后,提取基因组DNA,参照张萍华等(2021)方法进行PCR扩增、测序。将最终所得序列,按相似性高低对目标菌株进行BLAST比对分析,选取不同相似度序列,采用MEGA 5.0软件进行系统发育分析,采取邻接法(neighbor-joining, NJ)构建系统发育树,同时进行1 000次自举分析(bootstrap),分析所得的自举值标记在各分支上,最终确定菌株的分类地位。
1.6 黑翅土白蚁肠道放线菌发酵液不同极性物质的提取及抗菌活性测定
将目标菌株根据1.3节的方法制备发酵液,将制备好的发酵液依次用石油醚、二氯甲烷、乙酸乙酯和正丁醇4种溶剂萃取数次至萃取液上层无色,将得到的萃取液合并,减压蒸馏得到不同极性溶剂浓缩粗提物,并对上述粗提物采用滤纸片法确定目标菌株的活性部位(Zhangetal., 2011)。将4种供试菌活化培养1 d后备用,在无菌条件下将其培养液稀释到 3.0×108cfu/mL后,吸取200 μL涂布到牛肉膏蛋白胨固体培养基上。将事先准备好的粗提物以及阳性对照物用丙酮(分析纯)溶解,配制成6 mg/mL的溶液,并利用无菌滤膜(直径0.22 μm)过滤除菌后备用。取事先灭好菌的5 mm滤纸片,每片滤纸片上滴5 μL液体,等丙酮挥干后,贴于已经涂布好菌液的固体平板上。将平板倒置,于培养箱中培养2 d。每组实验重复3次,采用十字交叉法测量抑菌圈直径大小。
1.7 目标菌株中活性化合物的分离鉴定及其抗菌活性测定
将目标菌株在高氏固体培养基上28 ℃培养3 d后接种到高氏一号液体培养基(250 mL锥形瓶中装有50 mL液体培养基),在摇床220 r/min 30 ℃下振荡培养3 d,取30 mL培养液作为种子液转移到高氏一号液体培养基(1 000 mL锥形瓶中装有400 mL液体培养基)中,在摇床220 r/min 30 ℃下振荡培养7 d。 重复上述步骤直到积累到足够生物量的培养液。
用纱布过滤培养液作为上清液,在室温下用乙酸乙酯萃取上清液,将萃取后的上清液在真空中蒸发得到大量发酵液的粗浸膏。获得的萃取物先进行硅胶薄层层析(thin layer chromatography, TLC),选择合适的柱层析洗脱体系,本研究选用CH2Cl2和CH3OH混合溶液体系。粗分选用200~300目硅胶粉装填硅胶柱。上样时尽量使样品在硅胶柱表面分布均匀,用CH2Cl2∶CH3OH体系进行梯度(100∶0, 100∶1, 100∶2, 100∶4, 100∶8和100∶16, v/v)洗脱,200 mL/馏分减压浓缩干后,用少量CH2Cl2/CH3OH混合溶剂溶解,并进行薄层层析点板,经254和365 nm 紫外灯、 5%硫酸乙醇和碘显色等显色分析,合并相同组分。较纯组分经LH-20交联葡聚糖色谱柱,以甲醇为洗脱液进行柱层析,硅胶薄层层析点板验证化合物纯度。采用氢核磁共振谱、碳核磁共振谱、质谱等多种波谱学技术测定活性化合物的具体结构。采用滤纸片法和最低抑菌浓度(minimal inhibitory concentration, MIC)测定单体化合物的抗菌活性(Thomfordetal., 2018)。
2 结果
2.1 目标菌株的筛选与鉴定
从黑翅土白蚁肠道中共分离纯化得到62株肠道放线菌,采用牛津杯法对菌株发酵液进行抗菌活性测试,结果表明菌株BYC-18发酵液对白色念珠菌、金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有一定的抑制效果,抑菌圈直径分别为(9.2±0.2), (9.3±1.1), (10.3±0.3) 和(11.1±1.0) mm。
根据目标菌株BYC-18的菌落、气生菌丝、基内菌丝及孢子丝形态特征(菌落形态见图1),通过伯杰氏系统细菌学手册中所描述的放线菌培养特征进行比较,初步鉴定BYC-18菌株均为链霉菌属Streptomyces的放线菌。进一步提取BYC-18菌株的16S rRNA进行测序并进行比对,发现BYC-18的序列与链霉菌属S.griseoaurantiacus的16S rRNA序列相似性达98.81%,两者在系统发育树上处于同一分支(图2),因此,将菌株BYC-18鉴定为链霉菌属菌株Streptomycessp.。
图1 BYC-18的菌落形态Fig. 1 Colonial morphology of BYC-18
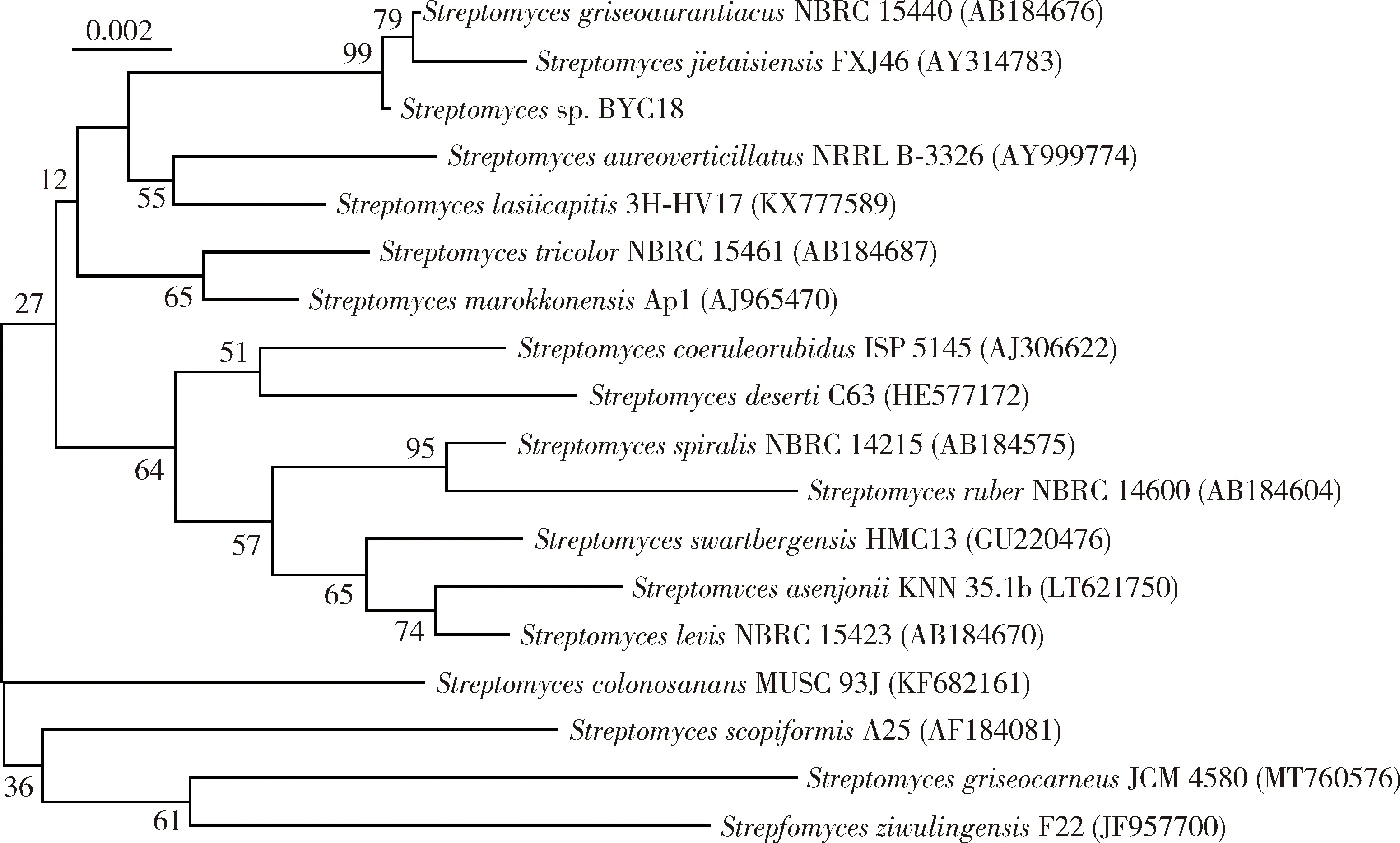
图2 采用邻接法基于16S rRNA序列构建的链霉菌BYC-18系统发育树Fig. 2 Phylogenetic tree of Streptomyces BYC-18 constructed with neighbor-joining method based on 16S rRNA sequence每个分支点上的数字为引导值的支持百分率;标尺代表0.2%的序列差异。The number at each branch point is the percentage supported by bootstrap. The scale bar indicates 0.002 sequence divergence.
2.2 放线菌BYC-18发酵液不同极性溶剂萃取物的抗菌活性
黑翅土白蚁肠道放线菌BYC-18发酵液不同极性溶剂萃取物对4种供试菌抗菌活性测定结果见表1,从表中可看出BYC-18发酵液的乙酸乙酯相萃取物对4种供试菌均有抑菌活性,对金黄色葡萄球菌的抑制作用最好,抑菌圈直径达到(11.1±0.2) mm,其他极性溶剂萃取物活性较差或无活性,因此,目标菌株BYC-18发酵液的抗菌活性物质主要存在于中等极性的乙酸乙酯部位。

表1 BYC-18不同极性溶剂萃取物对白色念珠菌和3种致病细菌的抑菌圈直径(mm)Table 1 Inhibition zone diameters (mm) of different polar solvent extracts of BYC-18on Candida albicans and three pathogenic bacteria
2.3 放线菌BYC-18活性化合物的分离与结构鉴定
对BYC-18通过硅胶柱和凝胶柱层析分离,从黑翅土白蚁共生放线菌BYC-18的发酵液的乙酸乙酯相粗提物中得到1个单体化合物BYC-18-1,TLC分析表明BYC-18-1的比移值为0.41(展开剂CH2Cl2∶MeOH=20∶1)(图3)。

图3 BYC-18-1的薄层层析(TLC)(展开剂CH2Cl2∶MeOH=20∶1)Fig. 3 Thin-layer chromatography (TLC) chromatogram of BYC-18-1 (developing solvent CH2Cl2∶MeOH=20∶1)
进一步测得BYC-18-1核磁共振氢谱和碳谱如图4和图5所示,单体化合物BYC-18-1是紫色粉末,ESI-MSm/z537[M+H]+,推测其分子式为C27H20O12。 该化合物的波谱数据如下:1H NMR(600 MHz, CDC13) δ:12.84 (1H, s, H-8′), 11.06 (1H, s, H-10), 7.46 (1H, s, H-6), 6.94 (1H, s, H-5), 6.76 (1H, s, H-6′), 4.03 (6H, s, 5′-OCH3, 7′-OCH3), 3.98 (3H, s, 7-OCH3), 3.67(1H, d,J=18.9 Hz, H-3′), 3.45 (1H, m, H-4), 3.34 (1H, d,J=18.9 Hz, H-3′), 2.94 (1H, m, H-4), 2.50 (1H, m, H-3), 2.30 (1H, m, H-3);13C NMR (150 MHz, CDC13) δ:181.9 (C-9′), 179.2 (C-4′), 164.9 (C-9), 160.4 (7-COOCH3), 179.2 (C-5′), 155.4 (C-7′), 154.9 (C-9′a), 150.5 (C-10), 149.6 (C-8′), 141.2 (C-7), 141.2 (C-10a), 131.5 (C-4a), 127.4 (C-5a), 127.4 (C-3′a), 118.2 (C -5), 113.5 (C-6), 111.1 (C-2), 114.8 (C-8′a), 110.6 (C-4′a), 106.6 (C-9a), 103.7 (C-6′), 57.1 (7′-OCH3), 56.4 (5(-OCH3), 52.9 (7-OOCH3), 40.1 (C-3′), 29.6 (C-3), 22.2 (C-4)。与尚宁宁等(2017)记载的数据对比,确定单体化合物BYC-18-1为β-玉红霉素(β-rubromycin),其具体化学结构如图6所示。

图4 BYC-18-1的氢谱Fig. 4 Hydrogen spectrum of BYC-18-1

图5 BYC-18-1的碳谱Fig. 5 Carbon spectrum of BYC-18-1

图6 BYC-18-1的化学结构Fig. 6 Chemical structure of BYC-18-1
2.4 β-玉红霉素的抗菌活性
β-玉红霉素的抗菌活性结果如表2所示。从表中可看出,当供试样品浓度为30 μg/6 mm滤纸片时,β-玉红霉素对4种供试菌均有不同程度的抑制作用,特别是对金黄色葡萄球菌具有较强的抑制作用,其抑菌圈直径达到(13.2±0.4) mm,与阳性对照药物硫酸庆大霉素的抑菌活性[抑菌圈直径(16.6±0.2) mm]相当;β-玉红霉素对大肠杆菌也表现出较强的抗菌活性[抑菌圈直径(9.5±0.4) mm],但比阳性对照硫酸庆大霉素抑制效果[抑菌圈直径(15.2±0.4) mm]稍弱;对枯草芽孢杆菌和白色念珠菌均表现出较弱的抑菌效果,抑菌圈直径均小于8 mm。最低抑菌浓度(MIC)活性测试表明β-玉红霉素对金黄色葡萄球菌的MIC为25.0 μg/mL,比阳性对照差。

表2 β-玉红霉素对白色念珠菌和3种致病细菌的抗菌活性Table 2 Antimicrobial activities of BYC-18-1 against Candida albicans and three pathogenic bacteria
抑菌圈直径测定中供试浓度为30 μg/6 mm滤纸片;硫酸庆大霉素和两性霉素B分别为3种致病细菌和白色念珠菌的阳性对照;丙酮为3种致病细菌和白色念珠菌的阴性对照。表中数据为平均值±标准误。The concentration in inhibition zone diameter test was 30 μg/6 mm filter paper. Gentamicin sulfate and amphotericin B were positive controls for three pathogenic bacteria andC.albicans, and acetone was the negative control for three pathogenic bacteria andC.albicans. Data in the table were mean±SE. MIC: 最低抑菌浓度Minimum inhibitory concentration.
3 讨论与结论
许多研究者将不同昆虫肠道微生物作为新的抗菌物质重要来源之一。李铭辉等(2023)从药用昆虫喙尾琵琶甲Blapsrynchopetera肠道中分离得到1株链霉菌Streptomycessp.,该菌株乙酸乙酯萃取物对多种病原菌均有抑菌活性,随后又进一步分离纯化其活性成分。同许多昆虫一样,黑翅土白蚁肠道中有存在着具有抗菌活性的微生物帮助宿主抵御外来病原菌的入侵。本研究中筛选出的BYC-18发酵液对白色念珠菌、金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有抑制效果,抑菌圈直径均大于9 mm,因此,黑翅土白蚁肠道放线菌BYC-18具有作为微生物源杀菌剂值得进一步研究的价值。
经形态学和分子生物学鉴定,BYC-18为链霉属Streptomycessp.放线菌,进一步发现其抗菌活性物质主要存在于中等极性的乙酸乙酯相(表1)。在活性跟踪指导下,经凝胶柱层析等多种色谱方法,从目标菌株BYC-18发酵液的乙酸乙酯相粗提物中分离得到1个单体化合物BYC-18-1(β-玉红霉素)(图6),目前已有报道该化合物对多种植物病原真菌的生长均有抑制作用(尚宁宁等, 2017)。本研究发现:当供试浓度为30 μg/6 mm滤纸片时,化合物β-玉红霉素对白色念珠菌、金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有不同程度的抑制活性(表2)。对金黄色葡萄球菌具有较强的抑菌活性,其抑菌圈直径达到13.2 mm,与阳性对照药物硫酸庆大霉素的抑菌活性(抑菌圈直径16.6 mm)相当;对大肠杆菌也表现出较强的抗菌活性(9.5 mm),但比阳性对照硫酸庆大霉素的抑制效果(抑菌圈直径15.2 mm)稍弱(表2)。因此β-玉红霉素可能是放线菌BYC-18的主要抑菌物质。单体化合物BYC-18-1作为抗菌先导化合物具有进一步的开发潜力,至于单体化合物β-玉红霉素的安全性和活性作用机理,以及其他单体化合物分离鉴定等有待进一步的研究探讨。
