小菜蛾肠道成团泛菌PxG45的分离鉴定及其抗真菌活性
2023-11-30付东冉许小霞冯淑杰金丰良
付东冉, 许小霞, 冯淑杰, 金丰良,*
(1. 华南农业大学植物保护学院, 绿色农药国家重点实验室, 广州 510642;2. 华南农业大学园艺学院植物保护实验室, 广州 510642)
小菜蛾Plutellaxylostella隶属于鳞翅目(Lepidoptera)菜蛾科(Plutellidae)。小菜蛾是寡食性害虫,食性专一,以十字花科蔬菜为主。为了对小菜蛾进行防治,长久以来,人们尝试使用各种广谱性化学杀虫剂。然而化学农药存在的3R[农药残留(residue)、抗药性(resistance)和害虫再猖獗(resurgence)]效应(李振宇等, 2020),使得寻找新生物农药、改良原有生物农药变得尤为重要。其中改良原有生物农药离不开对宿主响应机制的研究,目前已有报道指出,昆虫肠道共生菌很可能在此过程中起到重要作用(Chengetal., 2017; Gichuhietal., 2020; 王争艳等, 2020)。
昆虫肠道共生菌是栖息在昆虫肠道中的微生物,是肠道微生物群落中最主要的成员(Chenetal., 2018),它们对昆虫的生长发育(Shaoetal., 2012)、营养吸收(Salemetal., 2014)以及机体免疫(徐红星等, 2009)均具有重要影响。多数情况下,肠道共生菌对宿主昆虫是有利的,例如白蚁的肠道菌群可以将木质素降解为宿主可利用的物质,帮助宿主的营养代谢(Aroraetal., 2022);小菜蛾肠道共生菌肠球菌Enterococcussp.可以提高宿主昆虫对杀虫剂毒死蜱的抗性(Xiaetal., 2018);小菜蛾肠道中的蜡状芽孢杆菌Bacilluscereus可降解20%的茚虫威,降低小菜蛾在茚虫威施用后的死亡率(Ramyaetal., 2016)。
成团泛菌Pantoeaagglomerans是一种革兰氏阴性杆状细菌,属于变形菌门(Proteobacteria)γ-变形菌纲(γ-Proteobacteria)肠杆菌科(Enterobacteriaceae)泛菌属Pantoea(Spröeretal., 1999),是泛菌属的模式菌。成团泛菌广泛存在于土壤(Omaretal., 1989)、水(de los Angeles Mossoetal., 1994)和植物(Duanetal., 2007)中,同时成团泛菌也是许多昆虫的肠道共生菌(Gauthieretal., 2015),目前已从台湾乳白蚁Coptotermesformosanus(Potrikus and Breznak, 1977)、沙漠蝗Schistocercagregaria(Hunt and Charnley, 1981)、舞毒蛾Lymantriadispar(Brodericketal., 2004)、钩臂蚁蛉Myrmeleonbore(Nishiwakietal., 2007)、椿象(Pantatomidae)(Prado and Almeida, 2009)等多种昆虫肠道中分离鉴定出成团泛菌。Jin和Kim (2023)发现通过回补成团泛菌可以挽救抗生素处理后蓟马发育迟缓的现象,证明成团泛菌有利于宿主的生长发育。另一方面成团泛菌在宿主抵御病原微生物侵染的过程中起着重要作用,已有报道指出,沙漠蝗肠道中的共生菌成团泛菌可以通过分泌抗真菌的酚类物质帮助宿主抵抗昆虫病原真菌绿僵菌Metarhiziumanisopliae的侵染(Dillon and Charnley, 1995)。
越来越多的研究证明肠道菌成团泛菌在宿主存活和抵抗病原物侵染的过程中起到正向作用。然而截至目前,关于小菜蛾肠道中泛菌的报道仍停留在属的层面(戴楠晶, 2014),鲜有报道泛菌属下具体菌种及其在小菜蛾生存免疫等方面起到的作用。本研究从小菜蛾肠道中分离纯化出1株肠道菌PxG45,并对PxG45进行菌种鉴定和功能验证。结合平板对峙结果证明PxG45不仅可以抑制昆虫病原真菌的生长,还对植物病原真菌具有广谱性抑制作用。这不仅为肠道共生菌帮助宿主昆虫抵御病原微生物侵染提供了一个较好的案例,同时找到了一个利用害虫肠道共生菌的新方法,即将有抑菌作用的肠道菌作为生防菌防治植物病原微生物,为生物防治及新型农药开发提供参考依据。
1 材料与方法
1.1 供试昆虫与菌株
供试小菜蛾由本实验室传代饲养50代以上。饲养条件为温度(25±1) ℃、相对湿度65%、光周期16L∶8D。在传代过程中幼虫喂食人工饲料,饲料配方参照沈金红等(2018),成虫饲喂10%蜂蜜水补充营养,卵用浸过萝卜菜汁的卵卡收集。
供试小菜蛾肠道共生细菌PxG2由本实验室分离纯化并长期保存。PxG2属于肠杆菌属与PxG45同科不同属且无致病性,在本研究中作为同型对照使用。供试昆虫病原真菌球孢白僵菌Beauveriabassiana由中国科学院动物研究所邹振研究员惠赠。球孢白僵菌孢子悬浮液的制备、侵染浓度的确定及侵染方法(饲喂法)的可行性分析参考王冰等(2014)。
供试植物病原真菌希金斯炭疽菌Colletotrichumhigginsianum、刺盘孢炭疽菌C.camelliae、茄链格孢菌Alternariasolani和丁香假单胞菌杨梅致病变种Pseudomonassyringaepv.myricae菌株由华南农业大学园艺学院冯淑杰副教授惠赠,尖孢镰刀菌古巴专化型4号生理小种Fusariumoxysporumf. sp.cubenserace 4和稻瘟病菌Magnaportheoryzae菌株由华南农业大学植物保护学院李云峰教授实验室惠赠。
1.2 主要试剂
细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;2×Rapid Taq Master Mix和D2000 Marker购自南京诺唯赞生物科技股份有限公司;定量反转录试剂盒PrimeScriptTMRT Master Mix和实时荧光定量PCR试剂盒TB Green Premix Ex TaqⅡ 购自TaKaRa宝日医生物技术有限公司。本研究使用的其他试剂均为国产分析纯试剂。
1.3 PxG45的分离纯化与菌种鉴定
随机选取10头健康小菜蛾3龄第1天幼虫,使用75%酒精对其进行体表消毒,后用无菌蒸馏水洗涤3次洗去残留酒精。使用消毒的镊子解剖小菜蛾幼虫肠道置于200 μL PBS中。将解剖的肠道研磨成匀浆,涂布于Luria-Bertani固体培养基(LB)上,在30 ℃恒温培养箱中培养24 h时挑取培养基上的单菌落接种到新的LB固体培养基上重复纯化5次以上。将纯化后的细菌接种到LB液体培养基中37 ℃ 200 r/min培养至对数生长期,以1∶1 000比例(v/v)接种到LB液体培养基中,在37 ℃ 200 r/min条件下培养12 h得到种子液,再将种子液以1∶100比例(v/v)接种到新的LB液体培养基中,37 ℃ 200 r/min培养至OD600=1.0获得活化的PxG45菌株。使用平板划线法(Coleetal., 2004)将PxG45接种至LB固体培养基,30 ℃培养12 h观察菌落形态(佘小漫等, 2021)。使用光学显微镜观察革兰氏染色结果(徐德峰等, 2013)对PxG45菌株进行分类。通过超薄切片制样方法(Haegemanetal., 2009)使用透射电子显微镜对PxG45的内部结构进行观察。
使用细菌基因组DNA提取试剂盒提取活化的PxG45的基因组DNA,提取后的DNA作为PCR扩增模板。利用细菌16S rDNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGTTACCTTGTTACGACTT-3′)扩增PxG45的16S rDNA基因。PCR反应体系: 2×Rapid Taq Master Mix 12.5 μL,DNA模板1 μL,正反向引物(10 μmol/L)各1 μL,加灭菌ddH2O至25 μL。反应程序: 95 ℃预变性3 min; 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 1 min, 35个循环;72 ℃延伸5 min。PCR产物在1.0%琼脂糖进行电泳检测,切胶回收纯化并送往擎科生物技术公司(广州)进行测序。使用SeqMan(DNAStar)对测序所得的16S rDNA基因序列进行拼接,将拼接好的序列上传至GenBank数据库,并与NCBI中rDNA/ITS数据库进行BLAST比较(Altschuletal., 1990)。选择亲缘关系相近的10种细菌的16S rDNA基因序列,使用Clustal x1.8方法(Thompsonetal., 1997),结合Mega 7.0软件(Tamuraetal., 2013),采用邻接法(neighbor-joining, NJ)(Saitou and Nei, 1987)构建系统发育树,以确定PxG45系统发育关系。同时根据《伯杰细菌鉴定手册》(第9版)对PxG45菌株进行生理生化测定,鉴定PxG45可利用碳氮源。
1.4 PxG45对小菜蛾幼虫存活率的影响测定
将1.3节中2次接种的PxG45以8 000 r/min离心2 min,弃上清收集菌体,使用灭菌ddH2O清洗3次。用ddH2O将菌体进行重悬,调整菌悬液至OD600=1.0,同型对照菌PxG2菌悬液获得方法同上。去除1.1节人工饲料配方中的防腐剂,其他成分不变,制备不含防腐剂的人工饲料。将OD600=1.0的PxG45和PxG2两种菌悬液分别加入到不含防腐剂的人工饲料(250 μL∶1 g)中,充分搅拌混匀。
将健康小菜蛾3龄第1天幼虫放入无菌培养皿,3个培养皿为一个处理,每个培养皿15头虫。饥饿处理3 h后饲喂混有PxG45和PxG2的无防腐剂人工饲料,并以混有ddH2O(250 μL)的无防腐剂人工饲料(1 g)作为假处理对照。每隔12 h记录3组活虫数,直至3组活虫数不变,计算存活率,实验进行3次生物学重复。增设1组混有ddH2O(250 μL)的正常人工饲料(1 g,含防腐剂),平行对比PxG45在小菜蛾幼虫生存过程中所起作用与防腐剂是否有显著差异。
1.5 PxG45对球孢白僵菌的生物测定
使用仅含PxG45菌悬液(OD600=1.0)的人工饲料(250 μL∶1 g)持续饲喂小菜蛾3龄第1天幼虫12 h,以添加ddH2O(250 μL)的人工饲料(1 g)作为对照,12 h时更换仅添加球孢白僵菌孢子悬浮液(1×107CFU/mL)的人工饲料进一步饲喂2组小菜蛾。每隔12 h记录1次活虫数量,直至2组活虫数不变,实验进行3次生物学重复。为获得小菜蛾无肠道菌种群,我们向刚孵化的小菜蛾幼虫饲喂抗生素复合物(1 mg/mL左氧氟沙星、1 mg/mL环丙沙星和2 mg/mL甲硝唑)直至发育到3龄第1天;随后解剖小菜蛾肠道,取内容物涂板LB固体培养基;30 ℃培养24 h;与正常饲喂条件下所得内容物的涂板结果进行比较,参照Li等(2021)的方法进一步检测抗生素清除效果,获得无肠道菌小菜蛾幼虫。
为获得仅含PxG45的小菜蛾种群,我们将PxG45菌悬液回补给经抗生素处理后所得的无肠道菌小菜蛾种群,回补12 h时解剖取肠道内容物,涂板LB固体培养基,30 ℃培养24 h时观察细菌生长情况;以未回补PxG45的无菌小菜蛾种群作为对照,检测PxG45是否回补成功(Wangetal., 2022)。
向回补和未回补PxG45的小菜蛾无菌种群饲喂球孢白僵菌孢子悬浮液(1×107CFU/mL),对2组小菜蛾的存活率进行生物测定。将球孢白僵菌侵染后死亡的小菜蛾转移至PDA培养基,在温度(25±1) ℃和相对湿度75%±5%条件下培养,待菌丝体从死亡小菜蛾中萌发后使用体视镜进行观察,确保球孢白僵菌在饲喂条件下成功侵染小菜蛾。
1.6 PxG45对病原真菌抗菌活性测定
采用平板对峙方法(Fernandesetal., 2021)测定PxG45对球孢白僵菌以及植物病原真菌希金斯炭疽菌、刺盘孢炭疽菌、茄链格孢菌、丁香假单胞菌杨梅致病变种、尖孢镰刀菌古巴专化型4号生理小种和稻瘟病菌7种病原真菌的抗性,将活化的病原真菌接种在PDA固体培养基中心,在距菌饼2.5 cm的对称处分别接种PxG45。使用只接种病原真菌的平板作为对照,在温度(25±1) ℃和相对湿度75%±5%下倒置培养。根据病原真菌的生长周期,测定处理组和对照组的菌落直径,评估PxG45的抑菌作用。每组实验重复3次。抑制率(%)=[(对照组中病原真菌菌落直径-处理组中病原真菌菌落直径)/(对照组中病原真菌菌落直径)]×100。
1.7 数据分析
存活率数据使用艾波特公式(Abbott’s formula)校正(Abbott, 1925)。采用log-rank(Mantel-Cox)检验对不同处理下小菜蛾存活率差异进行统计分析。采用F检验对处理组(与PxG45拮抗生长)真菌菌落直径与对照组(单独接种真菌)进行方差同质性检验,方差同质性检验后采用独立样本T检验对数据进行差异显著性分析。数据处理及图表制作均使用 GraphPad Prism 8.0 软件进行。
2 结果
2.1 小菜蛾肠道菌PxG45形态
在LB固体培养基上生长的PxG45菌株颜色为黄色,菌落呈扁平圆形中部见凸起,菌体湿润黏着度高,菌落四周有淡色黄晕(图1: A)。革兰氏染色后细菌呈现红色(图1: B),为革兰氏阴性细菌(Kauretal., 2020)。通过透射电子显微镜对PxG45进行观察,结果表明该细菌是一种具有鞭毛的杆状细菌(图1: C)。
2.2 基于16S rDNA基因的PxG45系统发育
PCR结果显示,PxG45的16S rDNA基因序列大约长1 500 bp,通过测序结果确定序列全长1 437 bp (GenBank登录号: SUB9019981)。系统进化树表明(图2), PxG45分布在泛菌属进化分支上,与成团泛菌Pantoeaagglomerans16S rDNA (NR 041978.1)序列一致性最高,达98.9%。

图2 邻接法构建的基于16S rDNA基因序列小菜蛾3龄幼虫肠道细菌PxG45与其他菌种的系统发育树Fig. 2 Phylogenetic tree of the gut bacterium PxG45 from the 3rd instar larva of Plutella xylostella and other bacterial species based on 16S rDNA gene sequences constructed by neighbor-joining method
2.3 PxG45生理生化特征
PxG45生理生化测定结果显示,PxG45可利用甲基红、果糖、淀粉、D-甘露糖、乳糖、L-阿拉伯糖、D-甘露醇、麦芽糖、D-木糖、纤维二糖和葡萄糖,不可利用H2S、吲哚、柠檬酸盐、乳糖、棉子糖和氧化酶。通过形态学鉴定、系统发育分析和生理生化测定的综合结果,确定PxG45是成团泛菌P.agglomerans。
2.4 PxG45对小菜蛾幼虫存活率的影响
结果如图3所示,以只添加ddH2O无防腐剂人工饲料为食的小菜蛾3龄幼虫存活率显著低于以含有防腐剂的正常人工饲料为食的小菜蛾3龄幼虫存活率(P<0.01),且在48 h时无防腐剂组小菜蛾幼虫存活率下降到68%,而这一现象在向无防腐剂人工饲料中添加PxG45后被逆转,即在不含防腐剂的人工饲料中添加PxG45,小菜蛾3龄幼虫存活率显著高于添加ddH2O的假处理对照组(χ2=6.835,P=0.009)和添加PxG2的同型对照组(χ2=4.697,P=0.030)。24 h时,假处理对照组小菜蛾3龄幼虫存活率为83%,同型对照组小菜蛾3龄幼虫存活率为87%,而饲喂PxG45的处理组小菜蛾3龄幼虫存活率还在93%以上。此后36-48 h时饲喂PxG45组小菜蛾3龄幼虫与假处理对照组和同型对照组小菜蛾3龄幼虫存活率差异更加明显,直到48 h后3组活虫数均不再发生变化。此时2组对照组3龄幼虫存活率分别是68%(ddH2O)和73%(PxG2),而饲喂PxG45处理组幼虫存活率仍保持在91%以上。将混有PxG45的无防腐剂组与含有防腐剂组进行比较,得到结果显示两组间小菜蛾3龄幼虫存活率无显著差异(χ2=1.879,P=0.171)。以上结果说明PxG45与防腐剂等效,可以通过抑制环境中的微生物延缓饲料变质,对小菜蛾幼虫起到保护作用,提高小菜蛾幼虫的存活率。
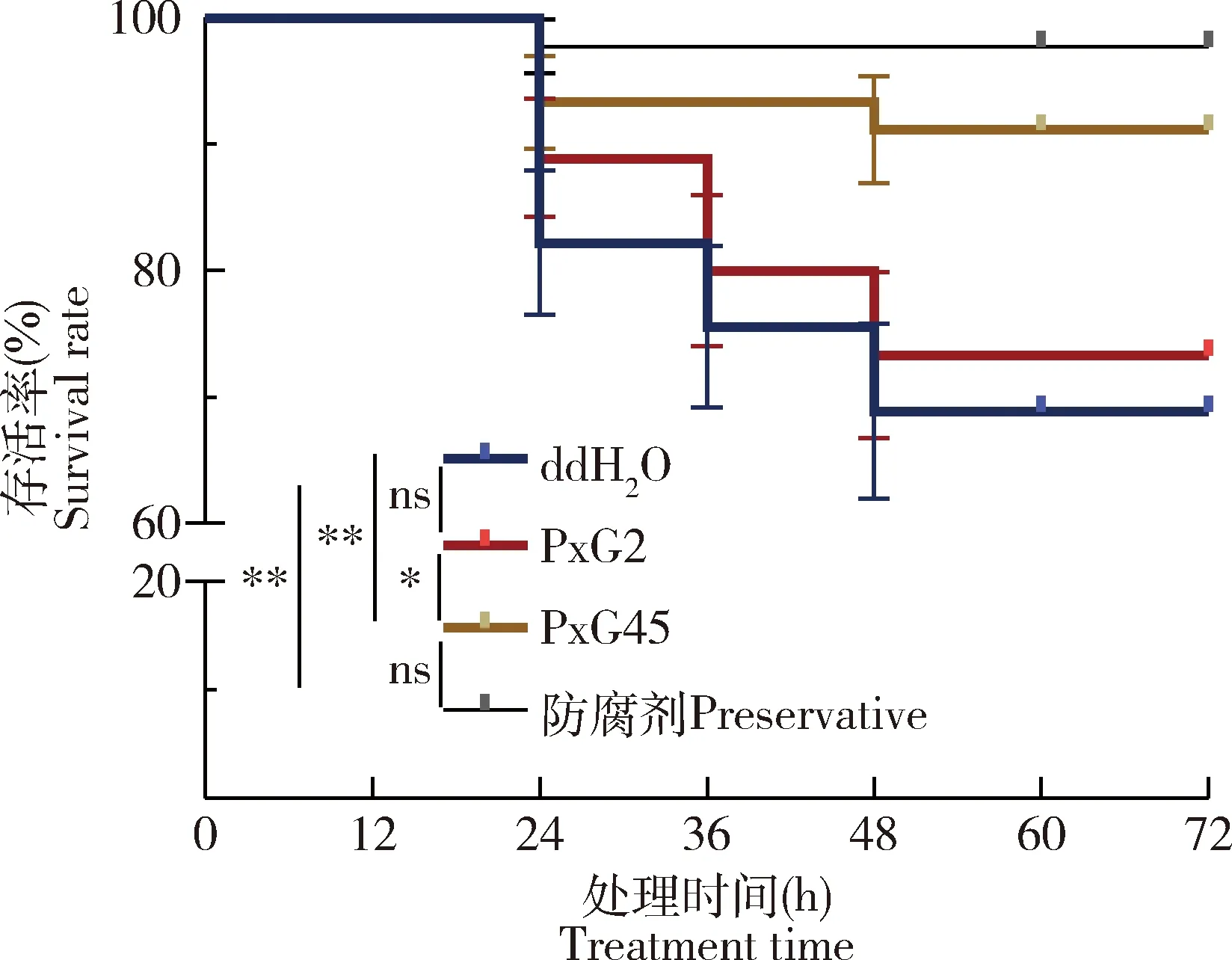
图3 饲喂成团泛菌PxG45后小菜蛾3龄幼虫的存活率Fig. 3 Survival rate of the 3rd instar larva of Plutellaxylostella fed with Pantoea agglomerans PxG45ddH2O, PxG2, PxG45: 分别表示添加ddH2O(假处理对照), PxG2(同型对照)和PxG45的无防腐剂人工饲料Preservative-free artificial diets with ddH2O (false treatment control), PxG2(isotype control) and PxG45, respectively; 防腐剂Preservative: 正常人工饲料Normal artificial diet. 图中数据为平均值±标准误(n=3);符号表示两组间的差异显著性(nsP>0.05; *P<0.05; **P<0.01)(对数秩检测)。Data in the figure are mean±SE (n=3). Symbols indicate significance of difference between two groups (nsP>0.05; *P<0.05; **P<0.01)[Log-rank (Mantel-Cox)] test. 图4和5同。The same for Figs.4 and 5.
2.5 PxG45对球孢白僵菌杀虫活性的影响
如图4所示,与饲喂ddH2O和球孢白僵菌的对照组相比,饲喂PxG45后球孢白僵菌侵染小菜蛾3龄幼虫存活率显著提高(χ2=4.169,P=0.041),在24 h时对照组已经出现3龄幼虫死亡,而处理组幼虫存活率为100%; 36-108 h时两组存活率差异更加明显,在108 h后两组活虫数均不再发生变化,此时对照组存活率是53%,而处理组存活率保持在75%以上,表明PxG45显著提高了球孢白僵菌侵染条件下小菜蛾幼虫的存活率。

图4 饲喂小菜蛾3龄幼虫成团泛菌PxG45后球孢白僵菌侵染后的存活率Fig. 4 Survival rate of the 3rd instar larva of Plutellaxylostella fed with Pantoea agglomerans PxG45 followed by Beauveria bassiana infectionBb: 球孢白僵菌B. bassiana; ddH2O+Bb: 对照组Control group.
如图5所示,与未回补PxG45的对照组相比,回补PxG45的无菌小菜蛾3龄幼虫对球孢白僵菌的敏感度显著降低,幼虫存活率显著提高(χ2=9.897,P=0.024),在球孢白僵菌侵染36 h时,未回补PxG45的小菜蛾无菌种群3龄幼虫出现死亡,而回补PxG45的小菜蛾无菌种群3龄幼虫存活率保持100%。48-96 h时两组小菜蛾存活率差异更加明显,在96 h后两组活虫数均不再发生变化。最后,在球孢白僵菌侵染96 h后,未回补PxG45的小菜蛾无菌种群3龄幼虫存活率为80%,回补PxG45组的存活率为95%。以上结果表明PxG45可以显著降低球孢白僵菌的杀虫活性。

图5 小菜蛾无菌种群3龄幼虫回补成团泛菌PxG45后球孢白僵菌侵染后的存活率Fig. 5 Survival rate of the 3rd instar larva of axenic Plutellaxylostella population reintroducted with Pantoea agglomerans PxG45 followed by Beauveria bassiana infectionBb: 球孢白僵菌B. bassiana; ddH2O: 对照组Control group; +PxG45, -PxG45: 分别为Bb侵染前回补PxG45和未回补PxG45 Reintroduction and non-reintroduction of PxG45 before Bb infection, respectively.
PxG45与球孢白僵菌拮抗培养的结果如图6(A, B),PxG45对球孢白僵菌的抑制率为51.88%,在划有PxG45菌株培养基上生长的球孢白僵菌菌落直径为(31.98±0.09) mm,而单独培养的球孢白僵菌菌落直径为 (66.46±0.373) mm, 显著大于与PxG45拮抗培养的处理组(P<0.001)。即PxG45对球孢白僵菌的生长有显著抑制作用。以上结果表明, PxG45可以通过抑制球孢白僵菌生长降低病原真菌对小菜蛾的杀虫活性,帮助宿主昆虫抵御外来病原微生物侵染。

图6 成团泛菌PxG45与球孢白僵菌的拮抗培养Fig. 6 Antagonistic culture between Pantoea agglomerans PxG45 and Beauveria bassianaA: Control, 单独接种球孢白僵菌(对照组) Control, inoculation with B. bassiana alone (control group); B: PxG45, 球孢白僵菌与PxG45拮抗培养(处理组) PxG45, antagonistic culture between B. bassiana and PxG45 (treatment group).
2.6 PxG45对植物病原真菌的抑制
为了探究十字花科蔬菜的病原真菌无法在小菜蛾肠道中定殖的原因是否与PxG45有关,PxG45与可引起多种十字花科蔬菜炭疽病的植物病原真菌希金斯炭疽菌C.higginsianum拮抗培养的结果如图7(A)所示,根据平板对峙结果统计所得的抑制率如表1所示。与PxG45拮抗培养的希金斯炭疽菌菌落直径显著小于单独培养时的菌落直径(P<0.001),希金斯炭疽菌生长被显著抑制,抑制率为49.00%。
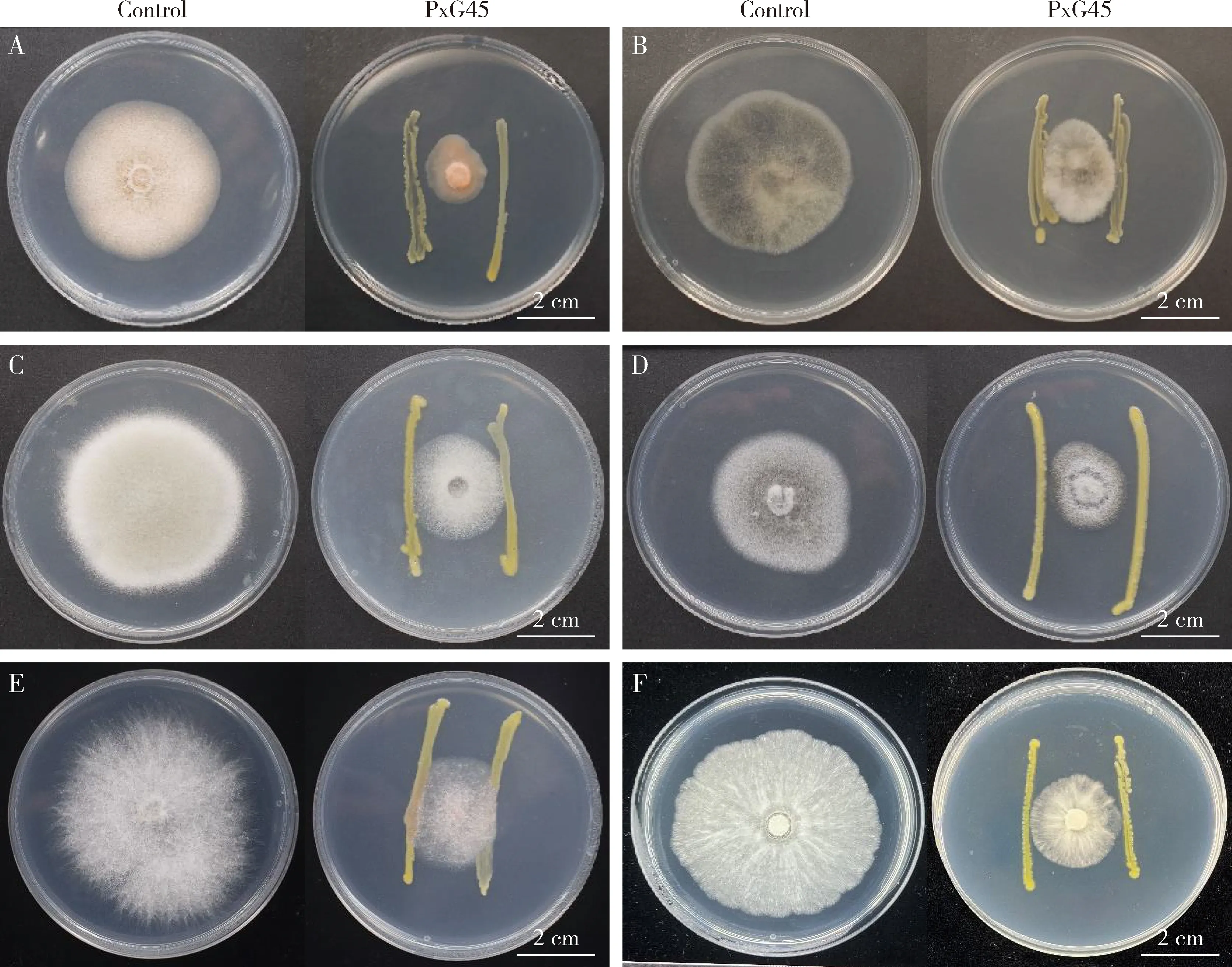
图7 成团泛菌PxG45与植物病原真菌的拮抗培养Fig. 7 Antagonistic culture between Pantoea agglomerans PxG45 and plant pathogenic fungiA: 希金斯炭疽菌Colletotrichum higginsianum; B: 刺盘孢炭疽菌C. camelliae; C: 尖孢镰刀菌古巴专化型4号生理小种Fusarium oxysporum f. sp. cubense race 4; D: 茄链格孢菌Alternaria solani; E: 稻瘟病菌Magnaporthe oryzae; F: 丁香假单胞菌杨梅致病变种Pseudomonas syringae pv. myricae. Control: 单独接种真菌Fungal inoculation alone; PxG45: 真菌与PxG45拮抗培养Antagonistic culture between fungi and PxG45.
结合PxG45对希金斯炭疽菌的抑菌结果,我们对PxG45是否具备广谱性抑制植物病原真菌的能力进行了实验。平板对峙结果如图7(B-F)所示,抑制率如表1所示,PxG45对5种不同的植物病原真菌的抑菌率均在50%以上,且接种PxG45后真菌菌落直径均显著小于同组中未接种的(P<0.05)。其中PxG45对刺盘孢炭疽菌的抑制率为50.01%,对茄链格孢菌的抑制率为51.24%,对稻瘟病菌的抑制率为51.07%,对尖孢镰刀菌古巴专化型4号生理小种的抑制率为53.11%,对丁香假单胞菌杨梅致病变种的抑制率最高,为61.56%。以上结果说明PxG45对植物病原真菌具有广谱性抑制作用。
3 讨论
成团泛菌是昆虫肠道中一种重要的共生细菌,已在多种昆虫肠道中被分离(张静宇, 2017)。本研究从小菜蛾肠道中分离纯化出1株肠道细菌PxG45,通过形态学、系统发育和生理生化特征鉴定(图1, 2),确定PxG45为成团泛菌。生测实验显示PxG45在体外与防腐剂效果类似,可以逆转饲喂无防腐剂饲料导致的小菜蛾幼虫死亡率高的问题(图3)。植物来源的成团泛菌通过编码一种类似溶菌酶的效应蛋白抑制环境中的竞争性细菌(Carobbietal., 2022)。我们推测PxG45通过抑制环境微生物生长、延缓饲料腐败,从而提高小菜蛾幼虫的存活率。
尽管已在飞蝗Locustamigratoria(Tanetal., 2023)、沙漠蝗(Dillon and Charnley, 1986)等多种昆虫中证明成团泛菌可以影响经体壁入侵的球孢白僵菌的杀虫活性,但关于其在球孢白僵饲喂侵染过程中所起作用鲜有报道。与此同时,多数实验设置条件:预先在体外混合成团泛菌与真菌,并以两者混合物作为侵染源,这导致实验结果不能证明成团泛菌可以在虫体内影响球孢白僵菌生长。本研究通过提前饲喂PxG45排除球孢白僵菌在体外被抑制的可能,生测结果显示PxG45显著降低以饲喂方式入侵小菜蛾的球孢白僵菌的杀虫活性,帮助宿主昆虫抵御外来病原真菌侵染(图4, 5)。观察死亡小菜蛾萌发的球孢白僵菌:宿主死亡后,真菌随体液从宿主口器、气门和外生殖器溢出,此时无法观察到真菌菌丝和孢子体;培养一段时间后可在溢出的体液附近观察到萌发的菌丝体和孢子体。这与球孢白僵菌体壁入侵导致的外部症状区别显著,经体壁感染的虫体表面直接萌发出菌丝,体表呈现白茸毛状(王砚妮等, 2023),无体液外溢现象。综合以上结果得出,本研究设置球孢白僵菌饲喂法可成功侵染小菜蛾,并以肠道而非体外作为成团泛菌功能行使场所。
平板对峙结果显示,与PxG45拮抗培养的球孢白僵菌菌落直径显著小于单独培养时的菌落直径,球孢白僵菌生长被显著抑制(图6)。这与分离自切叶蚁体壁的泛菌属细菌体外抑真菌圈结果相同(Mattosoetal., 2012),不仅如此我们的结果具体到种水平,对泛菌属下有抑制球孢白僵菌生长作用的菌种进行补充。
尽管小菜蛾以十字花科蔬菜为食,但可以感染十字花科蔬菜的病原真菌无法在小菜蛾肠道中定殖,这很可能是由于小菜蛾肠道中存在可以抑制植物病原真菌生长的肠道菌。在本研究中,通过将PxG45与可引起多种十字花科蔬菜炭疽病的植物病原真菌希金斯炭疽菌拮抗培养,结果显示PxG45可以显著抑制希金斯炭疽菌生长(图7: A)。已有报道表明,成团泛菌在植食性昆虫肠道中是保守的,影响植物病原菌在虫体的定殖(Vorwerketal., 2007),这与本研究所得结果相似。植物内生成团泛菌具备广谱抗植物病原真菌作用,其中包括分离自草莓(de Mouraetal., 2021)、辣根(Egamberdievaetal., 2020)和小麦(Thisseraetal., 2020)的。这些报道暗示成团泛菌作为生防菌有着较大应用前景。目前多数拮抗成团泛菌分离自植物,来源于昆虫的菌株鲜有报道。本研究通过增设PxG45与刺盘孢炭疽菌、尖孢镰刀菌古巴专化型4号生理小种、茄链格孢菌、稻瘟病菌和丁香假单胞菌杨梅致病变种5种植物病原真菌的平板对峙实验(图7: B-F),明确昆虫来源的成团泛菌PxG45具备广谱抗真菌活性。
昆虫肠道共生菌有着很高的应用价值,我们的发现鉴定了1株可以直接抑制病原微生物生长保护宿主昆虫的小菜蛾肠道菌PxG45,并通过实验验证其对多种植物病原真菌的生长具有抑制作用。这不仅填补了昆虫来源的拮抗成团泛菌研究的空白,同时为昆虫肠道共生菌的开发利用提供了一条以菌治菌的新思路。
