肝脂肪变性相关指数对2型糖尿病患者合并非酒精性脂肪性肝病的预测价值
2023-11-24田昊文邓霞杨玲
田昊文, 邓霞, 杨玲
(江苏大学附属医院内分泌科, 江苏 镇江 212001)
来自20个国家近50 000名2型糖尿病(type 2 diabetes mellitus,T2DM)患者的荟萃分析结果显示,T2DM患者非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)患病率全球约为55.5%,欧洲高达68.0%[1],并且T2DM和NAFLD的共存形成了一个恶性循环[2]。研究表明,NAFLD和T2DM患者更易发生非酒精性脂肪性肝炎、晚期纤维化、肝硬化或肝细胞癌等疾病,导致住院率和死亡率增加[3-4]。此外,与T2DM患者相比,T2DM合并NAFLD增加了胰岛素抵抗(insulin resistance,IR)程度和糖尿病慢性血管并发症(糖尿病肾病、糖尿病视网膜病变等)的风险[5]。因此,T2DM患者应定期参加体检,以确定是否发生NAFLD。在日常工作中,临床医生应充分重视对T2DM合并NAFLD患者的及时筛查,以便提供及时的干预和治疗[6-7]。诊断NAFLD的金标准依赖于肝活检,但该种检查耗时、费用高,且难以推广。超声是临床实践中使用最广泛的检测方法,其通过识别脂肪肝的特征进行NAFLD的诊断,但是在轻度脂肪肝中敏感性较差[2,8]。NAFLD的发生风险与超重或肥胖显著相关。体重指数(body mass index,BMI)是用于评价成人肥胖的指标,但是单独的指标难以独立预测NAFLD的发病风险。近年来的研究开发了数种基于常规实验室检验和人体测量参数的NAFLD相关指数[9-11]。其中,肝脂肪变性指数(hepatic steatosis index,HSI)和脂肪肝指数(fatty liver index,FLI)在不同人群中具有良好的诊断准确性。FLI最早由Bedogni等[9]提出,用于预测欧洲18~75岁人群的脂肪肝,研究者综合脂肪肝的独立预测因素进行分析,最终由BMI、腰围、三酰甘油和γ-谷氨酰转肽酶(GGT)计算得出FLI。FLI是针对欧洲白种人为主的指数,而东亚人群的腰围和BMI相对较低,实际应用后发现FLI<30在该人群中的敏感性较差。近年来Lee等[10]在FLI基础上提出了一种新型指数HSI,研究者考虑了性别和糖尿病可以独立预测NAFLD,并加入谷丙转氨酶(ALT)、谷草转氨酶(AST)和BMI计算得出HSI。既往研究报道,HSI对代谢性疾病如IR、糖尿病和代谢综合征的预测价值优于BMI、腰围、腰高比、脂质蓄积指数(LAP)和内脏脂肪指数(VAI)[12-13]。然而,HSI和FLI在T2DM中诊断NAFLD的价值尚未完全阐明。本研究旨在探讨HSI和FLI与T2DM患者发生NAFLD风险之间的关系,以及它们与T2DM患者各种代谢指标的联系。
1 对象与方法
1.1 研究对象
本研究为横断面研究,共纳入2018年5月至2020年7月于江苏大学附属医院标准化代谢性疾病管理中心就诊的T2DM患者566例,年龄均>18岁,其中男315例(55.65%),女251例(44.35%)。T2DM的诊断基于美国糖尿病协会2013年诊断标准[14]。排除标准如下:① 存在病毒性肝炎、药物性肝病、肝豆状核变性、自身免疫性肝病、血吸虫病肝病和肝硬化;② 过度饮酒(饮酒量:男性>40 g/d、女性>20 g/d持续5年,或>80 g/d超过2周);③ 存在急性感染、恶性肿瘤、妊娠、甲状腺功能亢进症;④ 口服糖皮质激素;⑤ 研究人员认为可能影响研究结果和数据收集不完整的其他情况。研究方案通过江苏大学附属医院伦理委员会的批准。
1.2 方法
1.2.1 临床资料及测量指标 记录所有受试者的一般临床资料,包括性别、年龄、糖尿病病程、吸烟史、高血压病史、降糖药物用药史、心率、身高、体重、腰围、臀围、收缩压和舒张压。夜间禁食超过8 h后采集血样。采用酶法测定血清总胆固醇、三酰甘油、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C);用动力学方法测定ALT、AST和GGT。采用高效液相色谱法测定糖化血红蛋白(HbA1c);采用葡萄糖氧化酶法测定空腹血糖;采用化学发光法测定空腹胰岛素(fasting insulin,INS)和空腹C肽(fasting C-peptide,C-P)。
1.2.2 相关指数计算 BMI=体重(kg)/身高2(m2)。腰高比=腰围(cm)/身高(cm)。FLI[9]=ey/(1+ey)×100,其中y=0.953×ln(三酰甘油,mg/dL)+0.139×BMI(kg/m2)+0.718×ln(GGT,U/L)+0.053×腰围(cm)-15.745。HSI[10]=8×[ALT(U/L)/AST(U/L)]+BMI(kg/m2)+(2,如果糖尿病)+(2,如果女性)。稳态模型评估胰岛素抵抗指数(HOMA-IR)=空腹血糖(mmol/L)×INS(μIU/mL)/22.5。稳态模型评估胰岛β细胞功能(HOMA-β)=20×INS(μIU/mL)/(空腹血糖,mmol/L)-3.5。
1.2.3 基于肝脏超声定义NAFLD NAFLD的诊断依据《非酒精性脂肪性肝病防治指南(2018年更新版)》[15]。腹部超声(全身彩色多普勒诊断仪LOGIQ-9)由专业超声医生进行,根据超声检查结果将患者分为无NAFLD组与NAFLD组。
1.3 统计学方法
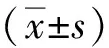
2 结果
2.1 两组间临床资料的比较
根据超声检查结果,将T2DM受试者分为无NAFLD组(n=194)和NAFLD组(n=372)。与无NAFLD组相比,NAFLD组的高血压患者比例,血压水平,血脂水平(三酰甘油、总胆固醇),BMI,腰围,臀围,腰高比,胰岛功能相关指标(INS、C-P、HOMA-IR、HOMA-β),肝功能相关指标(ALT、AST、GGT)均显著升高(P<0.05)。此外,NAFLD组的糖尿病病程、年龄和HDL-C明显低于无NAFLD组(P<0.001)。NAFLD组的HSI水平和FLI水平显著高于无NAFLD组,差异具有统计学意义(P<0.001)。两组间其他临床指标差异无统计学意义(P>0.05)。见表1。

表1 两组一般临床资料对比
2.2 HSI和FLI与临床参数的相关性分析
在校正了年龄、糖尿病病程、性别、吸烟史、高血压病史和用药史后,相关分析显示,肝脂肪变性相关指数(HSI、FLI)与收缩压、腰围、臀围、腰高比、总胆固醇、三酰甘油、ALT、AST、GGT、INS、C-P和HOMA-IR呈正相关,但与HDL-C呈负相关,差异具有统计学意义(P<0.05)。见表2。

表2 HSI和FLI与临床参数的相关性分析
2.3 Logistic回归分析HSI、FLI与T2DM患者发生NAFLD的关系
二分类Logistic回归分析的结果见表3。在未经调整的模型中,NAFLD的发生风险随着HSI(OR:1.381,95%CI:1.302~1.465,P<0.001)和FLI(OR:1.067,95%CI:1.055~1.079,P<0.001)的增加而增加。进一步分别或联合调整性别、年龄、糖尿病病程、吸烟史、高血压病史、用药史、腰围、臀围、腰高比、三酰甘油、总胆固醇、HDL-C、收缩压和舒张压等多种混杂因素后(模型1~4),HSI和FLI仍是T2DM患者发生NAFLD的危险因素。

表3 Logistic回归分析HSI、FLI与T2DM患者发生NAFLD的关系
2.4 ROC曲线评估HSI和FLI的诊断价值
HSI预测T2DM患者发生NAFLD的ROC曲线下面积为0.837(95%CI:0.802~0.872,P<0.001),最佳截断点为36.0,诊断T2DM合并NAFLD的敏感性为82.5%,特异性为68.6%。FLI的ROC曲线下面积为0.843(95%CI:0.808~0.878,P<0.001),最佳截断点为34.72,诊断T2DM合并NAFLD的敏感性为86.0%,特异性为70.5%。而BMI的ROC曲线下面积为0.803(95%CI:0.765~0.842,P<0.001),最佳截断点为23.61 kg/m2,诊断T2DM合并NAFLD的敏感性为83.1%,特异性为64.4%。见图1。

图1 ROC曲线分析HSI和FLI对T2DM患者合并NAFLD的诊断价值
3 讨论
本研究初步探讨了HSI、FLI对T2DM患者NAFLD发生风险的评估及预测价值。本研究中,T2DM人群中NAFLD的患病率为65.72%,与之前的流行病学调查结果一致[1]。本研究的回归分析结果显示,在调整了各种代谢风险相关指标后,HSI和FLI与T2DM患者发生NAFLD仍独立相关,提示HSI与FLI是T2DM患者发生NAFLD的独立预测因子。
本研究结果显示,与无NAFLD组相比,NAFLD组的HSI水平明显升高。HSI的ROC曲线下面积为0.837(95%CI:0.802~0.872),显示出82.5%的敏感性和68.6%的特异性。这一结果与Lee等[10]报道的ROC曲线下面积0.812(95%CI:0.801~0.824)相近,但与Sviklne等[16]报道的ROC曲线下面积0.746(95%CI:0.58~0.91)相比,本研究的结果更好。种族差异、合并不同类型糖尿病和NAFLD的诊断方法不同可能是导致HSI对NALFD的诊断效果存在差异的主要因素。此外,本研究还发现,HSI与腰围、臀围、腰高比和血脂等代谢风险指标相关。Sviklne等[16]和Tripolino等[17]的研究表明,HSI与代谢风险指标(腰围、三酰甘油、HDL-C)之间存在相关性,本研究结果与其一致。本研究结果还显示,NAFLD组的FLI显著高于无NAFLD组,FLI的ROC曲线下面积为0.843(95%CI:0.808~0.878)。这一结果与Bedogni等[9]报道的ROC曲线下面积0.85(95%CI:0.81~0.88)和Sviklne等[16]报道的ROC曲线下面积0.86(95%CI:0.72~0.99)相近。Motamed等[13]发现用肝脏超声诊断NAFLD时,FLI与NAFLD有很强的相关性。上述结果共同表明,HSI与FLI是预测T2DM合并NAFLD实用且良好的指标。
本研究的相关性分析发现HSI与FLI均与T2DM患者的糖脂代谢指标(C-P、HOMA-IR、三酰甘油、总胆固醇、HDL-C),肥胖相关指标(腰围、臀围、腰高比)和肝功能指标(ALT、AST、GGT)相关,表明HSI、FLI与糖脂代谢紊乱密切相关。大量研究表明,IR和血脂异常是NAFLD和T2DM发生的主要机制[18-20],IR是两者的共同发病机制[1]。根据计算公式,FLI兼顾了BMI、腹型肥胖与血脂指标,HSI兼顾了肝功能指标与BMI,两者均有BMI。BMI是T2DM患者发生NAFLD的独立影响因素[21]。本研究结果显示BMI预测T2DM患者发生NAFLD的ROC曲线下面积为0.803(95%CI:0.765~0.842)。李彦彦等[22]联合心脏代谢指数与BMI预测T2DM患者发生NAFLD的ROC曲线下面积为0.816(95%CI:0.78~0.86),相较之下本研究中HSI的ROC曲线下面积0.837(95%CI:0.802~0.872)和FLI的ROC曲线下面积0.843(95%CI:0.808~0.878)性能更好。Ren等[23]发现腹部脂肪、三酰甘油/HDL-C比值与IR相关。既往研究表明IR通过诱导脂肪组织中三酰甘油的脂解和肝脏中三酰甘油的合成来促进NAFLD的发生[24]。脂肪组织通过各种炎症机制促进IR[25]。NAFLD的发病机制涉及肝脏脂肪堆积[26],进而加重T2DM患者的IR。过氧化物酶体增殖物激活受体γ在其中发挥了重要作用,该肝脏因子的激活促进了三酰甘油的合成与葡萄糖的摄取,并上调了脂肪酸代谢靶基因[27]。肝脏的脂肪蓄积同时会导致肝功能的损伤,但是转氨酶的升高与NAFLD的严重程度无系统性关系[28]。综合以上考虑可能主要是IR介导了HSI、FLI与T2DM患者发生NAFLD间的联系。
本研究具有一定的局限性。本研究为横断面研究,确定危险因素与疾病发生的因果关系尚不够充分;NAFLD的诊断不是通过肝活检这一金标准;且NAFLD的患病率相对较高,这可能会对结果造成一些偏差。尽管如此,本研究结果仍然提示,HSI和FLI与代谢风险指标密切相关,在T2DM患者NAFLD的风险评估中具有良好的预测价值。
